一种H2O2偶联的指示系统检测唾液酸的试剂盒的制作方法
本发明涉及唾液酸的检测
技术领域:
,尤其是一种h2o2偶联的指示系统检测唾液酸的试剂盒。
背景技术:
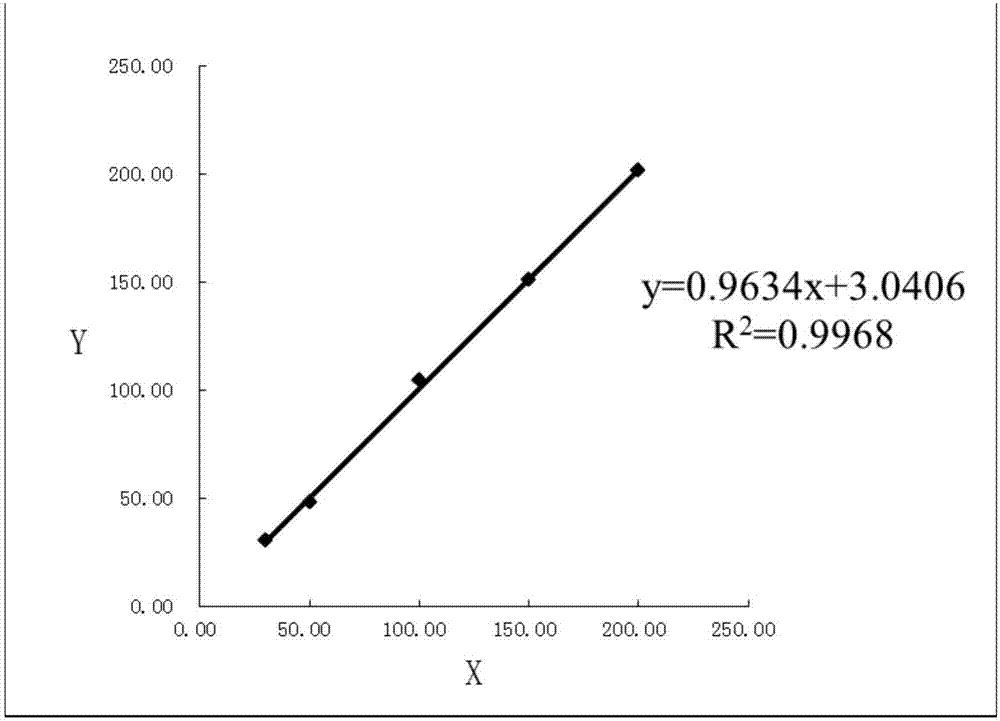
:目前,唾液酸(sialicacid,sa):是9-碳单糖的衍生物。通常以低聚糖,糖脂或者糖蛋白的形式存在。是细胞膜糖蛋白的重要组成部分,与生物体的许多生物学功能有关,且与细胞恶变、癌转移、浸润、失去接触性抑制、细胞粘附性降低以及肿瘤抗原性密切相关。测定血清唾液酸浓度,可作为癌肿诊断辅助性指标和疗效观察指标。唾液酸明显升高的疾病有:急性白血病、食道癌、贲门癌、胃癌、肠癌、肝癌、肺癌以及卵巢癌等,其中以急性白血病患者为最高。肿瘤患者血清唾液酸增高可能是肿瘤细胞涎糖蛋白合成增加和代谢的改变在血中的反映,可以用于早期发现肿瘤的转移和复发。目前唾液酸检测技术常用的方法有如下几种:硫代巴比妥酸法、r-试剂法、间苯二酚-过碘酸/盐酸法、hplc法、薄层层析法、酶法等。硫代巴比妥酸法、r-试剂法、间苯二酚-过碘酸/盐酸法操作繁复,不适用于自动化分析,hplc法、薄层层析法仪器成本偏高,酶法普遍以nad+-nadh指示系统测定物质的浓度或活性,但nadh稳定性较差,血浆中有许多以nadh为辅酶的脱氢酶,用nadh易产生负反应,存在内源性丙酮酸干扰,因此,一种灵敏度高,稳定性好的唾液酸检测方法,是本领域亟需解决的技术问题。技术实现要素:为了克服现有技术的不足,本发明提供了一种h2o2偶联的指示系统检测唾液酸的试剂盒,该试剂盒可以提高h2o2的稳定性,可以增加抗干扰性,排除维生素c、胆红素等物质的干扰,进一步提高了整个试剂的准确度和精密度。为了实现上述目的,本发明采用的技术方案是:一种h2o2偶联的指示系统检测唾液酸的试剂盒,其特征在于:包括由试剂1和试剂2组成的液体双试剂组分,试剂1与试剂2的体积比为3:1,试剂1成分如下:试剂2成分如下:采用上述方案,本发明的优势在于:利用h2o2偶联的指示系统,通过色素原酚和4-aa的指示具有很强的目的性和特异性,显色明显,规避了nadh稳定性较差,易产生负反应,存在内源性丙酮酸干扰等问题,具有较好的生色基团的稳定性和溶解度,提升灵敏度和检测的特异性。通过添加edta,提高h2o2的稳定性,添加亚铁氰化钾作为抗干扰剂,排除维生素c,胆红素等物质的干扰,也进一步提高了整个试剂的准确度和精密度。下面结合附图对本发明作进一步描述。附图说明附图1为本发明具体实施1所制得的测定唾液酸的试剂盒的线性相关图;附图2为本发明具体实施例2所制得的测定唾液酸的试剂盒的线性相关图;附图3为本发明具体实施例3所制得的测定唾液酸的试剂盒的线性相关图;附图4为本发明具体实施例2所制得的测定唾液酸的试剂盒与市售试剂盒的线性相关图。具体实施方式本发明结合具体实施例说明技术方案,本发明的保护范围不局限于上述具体实施方式,本领域一般技术人员根据本发明公开的内容,可以采用其他多种具体实施方式实施本发明的,或者凡是采用本发明的设计结构和思路,做简单变化或更改的,都落入本发明的保护范围。本发明的具体实施例所示的h2o2偶联的指示系统检测唾液酸的试剂盒,其包括由试剂1和试剂2组成的液体双试剂组分,试剂1与试剂2的体积比为3:1,试剂1成分如下:试剂2成分如下:其中,所用溶剂为纯化水,edta为稳定剂,亚铁氰化钾为抗干扰剂。本发明的原理为:本发明中的h2o2偶联的指示系统主要内容为h2o2在过氧化物酶的作用下,可使单一个或成对的无色的色素原氧化成有色的色素,导致某一波长吸光度的增加,因此可用来测定物质的浓度或活性。用于此指示系统的单一色素原有tmb、abts等;成对色素原有酚和4aa、mbth和dma等。其优点就在于色素原的指示具有很强的目的性和特异性,色素原显色明显,不易受nadh等的不稳定性和内源性丙酮酸的干扰。具体实施例1本发明的试剂盒包括了试剂1与试剂2的液体双试剂组分,其中具体实施例2本发明的试剂盒包括了试剂1与试剂2的液体双试剂组分,其中具体实施例3本发明的试剂盒包括了试剂1与试剂2的液体双试剂组分,其中具体实施例4精密度测定:用实施例1所制得的测定唾液酸的试剂盒,实施例2所制得的测定唾液酸的试剂盒,实施例3所制得的测定唾液酸的试剂盒分别对同一样品连续抽取20次进行测定,计算测定值的均数、标准差和变异系数,表1精密度检测结果变异系数cv通常用于衡量一项测定方法的精密度,cv值越小,表示该测定方法的结果精密度越好。对于临床化学检验项目而言,cv小于5%的方法精密度公认是可以接受的。表1中cv值均小于3%,表明本发明试剂盒具有优良的精密度。具体实施例5稳定性测定:用实施例1所制得的测定唾液酸的试剂盒,实施例2所制得的测定唾液酸的试剂盒,实施例3所制得的测定唾液酸的试剂盒分别进行开瓶稳定性和长期稳定性考察。开瓶稳定性:分别将实施例1所制得的测定唾液酸的试剂盒,实施例2所制得的测定唾液酸的试剂盒,实施例3所制得的测定唾液酸的试剂盒开瓶后放置于2℃-8℃保存30天后,取出后按照生化分析仪检测方法分别检测新鲜配制的50mg/dl唾液酸标准品,重复测定3次,计算检测结果与标示值的相对偏差。结果见表2。表2开瓶稳定性检测结果序号实施例1(mg/dl)实施例2(mg/dl)实施例3(mg/dl)152.4253.9652.47252.1452.8152.67350.4151.6952.19均值51.6652.8252.44cb3.31%5.64%4.89%表2中相对偏差均处于±15%范围内,表明本发明试剂盒开瓶稳定性较好。长期稳定性:将实施例1所制得的测定唾液酸的试剂盒,实施例2所制得的测定唾液酸的试剂盒,实施例3所制得的测定唾液酸的试剂盒放置于2℃-8℃保存12个月,取出后按照生化分析仪检测方法分别检测新鲜配制的50mg/dl唾液酸标准品,重复测定3次,计算检测结果与标示值的相对偏差。结果见表3。表3长期稳定性检测结果序号实施例1(mg/dl)实施例2(mg/dl)实施例3(mg/dl)154.7753.4154.82253.6352.5354.42354.1554.7352.12均值54.1853.5653.79cb8.37%7.11%7.57%表3中相对偏差均处于±15%范围内,表明本发明试剂盒长期稳定性较好。实施例6线性测定:分别用实施例1所制得的测定唾液酸的试剂盒,实施例2所制得的测定唾液酸的试剂盒,实施例3所制得的测定唾液酸的试剂盒做线性测定。使用去离子水将试剂稀释成5个梯度浓度,每个梯度浓度检测3次,取平均值,对测定值与预期值作回归分析,计算r值和相对偏差(结果见图1、图2、图3,单位mg/dl)。表4实施例1线性相关检测结果稀释浓度30.0050.00100.00150.00200.00测定值29.8949.72103.40141.38201.9327.8150.45101.71140.50205.9125.9352.3198.06142.61209.18均值2851101141206绝对偏差0.482.201.758.495.01相对偏差1.68%-4.53%-1.77%5.66%-2.50%通过表4得到相关系数:r2=0.9948,线性方程为:y=1.0136x-2.0530,结果表明本发明实施例1所制得的测定唾液酸的试剂盒相关性良好。表5实施例2线性相关检测结果稀释浓度30.0050.00100.00150.00200.00测定值29.2750.45101.86147.11190.2228.5151.22102.11151.80191.7327.9252.35104.83155.76192.31均值2951103152191绝对偏差3.380.133.554.004.30相对偏差10.58%-0.25%-3.57%-2.71%2.20%通过表5得到相关系数:r2=0.9968,线性方程为:y=0.9634x+3.0406,结果表明本发明实施例2所制得的测定唾液酸的试剂盒相关性良好。表6实施例3线性相关检测结果稀释浓度30.0050.00100.00150.00200.00测定值29.3747.14106.70150.02199.8129.7247.40109.15151.81192.1628.3848.27111.24158.62195.38均值2948109153196绝对偏差2.243.697.992.694.76相对偏差7.12%7.19%-7.91%-1.79%2.37%通过表6得到相关系数:r2=0.9942,线性方程为:y=0.9950x+1.5424,结果表明本发明实施例3所制得的测定唾液酸的试剂盒相关性良好。具体实施例7:本发明试剂盒与使用nad+-nadh指示系统的试剂盒的相关性研究,将实施例2所制得的测定唾液酸的试剂盒与使用nad+-nadh指示系统的市售试剂盒进行相关研究。对照的市售试剂盒,其信息如下:产品名称:唾液酸测定试剂盒【永和阳光(湖南)生物科技有限公司】方法:酶法剂型:液体双试剂(3:1)试剂成份:试剂1:tris-hcl100mmol/lph7.0神经氨酸苷酶0.2ku/l乳酸脱氢酶(ldh)2ku/l试剂2:烟酰腺嘌呤二核苷酸(nadh)0.13mmol/ln-乙酰神经氨酸醛缩酶(nana-醛缩酶)2ku/l分析方法:计算:检测仪器:au480市售试剂盒按说明书操作。1)线性相关测定:分别采用实施例2所制得的测定唾液酸的试剂盒与市售试剂盒,采用au480全自动生化分析仪,对50份样本(包含正常和异常样本),按各自参数进行测定,并对测定值进行相关分析(结果见图4,x轴表示的是实施例2所制得的测定唾液酸的试剂盒的测定值,y轴表示的是市售试剂盒的测定值)。相关系数:r2=0.9930,线性方程为:y=1.005x+1.060,结果表明本发明试剂盒与市售试剂盒相关性良好。表7线性相关检测结果2)精密度测定:将实施例2所制得的测定唾液酸的试剂盒与使用nad+-nadh指示系统的市售试剂盒分别对同一样品中连续抽取20次进行测定,计算测定值的均数、标准差和变异系数,表8精密度检测结果变异系数cv通常用于衡量一项测定方法的精密度,cv值越小,表示该测定方法的结果精密度越好。对于临床化学检验项目而言,cv小于5%的方法精密度公认是可以接受的。表8中两种试剂盒的cv值均小于5%,实施例2所制得的测定唾液酸的试剂盒cv为2.90%,相较市售试剂盒具有更好的精密度。3)准确度测定:将实施例2所制得的测定唾液酸的试剂盒与使用nad+-nadh指示系统的市售试剂盒分别用同一质控品,重复测定3次,取平均值,与质控品靶值相对偏差应在±15%范围内。表9准确度检测结果表9中两种试剂盒的相对偏差均处于±15%范围内,实施例2所制得的测定唾液酸的试剂盒相对偏差为4.49%,相较市售试剂盒具有更好的准确度。4)稳定性测定:将实施例2所制得的测定唾液酸的试剂盒与市售试剂盒分别进行开瓶稳定性和长期稳定性考察。开瓶稳定性:将实施例2所制得的测定唾液酸的试剂盒与市售试剂盒分别开瓶后放置于2℃-8℃保存30天后,取出后按照生化分析仪检测方法分别检测新鲜配制的50mg/dl唾液酸标准品,重复测定3次,计算检测结果与标示值的相对偏差。结果见表10。表10开瓶稳定性检测结果序号实施例2(mg/dl)市售试剂盒(mg/dl)153.9655.47252.8151.67351.6954.19均值52.8253.78cb5.64%7.55%表10中两种试剂盒的相对偏差均处于±15%范围内,实施例2所制得的测定唾液酸的试剂盒相对偏差为5.64%,相较市售试剂盒具有更好的开瓶稳定性。长期稳定性:将实施例2所制得的测定唾液酸的试剂盒与市售试剂盒放置于2℃-8℃保存12个月,取出后按照生化分析仪检测方法分别检测新鲜配制的50mg/dl唾液酸标准品,重复测定3次,计算检测结果与标示值的相对偏差。结果见表11。表11长期稳定性检测结果序号实施例2(mg/dl)实施例3(mg/dl)153.4155.24252.5355.89354.7353.17均值53.5654.77cb7.11%9.53%表11中两种试剂盒的相对偏差均处于±15%范围内,实施例2所制得的测定唾液酸的试剂盒相对偏差为7.11%,相较市售试剂盒具有更好的长期稳定性。5)特异性测定:进行干扰实验测定,分别取5份质控,其中一份做为对照,其他四份分别加入4种潜在干扰物:胆红素、维生素c、血红蛋白和乳酸,分别用实施例2所制得的测定唾液酸的试剂盒与市售试剂盒进行测定,结果如表12,表13所示:表12实施例2特异性检测结果表13市售试剂盒特异性检测结果表12,表13中两种试剂盒的cb均处于±15%范围内,实施例2所制得的测定唾液酸的试剂盒相对市售试剂盒具有更好的特异性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1