一种人多能干细胞的定向分化方法与流程
本发明属细胞培养分化方法技术领域,更具体地说,本发明涉及一种利用人多能干细胞在无外源造血细胞因子、无血清、无基质细胞、成分明确的培养条件下进行定向分化的方法。
背景技术:
在体外利用人多能干细胞(hpscs)进行定向分化,为规模化获得临床级别治疗用的造血祖细胞和成熟血细胞提供了机会,并为人体早期造血发育中的功能研究提供条件。
通常,利用hpscs进行定向造血发育的培养体系大多利用小鼠细胞系op9、magm-s3、s17、ms-5滋养层细胞进行共培养,这些共培养体系需要使用胎牛血清以维持小鼠基质细胞生长和实现hpscs分化。基质细胞共培养体系对不同批次间血清质量变化、基质细胞培养质量和用于分化的hpscs集落大小非常敏感。小鼠滋养层/基质细胞和胎牛血清均属于成分不明的异源性成分,其存在从根本上阻碍了对微环境在造血发育中的作用的研究。并且,上述培养体系也不能用于获得临床级别治疗用的血细胞。这是因为血清作为一种复杂的混合物,可能含有包括各种对原代细胞和细胞系有害的细胞毒素,并且其组分在不同批次产品之间差异巨大,容易导致细胞培养条件难以控制、且不同批次的血清可以产生不同的细胞分化和分析结果。若在使用血清之前筛选出最佳批次,又存在耗时费钱等问题。此外,商业血清可能含有各种有害污染物,比如病毒,朊病毒和支原体等。
另一种不依靠基质细胞进行hpscs定向造血分化的方法则需要形成类胚体(ebs)。然而,这种途径经常需要使用异源性血清,具有高度变化性和造血发育不同步的缺点。起始细胞团的大小和ebs的大小对hpscs的分化效率影响巨大,由于分化过程中ebs间经常互相粘附,并吸附在培养器皿表面,使得其大小很难控制。在基于ebs的培养体系中,通常先通过添加一系列生长因子以诱导中胚层分化,然后利用高的、往往超出生理浓度范围的细胞因子诱导造血分化,促进血祖细胞扩增,并影响它们的生存和分化潜能。但是,在血液早期发育过程中,初生血液祖细胞的过早扩增可能不利于建立祖细胞的潜能;此外,添加的细胞因子可能导致过早分化、成熟,因此消耗造血祖细胞对多向潜能血祖细胞负面影响可能最大。
有人报道了利用人多能干细胞在成分明确的培养条件下定向分化血细胞的实验方案;此后,还有人对其进行了进一步的优化。优化后的分化体系是利用化学成分明确的培养基,并采用纯化后的细胞外基质蛋白质取代基质细胞。后者实验方案的必备步骤包括在形成中胚层后,向细胞添加外源性细胞因子,并且选择的细胞因子种类和工作浓度是不符合生理条件的,大多数使用的细胞因子并不表达于人类早期发育孕体中。外源性的细胞因子刺激初生血细胞过度增殖并诱导它们进一步成熟为往往只能短暂存活的成熟血细胞。因此,这种培养方式显著地减少了造血祖细胞的数量,并限制了该实验方案的应用范围。另外,该实验方法是基于外源性细胞因子的hpscs定向分化,无法为人体血液发育的功能性研究提供好的模型。这是因为外源性细胞因子激活的细胞通路和内源性信号转导相干扰并影响分子作用,使得研究血液发育的分子机制变得复杂。此外,使用细胞因子进行细胞分化使得费用升高,并且实验可重复性还受到包括源自细胞因子生产过程、细胞因子稳定性、使用失误和细胞因子中的潜在杂质等一系列因素的影响。
综合以上,目前利用hpscs进行造血分化的方法存在一系列问题,包括:培养液中使用动物源性和成分不明的物质、使用滋养层细胞或基质细胞系共培养、添加过高浓度的生长因子诱导中胚层分化,以及使用造血相关细胞因子以扩增新生成的血液细胞。这些问题导致目前造血分化实验的低可重复性,限制了以规模化生产人血细胞为目的的技术应用和针对血细胞功能和机制的研究。而在现有的使用成分明确的培养基进行造血分化的方案中,人多能干细胞造血分化体系中往往添加有高浓度不同种血液细胞因子混合物以驱动造血祖细胞的发育。鉴于添加造血相关细胞因子会负面影响由hpscs产生的造血祖细胞的维持性,显著降低血液祖细胞的得率和增殖能力,因此降低了可用于生物医学领域的功能性血细胞的产量。添加细胞因子的分化手段干扰正常血液发育过程,不适合作为研究人类造血发育过程的模型和用于测试潜在药物。
因此,迫切需要一种使用成分明确的分化培养基、无细胞因子添加的hpsc诱导分化体系以解决上述问题,但此前从未报道过这种策略的成功案例。
技术实现要素:
本发明的目的在于:克服现有利用人多能干细胞进行造血分化的方法中存在的一系列问题和不足,提供一种利用人多能干细胞在成分明确、无细胞因子培养条件下进行定向分化的方法。
为达到上述发明目的,本发明提供了一种人多能干细胞(hpscs)的定向分化方法,其是将人多能干细胞先聚合形成类胚体,然后将类胚体在无外源造血细胞因子、无血清、无基质细胞、成分明确的细胞培养环境下进行二维培养,只添加血管内皮生长因子(vegf)和骨形态发生蛋白4(bmp4)以诱导中胚层发育。整个分化过程在铺有胶原蛋白iv的表面进行,生成造血祖细胞和血细胞。本发明方法中,血液发育在不使用任何外源性造血细胞因子的条件下开始,血液祖细胞依靠人多能干细胞分化产生的内源性因子维持达16~20天。
具体地,本发明人多能干细胞的定向分化方法包括如下步骤:
(1)将人多能干细胞在铺有matrigel的无血清mtesr1培养液中进行常规培养;
(2)将步骤(1)培养的人多能干细胞制成单细胞悬液,经离心、重悬后,加入培养板中培养,形成类胚体;
(3)将步骤(2)所得类胚体培养24h后,用添加了人血管内皮生长因子、人骨形态发生蛋白4和thiazovivin的mtesr1培养液悬浮类胚体,然后使类胚体贴附于铺有胶原蛋白iv的表面进行贴附培养;
(4)在类胚体贴附培养48h后,换成添加有人血管内皮生长因子的stemlineii培养液继续培养,生成造血祖细胞和血细胞。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,本发明所述人多能干细胞可以是人胚胎干细胞(hescs)、人细胞核移植胚胎干细胞(hnt-escs)或人诱导多功能干细胞(hipscs)。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(2)中,所述单细胞悬液可加入到aggrewell400培养板中进行培养形成类胚体,每个培养孔的加入量为4×105~2×106个细胞。
更优选地,上述每个培养孔的加入量为1×106个细胞,以形成最佳数量的类胚体。
可以理解的是,步骤(2)中,所述单细胞悬液也可以加入aggrewell400培养板以外的其它品牌和型号的细胞培养板中进行培养,每个培养孔的加入量也会随之发生变化。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(2)中,每个所述类胚体包含200~500个细胞。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(3)中,所述人血管内皮生长因子的添加量为2~100ng/ml,且当其添加量为50ng/ml时,成本效率最佳。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(3)中,所述人骨形态发生蛋白4的添加量为1~40ng/ml,且当其添加量为1~2ng/ml时,为促进造血分化的最佳浓度。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(3)中,所述thiazovivin的浓度为1~20μm,且当其浓度为10μm时,对类胚体的贴附和细胞分化最为有利。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(3)中,类胚体贴附于铺有胶原蛋白iv的表面进行贴附培养时,所述类胚体的接种密度为15~20个类胚体/cm2。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(3)中,所述胶原蛋白iv为小鼠胶原蛋白iv或人胶原蛋白iv。
更进一步地,所述胶原蛋白iv的铺设量为0.2~10μg/cm2;实验发现,铺设过高浓度的胶原蛋白iv会对造血分化产生消极影响,当胶原蛋白iv的铺设量为0.5μg/cm2时,可达到最佳分化效果。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(4)中,以stemlineii培养液继续培养的培养环境为5%二氧化碳、21%氧气、37℃加湿培养环境。本发明在不同种细胞系之间(hesc细胞系,如h1、h9、mel1、hn14;以及hipsc细胞系,如ips9、ips12)试验发现,传统细胞分化培养所常用的低氧环境(5%氧气,5%二氧化碳)应用于本发明方法中,并不能提高血细胞的得率。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,步骤(4)中,所述stemlineii培养液还添加有非必需氨基酸、glutamax和/或β-巯基乙醇,以达到更好的分化效果。
作为本发明人多能干细胞的定向分化方法的一种优选技术方案,所述stemlineii培养液可替换为其它成分明确、无血清的培养液,如可替换为stemspansfem培养液或stemdiffapel培养液。stemspansfem培养液与stemlineii培养液相比,生成人血细胞和血祖细胞得率稍低;stemdiffapel培养液与stemlineii培养液相比,能生成等数目或更多的多向潜能血祖细胞。
本发明人多能干细胞的定向分化方法不仅可以用于生成造血祖细胞和血细胞,还可用于有效生成cd31+cd146+ve-cadherin+cd34+的内皮细胞和cd31-cd146+的间充质细胞。当期望定向分化为内皮细胞和/或间充质细胞时,可在分化第0~2天添加activina(0.5~2ng/ml)微微促进cd34+cd43-和cd34+cd43+原始血液细胞的发育,并在此阶段在培养液中选择性添加碱性成纤维细胞生长因子(fgf2)。
相对于现有技术,本发明人多能干细胞的定向分化方法具有如下有益效果:
(1)本发明使用成分明确且不添加造血细胞因子的培养条件下实现造血分化,可提高分化获得的血细胞产量和质量,还可更准确地还原人体胚胎发育过程,适合作为研究人类血液发育分子机制的模型。
(2)本发明定向分化方法不使用血清和基质细胞,最少量地使用外部诱导因子,具有成本低,操作步骤简单、容易扩大培养、培养条件易于控制、血液分化过程有序的优点,避免血清中不明成分造成负面影响,显著提高了该方法的可重复性。
(3)本发明定向分化方法能大量产生可分化为成熟血细胞的造血祖细胞和cd45抗原高表达细胞、巨噬细胞和树突状细胞。
(4)利用本发明定向分化方法,还可通过敲除关键造血基因高度重演人体血液发育过程,在人体血液发育过程的机制研究中具有重要意义。
附图说明
下面结合附图和具体实施方式,对本发明人多能干细胞的定向分化方法和有益效果进行详细说明。
图1为本发明人多能干细胞的定向分化方法的流程示意图。
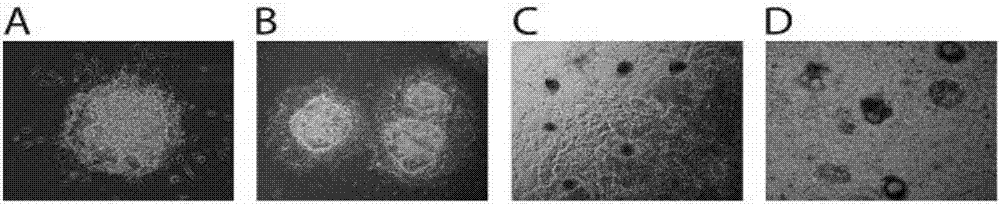
图2为本发明实施例中类胚体在培养皿底部培养的电子显微镜图像,将第零天定义为类胚体被冲出aggrewell培养板并铺于胶原蛋白iv表面的当天;其中,a为分化第二天附着的类胚体;b为分化第四天附着的类胚体;c为分化第六天形成的血管状丛;d为分化第十二天时产生的大量非附着血细胞。
图3显示本发明定向分化方法过程中的表观特征——“体外血岛”,即形成的血管丛状结构和产生最早cd43+血细胞的ve-cadherin+血细胞团;其中,a为人胚胎干细胞h1细胞系分化第六天的情况;b为人胚胎干细胞h1细胞系分化第八天的情况;上排为显微镜明场视野,下排为免疫细胞化学染色结果。
图4显示本发明定向分化方法中,人多能干细胞不同分化时期血液和内皮相关细胞表面抗原的表达情况;其中,a显示早期cd43+血细胞(灰色标示)共表达cd146(间充质性)和cd31(内皮性)抗原;分化晚期,表达这三个抗原的细胞群逐渐分开;b显示cd235a抗原(glycophorina)表达持续降低,以及cd41a+细胞增多,cd33+细胞用灰色标记;c显示cd43+早期血细胞为cd31+(灰色标示),并表达低水平ve-cadherin。
图5显示本发明定向分化方法中,人多能干细胞随着分化逐渐丧失其全能性,并分化为造血祖细胞;其中,a显示造血分化起始阶段,人多能干细胞全能性抗原表达下调;分化第六至八天,e-cadherin(cdh1,cd324)表达于一群未成熟红系细胞上;b显示不同时间点,cd43+cd45+血祖细胞在无细胞因子条件下分化情况,且cd45+细胞在分化第十天后,占所有活细胞数64%之多。
图6为本发明方法定向分化后所得细胞进行血细胞集落数分析结果,分化的全细胞在消化后加入无血清甲基纤维素培养基培养,14~18天后对集落进行计数;其中,a为利用人多能干细胞分化第12天和16天细胞进行集落分析的血细胞集落数,注意产生cfu-mix(红系髓系)和cfu-g,m,gm(髓系)的造血祖细胞随着分化得以保持或增加;b显示利用ips12细胞系分化,第十六天血祖细胞全存在于cd43+细胞群中;c为几种利用人多能干细胞分化形成的典型血细胞集落形态;a和b中均是以四个柱为一组进行比较的柱状图,每四个柱中,从左至右依次为:cfu-e,bfu-e、cfu-g/m/gm和cfu-mix。
图7为cd43+和cd43-细胞中转录因子(tfs)、细胞因子受体和其它血祖细胞相关基因表达水平情况;rnaseq转录组分析源于本发明定向分化方法第十二天的细胞;cd43+和cd43-细胞群各三个重复被用于分析。
具体实施方式
为了使本发明的目的、技术方案和有益技术效果更加清晰,以下结合实施例,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的实施例仅仅是为了解释本发明,并非为了限定本发明,实施例的参数、比例等可因地制宜做出选择而对结果并无实质性影响。
实施例1
(1)人多能干细胞(hpscs)在铺有matrigel的无血清mtesr1培养液中进行常规培养。在对hpscs进行3~5次短间隔的传代后,对处于指数生长阶段的细胞用胰蛋白酶消化成单细胞悬液。离心后接着用含有1μmthiazovivin的mtesr1培养液重悬浮细胞,并将单细胞悬液加入aggrewell培养板中形成ebs,每个agreewell400型号培养孔一百万细胞。每个eb含有200~500个细胞。
(2)ebs在标准hpscs培养条件下(5%二氧化碳,21%氧气,37℃,加湿环境)培养24h,之后小心将ebs用移液器吹打出来,用含有50ng/ml的hvegf165,2ng/mlhbmp4和10μmthiazovivin的mtesr1培养液悬浮后,加在铺有小鼠或人胶原蛋白iv(0.5μg/cm2)的塑料培养板上培养。ebs的培养密度为每平方厘米15~20个。在分化第0到第2天添加activina(0.5~2ng/ml)微微促进cd34+cd43-和cd34+cd43+原始血液细胞的发育。
(3)ebs在培养皿底部附着培养48小时(请参见图2)后,将培养液换成添加有非必须氨基酸,glutamax,2-mercaptoethano和50ng/mlhvegf165的stemlineii(5%二氧化碳,21%氧气,37℃,加湿环境)。从此阶段起,每隔一天换一半培养液,换液时应小心以避免吸走沉积在底部的非粘附性血细胞(本发明定向分化流程请参见图1)。
请参见图3,图3显示本实施例定向分化过程中的表观特征——“体外血岛”,即形成的血管丛状结构和产生最早cd43+血细胞的ve-cadherin+血细胞团;可以看出,在人胚胎干细胞h1细胞系分化第六天,cd43+血细胞出现在“体外血岛”的周围;人胚胎干细胞h1细胞系分化第八天,体外血岛造血和血细胞分散,cd43+血细胞开始从ve-cadherin+“体外血岛”向外分散。注意“体外血岛”坐落于ve-cadherin+的单层内皮细胞上。
在利用hesc细胞系h1进行分化时,最早的cd43+血细胞出现于分化第四天,cd43+cd45+血祖细胞最先在分化第八天被检测到,之后cd43+cd45+细胞群分化并扩增占到整个培养体系中超过50%的细胞(请参见图5)。分化第十天后,cd45高表达细胞群主要包括成熟的巨噬细胞和树突状细胞。在分化过程中内皮细胞表达高水平的ve-cadherin、cd34和cd31,而血细胞中这些表面抗原处于低至中表达水平。cd43+血细胞上的内皮抗原表达水平随着分化的持续而稳步降低。由图4可见,早期cd43+血细胞共表达cd146(间充质性)和cd31(内皮性)抗原;分化晚期,表达这三个抗原的细胞群逐渐分开;cd235a抗原(glycophorina)表达持续降低,以及cd41a+细胞增多;cd43+早期血细胞为cd31+,并表达低水平ve-cadherin。
实施例2
本实施例提供了扩大细胞培养规模的方法,步骤同实施例1,不同之处是在分化第二至四天时,用胰酶处理细胞,然后重新铺回包被有胶原蛋白iv的培养板或培养皿上,再在标准培养环境下孵育1h。接着轻轻吹打吸除仍悬浮或半吸附状态的细胞,以除去残存的非分化hpscs。吸附的细胞部分可以在原来的培养皿内继续按上述条件培养,或按照每平方厘米一万细胞数的密度播种在新的胶原蛋白iv包被过的培养皿内培养。本实施例方法可以扩大整个细胞培养规模约十倍。
实验例1
为了分析分化过程中生成的血祖细胞,处于不同分化阶段的全细胞或分选后细胞被添加到含有人细胞因子scf、g-csf、gm-csf、il-3、il-6和epo的无血清甲基纤维素培养基中进行集落分析。最早的血祖细胞出现于分化第四天。大部分具有血液集落生成能力的血细胞存在于悬浮细胞部分。基本上所有血祖细胞都存在于cd43+细胞群中(请参见图6)。cd43+细胞与cd43-细胞相比,高表达很多血细胞相关基因(请参见图7)。在分化的早期,红系祖细胞和多向潜能祖细胞(cfu-e,bfu-eandcfu-mix)是主要产生的造血祖细胞。在分化后期(分化第十四至十六天),由于无添加外源性细胞因子,多向潜能祖细胞得以很好维持。髓系祖细胞(cfu-m,cfu-g,cfu-gm)显著增长,而红系cfu-es大量减少(请参见图6)。
根据上述说明书的揭示和教导,本发明所属领域的技术人员还可以对上述实施方式进行适当的变更和修改。因此,本发明并不局限于上面揭示和描述的具体实施方式,对本发明的一些修改和变更也应当落入本发明的权利要求的保护范围内。此外,尽管本说明书中使用了一些特定的术语,但这些术语只是为了方便说明,并不对本发明构成任何限制。
- 还没有人留言评论。精彩留言会获得点赞!