一种电化学发光探针三联吡啶钌‑CBT及其制备方法与应用与流程
本发明涉及生物检测技术领域,特别涉及一种电化学发光探针三联吡啶钌-cbt(ru(bpy)32+-cbt)及其制备方法与应用。
背景技术:
蛋白酶是一组能够在特定的活性位点将蛋白质或寡肽酶解成更小碎片的蛋白水解酶。蛋白酶的存在非常丰富,几乎存在于所有的生物体中,这些酶几乎参与生物体所有的生物过程,其活性与许多疾病密切相关,因此蛋白酶常被用作药物治疗的靶点和疾病诊断的标志物。研究发现,蛋白酶在许多生理过程中起着关键性作用,包括蛋白质消化、血管生成、血液凝固、创伤修复、细胞自噬、衰老、坏死、细胞凋亡和dna遗传信息的传递等生物过程。蛋白酶种类繁多,包含胰蛋白酶、caspase家族蛋白酶、凝血酶、基质金属蛋白酶(mmp)、组织蛋白酶等,在体内发挥着各不相同的作用。许多蛋白酶已经成为疾病预测及诊断的生物检测靶点,因此,建立一种高灵敏且通用的蛋白酶活性检测方法,基础科学研究和疾病临床诊断领域具有重要意义。
目前,较常见的检测蛋白酶活性的方法有荧光法、比色法、电化学法、化学发光法和电化学发光法等,荧光法应用较早且用途广泛,已经发展得相当成熟,近年来不断有基于荧光法的纳米材料探针用于蛋白酶活性的体外检测和活细胞内实时原位检测的方法报道,但该类纳米探针制备有极强的技术性和很高的成本,严重限制了其临床应用。而比色法的不足之处在于不能达到足够高的灵敏度和稳定性,而且容易受杂质干扰而影响检测的精准度。电化学法具有灵敏度好、准确度高和选择性好的优点,但是多数高灵敏的检测平台多是在前期进行了繁琐的电极修饰,是的该类方法的技术要求较高,且由于通用性不足,间接增加了该类平台的检测成本。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的首要目的在于提供一种电化学发光探针ru(bpy)32+-cbt的制备方法。
本发明的另一目的在于提供通过上述制备方法制备得到的电化学发光探针ru(bpy)32+-cbt。
本发明的再一目的在于提供一种基于电化学发光探针ru(bpy)32+-cbt检测蛋白酶活性的方法。
该方法是一种基于功能化的电化学发光探针自发且特异性的与被蛋白酶切割后的多肽底物组装反应,对蛋白酶进行高灵敏度和高特异性检测的平台。
本发明的目的通过下述技术方案实现:
一种电化学发光探针ru(bpy)32+-cbt的制备方法,包括如下步骤:
(1)在cabt(6-氨基-2-氰基苯并噻唑)上引入活泼氨基,得到活泼氨基-cbt,用于修饰到三联吡啶钌上;
(2)通过氨基、羧基脱水缩合作用将活泼氨基-cbt修饰到ru(bpy)32+上,得到电化学发光探针ru(bpy)32+-cbt。
步骤(1)中所述的cabt(6-氨基-2-氰基苯并噻唑)购自上海欧堃化学有限公司。
步骤(1)中所述的活泼氨基-cbt优选为glycine-cbt;
所述的glycine-cbt合成步骤如下:
1)称取boc-glycine(n-叔丁氧羰基-甘氨酸)和nmm(n-甲基吗啡啉)到thf(四氢呋喃)中;
2)在0℃氮气保护条件下加入氯甲酸异丁酯,反应;
3)向步骤2)的反应溶液中加入cabt,0℃搅拌反应后,再室温下搅拌反应;
4)向步骤3)的反应溶液中加入饱和nahco3,再用乙酸乙酯萃取,并用无水硫酸钠干燥有机相;
5)通过减压旋蒸去除有机相后,利用硅胶柱层析纯化产物,二氯甲烷/甲醇洗脱终产物boc-glycine-cbt;
6)将步骤5)所得产物用二氯甲烷溶解,加入tfa(三氟乙酸),室温下反应;
7)纯化获得glycine-cbt;
步骤1)中所述的boc-glycine和nmm的质量比为7:6;
步骤1)中所述的nmm的浓度为7.5mg/ml;
步骤2)中所述的氯甲酸异丁酯与nmm的质量比为2:3;
步骤2)中所述的反应的条件为0℃反应30min;
步骤3)中所述的cabt与boc-glycine的质量比为1:2;
步骤3)中所述的0℃搅拌反应的时间为2h;
步骤3)中所述的室温下搅拌反应的时间为12h;
步骤5)中所述的二氯甲烷/甲醇中二氯甲烷与甲醇的体积比为10:1~5:1;
步骤6)中所述的tfa的终浓度为20%;
步骤6)中所述的室温下反应的时间为12h;
步骤(2)中所述的ru(bpy)32+来自ru(bpy)2dcbpy(pf6)2,ru(bpy)2dcbpy(pf6)2合成步骤如下:
1)称取0.1g二氯双(2,2′-联吡啶)钌、0.1gnahco3和0.075g4,4′-二羧酸-2,2′-联吡啶,80℃搅拌回流反应10h。
2)冰浴2h后,用1m硫酸调节ph值至4.4,滤纸过滤除去未反应的4,4′-二羧酸-2,2′-联吡啶,用2~3ml甲醇进一步冲洗滤纸。
3)向上述滤液中加入6.25mlnapf6溶液,室温下搅拌反应2h,用1m硫酸调节ph值至4,冰浴4h。
4)4℃5000rpm离心5min,收集析出晶体,冻干干燥产物,得到ru(bpy)2dcbpy(pf6)2。
5)称取230mgdcc和120mgnhs搅拌溶解于2ml无水dmf中,然后置于冰上。
6)向上述混合物中加入190mg三联吡啶钌,于冰水浴中搅拌反应30min,在室温反应5h。
7)于5000g,4℃离心5min,弃去沉淀,得到ru(bpy)2dcbpy-nhs溶液。
步骤(2)所述的将活泼氨基-cbt修饰到ru(bpy)2dcbpy(pf6)2上的反应步骤及体系如下:
a)取23.3mg活泼氨基-cbt缓慢加入到1.5mlru(bpy)2dcbpy-nhs溶液中,室温搅拌反应12h。
b)向上述反应体系中加入100ml去离子水,用10×100ml乙酸乙酯萃取产物,并用无水na2so4干燥。
c)通过减压旋蒸去除有机相后,利用硅胶柱层析纯化产物,二氯甲烷/甲醇(二氯甲烷:甲醇=5:1~1:1)洗脱终产物ru(bpy)32+-cbt。
一种电化学发光探针ru(bpy)32+-cbt,通过上述制备方法制备得到。
所述的电化学发光探针ru(bpy)32+-cbt在检测蛋白酶活性中的应用。
一种基于电化学发光探针ru(bpy)32+-cbt检测蛋白酶活性的方法,包括如下步骤:
(ⅰ)多肽底物与待检蛋白酶样品共孵育,然后加入蛋白酶抑制剂终止酶切反应,得到蛋白酶切产物ck-biotin;
所述的多肽底物序列模式为xxxxck-biotin,xxxx为蛋白酶特异性识别序列,多肽底物在被蛋白酶切割后会产生一个二肽cys-lys-biotin;
(ⅱ)电化学发光探针ru(bpy)32+-cbt与蛋白酶切产物ck-biotin组装反应,生成组装复合物ru(bpy)32+-cbt-ck-biotin;
(ⅲ)利用链霉亲和素包被的磁珠富集、分离复合物ru(bpy)32+-cbt-ck-biotin;
(ⅳ)对步骤(ⅲ)分离得到的ru(bpy)32+-cbt-ck-biotin进行电化学发光分析,从而间接反映蛋白酶的催化量。
步骤(ⅰ)中所述的蛋白酶需要具备这一特点:其所识别的多肽底物的序列是特异的,且允许在酶切位点碳末端一侧设计一个半胱氨酸。
步骤(ⅰ)中所述的多肽底物工作浓度优选为1μm。
步骤(ⅱ)中所述的电化学发光探针ru(bpy)32+-cbt与酶切产物ck-biotin组装反应的条件优选为:室温下温和震荡反应15~60min;优选为30min。
步骤(ⅱ)中所述的电化学发光探针ru(bpy)32+-cbt工作浓度优选为5μm。
步骤(ⅲ)中所述的链霉亲和素包被的磁珠对形成的组装复合物ru(bpy)32+-cbt-ck-biotin的富集及分离条件优选为:将磁珠加入到酶切溶液体系中后,室温下温和震荡反应15~30min(优选为15min),用磁分离架将磁珠与溶液分离,每个样品再分别用pbs温和重悬洗涤4次,最终用pbs重悬磁珠。
步骤(ⅳ)中所述的电化学发光分析平台为罗氏elecsys2010电化学发光全自动免疫分析仪及相关配套试剂。
本发明的基本原理如图1所示:
在这项研究中,我们首次将2-cyanobenzothiazole(cbt)和cysteine间的缩合反应应用于电化学发光发检测蛋白酶活性。cbt-cysteine缩合反应最初被发现发生在d-萤光素的生物合成过程中,这一反应可以在生理条件下快速进行,二级反应速率常数达到9.19m-1s-1。cbt与cysteine反应后生成新的稳定的化合物,cbt与不含有1,2-氨基硫醇的物质不会发生反应,如谷胱甘肽。研究表明,当cbt与一种链内部含有半胱氨酸残基的肽链不发生反应,这些都说明cbt只能与肽链n末端的半胱氨酸反应。我们在此将该种原理应用于蛋白酶的检测中,如图1.a,将cbt修饰到三联吡啶钌上,设计出能够特异性标记n末端半胱氨酸的电化学发光探针ru(bpy)32+-cbt。其次,在蛋白酶底物多肽的设计上,在蛋白酶切位点的c末端一侧,引入了一个半胱氨酸,在多肽底物的c末端标记有生物素,这样一个底物在被蛋白酶切割后会生成cys-lys-biotin,ru(bpy)32+-cbt可以特异性的与cys-lys-biotin组装反应,生成化合物ru(bpy)32+-cbt-ck-biotin,该化合物的量蛋白酶的催化量一致。用链霉亲和素磁珠富集和分离上述化合物ru(bpy)32+-cbt-ck-biotin进行电化学发光分析,电化学发光强度反映的则是蛋白酶的催化量,从能够精确且特异的检测蛋白酶活性(图1.b)。
本发明相对于现有技术,具有如下的优点及效果:
(1)本发明的方法更加简单快速,且通用性好,对于不同的靶标蛋白酶的检测,通过更换相应的多肽底物序列,就可以实现对不同蛋白酶的检测,应用范围广,对蛋白酶的检测特异性好,灵敏度高。
(2)探针设计简单,操作步骤简短,易于在科研和临床诊断等领域推广和应用;
(3)检测策略简单,无特殊的材料修饰和处理要求。
附图说明
图1是基于电化学发光检测技术的蛋白酶活性检测方法原理图。
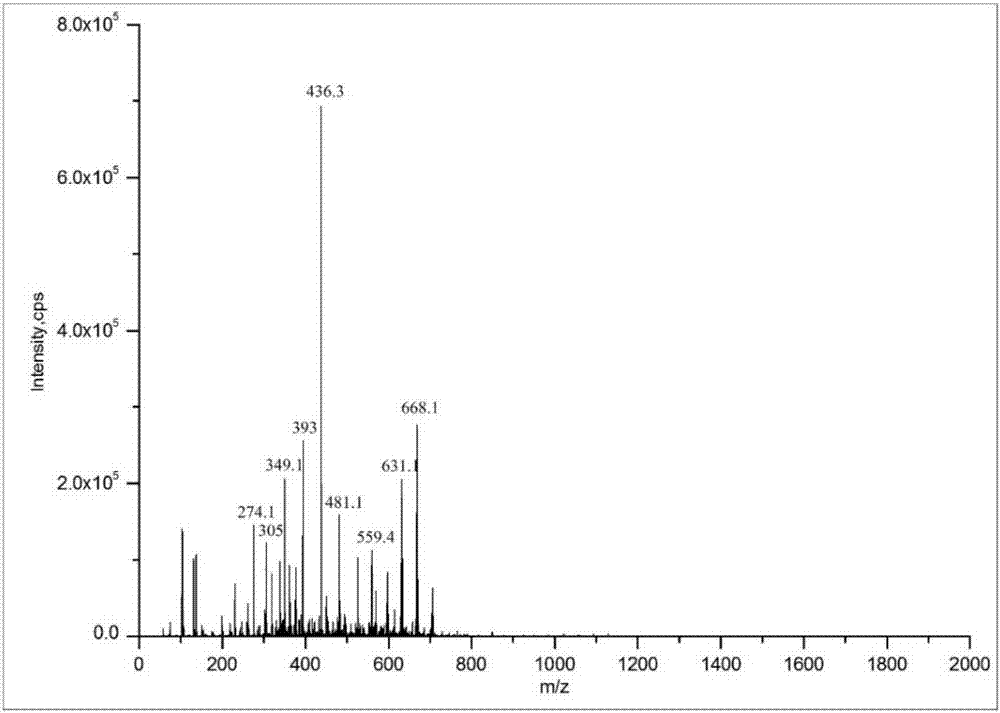
图2是对电化学发光探针ru(bpy)32+-cbt的质谱检测结果。
图3是对本电化学发光平台检测原理的验证。
图4是实施例1获得的本电化学发光平台对胰蛋白酶的检测灵敏度分析。
图5是实施例1获得的本电化学发光平台对caspase-3的检测灵敏度分析。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中未注明具体实验条件的实验方法,通常按照常规实验条件或按照制造厂商所建议的实验条件。
实施例中所用的ru(bpy)2dcbpy(pf6)2在文献中“synthesis,labelingandbioanalyticalapplicationsofatris(2,2′-bipyridyl)ruthenium(ii)-basedelectrochemiluminescenceprobe.2014(9),1146-1159”公开。
实施例1
一种电化学发光探针ru(bpy)32+-cbt的制备方法,具体包括如下步骤:
(1)合成glycine-cbt
合成glycine-cbt,以在cabt上引入活泼氨基,用于修饰到三联吡啶钌上。
具体步骤如下:
1.称取175mgboc-glycine和150mgnmm到20mlthf中。
2.在0℃氮气保护条件下加入100mg氯甲酸异丁酯,0℃反应30min。
3.向上述反应溶液中加入87.5mgcabt(购自上海欧堃化学有限公司),0℃搅拌反应2h后,再室温下搅拌反应12h。
4.向上述反应溶液中加入100ml饱和nahco3,再用3×150ml乙酸乙酯萃取,并用无水硫酸钠干燥有机相。
5.通过减压旋蒸去除有机相后,利用硅胶柱层析纯化产物,二氯甲烷:甲醇(10:1~5:1)洗脱终产物boc-glycine-cbt。
6.将上述所得产物用二氯甲烷溶解,加入tfa至终浓度为20%,室温下反应12h。
7.通过制备型高效液相色谱纯化获得glycine-cbt。
(2)对ru(bpy)32+进行glycine-cbt修饰
通过氨基、羧基脱水缩合作用将glycine-cbt修饰到ru(bpy)32+上,得到ru(bpy)32+-cbt。
具体步骤如下:
所述的ru(bpy)32+来自ru(bpy)2dcbpy(pf6)2,ru(bpy)2dcbpy(pf6)2合成步骤如下:
1.称取0.1g二氯双(2,2′-联吡啶)钌、0.1gnahco3和0.075g4,4′-二羧酸-2,2′联吡啶,80℃搅拌回流反应10h。
2.冰浴2h后,用1m硫酸调节ph值至4.4,滤纸过滤除去未反应的4,4′-二羧酸-2,2′联吡啶,用2~3ml甲醇进一补冲洗滤纸。
3.向上述滤液中加入6.25mlnapf6溶液,室温下搅拌反应2h,用1m硫酸调节ph值至4,冰浴4h。
4.4℃5000rpm离心5min,收集析出晶体,冻干干燥产物,得到ru(bpy)2dcbpy(pf6)2。
5.称取230mgdcc和120mgnhs搅拌溶解于2ml无水dmf中,然后置于冰上。
6.向上述混合物中加入190mg三联吡啶钌,于冰水浴中搅拌反应30min,在室温反应5h。
7.于5000g,4℃离心5min,弃去沉淀,得到ru(bpy)2dcbpy-nhs溶液。
所述的将glycine-cbt修饰到ru(bpy)32+上的反应步骤及体系如下:
1.取23.3mgglycine-cbt缓慢加入到1.5mlru(bpy)2dcbpy-nhs溶液中,室温搅拌反应12h。
2.向上述反应体系中加入100ml去离子水,用10×100ml乙酸乙酯萃取产物,并用无水na2so4干燥。
3.通过减压旋蒸去除有机相后,利用硅胶柱层析纯化产物,二氯甲烷/甲醇(二氯甲烷:甲醇=5:1~1:1)洗脱终产物ru(bpy)32+-cbt。
对得到的产物进行质谱检测,检测结果如图2所示,表明成功制备出了电化学发光探针ru(bpy)32+-cbt。
实施例2
电化学发光平台的检测原理验证
利用一个人工合成的ck-biotin(cys-lys-biotin)模拟蛋白酶切产物,验证探针ru(bpy)32+-cbt的功能及平台的检测可行性。
原理验证实验步骤如下:
1.在100μl的pbs溶液体系中,加入终浓度为1μm的ck-biotin和5μm的ru(bpy)32+-cbt探针,室温条件下震荡反应30min。
2.取200μl链霉亲和素包被的磁珠加入到上述体系中,室温条件下温和震荡反应15min,用磁分离架收集磁珠,弃去上清。用200μlpbs洗涤4次后,再用100μlpbs重悬磁珠,最后将上述产物加入到罗氏elecsys2010电化学发光全自动免疫分析仪进行光电分析,记录数据结果。
对本电化学发光平台检测原理的验证结果,如图3所示,结果表明电化学发光强度随着ck-biotin浓度的增大而增强,且呈线性关系(r2=0.9925),说明电化学发光强度的值能够反映溶液中ck-biotin的量,因此ru(bpy)32+-cbt探针可以用于检测蛋白酶对底物的切割。
实施例3
1.胰蛋白酶与特异性多肽底物的反应时间优化
胰蛋白酶多肽底物trck-biotin(thr-arg-cys-lys-biotin)购自上海强耀生物科技有限公司,胰蛋白酶、pmsf(苯甲基磺酰氟)购自sigma,链霉亲和素包被的磁珠购自罗氏诊断。在100μl的pbs溶液体系中,加入终浓度为1μm的底物trck-biotin和1.5uml-1的胰蛋白酶,分别在37℃温和震荡孵育1、2、3、4、5、7、9min后,加入1μl10μm的pmsf终止酶切反应。向上述体系中加入10μl浓度为50μmru(bpy)32+-cbt探针,室温条件下震荡反应30min后,取200μl链霉亲和素包被的磁珠加入到上述体系中,室温条件下温和震荡反应15min,用磁分离架收集磁珠,弃去上清。用200μlpbs洗涤4次后,再用100μlpbs重悬磁珠,最后将上述产物加入到罗氏elecsys2010电化学发光全自动免疫分析仪进行光电分析,记录数据结果。优化后的酶切反应时间为5分钟。
2.电化学发光系统对胰蛋白酶检测灵敏度的分析
在100μl的pbs溶液体系中,加入终浓度为1μm的底物trck-biotin和终浓度分别为0,5×10-4,1×10-3,5×10-3,1×10-2,5×10-2,1×10-1,5×10-1,1,1.5,3uml-1的胰蛋白酶,37℃温和震荡孵育5min后,加入1μl10μm的pmsf终止酶切反应。向上述体系中加入10μl浓度为50μmru(bpy)32+-cbt探针,室温条件下震荡反应30min后,取200μl链霉亲和素磁珠加入到上述体系中,室温条件下温和震荡反应15min,用磁分离架收集磁珠,弃去上清。用200μlpbs洗涤4次后,再用100μlpbs重悬磁珠,最后将上述产物加入到罗氏elecsys2010电化学发光全自动免疫分析仪进行光电分析,并记录数据结果。检测结果如图4所示,对胰蛋白酶的检测在1×10-3~1.5uml-1的范围内呈线性关系,且根据公式ilod=icontrol+3istdev(con)计算得检测限为8.4×10-4uml-1。
实施例4
1.caspase-3蛋白酶与特异性多肽底物的反应时间优化
caspase-3多肽底物devdck-biotin(asp-glu-val-asp-cys-lys-biotin)购自上海强耀生物科技有限公司,caspase-3蛋白酶购自biovisionincorporated,caspase-3蛋白酶抑制剂ac-devd-cho购自碧云天生物科技。在100μl的pbs溶液体系中,加入终浓度为1μm的底物devdck-biotin和0.0025uml-1的caspase-3蛋白酶,分别在37℃温和震荡孵育1、2、3、4、5、6、7和8h后,加入1μl1μm的ac-devd-cho终止酶切反应。根据实施例3的方法进行ru(bpy)32+-cbt探针的组装反应与后续的分离及检测。根据输出的ecl数据分析得到的最优反应时间是6h。
2.对本电化学发光系统对caspase-3蛋白酶检测灵敏度的分析
在100μl的pbs溶液体系中,加入终浓度为1μm的底物devdck-biotin和终浓度分别为0,2.5×10-6,5×10-6,7.5×10-6,1×10-5,5×10-5,7.5×10-5,1×10-4,5×10-4,1×10-3,1.5×10-3,2×10-3,2.5×10-3,3×10-3,3.5×10-3uml-1的caspase-3蛋白酶,37℃温和震荡孵育6h后,加入1μl1μm的ac-devd-cho终止酶切反应。根据实施例3的方法进行ru(bpy)32+-cbt探针的组装反应与后续的分离及检测。检测结果如图5所示,对caspase-3蛋白酶的检测在5×10-6~1.5×10-3uml-1的范围内呈线性关系,且根据公式ilod=icontrol+3istdev(con)计算得检测限为5×10-6uml-1。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>华南师范大学
<120>一种电化学发光探针三联吡啶钌-cbt及其制备方法与应用
<130>1
<160>2
<170>patentinversion3.5
<210>1
<211>4
<212>prt
<213>artificialsequence
<220>
<223>胰蛋白酶多肽底物
<220>
<221>biotin修饰
<222>(4)..(4)
<400>1
thrargcyslys
1
<210>2
<211>6
<212>prt
<213>artificialsequence
<220>
<223>caspase-3多肽底物
<220>
<221>biotin修饰
<222>(6)..(6)
<400>2
aspgluvalaspcyslys
15
- 还没有人留言评论。精彩留言会获得点赞!