益生菌乳片发酵菌种及其发酵方法与流程
本发明为食品技术领域,具体为植物乳杆菌m8及制备的益生菌大米乳片。
背景技术:
大米含有蛋白质、碳水化合物、维生素、无机盐等多种营养物质,但由于谷物营养物质的储存部位和感官特性影响,谷物制品的营养与口感往往不可兼得。
谷类的蛋白质含量在8%-12%之间,主要存在于谷粒外层,但谷粒外层的口感等感官特性比之里层有差距。为了追求口感,精制米面会去除外层而导致蛋白质含量降低。谷类中含有最多的营养物质是碳水化合物,达70%-80%,大部分以淀粉的状态呈现,是人体热能来源之一。其中淀粉可分为直链和支链两种分子结构,而直链淀粉和支链淀粉二者的含量也直接影响了谷物的加工特点和食用风味。谷物是b族维生素的重要来源,以维生素b1、b2和尼克酸为主,胡萝卜素和维生素e也存在于某些谷物的胚芽中。而胚芽、糊粉层、谷皮涵盖了大部分的维生素,导致了精米、精粉中维生素含量减少。谷类一般含有1.5%的无机盐,以磷和钙为主,同时含有较多的镁。同样的,无机盐的存在部位和其他营养物质相同,所以粗制米面的无机盐含量就相对较高。只是谷物中的无机盐多以植酸盐的形式存在,这并不利于为人体吸收利用。而发酵谷物制品在谷物营养物质的利用、食品的口感和消化性甚至更长的货架期等方面占据了优势。很多微生物在以谷物为底物的环境中可以获得良好的生长态势,并在生化和感官方面大大提升食品性状。微生物在生长代谢过程中所产生的代谢物可以增加食品中的微量营养元素(如矿物质、氨基酸等)、益生菌、益生元、植酸酶和消化酶等营养物质,而微生物本身在改善胃肠道环境,尤其是肠道微生物环境和活性方面具有独特功效。
大米产量及其营养价值较高,而营养价值更高的粗制米面由于口感、滋味的劣势,很大程度上得不到消费者尤其是青少年消费者的欢迎。益生菌在改善食品感官、营养价值等方面具有独特的效用,同时益生菌本身在改善内环境、改善胃肠道环境、提高胃肠道微生物活性等方面也有较大作用。
将大米进行微生物发酵,改善米制品的各项指标,再将大米发酵产物于液氮速冻和常规冷冻干燥处理制成疏松干爽的片剂,生产过程相对简单,具有较高的营养价值和独特的口感。
益生菌大米乳片的研发可以为解决谷物制品营养价值与食品口感难以兼备的问题提供一种可行的解决方式。
技术实现要素:
本发明的目的在于提供一种植物乳杆菌m8(lactobacillusplantarumm8),保藏编号为cctccm2015806,2015年12月30日保藏于中国典型培养物保藏中心,湖北,武汉。
植物乳杆菌m816srdna的核苷酸序列如seqidno:1所示。
在上述技术方案的基础上,本发明还提供一种发酵剂,包含所述的植物乳杆菌m8(lactobacillusplantarumm8),保藏编号为cctccm2015806,2015年12月30日保藏于中国典型培养物保藏中心,湖北,武汉。
在上述技术方案的基础上,本发明将所述的植物乳杆菌m8或发酵剂在发酵制作益生菌乳片上的应用。
上述的益生菌乳片为益生菌大米乳片。其制备方法包括如下步骤:
①糊化:将米粉和水混合后沸水浴糊化,糊化过程中不断搅拌保证糊化均匀;
②酶解:向步骤①中加入中温α-淀粉酶和糖化酶(中温α-淀粉酶的加入量为1-5u/g,糖化酶的加入量为20-25u/g),酶解10-30min;
③加糖:按样品总质量的1-7%加入白砂糖(进一步优选为白砂糖的接入量为2%),搅拌均匀;
④灭菌:将样品装入密封容器中,置于沸水中15min以杀灭杂菌;
⑤接种发酵:待样品冷却后,在超净工作台中,向样品接入菌种或发酵剂(菌种或发酵剂的接种量为原料总重量的0.1-0.5%),在30-35℃生化培养箱中,恒温培养10-12h,完成发酵;
⑥预冻:将发酵样品分装至小型容器,用保鲜膜封口,置入液氮速冻3min,至产品心部冻结;
⑦冻干:将预冻样品放入冻干机,冷冻干燥24h;
⑧包装:冻干产品取出后用常态包装。
本发明确定了淀粉充分水解的条件和适宜的辅料配方,开发了液氮预冻制作益生菌大米乳片的工艺。菌种比例对乳液的特性有影响,等量的比例菌种具有较高的胃耐受力。植物乳杆菌m8(lactobacillusplantarumm8)接种比例为0.3%时,乳片的感官品质最好,乳液的清除自由基能力较强。
附图说明
图1为本发明的工艺流程。
图2为[dpph·]清除能力标准曲线。
图3为可溶性蛋白标准曲线。
图4为游离氨基酸标准曲线。
图5为酶解时间对淀粉水解程度的影响。
图6为菌种比例对乳液滴定酸度的影响。
图7为菌种比例对乳液自由基清除能力的影响。
图8为菌种比例对乳液可溶性蛋白的影响。
图9为菌种比例对乳液游离氨基酸的影响。
图10为菌种比例对乳片活菌数的影响。
图11为模拟胃液耐受力(ph=2.0处理)。
图12为模拟胃液耐受力(ph=3.0处理)。
图13为空白样益生菌活力(ph=6.8处理)。
图14为产品性状。
图15为菌株植物乳杆菌m8(lactobacillusplantarumm8)的显微镜照片。
图16为菌株植物乳杆菌m8(lactobacillusplantarumm8)的pcr扩增电泳图。
图17为基于18srdna序列构建的植物乳杆菌m8(lactobacillusplantarumm8)的系统进化树。
图18为本发明植物乳杆菌m8(lactobacillusplantarumm8)的生长曲线和ph值。
具体实施方式
材料与方法
材料来源
米粉,黄冈东坡粮油集团有限公司生产的籼米粉。益生菌:植物乳杆菌m8(lactobacillusplantarumm8),本实验室筛自传统米浆的菌种,实验室保藏。中温α-淀粉酶(1.15万u/g),糖化酶(11.25万u/g),和氏璧生物技术有限公司生产。白砂糖,购自中百超市。
主要试剂
主要仪器
制作工艺:
①糊化:将米粉和水按1:5的比例混合,沸水浴糊化30min。糊化过程中不断搅拌保证糊化均匀。
②酶解:按比例加入中温α-淀粉酶(3u/g)和糖化酶(22u/g),酶解15min,酶解过程不断搅拌。
③加糖:按样品总量的2%加入白砂糖,搅拌均匀。
④灭菌:将样品装入密封容器中,置于沸水中15min以杀灭杂菌。
⑤接种发酵:待样品冷却后,在超净工作台中,向样品接入0.5%菌种,在35℃生化培养箱中,恒温培养12h。发酵完成后,视样品稠度加入少量增稠剂(0.5%卡拉胶)。
⑥预冻:将发酵样品分装至小型容器,用保鲜膜封口,置入液氮速冻3min,至产品心部冻结。
⑦冻干:将预冻样品放入冻干机,冷冻干燥24h。
⑧包装:冻干产品取出后用常态包装。
实验用菌种的培养
植物乳杆菌m8(lactobacillusplantarumm8):(1)纯化培养:配制mrs琼脂培养基(7.83gmrs粉末/150ml,加入1.5%-2%琼脂),在全自动反压高温灭菌锅中,以121℃/20min条件灭菌。将培养基分倒入平板,并接入植物乳杆菌m8,在37℃生化培养箱中培养24h。活化培养2代。(2)扩大培养:配制mrs液体培养基(7.5gmrs粉末/150ml),高温高压灭菌。冷却后取纯化培养得菌株接入mrs液体培养基,在37℃生化培养箱中培养24h。(3)离心分离:将扩大培养菌液在超净工作台中转移至50ml离心管,4000r/min离心3min。倒去上层清液,取菌泥加入少量无菌生理盐水,混匀后再次离心取下层菌泥,重复三次。将最后的菌泥,用少量生理盐水混合后,置于-4℃冰箱保存备用。
ph测量
ph的测量用ph计直接进行测量。
2.4.4滴定酸度的测定
滴定酸度的测定参照《食品分析》(第二版)。取样品1ml,用蒸馏水稀释十倍,以1%酚酞试剂作为指示剂,用0.1mol/lnaoh滴定,至样品变红且30s内不变色。滴定酸度的计算式如下:
式中:c表示标准氢氧化钠溶液的浓度,mol/l;v表示滴定消耗标准氢氧化钠的体积,ml;m表示样品体积,ml;k为换算系数,即以1mmolnaoh换算主要酸的比例。
其中,1%酚酞试剂用100ml95%乙醇溶解1g酚酞;naoh标准溶液在滴定前用邻苯二甲酸氢钾标定(准确称取0.4~0.6g(精确至0.0001g)邻苯二甲酸氢钾溶于50ml蒸馏水),以1%酚酞试剂为指示剂。同时做空白实验。计算式:
本实验中,当发酵进行到0h、6h和12h时,在超净工作台中取样。标定用的基准邻苯二甲酸氢钾的取用量为0.5667g,标定使用的氢氧化钠标准溶液的体积为26.52ml,空白实验用的氢氧化钠标准溶液体积为0.05ml,计算得氢氧化钠溶液的浓度为0.113mol/l。取用的样品为1ml,稀释至10ml,进行滴定。其中k值取0.090。
自由基清除能力测定
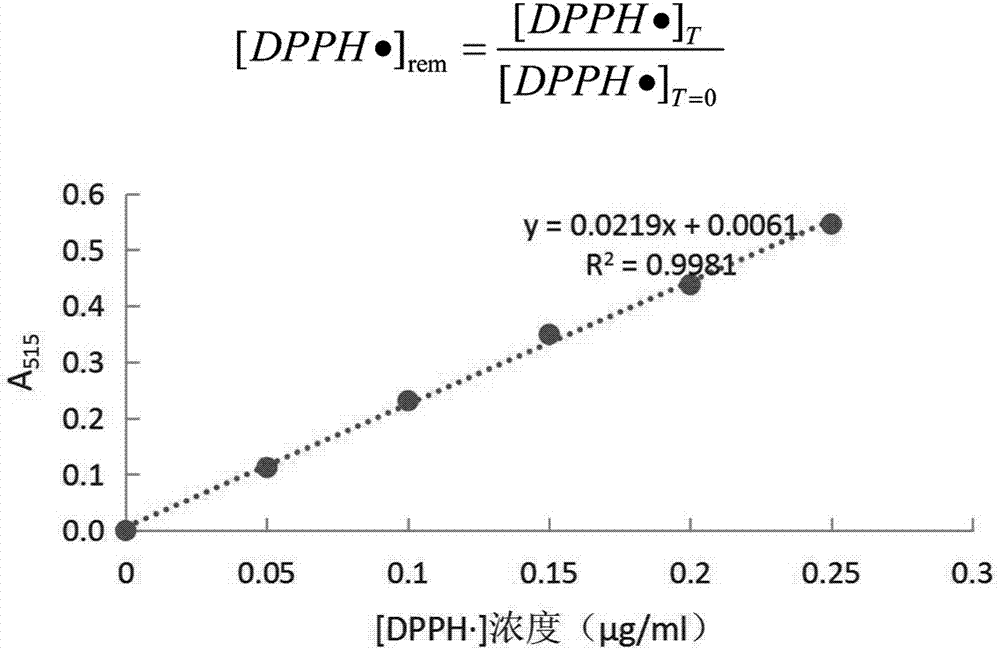
自由基清除能力的测定参照李春时等的dpph法。测定是利用抗氧化物质与自由基的结合降低[dpph·]含量,降低溶液吸光度,由此得到对样品自由基清除能力的评估。(1)标准曲线制作:以甲醇为溶剂配置0.025mg/ml[dpph·]标准溶液。制取质量浓度为0、5、10、15、20、25μg/ml的梯度溶液。在515nm处比色,制作标准曲线。标准曲线如图2。(2)样品:用甲醇将样品稀释至不同浓度,分别取0.1ml,加入3.9ml25mg/l的[dpph·]标准液,用甲醇定容至10ml。用甲醇代替样液作为空白。在515nm处测定吸光值。将样品的吸光值与标准曲线对照,可以得到样品中[dpph·]的残留量。其中,空白对照中含有[dpph·]39μg。本实验中取样同上,最终的测定的样品没有进行稀释。
[dpph·]残留率的计算用下列公式计算:
可溶性蛋白质含量的测定
可溶性蛋白质含量的测定参照赵英永等用的考马斯亮蓝g-250染色法。
①考马斯亮蓝试剂的制备:用50ml95%乙醇溶解100mg考马斯亮蓝g-250,并加入100ml85%磷酸,用蒸馏水定容到1000ml。
②标准蛋白溶液的制备:用0.15mol/l的nacl溶液将结晶牛血清蛋白配制成1mg/ml蛋白溶液。
③标准曲线:用标准蛋白溶液、0.15mol/lnacl溶液和考马斯亮蓝溶液配制梯度溶液,各试剂按表2添加。
表2考马斯亮蓝测可溶性蛋白标准曲线
取0号管为空白,在595nm处测定吸光值。
以吸光值a595为纵坐标、标准蛋白浓度为横坐标,绘制标准曲线,如图3。
④待测样液:取0.1ml样液,加入5ml考马斯亮蓝,在595nm处测定吸光值,使吸光值位于标准曲线范围内,并将吸光值换算为蛋白质含量。样液的取用同上。
游离氨基酸含量的检测
氨基酸含量的检测采用邵金良等采用的茚三酮比色法。
①氨基酸标准曲线的制作:准确称取100mg亮氨酸(精确至0.0001g)溶于100ml蒸馏水中,作为母液。将母液稀释至亮氨酸含量为0.1mg/ml,作为标准溶液。取氨基酸标液2.5、3.0、3.5、4.0、4.5、5.0、5.5ml,加入ph为8.0的磷酸缓冲液和2%茚三酮溶液各0.5ml,沸水浴加热15min,加蒸馏水定容至25ml。
在570nm处比色,并绘制标准曲线,如图4。
②茚三酮溶液的配制:称取水合茚三酮2g和氯化亚锡(sncl2·2h2o)50mg,加50ml蒸馏水,搅拌均匀,放在暗处静置24h。过滤后加水定容至100ml。
③样液处理:取1ml样品,稀释至5ml,再取0.5ml稀释液,加入0.5ml磷酸缓冲液和0.5ml茚三酮溶液。在570nm进行比色。对比标准曲线计算样液中的游离氨基酸含量。样液的取用同上。
其中,ph为8.0的磷酸缓冲液由5.3ml甲液(0.2mol/lnah2po4·2h2o溶液,31.21g/l)和94.7ml乙液(0.2mol/lna2hpo4·12h2o溶液,71.64g/l)均匀混合为100ml溶液而成。
酶解程度的测定
酶解程度的测定采用碘兰值的测定方法。取酶解液1ml于50ml比色管中,加入蒸馏水20ml、2ml0.1mol/lhcl、0.5ml碘试剂,在用蒸馏水定容至50ml。静置15min,与620nm处比色,测定吸光值。用吸光值表示碘兰值。其中,空白样以蒸馏水代替酶解液;碘试剂:2gki、0.2gi2,定容至100ml。
乳片初始活菌数的测定
样品的制备:精确称取1g样品,研磨后溶于10ml生理盐水作为稀释浓度为10-1的样品备用。
益生菌活菌数的测定采用平板计数法。测定植物乳杆菌m8(lactobacillusplantarumm8)活菌数需准备mrs固体培养基,将样品依次稀释至10-6,取10-4、10-5、10-6的稀释液0.1ml加入固体培养基平板中,用涂布器涂布均匀。将mrs固体培养基置于37℃的生化培养箱中恒温培养24h。培养完成后,平板计数。模拟胃液耐受力的研究
益生菌胃酸耐受力的研究采用的是charteris等使用的模拟胃液的方法。模拟胃液的制备用磷酸缓冲液溶解胃蛋白酶(0.3%,w/v)制备。缓冲液用hcl调整至ph为2.0、3.0和6.8(空白),并用高温高压灭菌锅在121℃条件下灭菌15min。分别取1g乳片研磨后,加入各个ph的10ml缓冲液中。反应3h后,取1ml各个ph的溶液用0.85%的灭菌生理盐水连续稀释。取合适稀释浓度的样品分别加入mrs琼脂平板,并置于37℃的生化培养箱中连续培养48h。
其中磷酸缓冲液的甲液和乙液如上述,ph为6.8的缓冲液由51ml的甲液和49ml的乙液混合而成。
感官评价
感官评价由五名食品专业人士组成感官评定小组,对谷物乳片产品的色泽、气味、组织状态和口感分别评价后再进行综合评价。感官评价标准如表2。
表2益生菌谷物乳片感官评价标准
试验设计
酶解时间确定
按米水比1:5,糊化时间30min,糊化米水混合物。将糊化样品置于60℃恒温水浴锅中,保持样品60℃。按中温α-淀粉酶活力3u/g和糖化酶活力22u/g加入样品进行酶解。取5min、10min、15min、20min、25min、30min酶解样品,沸水浴3min,致酶失活。在测定过程中,将样品稀释五倍后进行碘兰值的测定。由于酶解程度是相对的,故取测得吸光值作为碘兰值进行比较,确定酶解时间。菌种复配
按米水比1:5,糊化时间30min,中温α-淀粉酶添加量3u/g,糖化酶添加量22u/g,酶解时间15min,白砂糖添加量2%,灭菌时间沸水浴15min,制作米浆培养基。待培养基自然冷却至40℃左右时,接入添加总量为0.3%的菌种。将接入菌种的培养基置于35℃生化培养箱恒温培养12h。菌种植物乳杆菌m8(lactobacillusplantarumm8)的接种量为0.1、0.2、0.3、0.4、0.5。
12h发酵过程中,每6h于超净工作台中取样,测定发酵样品的滴定酸度、自由基清除能力、可溶性蛋白质含量、游离氨基酸含量和ph值。发酵完成后,对各菌种比例的样品进行活菌计数和模拟胃液耐受力检测。
液氮预冻及冷冻干燥条件确定
将发酵样品分置于25ml小塑料杯中,用保鲜膜封口。
产品加糖量:不加糖、2%白砂糖、7%白砂糖
增稠剂:不加增稠剂、0.5%卡拉胶
样品分装量:5ml、10ml、15ml
样品预冻时间:1min、2min、3min、4min、5min
预冻完成后,查看预冻效果:观察预冻后产品外观,检查预冻产品心部是否冻结。
对预冻效果较好的样品,置于冷冻干燥机进行冻干24h。冻干结束后,观察冻干产品组织结构完整性,检查冻干产品内部冻干效果,品尝冻干产品口感。数据处理
采用wps表格进行数据处理。除特殊情况和文中特别说明,指标都平行测定3次,感官平行5次,结果均以“平均值±标准差”的形式表示。
酶解时间的确定
碘兰值反应了淀粉的水解程度,由图5可知,前15min随着水解时间延长,碘兰值迅速下降。在15min之后,酶解底物浓度变稀,酶解反应降低,碘兰值的变化趋势减缓。当酶解时间为15min时,酶解效果达到最佳。
液氮预冻条件的确定
预冻时间对预冻结果的影响如表3所示。
表3预冻时间对预冻效果的影响
由表3可知,预冻时间达到3min时,产品的预冻效果较好,心部被冻结。
辅料配比的确定
辅料配比对乳片品质的影响见表4。由表4可知,添加了7%白砂糖、未添加增稠剂、分装量为15ml的样品心部水分未完全离解,并有吸潮现象,冻干效果较差。而未添加白砂糖、分装量为5ml的样品具有比较明显的干裂现象;在口感方面,添加了白砂糖的样品都具有一定的甜味,而7%的白砂糖添加量使样品有黏腻感。
综上所述,在样品的冻干工艺中,样品分装量和白砂糖添加量对产品的组织状态和口感具有较大影响。故2%的白砂糖添加量、不添加增稠剂和10ml的分装量较为合适。
表4辅料添加量对冻干效果的影响
注:表中a表示完全冻干,b表示心部稍有未冻干,c表示冻干效果较差
菌种比例对乳液性质的影响
菌种比例对乳液ph的影响
发酵过程中ph值的变化如表5所示。由表可知,随着发酵时间的延长,产品ph值不断下降,这表明在益生菌发酵过程中,产生了一定的酸性物质,导致了产品的ph下降。发酵前乳液ph没有显著差异,发酵过程中接种比例为0.1%、0.2%、0.3%的产品变化比较快,发酵12h,接种比例为0.3%和0.1%样品的ph较其余三组样品低。
表5菌种比例对乳液ph的影响(n=3,
字母不同表示同行数据有显著性差异(p<0.05)
菌种比例对乳液滴定酸度的影响
由图6可知,随着发酵时间的延长,产品的滴定酸度逐渐升高。这表明在发酵过程中,益生菌产生了大量酸性物质(乳酸菌产生乳酸),这有利于产品风味的形成。发酵前滴定酸度没有显著差异,发酵后乳酸菌比例较高的样品滴定酸度较高,表明较高比例的乳酸菌对产品的风味有较大的改变。
菌种比例对乳液自由基清除能力的影响
由图7可知,随着发酵时间的延长,产品与[dpph·]标液进行反应后,[dpph·]残留率大幅降低,即产品对自由基清除能力得到显著提高。其中植物乳杆菌m8(lactobacillusplantarumm8)接种比为0.4%的产品在发酵完成后,最终[dpph·]残留率仅为0.19,接种比为0.3%的产品残留率为0.29。表明益生菌发酵对产品的抗氧化能力的提升具有促进作用。发酵前复配比例不同的样品之间自由基清除能力没有显著差别,发酵后产品中自由基残留率较低,表明植物乳杆菌m8(lactobacillusplantarumm8)有利于提高产品抗氧化能力。
菌种比例对乳液可溶性蛋白的影响
由图8可知,随着发酵时间的而延长,可溶性蛋白含量逐渐减少,且菌种接种比为0.3%时,产品中可溶性蛋白含量减少了94.5%,复配比为0.2%时,产品中可溶性蛋白减少了91.1%。由此可知,发酵过程中,可溶性蛋白被大量降解。发酵后各组样品中的可溶性蛋白含量没有显著区别,表明植物乳杆菌m8(lactobacillusplantarumm8)具有很高的蛋白质降解能力。
菌种比例对乳液游离氨基酸的影响
由图9可知,随着发酵时间的延长,产品中氨基酸含量逐渐增加。其中植物乳杆菌m8(lactobacillusplantarumm8)接种为0.3%时,产品中氨基酸含量最高,达到了78.3%,接种比为0.5%时,产品中氨基酸含量仅为25.1%。由此可知,益生菌可以使基质中的部分大分子蛋白降解,产生多肽、氨基酸等小分子物质,从而提高产品的消化吸收性,而益生菌良好的适应性也使其能较大程度地利用产品中的营养成分,产生较多的营养物质。
益生菌大米乳片产品特性的测定
菌种比例对乳片活菌数的影响
由图10可知,产品中植物乳杆菌m8(lactobacillusplantarumm8)活力约为108cfu/g,活菌总数仅为108cfu/g,较一般益生菌产品低,可能的原因是接种量不够或者发酵时间不足;在各接种比例的样品中,植物乳杆菌m8(lactobacillusplantarumm8)接种量为0.3%的样品中乳酸菌活菌数最高,其次为0.2%的样品,最低为0.5%的样品。
模拟胃液耐受力
产品模拟胃液耐受力测定结果如图11-13所示。ph=2.0的模拟胃液处理过的样品中,益生菌的活力为106cfu/g;ph=3.0的模拟胃液处理过的样品中益生菌的活力为107cfu/g;空白样中,益生菌的活力为108cfu/g。其中等比例菌种配比样品的模拟胃液耐受力较强。在ph=2.0的模拟胃液中,益生菌的存活力仅为1%左右,在ph=3.0的模拟胃液中的存活力为10%左右。综上所述,ph越低,活菌数越少,表明模拟胃液的酸度是影响益生菌在模拟胃液中存活能力的重要因素。对比乳片产品,空白样中的益生菌活力都为108cfu/g,表明在胃液中主要影响益生菌活力的因素是酸度,胃蛋白酶的影响较小。
菌种比例对乳片感官品质的影响
由图14可知,产品主体成米白色,表面有大量孔洞,伴有轻微裂痕。产品具有轻微的发酵米乳香味,具有疏松干爽的口感,入口有淡淡的甜味和酸味。
由感官评价可知,各组样品都较有光泽,没有异色;0.3%和0.1%的样品气味较好,但口感较差,主要在于样品内部未干燥充分,有黏牙感;0.2%与0.4%的样品,具有疏松干爽的口感。样品表面产生孔洞现象,而0.5%的样品,产生有干裂破碎的现象。根据综合评定,复配比例为0.2%的样品得分最高。
表6感官评定得分表(n=5,
注:字母不同表示同行数据有显著性差异(p<0.05)
讨论
发酵产品最终的风味、口感和营养特性等,主要通过益生菌的代谢活动及其产物实现,而益生菌本身的存在,也作为发酵产品的一项重要指标。本课题主要研究益生菌在谷物发酵过程中对某些营养指标的影响,确定植物乳杆菌m8(lactobacillusplantarumm8)的接种比例,并通过冷冻干燥工艺对发酵产品进行冻干,制得片剂产品。
在发酵产品的制作上,主要沿用一般的米乳制备方法和试剂添加量。在酶解时间的控制上,通过对淀粉水解程度的研究,确定了15min的酶解时间,保证了水解效果和时间效率的最大化。在产品预冻与冻干工艺上,通过预冻与冻干产品的组织状态和口感评价,确定了3min的预冻时间、2%的白砂糖添加量和10ml的分装量。工艺的确定为产品的生产、指标的测定奠定了基础,并为工艺的进一步优化确定了大的方向和趋势。
植物乳杆菌m8(lactobacillusplantarumm8)免去了对菌种进行筛选、纯化的步骤,提高了生产效率,保证了产品品质。同时运用益生菌复配,解决了单一益生菌发酵产导致的单调性。利用益生菌对谷物进行发酵,既可以提高谷物制品的感官特性,又保留甚至提高了谷物制品的大部分营养成分。本实验为益生菌发展了又一新的应用途径,也为谷物制品的商业化提供了更广阔的前景。
将发酵谷物制品利用冷冻干燥技术制作成片剂形式,是对谷物的又一发展。片剂食品在携带型、储藏性等方面具有很大优势,并且直接冻干的产品与传统的片剂相比,又有疏松干爽的独特口感。
此外,产品中的活菌数不高,可能原因包括发酵温度、益生菌接种量、发酵底物中营养成分等对益生菌生长的影响。冷冻干燥工艺(如干燥时间、干燥温度、干燥真空度等)有待进一步优化。
菌种比例对乳液的特性有影响,0.3%的接种比例的菌种发酵后的产品具有较高的胃耐受能力,乳片的感官品质最好。
最佳工艺条件为,米粉沸水浴糊化30min,冷却至60-70℃,用中温α-淀粉酶(3u/g)和糖化酶(22u/g)酶解15min,加入2%的白砂糖,100℃灭菌15min,按1:1.5的比例接入植物乳杆菌m8(lactobacillusplantarumm8)菌株,于35℃下发酵12h。发酵液于液氮条件下预冻3min,冷冻干燥24h,得到益生菌谷物乳片。乳片呈米白色,表面有大量孔洞,具有疏松干爽的口感,乳片甜酸适度。乳片中益生菌活力为108cfu/g。
sequencelisting
<110>华中农业大学
<120>益生菌乳片发酵菌种及其发酵方法
<130>5
<160>1
<170>patentinversion3.5
<210>1
<211>1220
<212>dna
<213>植物乳杆菌m8(lactobacillusplantarumm8)
<400>1
cggttcacttacgcggctggctcctaaaaggttaccccaccgactttgggtgttacaaac
tctcatggtgtgacgggcggtgtgtacaaggcccgggaacgtattcaccgcggcatgctg
atccgcgattactagcgattccgacttcgtgcaggcgagttgcagcctgcagtccgaact
gagaacggttttaagagatttgcttgccctcgcgagtttgcgactcgttgtaccgtccat
tgtagcacgtgtgtagcccaggtcataaggggcatgatgatctgacgtcgtccccacctt
cctccggtttgtcaccggcagtctcactagagtgcccaacttaatgctggcaactagtaa
caagggttgcgctcgttgcgggacttaacccaacatctcacgacacgagctgacgacgac
catgcaccacctgtcattgcgttcccgaaggaaacgccctatctctagggttggcgcaag
atgtcaagacctggtaaggttcttcgcgtagcttcgaattaaaccacatgctccaccgct
tgtgcgggcccccgtcaattcctttgagtttcaaccttgcggtcgtactccccaggcgga
gtgcttaatgcgttagctccggcactgaagggcggaaaccctccaacacctagcactcat
cgtttacggcatggactaccagggtatctaatcctgttcgctacccatgctttcgagtct
cagcgtcagttgcagaccaggtagccgccttcgccactggtgttcttccatatatctacg
cattccaccgctacacatggagttccactaccctcttctgcactcaagttatccagtttc
cgatgcacttctccggttaagccgaaaggctttcacatcagacttagaaaaccgcctgca
ctctctttacgcccaataaatccggataacgcttgccacctacgtattaccgcggctgct
ggcacgtagttagccgtgactttctggttaaataccgtcaacgtatgaacagttactctc
atacgtgttcttctttaacacagagctttacgagccgaaacctctcactcacgcgtgtgc
tccatcaggcctgcgcccattgtgagatcctactgctgctccgtagagtatggcgtgtct
cagtccatgtgacgatcagtctctcaactcgcttgcatcatcgcatggtaggcgttatcc
accaacaaagctaatgtggt
- 还没有人留言评论。精彩留言会获得点赞!