一种多肽及其编码基因和用途的制作方法
本发明属于生物医药领域,涉及肿瘤领域,尤其是脑胶质瘤,具体涉及一种多肽及其编码基因和用途。
背景技术:
脑胶质瘤是发生于神经外胚层的肿瘤,是最常见的原发中枢神经系统肿瘤,占颅内瘤的50%-60%。世界卫生组织根据胶质瘤恶性程度将胶质瘤分为4级,其中3级和4级胶质瘤高度恶性,也称为恶性胶质瘤(glioblastoma,gbm)。gbm是致死率最高的常见脑癌。确诊后,不做任何治疗的病人一般有3个月左右的寿命,经过治疗后的平均寿命也只有14个月,不到5%的患者能延续5年以上的寿命。而且随着病人的年龄增高,预后也越糟糕。gbm浸润性强,和正常脑组织没有明显的界限,手术难以完全切除。加上gbm异质性高,放疗和化疗不是很有效。目前手术后进行替莫唑胺(tmz)化疗和放疗虽能相对提高中位生存期(medianoverallsurvival),但无法阻止gbm复发和有效提高患者的5年存活率。近30年gbm在我国的发病率以年增长率1.2%的速度逐年增加,在中老年人群中增加尤为明显。因此迫切需要研发新的治疗方法。
gbm中有一部分数量很少的类似干细胞的细胞,被称为胶质瘤干细胞(glioblastomastemcells,gscs)。gscs能抗化疗和放疗,是gbm复发的重要因素。研究显示常规剂量的化疗药物tmz虽然能杀死大量的gbm细胞,但是却会导致一些未杀死的gbm非干性细胞转变成像gscs一样的细胞,具备更高的浸润性和抗化疗的特性。gbm中包含很多基因变异,研究发现有86%临床样品的基因变异发生在pi3k/akt/mtor信号通路上。而pi3k/akt/mtor信号通路的活化直接和病患的低存活时间相关。pten作为此信号通路的抑制基因,在gbm样品中有高达36%的变异。与细胞周期和凋亡相关的基因pten和p53直接参与调控gscs的增殖和分化。pten缺失能使细胞的增殖不受抑制,甚至将神经干细胞(nscs)变成类似gscs的细胞。而pten的表达量高低也是一个重要的gbm预后评价指标。因此研究pten的调控机制,恢复pten的正常表达,可以抑制gscs的增殖,并可能控制gbm的发展和复发,从而提高治疗效果。
孤儿素核受体(tlx),在小鼠的脑癌干细胞(btscs)和人的gscs中都大量表达,是诱导gbm生成的关键基因。敲除tlx导致btscs失去自我增殖能力而分化。tlx缺失的btscs也会出现细胞凋亡、衰老和分化现象。同样,用病毒介导tlxshrna或纳米载体表达tlxsirna也能抑制病人来源的gscs异种移植的小鼠中gbm的形成和发展,延长小鼠的寿命。tlx在哺乳动物的脑海马体的齿状回和脑室下区大量表达,对于神经干细胞的自我更新非常重要。在神经干细胞和视网膜母细胞瘤中,tlx和组蛋白的去甲基化酶lsd1能形成复合体,共同调控细胞的增殖。
lsd1是最早发现的组蛋白去甲基化酶。它能使h3k4me1和h3k4me2脱去甲基。因为甲基化的h3k4是基因活化的表观遗传标志,因此lsd1通过除去此活化的表观遗传标志,抑制其靶基因的表达。lsd1在一些肿瘤细胞,如神经母细胞瘤细胞和乳腺癌细胞中异常高表达。lsd1在gbm中也高表达。同时抑制lsd1和组蛋白乙酰酶hdac,促进gbm细胞死亡。因此lsd1也是治疗gbm的一个重要靶标。
技术实现要素:
为了更好地解决肿瘤治疗的问题,本发明提供了一种治疗脑胶质瘤的多肽。
本发明的目的在于,提供一种多肽及其编码基因,提供表达多肽的表达载体,提供一种宿主细胞,提供该多肽及其编码基因、表达载体和宿主细胞的用途。
本发明所述的tlx均为孤儿素核受体;所述的lsd1均为组蛋白去甲基化酶。
为了实现上述目的,本发明所采取的技术方案为:一种多肽,所述多肽为:
(1a)如seqidno1所示的氨基酸序列;或者
(2a)与seqidno:1具有至少80%序列同一性且具有与seqidno:1相同功能的氨基酸序列。
seqidno:1:mpdiisgpqqtqkvfl;
其中,m为启动密码子。
上述所述多肽能特异性结合tlx,并阻断tlx和lsd1协同调控的gbm细胞增殖,很大程度地减少副作用。
优选地,所述多肽与seqidno:1具有至少90%序列同一性且具有与seqidno:1相同功能的氨基酸序列。
优选地,所述多肽与seqidno:1具有至少95%序列同一性且具有与seqidno:1相同功能的氨基酸序列。
优选地,所述多肽与seqidno:1具有至少98%序列同一性且具有与seqidno:1相同功能的氨基酸序列。
优选地,所述多肽与seqidno:1具有至少99%序列同一性且具有与seqidno:1相同功能的氨基酸序列。
优选地,所述多肽是上述所述的氨基酸序列经过修饰所得到的具有相同功能的多肽衍生物。
本发明提供了上述所述的多肽的编码基因。
优选地,所述多肽的编码基因为:
(1b)如seqidno:2所示的核苷酸序列;或者
(2b)具有与seqidno:2至少80%序列同一性且编码具有与seqidno:2相同功能的核苷酸序列。
seqidno:2:atgccagatattatcagtggaccacaacagacccagaaggtttttctttaa。
优选地,所述多肽的编码基因是具有与seqidno:2至少90%序列同一性且编码具有与seqidno:2相同功能的核苷酸序列。
优选地,所述多肽的编码基因是具有与seqidno:2至少95%序列同一性且编码具有与seqidno:2相同功能的核苷酸序列。
优选地,所述多肽的编码基因是具有与seqidno:2至少98%序列同一性且编码具有与seqidno:2相同的功能的核苷酸序列。
优选地,所述多肽的编码基因是具有与seqidno:2至少99%序列同一性且编码具有与seqidno:2相同功能的核苷酸序列。
本发明提供了一种表达载体,所述表达载体是将上述所述的编码基因连接到基础载体上而得的,用于表达上述所述多肽。
优选地,所述基础载体为哺乳动物表达载体。
优选地,所述基础载体为pcag质粒。
本发明提供了一种遗传工程化的宿主细胞,所述宿主细胞含有上述所述的表达载体。
优选地,所述宿主细胞是上述所述的表达载体转化或转染到宿主细胞而得到的。
本发明提供了上述所述表达载体表达的重组多肽,或者培养上述所述的宿主细胞得到的重组多肽。
本发明提供了上述所述的多肽、上述所述的编码基因、上述所述的表达载体、上述所述的宿主细胞、或上述所述的重组多肽在制备治疗肿瘤疾病药物中的用途。由于上述所述多肽是通过调控pi3k/akt/mtor信号通路来实现治疗肿瘤的目的,而pi3k/akt/mtor信号通路对于肿瘤的形成有着非常重要的作用,所以本发明所提供的多肽可能能用于其他肿瘤疾病的治疗,因而,使用所述多肽通过本发明所提供的抑制tlx和lsd1协同作用的机理在治疗肿瘤疾病的用途均在本发明的保护范围之内。
优选地,所述肿瘤疾病为脑胶质瘤。
本发明提供了上述所述的多肽、上述所述的编码基因、上述所述的表达载体、上述所述的宿主细胞、或上述所述的重组多肽在抑制tlx和lsd1协同作用中的用途。
本发明的有益效果为:相较于用sirna或化合物分别在gscs敲降或抑制tlx和lsd1,用上述所述多肽阻断tlx和lsd1协同调控gscs增殖有特异性强的优势。因为tlx作为转录调控因子参与调控大量的下游基因,而lsd1作为组氨酸去甲基化酶也广泛参与到很多正常的生理调控,不加选择的抑制两个蛋白的全方位功能难免带来较大的副作用,而使用上述所述多肽能特异性结合tlx并阻断tlx和lsd1协同调控的gbm细胞增殖,则很大程度地减少副作用。
附图说明
图1为pcag-puro载体质粒图谱。
图2为westernblot检测多肽表达结果图。
图3是证明btscs增殖需要lsd1和tlx的系列结果图;其中,
a是btscs贴壁(2d)和悬浮(3d)培养结果图;
b是实时pcr检测tlx和lsd1在神经元干细胞(nsc)和btscs(btsc)中的mrna水平结果图;
c是westernblot检测tlx和lsd1在神经元干细胞(nsc)和btscs(btsc)中的蛋白表达的结果图;
d对照shrna、tlxshrna和lsd1shrna转化btscs后用1ug/mlpuromycin筛选后的细胞形态图(标尺为50μm);
e实时pcr检测tlxshrna和lsd1shrna降低tlx和lsd1的mrna水平的结果图;
f是mtt实验检测tlxshrna和lsd1shrna转化btscs后在550nm波长处的吸光值图(实验数据为三次独立实验结果(*p<0.05;**p<0.005));
g是对照shrna、tlxshrna和lsd1shrna转化btscs后用抗ki67抗体免疫荧光染色图(细胞核用dapi染色呈蓝色,ki67呈红色。标尺为50μm)。
图4是tlx和lsd1在btscs中形成复合体共同抑制pten和p21表达的系列结果图;其中
a是用igg和抗tlx抗体进行免疫共沉淀实验证明tlx和lsd1结合,而igg不结合的结果图(抗体的轻链作为上样对照);
b是实时定量pcr检测tlx和lsd1被敲降后pten和p21在btscs中的表达的结果图(数据为3次独立实验的结果);
c是lsd1、tlx、pten和p21在tlx和lsd1被敲降后在btscs中的表达量的westernblot图(actin蛋白作为样品内参对照);
d是实时定量pcr显示染色质免疫沉淀实验gfp、lsd1和tlx在pten启动子(左)和p21启动子(右)的富集的结果图(数据为3次独立实验的结果);
e是实时定量pcr显示染色质免疫沉淀实验h3k4me1和h3k4me2在tlx和lsd1被敲降后在pten和p21启动子上的富集的结果图(数据为3次独立实验的结果(*p<0.05,**p<0.005))。
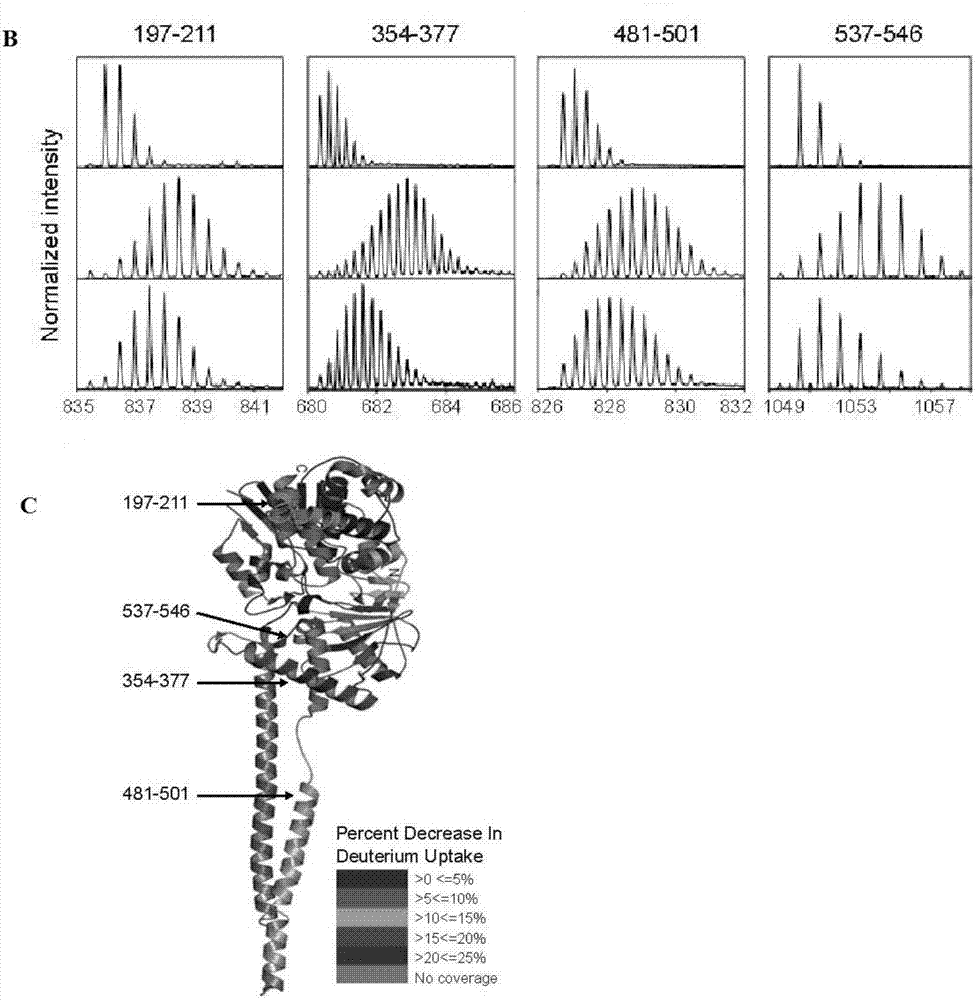
图5是氢/氘交换质谱法揭示体外lsd1参与结合tlx的多肽的系列结果图;其中,
a是lsd1和tlx:lsd1浸泡在以氘替换氢的溶液中30秒,1分钟,2分钟,5分钟和10分钟后蛋白上氢/氘置换的差异图;
b是用胃蛋白酶消化后,四段lsd1多肽在未进行氢/氘交换(上)、进行氢/氘交换后(中)、以及该lsd1肽段在和tlx混合进行氢/氘交换后(下)的质谱图;
c是在lsd1的蛋白晶体结构(pdbid:2z3y)上标示lsd1和tlx结合的四个肽链片段图(晶体结构的颜色依据氢/氘交换的比例而变换)。
图6是证明lsd1-197-211能显著抑制btscs的生长的系列结果图;其中,
a是ha-tlx分别和flag-lsd1和flag-lsd1突变体转化293t细胞后,全细胞裂解也用抗ha抗体沉淀,沉淀蛋白sds-page电泳后用抗flag抗体杂交的结果图(结果显示tlx和lsd1复合体在lsd1切除多肽197-211后解体);
b是在btscs中过表达有flag标记的lsd1多肽和flag-gfp对照,westernblot检测有flag标记的蛋白,pten和p21的表达的结果图;
c是在btscs中过表达flag-gfp和flag-lsd1多肽后免疫荧光染色图;
d是在btscs中过表达flag-gfp和flag-lsd1多肽后计数活细胞数的结果图(数据为4次独立实验的结构,统计差异由student’st-test计算而得,**p<0.005,***p<0.001);
e是在btscs中过表达flag-gfp和flag-lsd1多肽后,染色质免疫沉淀的结果图(数据为3次独立实验的结果(*p<0.05,**p<0.005),揭示h3k4me1和h3k4me2在pten和p21启动子区域的修饰)。
具体实施例
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
(1)多肽的制备
lsd1-197-211多肽的编码基因序列如seqidno:2所示。
seqidno:2:atgccagatattatcagtggaccacaacagacccagaaggtttttctttaa
所述多肽的克隆引物为:
n端引物:
seqidno:3:gatctccagatattatcagtggaccacaacagacccagaaggtttttctttaac
c端引物:
seqidno:4:tcgagttaaagaaaaaccttctgggtctgttgtggtccactgataatatctgga
克隆方案为:n端引物和c端引物退火后,用t4连接酶连接到bglii和xhoi消化好的pcag-flag-puro质粒。
pcag-puro载体质粒图谱如图1所示,mlu1-mcs-xho1为ecori-flag-bglii-mlu1-xho1,且所构建质粒经测序核实完全正确。
将表达载体转染到宿主细胞中,通过westernblot实验检测本实施例多肽的表达。图2为westernblot检测多肽表达结果图,lsd1-197-211多肽基因克隆pcag-flag-puro质粒的bglii和xhoi位点表达为flag-lsd1-197-211多肽。
(2)tlx和lsd1在gscs中形成复合体的鉴定
因为小鼠btscs是人的gscs的动物模型,而小鼠和人的tlx相似性为99.2%,小鼠和人的lsd1的相似性为98.6%(embossmatcher统计结果),所以,本实施例以小鼠的btscs为模型,通过免疫共沉淀实验,证明tlx和lsd1在btscs中形成复合体。
在小鼠脑内能高效形成恶性脑胶质瘤的btscs由德国癌症中心刘海坤博士馈赠,本实验室建立了成熟的btscs培养技术。图3是证明btscs增殖需要lsd1和tlx的系列结果图,其中,图3a是btscs贴壁(2d)和悬浮(3d)培养结果图。
悬浮培养btscs:在低吸附的6孔板培养皿的单个培养孔中添加2ml培养基。btsc培养基的组成成分为dmem/f12培养液中添加20ng/mlegf,10ng/mlfgf2,b27和itss。每个孔中接种105个细胞。btscs在该培养基中形成细胞球,显示出干细胞特性。
单层培养btscs:用100ug/mlpoly-l-lysine在37℃处理6孔板培养皿30分钟,晾干后再50ug/mllaminin处理30分钟,晾干后接种105个btscs培养。细胞单层贴壁生长。
悬浮培养的btscs和单层培养的btscs在长到一定量后都用accutase37℃消化20分钟后以1:5比例进行细胞传代。
首先,本实施例进行实时pcr定量实验和westernblot实验,图3b是实时pcr检测tlx和lsd1在神经元干细胞(nsc)和btscs(btsc)中的mrna水平结果图,图3c是westernblot检测tlx和lsd1在神经元干细胞(nsc)和btscs(btsc)中的蛋白表达的结果图,结果证明了tlx和lsd1在btscs中高表达。
为了检测tlx和lsd1在btscs中的功能,我们将对照shrna(seqidno:5:gatgaaatgggtaagtaca),tlxshrna(seqidno:6:ggctgtatctggcatgaat)和lsd1shrnas(seqidno:7:cacaaggaaagctagaaga)克隆到psuper-puro载体bglii和hindiii位点,采用amaxanucleofectorii电转化仪将对照shrna、tlxshrna和lsd1shrna质粒分别转化入btscs后,用1μg/mlpuromycin筛选。图3d为对照shrna、tlxshrna和lsd1shrna转化btscs后用1μg/mlpuromycin筛选后的细胞形态图,结果表明,三天后,显微镜下观察到tlxshrna和lsd1shrna敲降的细胞数目明显比对照减少。
用trizol提取rna,然后用primerscriptrtreagent(takara)试剂反转录2μgrna。通过takarasybrgreen试剂盒在abiprism7900ht仪器进行实时pcr实验检测tlx和lsd1的mrna表达水平,图3e为实时pcr检测tlxshrna和lsd1shrna降低tlx和lsd1的mrna水平的结果图,结果显示tlx和lsd1的mrna能显著被tlxshrna和lsd1shrna敲降。
mtt实验检测同期的对照shrna、tlxshrna和lsd1shrna质粒转化的btscs,图3f是mtt实验检测tlxshrna和lsd1shrna转化btscs后在550nm波长处的吸光值图,也间接显示tlx和lsd1敲降导致活性细胞减少。ki67是与细胞增殖密切相关的蛋白。
用4%pfa固定对照shrna,tlxshrna和lsd1shrna质粒转化的btscs并用puromycin筛选3天的细胞后,我们依次用抗ki67的抗体(ab15580)4℃孵育过夜和羊抗兔alexa594(a11012)孵育40分钟进行免疫荧光染色,同时我们用dapi染细胞核,接着用leica荧光显微镜检测ki67表达的细胞,图3g是对照shrna、tlxshrna和lsd1shrna转化btscs后用抗ki67抗体免疫荧光染色图(细胞核用dapi染色呈蓝色,ki67呈红色。标尺为50μm),结果显示tlxshrna和lsd1shrna敲降后ki67阳性细胞明显比对照敲降后的样品少。
以上结果证明tlx和lsd1是btscs增殖所必需的蛋白。
为了验证tlx和lsd1是否在btscs能形成复合体,进行了免疫共沉淀实验。
首先在50μl的蛋白g琼脂球中分别加入兔源tlx抗体(刘海坤实验室赠送)和对照兔源igg抗体(millipore12-370)室温孵育2小时制备抗体结合的琼脂球,然后用洗液(50mmtris-hclatph8,150mmnacl,1mmedta,0.1%tritonx-100,10%glycerol)1ml清洗两遍,洗去未结合到琼脂球的抗体。接着用细胞裂解液(50mmtris-hclatph8,150mmnacl,1mmedta,1%nonidetp-40,0.25%deoxycholatena,10%glycerol,proteinaseinhibitorcocktail)裂解btsc后,加入抗体结合的琼脂球在4℃孵育过夜。然后用1ml洗液清洗琼脂球3次,再加100μl的蛋白上样液到琼脂球中,100度加热5分钟。然后通过sds-page电泳分离蛋白质,接着用抗lsd1抗体(ab17721)进行westernblot实验检测不同抗体结合下来的蛋白中是否有lsd1。图4a是用igg和抗tlx抗体进行免疫共沉淀实验证明tlx和lsd1结合,而igg不结合的结果图(抗体的轻链作为上样对照),实验结果显示用抗tlx的抗体能够沉淀lsd1,而对照igg则不能,说明tlx和lsd1形成了复合体。
(3)tlx-lsd1协同调控pten的验证
证实tlx和lsd1在btscs中形成复合体后,我们分别用shrna敲降tlx和lsd1后,pten和p21(p53的下游基因,也是细胞周期和凋亡的重要调控基因)启动子附近的h3k4me1和h3k4me2修饰明显增加,而pten的基因表达相应增高,处于增殖期的btscs也显著减少,说明tlx-lsd1协同调控pten(图4)。
用amaxanucleofectorii电转化仪将对照shrna、tlxshrna和lsd1shrna质粒分别转化入btscs,用1μg/mlpuromycin筛选三天后,加入trizol提取rna,再用primerscriptrtreagent(takara)反转录2μgrna。通过takarasybrgreen试剂盒在abiprism7900ht仪器进行实时pcr实验检测基因的mrna表达水平。实验结果显示,当tlx和lsd1被tlxshrna和lsd1shrna敲降后,pten和p21的mrna升高。用细胞裂解液(50mmtris-hclatph8,150mmnacl,1mmedta,1%nonidetp-40,0.25%deoxycholatena,10%glycerol,proteinaseinhibitorcocktail)分别裂解对照shrna、tlxshrna和lsd1shrna质粒转化的btscs,用抗pten抗体(ab-31392)和抗p21抗体(sc-6246)做westernblot,结果显示,当tlx和lsd1分别被tlxshrna和lsd1shrna敲降后,pten和p21蛋白表达水平都升高了。图4b是实时定量pcr检测tlx和lsd1被敲降后pten和p21在btscs中的表达的结果图,图4c是lsd1、tlx、pten和p21在tlx和lsd1被敲降后在btscs中的表达量的westernblot图(actin蛋白作为样品内参对照),由图4b和图4c可知,tlx和lsd1在btscs中抑制pten和p21的表达。
为了检测tlx和lsd1是否直接调控pten和p21基因的表达,我们进行了染色质免疫沉淀。btscs用1%(w/v)formaldehyde固定后10分钟后,用125mmglycine中止formaldehyde的作用。染色质用超声破碎仪破碎成200bp到600bp大小的片段;接着我们将结合了抗tlx抗体或抗lsd1抗体的dynabead加入到超声破碎后的染色质溶液中,在4℃混匀过夜。tlx抗体和lsd1抗体所富集的dna片段用实时pcr进行定量。图4d是实时定量pcr显示染色质免疫沉淀实验gfp、lsd1和tlx在pten启动子(左)和p21启动子(右)的富集的结果图,结果显示,tlx和lsd1在pten和p21启动子区域有一定的富集。采用对照shrna、tlxshrna和lsd1shrna质粒转化的btscs的染色质,使用h3k4me1抗体(ab8895)和h3k4me2抗体(ab7766)进行染色质免疫沉淀,图4e是实时定量pcr显示染色质免疫沉淀实验h3k4me1和h3k4me2在tlx和lsd1被敲降后在pten和p21启动子上的富集的结果图,由图4e可知,tlx和lsd1的表达被敲降后,pten和p21启动子区域的h3k4me1修饰和h3k4me2修饰和对照敲降的样品相比,明显升高。这些数据说明,tlx和lsd1复合体通过对pten和p21启动子区域的h3k4me1和h3k4me2去甲基化来抑制pten和p21的表达。
(4)tlx和lsd1复合体结构的解析
依据上述成果,我们进一步探究了人源的lsd1和tlx相结合的信息。通过氢/氘交换质谱法解析得到的tlx和lsd1的结合界面的信息,我们发现lsd1的4条多肽可能参与结合tlx(图5)。具体实验方法如下:
首先克隆lsd1和tlx基因到pgex6p-1质粒中,gst-lsd1和gst-tlx蛋白在bl21(de3)细菌中表达。gst-标记用prescissionprotease在4℃过夜孵育切除,然后通过层析法获得纯化的tlx和lsd1蛋白。
我们首先试图通过晶体学方法解析tlx和lsd1复合体的结构。由于无法获得tlx和lsd1复合体的结晶,我们于是采用氢/氘交换质谱法(hdx-ms)来研究tlx和lsd1的结合界面。我们将lsd1蛋白及lsd1-tlx复合物分别溶解在用氘替代了氢的溶剂中30秒,1分钟,2分钟,5分钟和10分钟进行氢/氘交换。然后,lsd1蛋白和lsd1-tlx复合物分别通过纳米超高效液相色谱仪(nano-ultraperformanceliquidchromatography)进行质谱实验。该实验进行线上胃蛋白酶(pepsin)消化。消化片段脱盐处理后进入反向层析柱(reverse-phaseanalyticalcolumn)进行分析。其中覆盖80%的lsd1的肽链片段被检测到,并显示出氢/氘交换的差异,图5a是lsd1和tlx:lsd1浸泡在以氘替换氢的溶液中30秒,1分钟,2分钟,5分钟和10分钟后蛋白上氢/氘置换的差异图。
图5b是用胃蛋白酶消化后,四段lsd1多肽在未进行氢/氘交换(上)、进行氢/氘交换后(中)、以及该lsd1肽段在和tlx混合进行氢/氘交换后(下)的质谱图,其中四个lsd1片段在单独检测和与tlx共同检测时,氢/氘交换率明显不同,这个结果说明这四个lsd1片段可能参与结合tlx。
图5c是在lsd1的蛋白晶体结构(pdbid:2z3y)上标示lsd1和tlx结合的四个肽链片段图(晶体结构的颜色依据氢/氘交换的比例而变换),我们将这四个片段标记在lsd1的晶体结构(pdbid:2z3y)上,其中多肽197-211lsd1的swrim结构域,多肽354-377和多肽537-546位于amineoxidase区域,多肽481-501位于towel部位。
(5)四条多肽功能的检测
接着我们在小鼠btscs中检测了这4条多肽的功能。通过在小鼠btscs敲除和过表达这4条人源lsd1的多肽,我们发现位于lsd1的swirm结构域的多肽197-211为参与tlxtlx和lsd1结合的最关键多肽,用pcag-flag质粒在btscs中过表达这条多肽(多肽氨基酸序列为:mpdiisgpqqtqkvflstop)能阻断tlx-lsd1协同调控的细胞增殖(图6)。
我们首先在pcag-flag质粒mlu1和xhoi位点分别克隆切除了肽段197-211、354-377、481-501和537-546的lsd1突变体以表达flag-lsd1突变体,在pcag-ha质粒的bglii和xhoi位点克隆tlx以表达ha-tlx。我们用lipofectamine共转化ha-tlx和flag-lsd1的突变体质粒到293t细胞中。三天后,裂解细胞后加入抗ha抗体耦合的磁珠过夜孵育,磁珠沉淀下来的蛋白用抗flag抗体进行westernblot实验。图6a是ha-tlx分别和flag-lsd1和flag-lsd1突变体转化293t细胞后,全细胞裂解也用抗ha抗体沉淀,沉淀蛋白sds-page电泳后用抗flag抗体杂交的结果图,结果显示tlx和lsd1复合体在lsd1切除多肽197-211后解体,结构显示flag-lsd1-δ197-211、flag-lsd1-δ354-377和flag-lsd1-δ537-546可以稳定表达,而lsd1在切除481-501后则无法稳定表达,而ha共沉淀后,flag-lsd1-δ354-377和flag-lsd1-δ537-546都可以被ha-tlx沉淀下来,只有flag-lsd1-δ197-211没有被沉淀下来,说明lsd1-197-211对lsd1和tlx结合是不可缺少的。
然后我们在pcag-flag-puro质粒的bglii和xhoi位点分别克隆4个lsd1肽段197-211、354-377、481-501和537-546以表达为flag-lsd1多肽。电转化flag-lsd1多肽质粒进btscs后,用1μg/mlpuromycin筛选三天,然后裂解细胞后用抗flag-抗体进行westernblot实验,结果显示4条肽段都能在btscs中稳定表达。进一步用抗pten抗体(ab-31392)和抗p21抗体(sc-6246)进行westernblot实验检测过表达4条lsd1多肽的btscs裂解液,图6b是在btscs中过表达有flag标记的lsd1多肽和flag-gfp对照,westernblot检测有flag标记的蛋白,pten和p21的表达的结果图,我们发现只有在过量表达lsd1-197-211多肽的btscs中pten和p21蛋白明显增加,说明此多肽干扰了tlx和lsd1对pten和p21的协同抑制。
电转化pcag-flag-gfp对照质粒和flag-lsd1多肽质粒进btscs后,用1μg/mlpuromycin筛选三天后,用4%pfa固定细胞,后用抗ki-67抗体(ab15580)在4℃过夜孵育,然后用alexa-94羊抗兔抗体孵育40分钟,dapi染核,leica荧光显微镜观察和拍照。图6c是在btscs中过表达flag-gfp和flag-lsd1多肽后免疫荧光染色图,实验结果揭示pcag-flag-lsd1-197-211质粒转化的btscs中,ki67阳性的细胞明显少于pcag-flag-gfp或pcag-flag-lsd1-517-546质粒转染的细胞,说明过表达lsd1-197-211抑制了btscs的增殖。
图6d是在btscs中过表达flag-gfp和flag-lsd1多肽后计数活细胞数的结果图,计数活细胞也证实lsd1-197-211能明显抑制btscs的生长。
为检测lsd1-197-211的作用是否是通过干扰tlx和lsd1协同对pten和p21启动子区域h3k4me1和h3k4me2的去甲基化,我们电转化pcag-flag-gfp对照质粒和flag-lsd1多肽质粒进btscs后,用1μg/mlpuromycin筛选三天,然后用超声破碎法将细胞染色质破碎成200bp至600bp的大小,再加入h3k4me1抗体(ab8895)和h3k4me2抗体(ab7766)4度过夜孵育进行染色质免疫沉淀,实时pcr进行定量。图6e是在btscs中过表达flag-gfp和flag-lsd1多肽后,染色质免疫沉淀的结果图,结果显示lsd1-197-211多肽表达后,pten和p21启动子区域的h3k4me1和h3k4me2水平比对照gfp和lsd1-354-377多肽表达后明显要高,说明tlx和lsd1的协同作用的表观遗传修饰被lsd1-197-211抑制。lsd1-197-211多肽通过阻断tlx-lsd1复合体的形成抑制脑癌干细胞的增殖。
上述结果表明,相较于用sirna或化合物分别在gscs敲降或抑制tlx和lsd1,用lsd1多肽阻断tlx和lsd1协同调控gscs增殖有特异性强的优势。因为tlx作为转录调控因子参与调控大量的下游基因,而lsd1作为组氨酸去甲基化酶也广泛参与到很多正常的生理调控,不加选择的抑制两个蛋白的全方位功能难免带来较大的副作用。在理想状态下,如果lsd1-197-211多肽能特异性结合tlx并阻断tlx和lsd1协同调控的gbm细胞增殖,则能很大程度减少副作用。虽然此多肽也会抑制采用同样tlx-lsd1机制调控细胞增殖的神经干细胞,但是此多肽用于治疗神经干细胞增殖不活跃的gbm年长患者还是有实际应用价值的。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>中山大学附属第六医院
<120>一种多肽及其编码基因和用途
<160>7
<170>patentinversion3.3
<210>1
<211>16
<212>prt
<213>氨基酸序列
<400>1
metproaspileileserglyproglnglnthrglnlysvalpheleu
151015
<210>2
<211>51
<212>dna
<213>人工合成序列
<400>2
atgccagatattatcagtggaccacaacagacccagaaggtttttctttaa51
<210>3
<211>54
<212>dna
<213>人工合成序列
<400>3
gatctccagatattatcagtggaccacaacagacccagaaggtttttctttaac54
<210>4
<211>54
<212>dna
<213>人工合成序列
<400>4
tcgagttaaagaaaaaccttctgggtctgttgtggtccactgataatatctgga54
<210>5
<211>19
<212>dna
<213>人工合成序列
<400>5
gatgaaatgggtaagtaca19
<210>6
<211>19
<212>dna
<213>人工合成序列
<400>6
ggctgtatctggcatgaat19
<210>7
<211>19
<212>dna
<213>人工合成序列
<400>7
cacaaggaaagctagaaga19
- 还没有人留言评论。精彩留言会获得点赞!