伪狂犬病病毒双基因缺失弱毒株及其应用的制作方法
本发明属于动物医学的疫苗领域,具体涉及伪狂犬病病毒双基因缺失弱毒株及其应用。
背景技术:
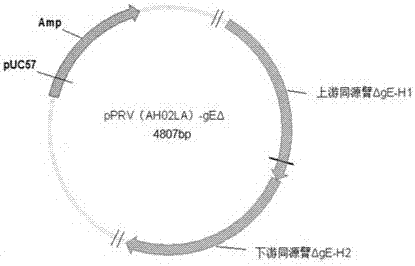
:伪狂犬病是由伪狂犬病病毒(pseudorabiesvirus,prv)引起的一种急性、烈性传染病。牛、羊等家畜和野生动物发生伪狂犬病时常表现为奇痒的典型症状,以及发热和脑脊髓炎等临床症状。而猪发生伪狂犬病的症状与年龄相关,母猪常发生流产;新生仔猪有神经症状,死亡率高;育肥猪主要是呼吸道症状,成年猪感染伪狂犬病毒后生长停滞,通常不发生死亡。由于prv基因缺失株疫苗(如ge基因缺失的barthak61株等)的发明和大规模推广使用,并配合鉴别免疫猪与野毒感染猪的prvge抗体的elisa检测方法的建立和应用,通过持续淘汰阳性种猪,世界上许多国家实现了在家养猪群中伪狂犬病病毒的净化,在我国,许多猪场也成功建立了prvge抗体阴性的猪群,不少猪场基本实现了prv的净化,猪伪狂犬病得到了较好控制。自2011年以来,我国北方许多免疫过传统猪伪狂犬病疫苗的猪场大规模出现猪伪狂犬病疫情,之后疫情迅速向全国大部分养猪场蔓延,prvge抗体阳性率居高不下,对我国养猪业造成严重危害。多个团队的研究结果证明此轮疫情是由变异的prv野毒株引起,该变异株的致病性显著增强,其主要抗原基因与传统疫苗株有明显不同,为更有效地应对prv变异株的危害,应用变异株研制既能提高保护力,又能鉴别诊断免疫猪与野毒感染猪的新型疫苗是当前我国猪伪狂犬病防控的关键。但是,现有变异株活疫苗的安全性还不够高。例如,申请号为201510388390.9的发明专利中公开了通过敲除伪狂犬病病毒野毒ah02la株ge基因后获得的la-a株,采用该毒株制备的疫苗对伪狂犬病病毒变异株100%保护效果,尤其是该疫苗不但能阻止发病,还能阻止排毒,但是,该毒株仅对4周龄仔猪安全。技术实现要素:本发明的目的是提供伪狂犬病病毒双基因缺失弱毒株,该毒株能够很好的适应st细胞,滴度高,毒力显著降低,对1日龄仔猪无致病性,因此是具有较高安全性的疫苗候选弱毒株。伪狂犬病病毒双基因缺失弱毒株,是伪狂犬病病毒la1206-80株,保藏编号为:cgmccno.14329。本发明的另一目的是提供伪狂犬病病毒双基因缺失弱毒株在制备伪狂犬病疫苗中的应用,采用该疫苗免疫后能够对免疫猪只提供100%保护,不但能阻止发病,还能阻止排毒,由于该毒株毒力显著降低,对1日龄仔猪无致病性,因此可用于初生仔猪的早期免疫,尽早阻断野毒的感染,该活疫苗具有较高的安全性。本发明的再一目的是提供以伪狂犬病病毒双基因缺失弱毒株为活性成分的疫苗。采用伪狂犬病病毒la1206-80株的疫苗对1日龄初生仔猪安全,接种断奶prv阴性易感仔猪后7天即能达到对伪狂犬病病毒变异株100%保护效果,尤其是该疫苗不但能阻止发病,还能阻止排毒,在安全性和免疫效力上都取得了意想不到的技术效果。通过对抗体进行监测,可以区分免疫该疫苗的动物与感染动物,有利于对prv变异株的净化。本发明还提供一种重组载体活疫苗,其活性成分是所述伪狂犬病病毒双基因缺失弱毒株基因组中插入了外源保护性抗原基因表达盒后得到的。启动子可以选择pmcmvie、sv40和phcmvie等,外源基因的插入位点包括基因组的ul22与ul21之间、ul46与ul27之间、ul51与ul50之间、ul35与ul36之间、ul40与ul41之间、ul44与ul26.5之间和ul4与ul3.5之间的非编码区,插入的外源基因包括猪瘟病毒的e蛋白基因、猪圆环病毒的cap蛋白基因、狂犬病病毒的g蛋白基因、口蹄疫病毒的vp1基因、猪流感病毒的ha基因和兔瘟病毒的vp60基因等。本发明活疫苗,是以伪狂犬病病毒la1206-80株为活性成分,疫苗内可以加入免疫佐剂与疫苗赋形剂等,本领域技术人员可以容易地进行生产。申请人通过大量富有创造性的劳动,获得了一株伪狂犬病病毒基因缺失弱毒株,即prvla1206-80株。la1206-80株gc和gd基因与ah02la株完全一致(gc基因genbank:kr605320;gd基因genbank:kr605321),均与现公开变异毒株高度同源。本发明伪狂犬病病毒la1206-80株是首先将prvah02la株ge基因(genbank:kr605321)第13~1298位碱基敲除,再继续敲除tk基因(seqidno:1)第184~530位碱基,然后经细胞传代致弱后克隆筛选而得。伪狂犬病病毒la1206-80株能够很好地适应st细胞,生长滴度高达108.5tcid50/ml。伪狂犬病病毒la1206株的活疫苗对1日龄初生仔猪100%安全,可用于初生仔猪的早期免疫,尽早阻断野毒的感染。接种断奶prv阴性仔猪后能快速产生高效保护力,对伪狂犬病病毒变异株100%保护,尤其是该疫苗不但能阻止发病,还能阻止排毒,取得了意想不到的技术效果。通过对prvge和gb抗体进行监测,可以区分免疫该疫苗的动物与感染动物,非常有利于对prv变异株的净化。将其用作活载体表达猪易感病原的保护性抗原,还能达到接种一针防两种或多种疫病的效果。附图说明图1、转移载体pprv(ah02la)-gfp(ge-)的结构图。图2、转移载体pprv(ah02la)-geδ的结构图。图3、伪狂犬病病毒prvah02la(δge)株构建示意图。(a)所示为prvah02la株的基因组,ul指独特长区,us指独特短区,ir和tr分别指内部和未端重复区。(b)所示为通过上游同源臂δge-h1和下游同源臂δge-h2进行同源重组将gfp表达盒替换掉ge基因的部分序列。(c)所示为再次通过同源重组将gfp表达盒敲除,获得缺失ge基因第13~1298位共1286bp核苷酸的prvah02la(δge)株。图4、转移载体pprv(ah02la)-gfp(tk-)的结构图。图5、转移载体pprv(ah02la)-tkδ的结构图。图6、伪狂犬病病毒la1206株构建示意图。(a)所示为prvah02la(δge)株的基因组,ul指独特长区,us指独特短区,ir和tr分别指内部和末端重复区。(b)所示为通过上游同源臂δtk-h1和下游同源臂δtk-h2进行同源重组将gfp表达盒替换掉tk基因的部分序列。(c)所示为再次通过同源重组将gfp表达盒敲除,获得缺失ge基因第13~1298位共1286bp核苷酸和tk基因第184位至530位共347bp核苷酸的la1206株。图7、la1206-80株和亲本病毒的体外生长特性比较。a:感染st细胞后感染细胞上清液中病毒的滴度;b:感染st细胞后细胞结合性病毒的病毒滴度。具体实施方式以下通过具体实施例进一步说明本发明,但本发明的范围和精神并不限于所列实施例。实施例一、伪狂犬病病毒ge基因缺失株的构建与鉴定1、转移载体的获得为敲除伪狂犬病病毒prvah02la株的部分ge基因,人工合成了由ge基因上游同源臂δge-h1、绿色荧光蛋白表达盒和ge基因下游同源臂δge-h2组成的基因片段,然后将该片段克隆到puc57载体(南京金斯瑞生物科技有限公司),得到gfp转移载体pprv(ah02la)-gfp(ge-),其结构如图1所示。ge基因上游同源臂δge-h1的序列如seqidno:2所示,ge基因下游同源臂δge-h2的序列如seqidno:3所示,gfp表达盒的序列同申请号为201510388390.9发明专利。然后人工合成由ge基因上游同源臂δge-h1和ge基因下游同源臂δge-h2组成的基因片段,将该片段克隆到puc57载体(南京金斯瑞生物科技有限公司),得到转移载体pprv(ah02la)-geδ,其结构如图2所示。ge基因上游同源臂δge-h1的序列如seqidno:2所示,ge基因下游同源臂δge-h2的序列如seqidno:3所示。2、gfp重组伪狂犬病病毒ah02la株的获得应用9~10日龄spf鸡胚制备原代鸡胚成纤维细胞(chickenembryofibroblasts,cef),细胞长成单层后,进行转染。按照常规磷酸钙转染法进行转染时,将0.5~1μggfp转移载体pprv(ah02la)-gfp(ge-)dna与0.2~1μg伪狂犬病病毒ah02la株的dna共转染原代cef,进行同源重组(图3),24小时后吸除培养液,加入含10%胎牛血清和0.5%甲基纤维素dmem培养基覆盖,继续培养24~48h,挑取在波长为488nm紫外光激发下发出绿色荧光的重组病毒蚀斑,接种到新鲜的cef,如此重复3个循环以上,获得纯化的重组病毒,命名为prvah02la(δge)-gfp株。以prvah02la(δge)-gfp株的dna为模板,应用一对引物(上游引物prvgesiteckeckf序列为:5’-tctggaggggccctcgccga-3’;下游引物prvgesiteckeckr序列为:5’-agagagaggacggaggcgtgtcatc-3’)pcr扩增由ge基因上游同源臂(δge-h1)、绿色荧蛋白表达盒(gfp)和ge基因下游同源臂组成的基因片段(δge-h2),将扩增产物进行电泳和序列测定,以验证序列是否正确插入。pcr反应体系(表1)和反应程序如下。表125μlpcr反应体系pcr反应体系中的lataqdna聚合酶、2×gcbufferii购自takara公司。将反应体系混匀,进行pcr扩增,反应程序如下:94℃预变性4min;94℃变性40s,57℃退火40s,72℃延伸4min30s,30个循环;72℃延伸10min。将pcr产物进行1%琼脂糖凝胶电泳,检测是否有4585bp左右的目的条带并将其切下,采用dna凝胶回收试剂盒回收,将回收产物送华大基因公司测序。鉴定结果表明重组病毒prvah02la(δge)-gfp株采用上述引物进行pcr扩增后,得到了4585bp左右的目的产物,序列测定结果正确,该重组病毒是将伪狂犬病病毒ah02la株ge基因第13位至1298位共1286bp核苷酸替换插入了gfp表达盒(图3)后获得的,与预期完全一致。3、伪狂犬病病毒ge基因缺失株的获得与鉴定取1~3μg重组病毒prvah02la(δge)-gfp株的dna与700~2000ng的pprv(ah02la)-geδ的dna,按照常规磷酸钙转染法转染原代cef,进行第二次同源重组,以敲除gfp表达盒(图3)。共转染后24小时吸除培养液,加入含10%胎牛血清和0.5%甲基纤维素的dmem培养基覆盖,继续培养24~48h,在波长为488nm紫外光激发下挑取不发出绿色荧光的病毒蚀斑接种新鲜cef,如此重复3~5个循环,获得纯化后的病毒,命名为prvah02la(δge)株,并作为种毒。提取prvah02la(δge)株的dna作为模板,应用引物prvgesiteckeckf和prvgesiteckeckr进行pcr扩增,检测是否有2937bp左右的目的条带并将其切下,采用dna凝胶回收试剂盒回收,并进行序列测定。结果显示,以prvah02la(δge)株dna为模板pcr扩增获得了2900~3000bp的特异性片段,测序结果与预期一致,即ge基因第13位至1298位共1286bp核苷酸被成功敲除。实施例二、伪狂犬病病毒ge、tk双基因缺失株的构建与鉴定1、转移载体的获得为继续敲除伪狂犬病病毒prvah02la(δge)株的部分tk基因,送南京金斯瑞生物科技有限公司人工合成由tk基因上游同源臂δtk-h1、绿色荧光蛋白表达盒(gfp)和tk基因下游同源臂δtk-h2组成的基因片段,然后将该片段克隆到puc57载体,得到gfp转移载体pprv(ah02la)-gfp(tk-),其结构如图4所示。tk基因上游同源臂δtk-h1的序列如seqidno:4所示,tk基因下游同源臂δtk-h2的序列如seqidno:5所示,gfp表达盒的序列同申请号为201510388390.9发明专利。送南京金斯瑞生物科技有限公司人工合成由tk基因上游同源臂δtk-h1和tk基因下游同源臂δtk-h2组成的基因片段,然后将该片段克隆到puc57载体,得到转移载体pprv(ah02la)-tkδ,其结构如图5所示。2、gfp重组伪狂犬病病毒prvah02la(δge)株的获得应用9~10日龄spf鸡胚制备原代鸡胚成纤维细胞(chickenembryofibroblasts,cef),细胞长成单层后,进行转染。按照常规磷酸钙转染法进行转染时,将0.5~1μggfp转移载体pprv(la-a)-gfp(tk-)dna与0.2~1μg伪狂犬病病毒prvah02la(δge)株的dna共转染原代cef,进行同源重组(图6),24小时后吸除培养液,加入含10%胎牛血清和0.5%甲基纤维素的dmem培养基覆盖,继续培养24~48h,挑取在波长为488nm紫外光激发下发出绿色荧光的重组病毒蚀斑,接种到新鲜的cef,如此重复3个循环以上,获得纯化的重组病毒,命名为prvah02la(ge-)-gfp(tk-)株。以prvah02la(ge-)-gfp(tk-)株的dna为模板,应用一对引物(上游引物prvδtkckeckf序列为:5’-cgcaccccgaggttgacttcaa-3’;下游引物prvδtkckeckr序列为:5’-ttgtacgcgccgaagagggtgt-3’)pcr扩增由tk基因上游同源臂(δtk-h1)、绿色荧蛋白表达盒(gfp)和tk基因下游同源臂(δtk-h2)组成的基因片段,将扩增产物进行电泳和序列测定,以验证序列是否正确插入。pcr反应体系(表2)和反应程序如下。表225μlpcr反应体系pcr反应体系中的lataqdna聚合酶、2×gcbufferii购自takara公司。将反应体系混匀,进行pcr扩增,反应程序如下:94℃预变性4min;94℃变性40s,58℃退火40s,72℃延伸2min30s,30个循环;72℃延伸10min。将pcr产物进行1%琼脂糖凝胶电泳,检测是否有2200bp左右的目的条带并将其切下,采用dna凝胶回收试剂盒回收,将回收产物送华大基因公司测序。鉴定结果表明重组病毒prvah02la(ge-)-gfp(tk-)株采用上述引物进行pcr扩增后,得到了2200bp左右的目的产物,序列测定结果正确,该重组病毒是将伪狂犬病病毒prvah02la(δge)株的tk基因第184位至530位共347bp核苷酸替换插入了gfp表达盒(图6)后获得的,与预期完全一致。3、伪狂犬病病毒ge、tk双基因缺失株的获得与鉴定取1~3μg重组病毒prvah02la(ge-)-gfp(tk-)株的dna与700~2000ng的pprv(ah02la)-tkδ的dna,按照常规磷酸钙转染法转染原代cef,进行第二次同源重组,以敲除gfp表达盒(图6)。共转染后24小时吸除培养液,加入含10%胎牛血清和0.5%甲基纤维素的dmem培养基覆盖,继续培养24~48h,在波长为488nm紫外光激发下挑取不发出绿色荧光的病毒蚀斑接种新鲜cef,如此重复3~5个循环,获得纯化后的病毒,命名为prvla1206株,并作为种毒。提取prvla1206株的dna作为模板,应用引物prvδtkckeckf和prvδtkckeckr进行pcr扩增,检测是否有347bp的目的条带并将其切下,采用dna凝胶回收试剂盒回收,并进行序列测定。结果显示,以prvla1206株dna为模板pcr扩增获得了300~400bp的特异性片段,测序结果与预期一致,即prvah02la(δge)株的tk基因第184位至530位共347bp核苷酸被成功敲除。4、伪狂犬病病毒la1206株种毒的传代为进一步提高伪狂犬病病毒la1206株的安全性,将伪狂犬病病毒la1206株种毒在cef上进行连续传代,每5代保存一批种子,共传到第120代,其中从第75代至第80代系经连续5代挑取单个病毒蚀斑克隆而得f80代。伪狂犬病病毒la1206株种毒第1代记为伪狂犬病病毒la1206株种毒f1代,其他依次类推。各代次保存的种子置-70℃储存备用。5、伪狂犬病病毒la1206株的gc和gd基因序列的测定取伪狂犬病病毒la1206株种毒f2代和f80代的dna,通过pcr扩增其gc和gd基因片段,并进行序列测定。首先根据genbank中的prvzj01株(genbank登录:km061380.1)全基因组序列,应用vectornti软件,共设计2对pcr引物(如表3),这些引物的扩增片段覆盖了prv的主要保护性抗原gc和gd基因序列。所有设计的引物由南京金斯瑞生物科技有限公司进行合成。表3扩增prvgc和gd基因的pcr引物以伪狂犬病病毒la1206株种毒f2代和f80代的dna为模板,分别扩增gc和gd基因序列。将如表1所示pcr反应体系中的引物替换为表3中的引物,其他不变。pcr反应条件为:94℃1min;94℃30s,退火30s(根据引物tm值确定退火温度),72℃延伸(根据扩增片段大小确定延伸时间),30个循环;72℃延伸5min。pcr完成后,用1%琼脂糖凝胶电泳鉴定,切下含有与预期大小一致的pcr目的条带凝胶块进行dna的回收,将回收的2个糖蛋白基因片段送华大基因公司进行测序。测序结果显示,伪狂犬病病毒la1206株种毒f2代和f80代的gc和gd基因序列相同,且与ah02la株相同,具有prv变异株的典型特征,且传代中未发生任何变异。gc和gd是伪狂犬病病毒的主要保护性抗原,其基因未因传代发生改变,表明伪狂犬病病毒la1206株种毒的免疫原性得到完整保持。将伪狂犬病病毒la1206株种毒f80代命名为伪狂犬病病毒la1206-80株,即prvla1206-80株。实施例三、prvla1206-80株的生长特性鉴定将强毒株prvah02la株、prvla-a株和prvla1206-80株分别以moi为0.004接种长满单层的st细胞上,置5%co2恒温培养箱中37℃孵育1h后,吸去上清液,应用pbs洗涤3次后,换成细胞维持液(含3%胎牛血清(fbs)的dmem培养基(gibco))进行培养,并分别于接种后0h、6h、12h、24h、36h、48h和72h测定感染细胞上清液中游离病毒和感染细胞中细胞结合性病毒的含量。感染细胞上清液的游离病毒含量是按照以下方法进行操作:在指定时间点分别收集感染细胞上清液1ml,376×g离心5min取100μl上清液,加入900μldmem培养基中混匀,再从中吸取100μl至900μldmem培养基中,重复以上步骤,即对感染细胞上清液作10~109倍比稀释。将病毒稀释液接种于预先铺满的单层st细胞的96孔细胞板中,每个稀释度作8个重复,37℃孵育2h,弃掉病毒液,每孔加入100μl的细胞维持液(含3%胎牛血清(fbs)的dmem培养基(gibco))。12h后开始观察细胞病变情况,连续观察3天,按照reed-muench法计算病毒tcid50,统计所有时间点病毒液的tcid50,绘制生长曲线。感染细胞的细胞结合性病毒含量检测按照以下方法进行操作:吸去细胞上清液,用pbs清洗感染细胞2次,刮取细胞后用2mldmem重悬,-70℃与37℃反复冻融3次后500×g离心5min,取100μl上清液作10~109倍比稀释。按上述游离病毒含量检测相同方法接种st细胞并测定病毒tcid50,统计所有时间点病毒液的tcid50,绘制生长曲线。从病毒的体外生长曲线(图7)可以看出,tk、ge双基因缺失株弱毒株prvla1206-80株与ge基因缺失病毒prvla-a株和亲本病毒prvah02la株具有相似的生长动力学,在接种后24h~48h都达到峰值,虽然prvla1206-80株较la-a株和ah02la株略有下降,但滴度仍达到108.0tcid50/ml以上,能满足活疫苗生产的要求。实施例四、prvla1206-80株的安全性1、试验材料1.1病毒将prvla1206-80株接种st细胞,采用含3%(体积百分浓度)胎牛血清的dmem培养基培养40小时,收获病毒培养物,冻融后离心取上清液作为prvla1206-80株病毒液。伪狂犬病病毒la1206株种毒f2代病毒液(制备方法同prvla1206-80株病毒液)和prvla1206-80株病毒液,病毒含量分别为108.0tcid50/ml和108.1tcid50/ml;prvah02la株病毒液,病毒含量为109.0tcid50/ml;prvla-a株病毒液,病毒含量为108.3tcid50/ml。病毒均置-70℃保存。1.2诊断试剂盒prvge抗体诊断试剂盒,civtestsuisadvgbhipra公司产品。prvgb抗体诊断试剂盒,civtestsuisadvgbhipra公司产品。2、试验动物试验仔猪为同窝1日龄健康仔猪,其prv抗体均为阴性。接种前核实猪只的饮食、精神状况和临床情况等,凡不健康的猪只排除出试验。通过耳标号码和笼号进行标识。与哺乳母猪共同在隔离环境中饲养。专人负责饲养,每天进行2次清洁卫生。试验小鼠为17~22克昆明系清洁级小鼠,购自上海杰思捷实验动物有限公司。饲养于清洁的环境中,专人饲养,每日清洁卫生。3、分组同窝1日龄试验仔猪,随机分成3组(a-1、a-2、a-3),每组4头,进行prvla1206株种毒f2代、prvla1206-80株和prvla-a株滴鼻接种的安全性试验。另一窝1日龄试验仔猪,随机分成3组(b-1、b-2、b-3),每组4头,进行prvla1206株种毒f2代、prvla1206-80株和prvla-a株肌肉注射接种的安全性试验。试验小鼠随机分为20组,每组4只,进行prvah02la株、prvla-a株、prvla1206株种毒f2代、prvla1206-80株的安全性试验,具体分组方法见表4。表4、试验小鼠分组4、试验方法4.1同窝1日龄仔猪接种方法及临床观察将prvla1206株种毒f2代、prvla1206-80株和prvla-a株分别应用dmem培养基稀释至107.0tcid50/ml,分别以滴鼻接种和肌肉注射接种的方式各接种1日龄仔猪一组(4头),接种量为1ml/头,具体见表5。自接种日至接种后14天,每日测量试验仔猪的体温,观察饮食和精神状况以及临床症状。4.2小鼠接种方法及观察将prvah02la株和prvla1206株种毒f2代、prvla1206-80株以及prvla-a株分别应用dmem培养基稀释至106.0tcid50/0.2ml,再分别用dmem培养基稀释至合适浓度,以皮下注射方式接种,各病毒接种量如表4,病毒液的接种体积为0.2ml/只。自接种日至接种后14天,观察试验小鼠死亡情况。按reed和muench法计算对小鼠的半数致死量。5、试验结果5.11日龄仔猪试验结果各毒株对仔猪的安全性试验结果见表5。缺失ge基因的prvla-a株对1日龄prv抗体阴性仔猪仍有较强的致病力,在进行tk和ge基因双缺失后其(即prvla1206株种毒f2代)致病力显著下降,但无论是滴鼻接种还是肌注接种都引起试验猪的体温升高,且4头试验猪中都有1头发病死亡(表4),表明仍有毒力,而经过连续传代到f80代后,无论是滴鼻还是肌注接种都未引起试验猪体温升高,无发病死亡,表明连续传代进一步将tk和ge双基因缺失株致弱了,证明了prvla1206-80株具有良好的安全性。表51日龄仔猪的安全性试验分组及结果5.2小鼠实验结果prvah02la株对小鼠的ld50为102.57tcid50,prvla-a株对小鼠的ld50为104.96tcid50,prvla1206株种毒f2代和prvla1206-80株以106.0tcid50接种小鼠不引起死亡。prvla1206-80株的保藏信息如下:保藏单位:中国微生物菌种保藏管理委员会普通微生物中心。单位地址:北京市朝阳区北辰西路1号院3号中科院微生物研究所。参椐的生物材料(株):prvla1206-80。分类命名:猪疱疹病毒1型。保藏号:cgmccno.14329。保藏日期:2017年7月24日。实施例五、prvla1206-80株的免疫效力1、试验材料1.1病毒与伪狂犬病活疫苗prvla1206-80株病毒液,病毒含量为108.1tcid50/ml。伪狂犬病活疫苗(barthak61株),购自南京天邦生物科技有限公司,批次150826。prvah02la株,用于攻毒试验,对45日龄prv阴性猪的ld50为106.5tcid50。1.2诊断试剂盒prvge抗体诊断试剂盒和prvgb抗体诊断试剂盒,来自北京爱德士元亨生物科技有限公司(idexx)公司。2、试验动物28~35日龄健康仔猪24头,其prv抗原和prvge与gb抗体均为阴性,猪繁殖与呼吸障碍综合征病毒(prrsv),猪瘟病毒(sfv),猪圆环病毒2型(pcv2)和o型口蹄疫病毒(fmdv(o))抗原与抗体均为阴性。接种前核实猪只的饮食、精神状况和临床情况等,凡不健康的猪只排除出试验。通过耳标号码和笼号与圈号进行标识。在隔离环境中分笼饲养。饲料为全价配合饲料(市售产品),饮水为自来水,每日上午和下午各饲喂一次。专人负责饲养,每天进行2次清洁卫生。3、分组试验动物一次引入,随机分为a~f组,每组4头,具体见表6。4、试验方法和研究的指标(1)试验方法免疫:将prvla1206-80株病毒液和伪狂犬病活疫苗(barthak61株)应用无菌dmem培养液进行稀释至合适的浓度,肌肉注射,2ml/头,a组、b组和c组分别接种1000tcid50、10000tcid50和100000tcid50的prvla1206-80株病毒液,d组接种100000tcid50的伪狂犬病活疫苗(barthak61株),e、f组每头肌注2mldmem液(表6)。表6、动物免疫攻毒试验分组组别免疫剂量接种毒株a组1000tcid50prvla1206-80株b组10000tcid50prvla1206-80株c组100000tcid50prvla1206-80株d组100000tcid50伪狂犬病活疫苗(barthak61株)e组空白对照/f组攻毒对照/攻毒:除空白对照组外的所有猪只于接种后1周攻毒,应用prvah02la株,以2ld50/头滴鼻攻毒,每头2ml,攻毒后观察14天。血清gb和ge抗体检测:免疫前、攻毒前和攻毒结束时(即攻毒后14天)三个时间点采取所有猪只血清样品,应用试剂盒检测prvge和gb抗体。临床症状观察:所有试验猪只每天观察精神、饮食状况和各种呼吸系统、神经系统和全身性临床表现。体温测量:从接种前开始,至试验结束(攻毒后14天),所有猪只每天测量体温一次(直肠温度)。排毒情况检测:攻毒前、攻毒后至试验结束(攻毒后14天),每天采集猪只鼻拭子样品,样品置-70℃保存,检测时倍比稀释后接种bhk-21细胞观察病变以确定是否排出病毒。(2)研究的指标发病率、死亡率、体温升高情况、排毒情况、血清抗体阳转情况。5、试验结果接种前所有试验猪的prvgb和ge抗体均为阴性,空白对照猪(e组)至试验结束时的prvgb和ge抗体均为阴性,接种后1周时(即攻毒前)a组、b组、c组和d组的所有试验猪的prvgb抗体均为阳性,攻毒后所有免疫组猪和攻毒对照组存活猪的prvge抗体均为阳性(表7)。表7、免疫攻毒试验猪血清抗体阳转情况统计表攻毒后,空白对照组猪只无发病死亡,无体温升高,未检出排毒;攻毒对照组4头猪从攻毒后第2天开始全部出现减食,精神沉郁,打喷嚏,流鼻涕和呼吸困难等症状,体温都升高到40.5℃以上,均从鼻拭子样品中检出排毒,在攻毒后第4~6天陆续死亡3头;表明试验对照成立(表8)。a组、b组、c组所有试验猪均无临床症状,无体温升高,未检出排毒,表明prvla1206-80株能对prv变异株产生完全保护;d组试验猪无死亡,有1头猪出现临床症状,4头猪均出现体温升高,均从鼻拭子样品中检出排毒,表明prvbarthak61株只产生了部分保护(表8)。表8、免疫攻毒试验猪临床情况统计表综上所述,prvla1206-80株免疫猪只均能产生对prv野毒株ah02la株的完全保护,最低至1000tcid50的接种量免疫后也能抵抗发病和排毒,而100000tcid50的prvbarthak61株只能产生部分保护,不能阻止体温反应和排毒,la1206-80株作为疫苗株对变异株的保护效果显著优于barthak61株。prvla1206-80株制备的活疫苗接种猪只检出prvgb抗体,未检出prvge抗体,是一种能鉴别疫苗免疫动物与野毒感染动物的diva疫苗,其推广应用将非常有利于在猪场中进行prv变异株的净化,前景广阔。由于la1206-80株,毒力显著降低,对1日龄仔猪无致病性,因此是具有较高安全性的疫苗候选弱毒株,可用于初生仔猪的早期免疫,尽早阻断野毒的感染。sequencelisting<110>江苏省农业科学院<120>伪狂犬病病毒双基因缺失弱毒株及其应用<130>20171103<160>5<170>patentinversion3.3<210>1<211>963<212>dna<213>prvah02la株<400>1atgcgcatcctccggatctacctcgacggcgcctacggcaccggcaagagcaccacggcc60cgggtgatggcgctcggcggggcgctgtacgtgcccgagccgatggcgtactggcgcact120ctgttcgacacggacacggtggccggtatttacgatgcgcagacccggaagcagaacggc180agcctgagcgaggaggacgcggccctcgtcacggcgcagcaccaggccgccttcgcgacg240ccgtacctgctgctgcacacgcgcctggtcccgctcttcgggcccgcggtcgagggcccg300cccgagatgacggtcgtctttgaccgccacccggtggccgcgacggtgtgcttcccgctg360gcgcgcttcatcgtcggggacatcagcgcggcggccttcgtgggcctggcggccacgctg420cccggggagccccccggcggcaacctggtggtggcctcgctggacccggacgagcacctg480cggcgcctgcgcgcccgcgcgcgcgccggggagcacgtggacgcgcgcctgctcacggcc540ctgcgcaacgtctacgccatgctggtcaacacgtcgcgctacctgagctcggggcgccgc600tggcgcgacgactgggggcgcgcgccgcgcttcgaccagaccgtgcgcgactgcctcgcg660ctcaacgagctctgccgcccgcgcgacgaccccgagctccaggacaccctcttcggcgcg720tacaaggcgcccgagctctgcgaccggcgcgggcggccgctcgaggtgcacgcgtgggcg780atggacgcgctcgtggccaagctgctgccgctgcgcgtctccaccgtcgacctggggccc840tcgccgcgcgtctgcgccgcggccgtggcggcgcaggcgcgcggcatggaggtgacggag900tccgcgtacggcgaccacatccggcagtgcgtgtgcgccttcacgtcggagatgggggtg960tga963<210>2<211>1023<212>dna<213>artificial<220><223>ge基因上游同源臂δge-h1<400>2tgtttctggaggggccctcgccgagcaactacagcgggcgcgtggagctgctgcgcctcg60accccaagcgcgcctgctacacgcgcgagtacgccgccgagtacgacctctgcccccgcg120tgcaccacgaagccttccgcggctgcctgcgcaagcgcgagccgctcgcccggcgcgcgt180ccgccgcggtggaggcgcgccggctgctgttcgtctcgcgcccggcctcgggggacgcgg240ggtcgtacgtgctgcgggtccgcgtgaacgggaccacggacctctttgtgctgacggccc300tggtgccgccgagggggcgccccgtccccacgtcgccgcccgcggacgagtgccggcccg360tcgtcggatcgtggcacgacagcctgcgcgtcgtggaccccgccgaggacgccgtgttca420ccacccagcccccgcccgagcccgagccgccgacgacccccgcgcccccccgggggaccg480gcgccacccccgagccccgatcggacgaggaggaggaggtgacgcggagacgacgacgcc540gactgacccccgcgcccgggaccctggacgcgaacggcacgatggtgctgaacgccagcg600tcgtgtcgcgcgtcctgctcgccgccgccaacgccacggcgggcgcccggagccccggga660agatagccatggtgctggggcccacgatcgtcgtcctcctgatcttcctgggcgggatcg720cctgcgtggcccggcgctgcgcgcggaatcgcatctaccggccgcgacccgggcgcggat780cggcggtccatgcggcgcccccgcggcgcccgcccccaaccccggtcgccggggcgcccg840tcccccagcccaagatgacgttggccgagctgcgccagaagctcgccaccatcgcagaag900aacaataaaaaggtggtgtttgcataattttgtgggtggcgttttatctccgtccgcgcc960gttttaaacctgggcacccccgcgagtctcgcacacaccggggttgagaccatgcggccc1020ttt1023<210>3<211>1113<212>dna<213>artificial<220><223>ge基因下游同源臂δge-h2<400>3gctggcgctgggctccttcgtgatgacgtgcgtcgtcgggggggccatctggctctgcgt60gctgtgctcccggcgccgggcggcctcgcggccgttccgggtgccgacgcgggcgcggac120gcacatgctctctccggtgtacaccagcctgcccacgcacgaggactactacgacggcga180cgacgacgacgacgaggaggcgggcgtcatccgccggcggcccgcctcccccagcggaga240cagcggctacgaggggccgtacgcgagcctggaccccgaggacgagttcagcagcgacga300ggacgacgggctgtacgtgcgccccgaggaggcgccccgctccggcttcgacgtctggtt360ccgcgatccggagaaaccggaagtgacgaatggacccaactatggcgtgaccgccaaccg420cctgttgcatgtcccgccccgctaaaataccgggagaaccggtccgcccgcattccgaca480tgcccggcgccgcctccgtcgacatggacacgtttgaccccagcgcccccgtcccgacga540gcgtctcgaacccggccgccgacgtcctgctggcccccaagggaccccgctccccgctgc600gcccccaggacgactcggactgctactacagcgagagcgacaacgagacgcccagcgagt660tcctgcgccgcgtgggacgccggcaggcggcgcgtcggagacgccgccgctgcctgatgg720gcgtcgcgatcagcgccgccgcgctggtcatctgctcgctgtccgcgctactcgggggca780tcgtcgccaggcacgtgtagcgagcgagcgagcgaacgggagcgggggcccgcccccatc840cgccgcgcccaggagaggggggagagagcggggggttgggcgcgccacgtggtgtgggca900cggactcggacttgtcacaataaatgggccccggcgtgtccgggcgcacacagcagcctt960cctctcctccgcgtctctgttccgcccgtctctcgccggactcttcttctccaccgcctc1020caccgtcgcagttgtcgcgagcgcgttcgcaccatgggggtgacggccatcaccgtggtc1080acgctgatggacggggccgggcgcatccccgcc1113<210>4<211>1204<212>dna<213>artificial<220><223>tk基因上游同源臂δtk-h1<400>4cgtcgtaggcgagcgccacgtcgttcttggcgatctgcacctcgcggccctcgtccgcgg60ccgcgaccgcctcgggcgcctcctcggcggcgcgcgccgcgtccgcctcctcggcggcgc120gcgccgtctcctcgagcaccacgagcgcctcggccacgcgctccacctgccgctccagcg180gccgcagctgctcgtccacctcggcctcgaggcgcgcgcccgcggccatggcgttgtcca240gcgccgcggcggccgcgcggcggcgcgcgttcgcgtgcgccagcgcgaggcgcgcgtcga300ggccctcgccgaagcccgggcgggcccagaagcccacggggaacgggggcgcgatgaagt360ggcgcgcgctgcccgggatcgcagcggcctcgaaggcgaaccacgcgcggtccatggcgc420ggggggacatgggccgcgcggcggcgcgcgccgccttatcatccccgctccccgccgccg480cccggcccggccccgcgcgcgccgcgatcgcgatcaccgccgcggcccggcgacgtactc540ggcgaggccgcgcacggtcgcggccatcgcgctcgcgttgccgcgcgtctgggtgcaggg600caggcgcgtcacgtcgagcacgcgcatgctccgctgggccacaaacaccagcaggggcac660gagcgtgatctcctcgccgcccgggggcacggcggcggcgaggaggcgcgccgagtcgcg720cagctggcacagcccctcgtgccgctgcccgcgcttgctgggcgtgttgaggttccgggg780gaagcggcacgtcttgagctcgatgaggaagcacaggtgcgggcccgcccccagccgcac840cacgcacacgcagtcggggcggcgcaccccgaggttgacttcaaaggccagggtcaagga900cgccttcttaagcgtctctcggggaagcccgaagagactctcgccgtacgcggacgggtc960gcgtcgcaggcgttcgtagaagcggttgtggcagcggatccccgcccggaagcgcgccgg1020gatgcgcatcctccggatctacctcgacggcgcctacggcaccggcaagagcaccacggc1080ccgggtgatggcgctcggcggggcgctgtacgtgcccgagccgatggcgtactggcgcac1140tctgttcgacacggacacggtggccggtatttacgatgcgcagacccggaagcagaacgg1200cagc1204<210>5<211>1216<212>dna<213>artificial<220><223>tk基因下游同源臂δtk-h2<400>5gctcacggccctgcgcaacgtctacgccatgctggtcaacacgtcgcgctacctgagctc60ggggcgccgctggcgcgacgactgggggcgcgcgccgcgcttcgaccagaccgtgcgcga120ctgcctcgcgctcaacgagctctgccgcccgcgcgacgaccccgagctccaggacaccct180cttcggcgcgtacaaggcgcccgagctctgcgaccggcgcgggcggccgctcgaggtgca240cgcgtgggcgatggacgcgctcgtggccaagctgctgccgctgcgcgtctccaccgtcga300cctggggccctcgccgcgcgtctgcgccgcggccgtggcggcgcaggcgcgcggcatgga360ggtgacggagtccgcgtacggcgaccacatccggcagtgcgtgtgcgccttcacgtcgga420gatgggggtgtgaccctcgcccctcccacccgcgccgcggccggatggagaccgcgacgg480aggcaacgacgacggcgtgggagggggctcggggcgcgtataaagccatgtgtatgtcat540cccaataaagtttgccgtgcccgtcaccatgcccgcgtcgtccgtgcgcctcccgctgcg600cctcctgaccctcgcgggcctcctggccctcgcgggggccgccgccctcgcccgcggcgc660gccgcagggtgggccgccctcgccgcaggggggtcccgcgcccaccgcggcgcccgcgcg720cgggcccaccctgttcgtcctggacggcgacggctccgcgtggttcgtcttccagctcgg780cgggctgggggcgctcaacgacacgcgcatccgcgggcacctgctcggccggtacctcgt840ctcgtaccaggtggtgcccccgcccgtctccgcgtggtactttgtgcagcgcccgcgcga900gcgcccgcgcctctcggggccgccctcgggcgcggagctcgtggccttcgacgcgcccgg960cgtccggcgcacgtacaccacggcggcggtgtggcccgcggaggtggccgtcctcgcgga1020cgcggaggcgcgctgccccgcggccgtcttcaacgtgacgctgggcgaggccttcctcgg1080cctgcgcgtcgcgctgcgctccttcctgccgctggaggtcatcatctccgccgagcggat1140gcgcatgatcgcgcccccggcgctcggctcggacctggagccgccgggcccgcccgcggg1200ccgcttccacgtgtac1216当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1