一种DNA甲基转移酶缺陷型CHO细胞系及其制备方法及应用与流程
本发明涉及一种dna甲基转移酶缺陷型中国仓鼠卵巢(cho)细胞系的制备方法及应用,属于基因工程技术领域。
背景技术:
二十世纪八十年代组织纤溶酶原激活剂(tissuetypeplasminogenactivator,t-pa)在重组中国仓鼠卵巢(chinesehamsterovary,cho)细胞中首次成功表达并获得美国fda批准用于临床,标志着以cho细胞为基础的生物制药时代的到来。目前cho细胞源生产的重组药物蛋白已占哺乳动物细胞生产的近70%。但现阶段cho细胞表达系统存在表达量低、尤其是表达不稳定等问题,无法满足用于疫苗开发、临床治疗和基因疗法等方面日益增长的需求。因此,利用基因和细胞工程的方法进行cho细胞重组表达研究,对于提高其转基因表达水平和表达稳定性、建立高产稳产的重组蛋白cho细胞表达系统具有十分重要的意义。研究已证实,通过减少启动子中的cpg岛(cpgislands)而使转基因对甲基化不敏感有利于重组蛋白的高效和持续表达。例如,hcmv-mie启动子转录起始位点上游的c-179突变为g能够显著提高稳定转染cho细胞中重组蛋白的持续表达。因此,深入研究dna甲基化对转基因表达的影响及其机制将有助于筛选获得高产稳产的重组cho细胞系。
dna甲基化(dnamethylation)是一种在原核和真核生物基因组中常见的表观遗传修饰,也是哺乳动物中基因表达的重要调控方式,在基因转录抑制方面起关键作用:基因启动子区域(包括转录因子结合位点)cpg岛的高甲基化状态能够直接阻止转录因子的结合而导致染色质结构的改变,从而限制转录因子与基因启动子结合,进而对基因转录、剪接、翻译及表达量等造成影响。有关dna甲基化在cho细胞中对重组蛋白表达的作用研究主要集中于启动子的改造,包括启动子甲基化位点点突变、无cpg岛启动子、合成性启动子的应用以及核心cpg岛元件的插入等。dna甲基化需要dna甲基转移酶(dnamethyltransferase,dnmt)包括从头甲基转移酶dnmt3a和dnmt3b以及dna甲基化维持酶dnmt1的催化,特别是dnmt3a介导的启动子甲基化与转基因的不稳定表达密切相关。
当前,利用细胞工程技术对细胞进行改造已广泛应用,特别是通过基因敲除或基因沉默等影响与特定生物学功能相关基因的表达水平,以获得特定生物学功能发生改变的细胞。由于其具有操作简便、稳定、灵活及效率高等技术上的优势,将是目前及未来改造cho细胞不断提升其重组蛋白生产能力的主要技术策略。
技术实现要素:
为解决上述技术问题,本发明利用crispr/cas9基因编辑技术敲除cho细胞dna甲基转移酶dnmt3a基因,筛选并鉴定获得dna甲基转移酶dnmt3a缺陷型cho细胞,通过转染真核表达载体并筛选稳定表达重组cho细胞株而建立基于dna甲基转移酶dnmt3a缺陷型的新型无甲基化的cho细胞表达系统。
为了实现以上目的,本发明所采用的技术方案如下:
一种dna甲基转移酶dnmt3a基因缺陷型的cho细胞系。
所述dna甲基转移酶dnmt3a基因组dna序列为genbank:nw_003613640.1,dnmt3a缺陷型cho细胞基因组dna序列敲除缺失199个碱基即第41138-41336位碱基。
进一步地,所述cho细胞系选自cho-k1、cho-s、cho-dg44中的任意一种。
本发明还提供上述dna甲基转移酶dnmt3a基因缺陷型的cho细胞系的制备方法,可利用crispr/cas9基因编辑技术敲除cho细胞dna甲基转移酶dnmt3a基因而获得;包括利用crispr/cas9基因编辑技术敲除dna甲基转移酶dnmt3a基因,筛选并鉴定获得dnmt3a缺陷型cho细胞,通过细胞增殖、细胞凋亡等细胞生物学特性检测验证缺陷型细胞系能否进行正常的增殖和传代培养。
具体地,上述方法包括如下步骤:
1)针对候选基因确定打靶位点:根据ncbi的genbank中中国仓鼠dna甲基转移酶基因dnmt3a基因组序列(no.nw_003613640.1)和mrna序列(no.xm_016964036.1)设计引物进行相应基因组dna基因片段pcr扩增,将pcr扩增基因片段进行克隆测序验证序列的准确性;应用在线工具(http://crispr.mit.edu/)辅助设计dnmt3a基因的嵌合单链向导rna(chimericsingle-guiderna,chimericsgrna)打靶位点,根据靶向序列分别设计两对引物以构建表达crispr/cas9的打靶sgrna载体;
2)sgrna载体的构建:使用bbsi限制性内切酶线性化px330载体质粒并胶回收线性片段;sgrna寡核苷酸单链退火形成双链;将线性化px330载体与双链sgrna进行连接过夜;连接产物转化dh5α感受态细胞,氨苄抗性涂板筛选,挑取单菌落,37℃摇床摇菌过夜提取质粒并进行测序验证;选取测序正确的阳性克隆质粒进行细胞转染;
3)cho细胞转染、单克隆挑选及细胞敲除鉴定
转染前将2.0×105个cho细胞接种于24孔培养板中,当细胞融合度达到80%-90%时加入上述含有sgrna的重组质粒共转染cho细胞;将转染细胞进行梯度稀释和极限稀释,以达到挑选出具有独立敲除的单克隆突变型细胞;对获得的缺陷型细胞株提取其基因组dna,利用pcr扩增dnmt3a基因片段并测序以确定基因敲除成功。
本发明还提供包含上述dna甲基转移酶dnmt3a基因缺陷型的cho细胞系的真核细胞表达系统。
本发明还提供上述真核细胞表达系统的制备方法,包括:将目的基因插入表达载体中,构建得到重组表达载体;将该重组表达载体转染进入所述缺陷型的cho细胞系,经筛选得到表达系统。
进一步地,可将所构建的表达载体转染dnmt3a缺陷型和正常对照cho细胞,筛选多克隆cho重组细胞株并传代培养,检测分析目的基因在重组cho细胞中瞬时表达和长期稳定表达情况。
本发明还提供上述dna甲基转移酶dnmt3a基因缺陷型的cho细胞系、上述真核细胞表达系统在制备目的蛋白等方面的应用。
重组细胞株中目的基因不能持续高效表达甚至出现表达衰退是利用cho细胞进行重组蛋白生产普遍和突出存在的问题。目前认为dna甲基化是造成这种表达不稳定性的主要原因,特别是dna甲基转移酶dnmt3a介导的启动子甲基化与转基因的不稳定表达密切相关。近年来,细胞工程改造策略即利用细胞工程技术特别是基因敲除、基因过表达或基因沉默等技术,改变与重组蛋白表达量或活性相关的生物学功能基因表达水平,表现出提高重组蛋白产量和(或)活性的巨大潜力。因此,本发明将宿主细胞遗传改造和表达载体优化相结合,利用crispr/cas9基因编辑技术构建基于dna甲基转移酶缺陷型的新型cho细胞表达系统,能够明显提高重组蛋白的表达水平,克服了目前表达系统存在的表达水平较低、表达不稳定的问题。
附图说明
图1:cho细胞dnmt3a基因敲除单克隆dnmt3a-30测序鉴定结果;其中,划删除线的为基因敲除缺失的199个碱基序列,箭头所指为缺失突变位点,下划线为dnmt3a基因片段扩增引物,波浪线为sgrna打靶位点。
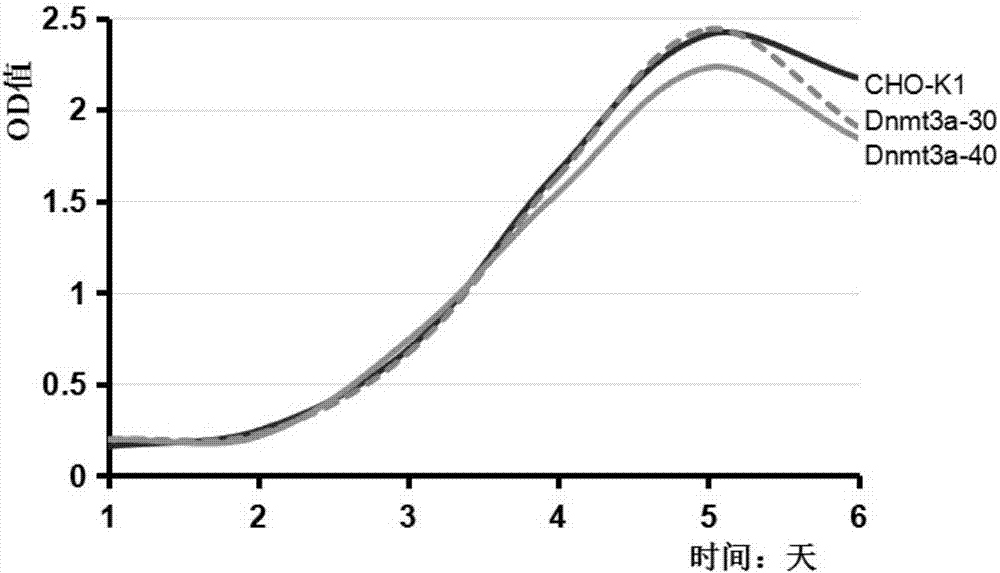
图2:cck-8法检测dnmt3a缺陷型cho细胞单克隆细胞dnmt3a-30和dnmt3a-40及正常cho-k1细胞增殖结果图。
图3:流式细胞术检测dnmt3a缺陷型cho细胞及正常cho细胞凋亡结果图。
图4:cmv启动子驱动的真核表达载体pwty-02示意图。
图5:由cmv启动子驱动的egfp基因在dnmt3a缺陷型cho细胞和正常cho细胞中表达阳性细胞率。
图6:cmv启动子驱动表达的egfp在dnmt3a缺陷型cho细胞和正常cho细胞中表达稳定性实验结果。
图7:重组epo蛋白在dnmt3a缺陷型cho细胞和正常cho细胞中的表达量检测分析结果。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
实施例1cho细胞dnmt3a基因的敲除
1.1针对候选基因确定打靶位点
根据ncbi的genbank中中国仓鼠dna甲基转移酶基因dnmt3a基因组序列(no.nw_003613640.1)和mrna序列(no.xm_016964036.1)设计引物(d3a-ex1seq-l:5′-gaccacaagaattccggctc-3′,d3a-ex1seq-r:5′-cgtgtgtgaatctgtgtggg-3′)进行相应基因片段pcr扩增,将pcr扩增片段进行克隆测序验证序列的准确性。应用在线工具(http://crispr.mit.edu/)辅助设计的dnmt3a基因的嵌合单链向导rna打靶位点如下:
d3a-ex1-98rev:5′-atcatcctcccgctccaaagtgg-3′;
d3a-ex1-308fw:5′-tttgaggggtcatccttgcaggg3′
根据靶向序列分别设计两对引物以构建表达crispr/cas9的打靶sgrna载体。
1.2sgrna载体的构建
使用bbsi限制性内切酶线性化px330载体质粒并胶回收线性片段。sgrna寡核苷酸单链退火形成双链。将线性化px330载体与双链sgrna进行连接过夜。连接产物转化dh5α感受态细胞,氨苄抗性涂板筛选,挑取单菌落,37℃摇床摇菌过夜提取质粒并进行测序验证。选取测序正确的阳性克隆质粒进行细胞转染。
1.3cho细胞转染、单克隆挑选及细胞敲除鉴定
转染前将2.0×105个cho-k1细胞接种于24孔培养板中,当细胞融合度达到80%-90%时加入上述含有sgrna的重组质粒共转染cho-k1细胞。将转染细胞进行梯度稀释和极限稀释,以达到挑选出具有独立敲除的单克隆突变型细胞。利用crispr/cas9基因敲除方法和pcr扩增验证结果,我们最终筛选获得了6株dnmt3a缺陷型cho细胞单克隆(克隆30,31,32,33,40,41)。对其中dnmt3a缺陷型细胞株克隆30的pcr扩增产物的测序结果表明,基因敲除造成dnmt3a基因199个碱基的缺失突变,基因敲除成功(结果见图1)。
实施例2dnmt3a缺陷型cho细胞的生物学特性验证
以野生型cho-k1细胞作为对照,对获得的dnmt3a缺陷型cho细胞单克隆进行细胞生长特性验证,包括细胞形态和生长状态观察、cck-8法检测细胞增殖情况、流式细胞术(fcm)检测细胞凋亡情况,验证dnmt3a缺陷型cho细胞系能否进行正常的生长和传代。cck-8试剂盒(cellcountingkit-8试剂盒,碧云天beyotime生物公司)检测细胞增殖(结果见图2)和流式细胞术检测细胞凋亡结果(结果见图3)提示,获得的dnmt3a缺陷型cho细胞株能够正常进行生长和传代,细胞生长状态、形态、细胞增殖、细胞凋亡等生物学特性与正常cho细胞无显著性差别。
实施例3不同启动子驱动的重组表达载体的构建
本发明以真核表达载体piresneo2(clontech公司)为母载体,构建由cmv启动子驱动表达绿色荧光蛋白(egfp)的真核表达载体pwty-02(见图4)。
实施例4目的基因egfp在重组cho细胞中的表达分析
4.1cho细胞转染
培养cho-k1细胞,细胞转染前1天,以1×105细胞密度传代到新鲜的无血清培养基,待细胞融合度达80%-90%时即可用脂质体3000(invitrogen,usa)进行转染。分别转染两组cho细胞:dnmt3a缺陷型和正常对照cho-k1细胞。每个质粒平行转染3个复孔。
4.2转染细胞株瞬时表达观察
转染24h,倒置荧光显微镜观察瞬时转染细胞中egfp的表达情况。结果表明,真核表达载体在dnmt3a缺陷型和正常cho-k1细胞转染效率相当,两者egfp表达阳性细胞率无明显差别(见图5)。这说明dnmt3a基因敲除对细胞转染效率没有影响。
4.3稳定表达多克隆cho细胞株筛选及egfp长期稳定表达分析
加g418筛选,筛选培养两周后获得稳定转化的多克隆细胞株并在有筛选压力(加g418)和无筛选压力(不加g418)下传代培养50代,每10代分别将各实验组cho细胞按照每个样本106个细胞进行流式细胞仪检测分析,测定egfp平均荧光强度(meanfluorescenceintensity,mfi)。流式检测结果表明,无论是否存在g418筛选压力,由cmv启动子驱动表达的egfp可在dnmt3a缺陷型cho细胞长期稳定表达(见图6)。
实施例5促红细胞生成素(epo)目的蛋白在重组cho细胞中的表达分析
为进一步测试dnmt3a缺陷型cho细胞对重组蛋白表达稳定性的作用,我们以质粒pwty-02为基础,构建了由cmv启动子驱动促红细胞生成素(erythropoietin,epo)基因表达的真核表达载体。将构建的含epo基因表达载体质粒分别转染dnmt3a缺陷型和正常cho-k1细胞。转染的细胞在含有g418(800μg/ml)的培养基中培养15天以筛选稳定转染的重组细胞池(cellpool),每隔3天将重组cho细胞进行传代培养至50代。随后将重组cho细胞在125ml培养摇瓶中用25ml无蛋白、无血清、化学成分确定的cdcho培养基(lifetechnologies公司,培养基中含有8mm的l-谷氨酰胺)培养5天至细胞数达到8×106,离心收集上清液用于重组epo蛋白表达检测分析。
采用westernblot检测分析重组epo蛋白在dnmt3a缺陷型和正常cho-k1细胞池中的表达。具体地,将含有重组epo的上清液加入5×sds样品缓冲液煮水浴煮10分钟充分变性。分别取10μl蛋白样品经10%sds-聚丙烯酰胺凝胶电泳分离后,湿转法转移至硝酸纤维素膜。5%bsa封闭膜2小时,1:1000稀释的抗epo一抗(santacruz,ca)4℃孵育过夜,tbst洗膜后加1:5000稀释的hrp标记的抗小鼠igg二抗(santacruz,ca)37℃孵育1小时,tbst洗膜后加化学发光显色液显影,在凝胶成像仪上观察并采集图像结果,分析目的蛋白的灰度值表示待测蛋白的表达水平。westernblot检测结果表明,重组epo蛋白在dnmt3a缺陷型cho细胞池中的平均表达量(860.5±42.9mg/l)显著高于在未缺陷型cho细胞池中的平均表达量(373.7±29.6mg/l)。重组epo蛋白在稳定培养50代的重组dnmt3a缺陷型cho细胞池和未缺陷型cho细胞池中的表达量分别为:672.7±35.1mg/l和157.9±16.2mg/ml。表达量差异均具有统计学意义(见图7,p<0.05)。这些结果说明,dnmt3a缺陷型cho细胞可明显提高重组epo蛋白的表达水平和长期表达稳定性。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>新乡医学院华兰生物疫苗有限公司
<120>一种dna甲基转移酶缺陷型cho细胞系及其制备方法及应用
<130>khp171117122.3
<160>4
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
gaccacaagaattccggctc20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgtgtgtgaatctgtgtggg20
<210>3
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>3
atcatcctcccgctccaaagtgg23
<210>4
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>4
tttgaggggtcatccttgcaggg23
- 还没有人留言评论。精彩留言会获得点赞!
- 基于纳米颗粒团聚的dna去甲基化酶的生物传感方法
- 一种多肽——葡萄糖基转移酶蛋白-25.52和编码这种多肽的多核苷酸的制作方法
- 用于抑制法呢基蛋白转移酶的苯并(5
- 作为组蛋白脱甲基酶抑制剂的取代的(e)-n’-(1-苯基亚乙基)苯甲酰肼类似物的制作方法
- 利用雷帕霉素特异性甲基化酶标记雷帕霉素的制作方法
- 转录因子creb在调控jhdm2a基因表达及减少猪脂肪沉积中的应用的制作方法
- 一种新的多肽——dna甲基化酶13和编码这种多肽的多核苷酸的制作方法
- (3r)-去-o-甲基毛狄泼老素在制备预防或治疗抑郁症的药物中的用途的制作方法
- 法呢基蛋白转移酶的新的苯基取代的三环抑制剂的制作方法
- 新的法呢基-蛋白转移酶的三环磺酰胺抑制剂的制作方法
- 一种新的多肽——dna甲基化酶13和编码这种多肽的多核苷酸的制作方法
- 具有治疗活性的环亚甲基-1,2-二羧酸酰胺,制备它们的方法和含它们的药物组合物的制作方法
- 组蛋白去乙酰化酶抑制剂的制作方法
- 基于dna聚合酶链反应的甲基化dna检测方法
- 检测Cre位点特异重组酶活性的转基因报告猪及培养方法
- 一种多肽——人含胞嘧啶特异性dna甲基化酶特征性序列片段的蛋白-9.35和编码这种 ...的制作方法
- 一种多肽——脱氧核糖核酸甲基化酶-9.35和编码这种多肽的多核苷酸的制作方法
- 利用酶活性的竞争性干扰和恢复检测被分析物的制作方法
- 一种基于化学发光反应的甲基化酶检测探针、检测试剂盒及检测方法
- 编码甲基化儿茶素生物合成酶的基因的制作方法