表达猪丹毒杆菌重组蛋白GAPDH的基因gapdh及其重组大肠杆菌与应用的制作方法
本发明涉及疫苗基因工程领域,具体地指一种表达猪丹毒杆菌重组蛋白gapdh的基因gapdh及其重组大肠杆菌与应用。
背景技术:
动物丹毒病是由猪丹毒杆菌(红斑丹毒丝状杆菌,erysipelothrixrhusiopathiae)引起的多种动物(包括人类)发病的一种细菌性传染病。猪丹毒主要表现为猪的败血症、心内膜炎和多发性关节炎等,给养猪业带来巨大经济损失。猪丹毒曾经处于散发状态,但是2010年以来,猪丹毒发病呈现逐年上升趋势,且主要为规模化猪场发病,损失巨大。
由于对抗生素的滥用,导致猪丹毒杆菌耐药菌株的产生,使药物治疗趋向无效;抗生素药物的残留,对我国猪肉的食品安全构成重大威胁。因此,采用疫苗预防猪丹毒杆菌是目前最有效的方法。
目前市场上猪丹毒疫苗有灭活疫苗和弱毒活疫苗。猪丹毒灭活苗是强毒株c43-5的菌液用甲醛溶液处理灭活后,加入氢氧化铝胶浓缩制成的,所以也将其称为猪丹毒氢氧化铝甲醛菌苗。灭活疫苗对猪丹毒杆菌具有较好的免疫保护,但对于猪的应激比较大,且保护力持续的时间比较短,在制苗过程中灭活不当极易造成病原逃逸。猪丹毒弱毒活菌苗使用的菌株是猪丹毒gc42和g4t10弱毒株,在适宜的培养基中培养后,加入保护剂真空冷冻干燥制成。弱毒活疫苗可使猪得到保护,但不能清除定居在扁桃体或关节里的红斑丹毒丝菌,也不能清除隐性感染猪扁桃体内的细菌。不同培养基对疫苗质量有一定影响。此外,弱毒疫苗存在散毒和返强的风险,对易感猪群存在很大的威胁。因此,迫切需要新型的安全、高效的亚单位疫苗。
目前已知的保护性抗原非常有限,这严重影响了猪丹毒新型亚单位疫苗的创制。
技术实现要素:
本发明目的是提供了一种表达猪丹毒杆菌重组蛋白gapdh的基因gapdh及其重组大肠杆菌与应用。
为实现上述目的,本发明提供的一种表达猪丹毒杆菌重组蛋白gapdh的基因gapdh,即为3-磷酸甘油醛脱氢酶glyceraldehyde-3-phosphatedehydrogenase(gapdh)基因,其核苷酸序列如seqidno.1所示。
3-磷酸甘油醛脱氢酶glyceraldehyde-3-phosphatedehydrogenase(gapdh)是细菌糖酵解过程中必不可少的一种酶。但是研究发现很多病原微生物都可以将该蛋白展示在细菌表面,进而发挥粘附素的作用。gapdh在许多病原微生物中不仅可以作为一种粘附因子,还是有效的保护性抗原。
上述猪丹毒杆菌重组蛋白gapdh,其氨基酸序列如seqidno.2所示。
本发明还提供了一种重组载体pet-28a-gapdh,含有上述基因gapdh的大肠杆菌表达载体。所述大肠杆菌表达载体为pet-28a。
本发明还提供了一种含有上述重组载体pet-28a-gapdh的重组大肠杆菌bl21(de3)-gapdh。
上述重组大肠杆菌bl21(de3)-gapdh的构建方法,包括以下步骤:
1)以基因gapdhseqidno.1为模板设计引物对,且引物对分别上加bamhi、ecori酶切位点和保护碱基,如下:
正向引物c1:
5’-cgcggatccatgacagttaaagtagcaat-3’,划线部分为bamhi酶切位点;
反向引物c2:
5’-ccggaattcttagaattttgaagcaacgtaat-3’,划线部分为ecori酶切位点;
2)以基因gapdhseqidno.1为模板进行pcr,得到pcr产物;
3)用bamhi、ecori将pcr产物进行酶切,纯化回收;同时,用bamhi、ecori将大肠杆菌表达载体pet-28a进行双酶切,酶切产物跑琼脂糖凝胶电泳检测并回收大片段。
4)将回收的大肠杆菌表达载体pet-28a大片段和回收的pcr产物用t4连接酶4℃连接过夜,连接产物转化大肠杆菌感受态细胞bl21(de3),将筛选得到的阳性克隆用bamhi、ecori进行酶切验证,获得得到重组大肠杆菌bl21(de3)-gapdh。
作为优选方案,所述步骤2)中,pcr反应体系:
pcr扩增条件如下:
1.95℃,2min;2.94℃,30sec;3.56℃,30sec,4.72℃,1min;5.72℃,5min;步骤2,3,4重复循环35次。
本发明还提供了一种利用上述重组大肠杆菌bl21(de3)-gapdh制备重组蛋白gapdh的方法,包括以下步骤:
1)将重组大肠杆菌bl21(de3)-gapdh在含卡那霉素抗性的lb平板上划线培养,然后挑取单菌落落于含卡那霉素抗性的lb液体培养基中,然后进行诱导培养,继续培养过夜,常温离收集菌体,
2)将收集菌体中加入ni-ntabindingbuffer,混匀后于冰浴中超声,取上清;
3)先用bindingbuffer平衡镍离子亲和层析柱,然后将收集的上清上样于镍柱,洗脱,收集得到重组蛋白gapdh。
本发明还提供了一种上述方法制备得到重组蛋白gapdh在制备抗gapdh的抗体中应用。
本发明的有益效果在于:
本发明提供了一种表达猪丹毒杆菌重组蛋白gapdh的基因gapdh及其重组大肠杆菌与应用,提供了一种重组蛋白gapdh的表达方法,使用重组蛋白gapdh对小鼠免疫接种后,测定抗gapdh抗体滴度,并进行攻毒处理,并证明了重组蛋白gapdh免疫小鼠产生抗gapdh抗体显著高于未免疫小鼠,免疫小鼠的攻毒后存活率显著高于未免疫小鼠。
附图说明
图1为猪丹毒杆菌gapdh与化脓链球菌gapdh的氨基酸序列对比图。
其中,相同或相似的氨基酸分别以星号或点来表示。
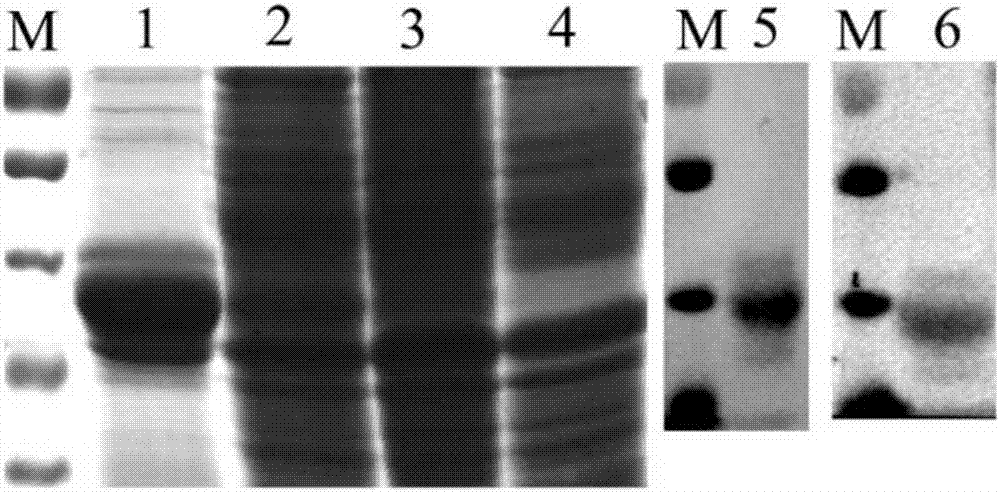
图2为猪丹毒重组蛋白gapdh的sds-page和免疫印迹分析结果图。
其中,泳道m、1、2、3、4、5、6分别为分子标记物、ni-nta纯化的重组蛋白gapdh、大肠杆菌诱导、大肠杆菌非诱导、空载体大肠杆菌、重组蛋白gapdh与his单抗的免疫印迹分析结果、重组蛋白gapdh与猪丹毒康复猪血清的免疫印迹分析结果,
图3为二次免疫10天后小鼠体内抗gapdh抗体水平。
图4为攻毒后小鼠的存活率。
其中,攻毒剂量为猪丹毒杆菌强毒株se38株100cfu/只,观察时间为攻毒后14天。
具体实施方式
为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。
实施例1:表达猪丹毒杆菌重组蛋白gapdh的重组大肠杆菌的构建
1材料与方法
1.1菌株与生长条件
菌株采用猪丹毒杆菌本地强毒流行株se38(以下简称se38株,见文献“湖北部分地区红斑丹毒丝菌分离株耐药性分析”);培养基为含10%胎牛血清(gibco公司)的tsb培养基中或者tsa培养基(bd公司);载体为大肠杆菌pet-28a,感受态细胞为大肠杆菌bl21(d3),均购自transgene公司。
1.2试剂
基因组提取试剂盒购自tiangen公司
下述引物对以基因gapdhseqidno.1为模板设计,并且引物对是由上海生工生物工程技术服务有限公司合成。
正向引物c1(seqidno.3)如序列表中seqidno.3所示:
5’-cgcggatccatgacagttaaagtagcaat-3’,划线部分为bamhi酶切位点;
反向引物c2(seqidno.4)如序列表中seqidno.3所示:
5’-ccggaattcttagaattttgaagcaacgtaat-3’,划线部分为ecori酶切位点;
诱导剂异丙基-β-d-硫代吡喃半乳糖苷(iptg)购自sigma公司
1.3pcr扩增猪丹毒杆菌gapdh基因
取猪丹毒杆菌野生强毒株se38株的tsb培养液5ml按照tiangen细菌基因组dna提取操作步骤进行提取。结合使用上述引物进行pcr扩增,具体如下:
1)以基因gapdh如序列表中seqidno.1所示的序列为模板进行pcr,得到pcr产物;
pcr反应体系
pcr扩增条件如下:
1.95℃,2min;2.94℃,30sec;3.56℃,30sec,4.72℃,1min;5.72℃,5min。步骤2,3,4重复循环35次。
2)用bamhi、ecori将pcr产物进行酶切,纯化回收;同时,用bamhi、ecori将大肠杆菌表达载体pet-28a进行双酶切,酶切产物跑琼脂糖凝胶电泳检测并回收大片段。
3)将回收的大肠杆菌表达载体pet-28a大片段和回收的pcr产物用t4连接酶4℃连接过夜,连接产物转化大肠杆菌感受态细胞bl21(de3),将筛选得到的阳性克隆用bamhi、ecori进行酶切验证,获得得到重组大肠杆菌bl21(de3)-gapdh。
实施例2重组蛋白的制备
利用上述重组大肠杆菌bl21(de3)-gapdh制备重组蛋白:具体方法:
1)重组大肠杆菌bl21(de3)-gapdh在含卡那霉素抗性的lb平板上划线,37℃培养12-14h,挑取单菌落于5ml含卡那霉素抗性的lb液体培养基中,37℃,220r/min振荡培养12-14h,将菌液以1:200的比例接种到1l含卡那霉素抗性的lb液体培养基中,37℃培养直到od600达到0.8,加入终浓度200mmol/liptg选行诱导,继续培养过夜,5000r/min常温离心15min收收集菌体;同时做非诱导对照试验。
2)每1l菌体加入40mlni-ntabindingbuffer,混匀后于冰浴中超声,每个超声循环工作1sec,停止3sec,总工作时间为4min,超声总能量约4000j,超声后继续置冰上裂解30min,12000r/min,4℃离心20min,取上清。
3)结合半小时左右,收集留出液flowthrough,用washbuffer洗3个柱体积,收集washthrough,最后用elutebuffer洗脱蛋白,收集重组蛋白gapdh,测序,其序列如序列表中seqidno.2所示:
实施例3sds-page与免疫印迹分析
1.sds-page与免疫印迹分析
纯化后的重组蛋白gapdh与未纯化的粗蛋白经sds处理后在12%的page胶上进行电泳,电泳结束后通过半干法将重组蛋白gapdh转入硝酸纤维素膜上,进而使用his单抗或者猪丹毒的康复猪血清作为一抗,羊抗鼠或者羊抗猪igg(h+l)-hrp作为二抗进行免疫印迹分析。
2.结果判定
2.1进行pcr扩增得到1023bp的碱基序列,其中包含猪丹毒杆菌gapdh全长orf(seqidno.1),将推导的猪丹毒杆菌gapdh氨基酸序列(seqidno.1)与化脓链球菌的gapdh氨基酸序列(genbank序列号aak33348)进行比对发现二者存在很高的相似性(见图1,相似性:79.8%;一致性66.6%)。
2.2重组蛋白gapdh诱导表达情况见图2。比较诱导和非诱导培养的细菌粗蛋白,证明蛋白表达成功,诱导蛋白的条带与预测的大小相一致(39kd)。通过ni-nta亲和层析的方式获得纯化重组蛋白,该蛋白与his单抗具有良好的免疫反应证明其具备his标签。该蛋白与感染猪丹毒杆菌的康复猪血清表现良好的免疫反应,证明猪丹毒杆菌重组蛋白gapdh具有良好的免疫原性。(见图2)。
实施例4小鼠免疫接种与攻毒试验
1.实验过程
1.1实验动物
20只4周龄c57/b6雌鼠,随机分成2组,每组10只。
1.2.实验处理
实验组:50μg纯化的重组蛋白gapdh用弗氏完全佐剂乳化后,腹腔注射免疫第1组小鼠,14天后,以50μg纯化的重组蛋白gapdh用弗氏不完全佐剂乳化后,以同样的方式第二次注射免疫小鼠;阴性对照组:向第2组小鼠注射佐剂乳化的pbs,使用的佐剂与阳性对照组的佐剂相同;
1.3测定抗gapdh抗体滴度
所有小鼠第二次免疫10天后尾静脉取血获得血清,测定抗体,
1.4攻毒与观察
使用猪丹毒杆菌强毒株se38株(100cfu/只)皮下注射攻毒,攻毒后连续观察14天,记录小鼠的发病和死亡情况,待观察结束后将存活的小鼠安乐处死并尝试从其体内分离猪丹毒杆菌。
2实验结果
2.1二次免疫10天后抗gapdh抗体产生情况见图3。实验组产生抗gapdh抗体,且显著高于对照组。
2.2攻毒后的小鼠存活率见图4。攻毒后第3天阴性对照组有2只小鼠死亡,第4天后阴性对照组有5只小鼠死亡,第5天阴性对照组剩余3只小鼠也死亡。实验组在观察的14天里,无死亡,无发病;在攻毒实验完成14天后,存活的小鼠体内没有分离出猪丹毒杆菌。
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 还没有人留言评论。精彩留言会获得点赞!