一种应答3-脱氢莽草酸的生物传感器及其应用的制作方法
本发明涉及生物传感器及生物技术领域,尤其涉及新型3-脱氢莽草酸应答功能生物传感器、包含该生物传感器的转录表达系统以及包含该生物传感器的高通量筛选系统。
背景技术:
3-脱氢莽草酸(3-dehydroshikimate,dhs)是植物和微生物生存所必需的中间代谢产物,经进一步加工可形成高附加值产品,是一种重要的药物及精细化学品原料。传统采用化学方法进行合成,由于其合成原料用到苯或甲苯,往往对人体和环境造成危害。近年来,利用基因工程或代谢工程等手段生产3-脱氢莽草酸获得成功,但快速获得高效稳产的菌株成为利用生物手段规模化生产3-脱氢莽草酸的最大瓶颈,其原因在于:3-脱氢莽草酸化合物本身无色,且缺少有效的显色反应,目前,筛选3-脱氢莽草酸高效稳产细胞主要基于hplc或质谱,检测速度慢,检测量每天仅数千个候选菌。因此,寻找高通量细胞筛选方法成为利用高效菌株规模划化生产3-脱氢莽草酸的重要途径。
近年来,采用能够应答小分子代谢物的生物传感器,并结合报告基因构建生物传感器,实现小分子代谢物含量及其表达细胞的快速检测已经获得巨大成功。已有通过代谢物小分子应答基因构建生物传感器用于相应工程菌株筛选以及通过代谢物小分子应答基因可控表达目的基因的案例,包括相应生物传感器应用于缬氨酸、亮氨酸、苯甲酸酯等多种小分子菌株突变库筛选工作,但是,目前还没有正相关应答3-脱氢莽草酸基因的报道。
munson和gudipart等分别研究证实:调控基因cusr为胞质内铜离子感应调控因子,其与编码膜结合感应组氨酸激酶的基因cuss共同组成cussr双元件系统,该cussr双元件系统将调控激活位于该双元件系统相反方向操纵子cuscfba的表达,该操纵子的基因cusb和cusa预测编码跨膜蛋白,cusa编码的膜蛋白形成双通道泵的结构用以排除胞内过多的铜离子,而基因cusc预测为膜外蛋白,起到感应铜离子浓度作用。综上,操纵子cuscfba的作用在于排除胞内铜离子,使细胞免受过高铜离子带来的危害。但已公开的信息中从未报道cusr与3-脱氢莽草酸的一定正相关应答特性。
技术实现要素:
本发明的目的在于提供一种应答3-脱氢莽草酸的生物传感器,并利用该生物传感器构建应答3-脱氢莽草酸浓度生物传感器,进而构建一种高产3-脱氢莽草酸细胞的筛选方法。
一种应答3-脱氢莽草酸的生物传感器,所述生物传感器包括调控基因cusr和/或调控基因cusr的启动子组成的传感器核心元件。
本发明中调控基因cusr的核苷酸序列为下述的任意一种:
1)seqidno:1所示的多核苷酸;
2)seqidno:1所示序列的同源性≥80%,(较佳的≥95%),且其表达强
度表现出与3-脱氢莽草酸浓度应答正相关性。
3)与1)-2)任一所述的多核苷酸互补的多核苷酸。
本发明中调控基因cusr的启动子的核苷酸序列为下述的任意一种:
1)seqidno:2所示的多核苷酸;
2)seqidno:2所示序列的同源性≥80%,(较佳的≥95%),且其能控制
cusr基因转录。
3)与1)-2)任一所述的多核苷酸互补的多核苷酸。
本发明中所述的生物传感器用于构建应答3-脱氢莽草酸的生物传感器;
具体的,应答3-脱氢莽草酸的生物传感器由生物传感器核心元件、连接序列和报告基因组成;
更进一步的,应答3-脱氢莽草酸的生物传感器核酸结构式优选为:r-l-rp,其中r为生物传感器核心元件,l为连接序列,rp为报告基因。
本发明中所述的连接序列l的大小为0-200nt,所述的连接序列l的核苷酸序列优选为:5’-ggtggtggtggttctggtggtggtggatccggtggcggtggttct-3’。
需要说明的是:上述连接序列l的核苷酸序列可以根据实际情况,在不影响核酸转录的情况下任意设计,上述核苷酸序列优选仅是本实验室经过长期反复试验得出的效率较高的一种,对于连接序列l的大小为0-200nt的限制,也是根据反复试验得到的一个优选的范围,本领域的技术人员根据上述核酸结构式,简单的改变连接序列的大小或核苷酸序列应当理解为与本技术方案等同。
本发明中所述的报告基因为荧光蛋白基因,优选黄色、绿色或红色荧光蛋白基因中的一种。
本发明中所述的一种应答3-脱氢莽草酸浓度生物传感器,其核酸序列为下述的任意一种:
1)seqidno:3所示的多核苷酸;
2)seqidno:3所示序列的同源性≥80%,(较佳的≥95%),且其表达强度表现出与3-脱氢莽草酸浓度应答正相关性;
3)与1)-2)任一所述的多核苷酸互补的多核苷酸。
本发明中一种产3-脱氢莽草酸菌株突变库筛选方法,所述方法包括以下步骤:
1)提供一宿主细胞,所述宿主细胞含有应答3-脱氢莽草酸的生物传感器,即该生物传感器由调控元件r、连接序列l和报告基因rp组成;其优选的核酸结构式为:r-l-rp。
2)将步骤1)中所得宿主细胞进行处理建立突变库。
3)通过筛选平台对宿主细胞突变库进行筛选,以获得3-脱氢莽草酸生产菌株,尤其是-3-脱氢莽草酸高产菌株。
更进一步的,本发明中所述的宿主为原核细胞,可以是大肠杆菌、克雷伯氏菌、沙门氏菌、链球菌、肠球菌、变形杆菌、假单胞菌、弧菌等中的任意一种;
更为优选的,本发明中的宿主细胞优选为大肠杆菌细胞。
需要说明的是,本实验室已经初步验证酵母菌、植物细胞、哺乳动物细胞也可以作为宿主并获得成功,仅由于研究进度及研究目的得限制,未能进行深入探索,如果本领域技术人员在不脱离本发明构思的情况下,仅利用常规生物技术手段,变更宿主及相应宿主对应的载体,应属于本发明的保护范围。
更进一步的,本发明中所述的宿主细胞中转化或转染有包含本发明中所述的生物传感器和报告基因的重组载体或其染色体上整合包含报告基因以及与该报告基因可操作连接的传感器核心元件。
更进一步的,上述重组载体中,还包含有相关基因的启动子和终止子。
本发明中,用于重组载体的方法是本领域普通技术人员所熟知的。表达载体可以是细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,只要其能够在宿主体内复制和稳定,任何质粒和载体都可以被采用。
本领域的普通技术人员,可以采用熟知的方法构建含有本发明中生物传感器用于产3-脱氢莽草酸菌株突变库筛选体系的核酸结构式。
本发明利用转录组测序分析结合实时pcr验证方法从大肠杆菌e.coliatcc8739(e.coliatcc8739获自美国模式培养物集存库americantypeculturecollection,atcc8739)中挖掘出代谢物小分子化合物3-脱氢莽草酸应答功能基因cusr,该功能基因编码序列如序列表seqidno:1;同时挖掘出基因cusr的启动子,该启动子的基因编码序列如序列表seqidno:2。
上述基因cusr可应用于构建3-脱氢莽草酸生物传感器,建立相应3-脱氢莽草酸高产菌株流式细胞筛选等高通量筛选方法,进而应用于3-脱氢莽草酸高产菌株筛选工作中。
具体操作如下:
1)3-脱氢莽草酸生物传感器构建
设计编码序列为5’-ggtggtggtggttctggtggtggtggatccggtggcggtggttct-3’的dna片段作为连接序列l,将rp报告基因的去起始密码子的编码序列与功能应答基因cusr去终止密码子的编码序列相连接组成3-脱氢莽草酸应答功能融合基因片段,同时在功能融合元件基因片段上下游分别引入酶切位点ecori和hindiii,然后将构建好的3-脱氢莽草酸应答功能融合基因片段共质粒pet30a进行双酶切连接,将功能片段插入pet30a载体的多克隆位点,构建获得3-脱氢莽草酸生物传感器的重组质粒pet30ar。
2)生物传感器应答3-脱氢莽草酸的功能验证
正相关性验证采用外源添加和内源生产3-脱氢莽草酸两种方式诱导传感器应答。
外源添加方式:以构建的传感器功能菌株,即e.coliatcc8739含生物传感器的重组质粒pet30ar,命名为e.coliatcc8739-sensor为实验菌株,菌株摇瓶培养至对数期,通过梯度外加3-脱氢莽草酸对菌株e.coliatcc8739-sensor进行诱导表达,定点取样并经磷酸缓冲液处理后,利用酶标仪检测分析e.coliatcc8739-sensor细胞中生物传感器报告基因的表达量,以显示生物传感器对3-脱氢莽草酸应答关系。
内源生产方式:以自产3-脱氢莽草酸生物传感器功能菌株,即e.coliwj060(大肠埃希氏菌(escherichiacoil),于2015年6月10日由中国科学院天津工业生物技术研究所保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号:cgmccno.10976)含生物传感器的重组质粒pet30ar,命名为e.coliwj060-sensor为实验菌株,对菌株进行摇瓶发酵培养,选择合适时间点定点取样并经磷酸缓冲液处理后,利用酶标仪检测分析e.coliwj060-sensor细胞中生物传感器报告基因的表达量,以及利用液相分析培养液中3-脱氢莽草酸的浓度,观察分析生物传感器与细胞生产3-脱氢莽草酸应答反应。
3)基于3-脱氢莽草酸生物传感器的高通量筛选方法开发
在上述验证生物传感器pet30ar应答3-脱氢莽草酸灵敏感应区间的基础上,本实验利用artp(常压室温等离子体atmosphericandroomtemperatureplasma)诱变技术对含生物传感器的功能菌株e.coliwj060-sensor进行诱变建库,然后对突变库进行摇瓶发酵培养,选择合适时间点定点取样经磷酸缓冲液处理后,利用流式细胞仪对e.coliwj060-sensor突变库菌株发酵过程中荧光表达强度变化进行监测,分析验证生物传感器pet30ar在e.coliwj060-sensor突变库菌株内应答3-脱氢莽草酸敏感区间,以此为依据,选择流式分选最佳时间区间,建立3-脱氢莽草酸生物传感器高通量筛选方法。
4)基于3-脱氢莽草酸生物传感器高通量筛选方法应用
以产3-脱氢莽草酸菌株e.coliwj060-sensor为出发菌株,利用artp技术对出发菌株进行诱变建立突变库,依据上述建立的3-脱氢莽草酸生物传感器高通量筛选方法对突变库进行流式分选,初步筛选获得荧光信号强度高的菌株分选库后,对分选突变体库进行二轮流式分选富集,经过两轮流式分选富集获得的分选突变体库进行平板培养,从平板长出的菌落中任意挑取10个单菌落进行摇瓶发酵评价,根据液相分析结果精确评价3-脱氢莽草酸生产菌的筛选效果,获得3-脱氢莽草酸高产菌株。
本发明提供了一种3-脱氢莽草酸浓度应答功能基因cusr,并应用该功能基因cusr与绿色荧光蛋白gfp报告基因以融合共表达方式构建了生物传感器pet30ar,该生物传感器表现出对代谢物小分子3-脱氢莽草酸浓度应答正相关性、特异性及灵敏性特点,进一步应用生物传感器pet30ar进行产3-脱氢莽草酸菌株突变库流式细胞高通量筛选,获得3-脱氢莽草酸产量提高的突变菌株,实例验证生物传感器pet30ar可实现对3-脱氢莽草酸合成菌株突变库有效筛选,奠定了3-脱氢莽草酸高产菌株选育的改造基础。
本发明的优点在于:
1)首次揭示了调控基因cusr和/或调控基因cusr的启动子能应答3-脱氢莽草酸,并表现为与3-脱氢莽草酸浓度正相关,克服了调控基因cusr仅为胞质内铜离子感应调控因子的技术偏见。
2)调控基因cusr和/或调控基因cusr的启动子组成的生物传感器,用于产3-脱氢莽草酸菌株突变库筛选的核酸结构式中引入报告基因,解决了因3-脱氢莽草酸化合物本身无色,且缺少有效的显色反应,仅能通过低通了的高效液相分析或质谱分析筛选3-脱氢莽草酸高产菌株的技术难题。
附图说明
图1、基于生物传感器的3-脱氢莽草酸高产菌株筛选原理;
图2、调控基因cusr应答内源生产3-脱氢莽草酸实时pcr验证;
图3、调控基因cusr应答外源添加3-脱氢莽草酸实时pcr验证;
图4、调控基因cusr、报告基因gfp、生物传感器功能片段cusr-l-gfp的pcr验证;
图5、生物传感器重组质粒pet30ar图谱;
图6、生物传感器应答外源添加3-脱氢莽草酸正相关性验证;
图7、生物传感器应答内源生产3-脱氢莽草酸正相关性验证;
图8、生物传感器在菌株e.coliwj060突变体库发酵24h过程中应答灵敏区间监测;
图9、筛选获得的高产菌株3-脱氢莽草酸生产能力分析。
具体实施方式
实施例1:转录组分析挖掘3-脱氢莽草酸应答功能调控基因
以产3-脱氢莽草酸菌株e.coliwj060为实验菌株,以不产3-脱氢莽草酸菌株e.coliatcc8739为对照菌株,分别挑取单菌落接种lb培养基,37℃摇瓶发酵24h,菌株e.coliwj060选取发酵培养12h和20h两个取样点的发酵培养液(wj060-12h和wj060-20h),菌株e.coliatcc8739选取发酵培养12h取样点的发酵培养液(8739-12h)。发酵培养液在4℃、3200rpm条件下离心5min,菌体细胞快速用液氮冷冻保存,送样进行转录组测序分析。
为挖掘3-脱氢莽草酸应答功能基因,利用生物信息学软件bowtie2分别将3个转录组测序数据与e.coliatcc8739基因组基因比对,共有4199个基因通过匹配,通过分析软件rsem(rna-seqbyexpectation-maximizationv1.2.4)对基因组比对匹配的基因fpkm((fragmentperkbpermillionfragments)值进行了统计,设置参数8739-12h_fpkm<wj060-12h_fpkm<wj060-20h_fpkm进行筛选及分类,初步筛选出526个基因满足筛选条件。
在自然界中,细胞进化出多种代谢物感应蛋白(包括转录因子、酶、周质结合蛋白)及rna(包括核糖开关和核酶)能够感应胞内环境(包括酶和小分子化合物等)并作出应答,其中转录调控基因则为其重要的一类。在转录分析初筛结果中包含19个转录调控基因,根据3-脱氢莽草酸浓度应答灵敏且相关性好的调控基因应该满足wj060-20h_fpkm/wj060-12h_fpkm比值差异较大同时8739-12h_fpkm值较小的条件,本实验进一步筛选出10个转录调控基因作为3-脱氢莽草酸正应答候选基因,10个转录调控基因fpkm值信息见表1。
表1转录调控基因fpkm值
其中wj060-20h_fpkm/wj060-12h_fpkm比值差异较大(比例>1.5)调控基因为:ypdb、yegw、yidz、citb、narp、rcnr、cusr;而8739-12h_fpkm值较小(<50)的调控基因为:ypdb、yegw、cusr、citb、bdcr,综合两者分析,初筛的10个调控基因中,ypdb、yegw、cusr和citb作为3-脱氢莽草酸应答正相关基因的可能性比较大。
实施例2:转录调控基因响应3-脱氢莽草酸的实时pcr验证
1)转录调控基因应答内源生产3-脱氢莽草酸实时pcr验证
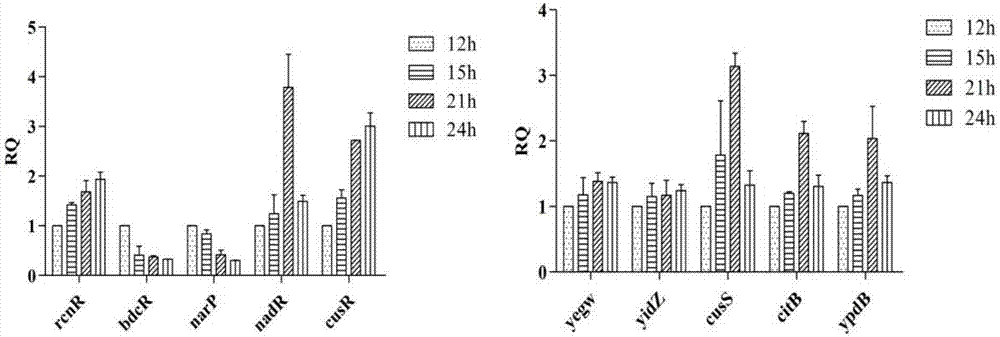
以产3-脱氢莽草酸菌株e.coliwj060为实验菌株,挑取单菌落于lb培养基,37℃过夜培养。然后以2%过夜培养液2%接菌量转接nbs培养基,37℃摇瓶发酵培养,分别在12h、15h、21h、24h四个时间点定点取样,按照实时pcr操作流程对10个调控基因进行实时pcr验证,分析10个转录调控基因随发酵过程中胞内3-脱氢莽草酸产物浓度不断积累作出的应答反应。
结果如图2,在四个发酵时间点,转录调控基因cusr和rcnr表现出良好的转录表达递增趋势。相比于12h的转录表达水平,转录调控基因cusr在24h时最大提高3倍左右,调控基因rcnr最大提高2倍左右,除基因narp和bdcr外,其他基因转录表达则在前21h前随发酵时间增加而提高,而在24h时间点出现减弱现象,分析可能原因为细胞进入平台衰老期,代谢机能减弱,代谢调控水平降低。
同时对比实时pcr结果与转录组测序结果,在12h至21h之间,实时pcr递增幅度较大的调控基因为nadr、cuss、cusr、ypdb、citb、rcnr、yegw,提高幅度在1.5-4之间;转录组分析提高幅度较大的基因为ypdb、yegw、yidz、citb、narp、rcnr、cusr,提升幅度在1.5-2.5之间。包括ypdb、yegw、citb、rcnr、cusr在内的5个转录调控基因在两种分析结果中一致,该结果说明两种分析方法结果基本得到互为验证。
而针对转录调控基因narp和bdcr出现递减趋势现象,原因机理还未知;此差异现象也说明由于胞内物质和调控网络的复杂性,单从转录调控基因应答内源生产的3-脱氢莽草酸并不能完全确定3-脱氢莽草酸应答功能基因,转录调控基因应答外源添加3-脱氢莽草酸验证有必要进行,有利于进一步确认和鉴定3-脱氢莽草酸生物传感器应答功能的生物传感器。
2)转录调控基因应答外源添加3-脱氢莽草酸实时pcr验证
以不产3-脱氢莽草酸菌株e.coliatcc8739为实验菌株,挑取单菌落于lb培养基,37℃过夜培养。然后以2%过夜培养液转接nbs培养基,37℃摇瓶培养至对数期,梯度外加3-脱氢莽草酸进行应答验证,对应的3-脱氢莽草酸浓度梯度为是0g/l、0.5g/l、1g/l、2g/l、4g/l和6g/l;应答处理培养3h,按照实时pcr操作流程对10个调控基因进行实时pcr验证,分析10个转录调控基因在外源3-脱氢莽草酸梯度处理3h条件下应答反应。实时pcr分析结果如图3,随着外源3-脱氢莽草酸浓度的增加,转录调控基因cusr和bdcr表现出良好的转录表达递增趋势,其中,相比于低浓度处理,转录调控基因cusr上调最大值为4倍左右,而bdcr基因最大上调值为5左右;其他基因则未表现出明显正相关性,综合转录调控基因应答外源添加3-脱氢莽草酸和内源生产的3-脱氢莽草酸实时pcr结果,转录调控基因cusr在两种诱导条件下表现出良好的一致性以及良好的3-脱氢莽草酸正应答相关性,并且最大倍增倍数保持在3-4之间,这些特性满足生物传感器感应应答元件的基本要求,即能够积极正向地感应目标产物3-脱氢莽草酸同时作出正向积极的应答反应。
综合以上转录组分析与实时pcr验证结果,本实验确定转录调控基因cusr成为下步构建3-脱氢莽草酸应答生物传感器的首选生物传感器。
实施例3:构建3-脱氢莽草酸生物传感器
为构建3-脱氢莽草酸感应生物传感器,首先需要获得3-脱氢莽草酸应答功能融合元件dna片段,该功能元件dna片段包含调控基因cusr、荧光报告基因gfp以及连接序列l(linker)三部分。其中,连接功能应答调控基因cusr和gfp报告基因的中间连接序列l设计为一个15个氨基酸短肽,将gfp基因的去起始密码子的编码序列与正相关基因cusr去终止密码子的编码序列相连接,其l的编码序列是5’-ggtggtggtggttctggtggtggtggatccggtggcggtggttct-3。
为获得调控基因cusr基因片段,本实验以菌株e.coliatcc8739基因组为模板,利用上游引物序列为:5’-ccggaattcggctgagtgagaactgctgcgg-3’和下游引物5’-gccaccggatccaccaccaccagaaccaccaccaccctgaccatccggcacctcaa-3’进行pcr扩增获得上游带有ecori酶切位点、下游带有部分linker连接序列和cusr基因的目的条带(图4a),对该基因片段进行测序分析验证,结果显示条带序列正确。
为获得报告基因gfp功能片段,以实验室保存的含有gfp基因的重组质粒pet30a-gfp为模板,利用上游引物5’-gtggtggtggatccggtggcggtggttctgtgagcaagggcgaggagct-3’和下游引物5’-cccaagcttttacttgtacagctcgtccatgcc-3’进行pcr扩增获得上游带有部分连接序列linker、下游带有hindiii酶切位点和gfp基因的目的条带(图4b),对该基因片段进行测序分析验证,验证结果显示条带基因序列正确无误。
然后基于调控基因cusr片段与报告基因gfp片段的linker的重叠区,将两者进行overlappcr反应,最终获得上游带有ecori酶切位点、下游带有hindiii酶切位点的生物传感器功能条带cusr-l-gfp。该功能条带通过含有15个氨基酸的g4slinker将调控基因cusr与报告因子基因gfp偶联,两者共用cusr调控基因启动子(图4c)。
将构建好的3-脱氢莽草酸应答功能融合基因片段与质粒pet30a进行双酶切连接,上下游双酶切位点分别为ecori和hindiii,将功能片段插入pet30a载体的多克隆位点,构建获得生物传感器重组质粒pet30ar(图5),该生物传感器重组质粒抗性标记基因为kan,报告基因gfp的编码序列与调控基因cusr的编码序列通过linker连接并共同被调控基因cusr的启动子控制进行融合共表达。
实施例4:生物传感器应答3-脱氢莽草酸正相关性验证
1)生物传感器应答外源添加的3-脱氢莽草酸正相关性验证
以不产3-脱氢莽草酸菌株、含有生物传感器重组质粒pet30ar的e.coliatcc8739-sensor为实验菌株,挑取单菌落于lb培养基,37℃过夜培养。以2%的过夜培养液转接至nbs培养基,37℃摇瓶培养至对数期,分别添加0.5g/l、1g/l、2g/l、4g/l和6g/l不同浓度3-脱氢莽草酸,培养处理3h,每个浓度取样1ml。培养液样品在12000g条件下离心1min,用相同体积磷酸缓冲液洗涤两次后,然后用磷酸缓冲液重悬菌体并稀释到适宜浓度,取200μl转移至96孔板,利用酶标仪进行荧光检测。荧光检测的激发波长/发射波长分别为480nm/520nm;同时进行测定细胞浓度(od600),以计算单位细胞的荧光强度,从而分析生物传感器对3-脱氢莽草酸应答反应(图6)。
结果表明在胞外3-脱氢莽草酸浓度为6g/l范围内,随着外源添加的3-脱氢莽草酸的增加,菌株单位细胞荧光强度呈现持续上升趋势,表明胞内生物传感器携带的调控基因cusr感应3-脱氢莽草酸浓度变化并作出正相关性应答,并通过生物传感器以绿色荧光信号的方式显现出来。相比最低浓度,最高浓度诱导条件下,单位细胞荧光强度提高约2.5-3倍,表明该生物传感器在外源添加3-脱氢莽草酸诱导条件下能够作出良好正相关性应答。
2)生物传感器应答内源生产的3-脱氢莽草酸正相关性验证
以可以生产3-脱氢莽草酸、含有生物传感器重组质粒pet30ar的e.coliwj060-sensor为实验菌株,挑取单菌落于lb培养基,37℃过夜培养。以2%的过夜培养液转接至nbs培养基,发酵培养并定点取样,取样时间分别为1h、6h、9h、12h、20h、24h和32h,美国取样时间各取样1ml,发酵液样品12000g条件下离心1min,用相同体积磷酸缓冲液洗涤两次后,然后用磷酸缓冲液重悬菌体并稀释到适宜浓度,取200μl转移至96孔板,利用酶标仪进行荧光检测。荧光检测的激发波长/发射波长分别为480nm/520nm;同时进行测定细胞浓度(od600),以计算单位细胞的荧光强度。同时取样1ml在12000g条件下离心10min,取上清液进行高效液相分析3-脱氢莽草酸含量,从而分析产物传感器对内源生产的3-脱氢莽草酸应答反应(图7)。
结果显示在24h发酵过程中,随着发酵时间的增加,3-脱氢莽草酸合成量不断增加,在24h时3-脱氢莽草酸产量最高为1.8g/l,同时生物传感器荧光表达水平呈现递增增强趋势,其中荧光强度最大提高约2.5倍。
liuy等根据相关研究证明随着发酵时间的增长,菌株生产的小分子不断积累,其中大部分将通过运输系统排到胞外,胞内小分子也存在一定的积累过程,并且在一定范围内与胞外浓度成正比。因此,在一定浓度范围内,胞内生产3-脱氢莽草酸诱导胞内传感器荧光表达可代表菌株3-脱氢莽草酸合成能力。生物传感器荧光表达水平随菌株e.coliwj060-sensor内3-脱氢莽草酸合成量增加而递增的现象说明3-脱氢莽草酸生物传感器能够感应胞内内源3-脱氢莽草酸浓度增加变化,并表现出良好的正相关性。另外,结合实施例2中外源添加到3-脱氢莽草酸诱导生物传感器实验结果,证明该生物传感器对于内源生产及外源添加3-脱氢莽草酸均表现出较好的应答正相关性,说明该生物传感器可应用于3-脱氢莽草酸高产菌株筛选的有效工具。
实施例5:基于3-脱氢莽草酸生物传感器高通量筛选方法的建立
本实验利用artp诱变技术对含有生物传感器重组质粒pet30ar的e.coliwj060-sensor菌株进行诱变建库,取artp诱变库100μl至1mllb培养基中进行复苏富集培养,37℃培养3h。然后以起始接菌量0.1od600转接至nbs培养基,37℃发酵培养,定点取样,取样时间分别是3h、6h、9h、12h、18h和24h,各取样1ml,样品12000g条件下离心1min,用相同体积磷酸缓冲液洗涤两次后,磷酸缓冲液重悬菌体并稀释到适宜浓度,取500μl处理过的样品进行流式细胞检测。流式细胞检测的激发波长/发射波长分别为488nm/520nm。通过流式细胞仪对菌株e.coliwj060-sensor的artp诱变库发酵24h过程中荧光表达强度变化进行监测(图8),结果显示生物传感器在突变库培养9-12h时荧光表达差异较大,分析为生物传感器在菌株e.coliwj060-sensor突变库培养应答灵敏区间。因此,确定发酵时间10h作为流式细胞筛选最佳时间点,从而建立了基于3-脱氢莽草酸生物传感器的流式细胞高通量筛选方法。
实施例6:3-脱氢莽草酸生物传感器高通量筛选方法应用
以产3-脱氢莽草酸菌株e.coliwj060-sensor为出发菌株,利用artp技术对出发菌株进行诱变建立突变库,依据3-脱氢莽草酸生物传感器高通量筛选方法对突变库进行培养及流式细胞分选。取菌株e.coliwj060-sensor的artp诱变库100μl至1mllb培养基中进行复苏富集培养,37℃培养3h,然后以起始接菌量0.1od600转接至nbs培养基,37℃发酵培养10h,取样2ml,样品在12000g条件下离心1min,用相同体积磷酸缓冲液洗涤两次后,然后用磷酸缓冲液重悬菌体并稀释到适宜浓度,进行流式细胞分选。
设置分选阈值,筛选高荧光信号强度突变菌株1000株菌,分选获得的菌株进行lb平板涂布培养,37℃培养14h,然后对分选库进行复苏培养,将平板中菌落冲洗至lb液体培养基,在37℃条件下培养1h。然后以上述相同操作对分选库发酵培养、流式细胞分选以及平板培养,然后从平板长出的菌落中任意挑取10个单菌落进行摇瓶发酵评价。
3-脱氢莽草酸发酵生产评价的具体方法为:挑取筛选平板中单菌落接种lb培养基,37℃过夜培养。然后以起始接菌量0.1od600进行转接nbs培养基,37℃发酵培养。分别在24h和32h取样1ml,通过高效液相分析分选获得的菌株的3-脱氢莽草酸合成能力。
结果显示相对于出发菌株e.coliwj060-sensor,有两株突变菌株3-脱氢莽草酸产量得到提高,其中突变菌株m9的3-脱氢莽草酸产量提高幅度较大,其摇瓶发酵32h的产量为2.64g/l,相对于出发菌株的产量提高了20%。
另外,以菌株m9为出发菌,进行新一轮的artp诱变库和筛选,获得3-脱氢莽草酸产量进一步提高的菌株。在筛选出的高产菌株中,3-脱氢莽草酸产量最高的三株突变菌分别为m3-7、m3-8和m7-7(图9),它们的3-脱氢莽草酸的产量分别为2.85g/l、2.86g/l和2.80g/l,相对于原始出发菌株e.coliwj060-sensor的产量,分别提高了29.5%、30%和27.3%。
本发明所述的实施例是说明性的,而非限定性的,上述实施例只是帮助理解本发明,因此本发明并不限于具体实施方式中所述的实施例。本领域的技术人员在本技术方案的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可以做出很多有益的保护功能和功能强化,这些均属于本发明的保护之内。
sequencelisting
中国科学院天津工业生物技术研究所
一种应答3-脱氢莽草酸的生物传感器及其应用
3
patentlnversion3.5
1
684
dna
cusr
1
atgaaactgttgattgtcgaagatgaaaagaaaaccggagaatacttgaccaaagggtta60
accgaagccggttttgtggtcgatttggccgacaacgggctgaatggctaccatctggcg120
atgaccggtgattatgatctgataatcctcgatattatgctgccggacgtgaacggctgg180
gatatcgtgcgcatgttacgctccgccaataaagggatgccgattctgttgcttaccgcg240
cttggcaccattgaacatcgcgtcaaggggctggagttgggggcagatgactacctggtg300
aagccattcgcttttgctgaactgctggcgcgggtgcgcacattactgcggcgcggggcg360
gcggtgattatcgaaagtcagtttcaggttgccgatttgatggtcgatctcgtcagccgc420
aaagtcacccgcagcggcacgcgcatcactttgaccagtaaagagtttactctgctggag480
ttcttccttcgccatcagggcgaagtgctgccccgctcgcttatcgcctcgcaggtatgg540
gacatgaattttgacagcgataccaatgctattgatgtggcggtgaagcggctgcgcggc600
aaaatcgacaacgactttgagccgaagctaattcagaccgtgcgcggcgtgggttacatg660
cttgaggtgccggatggtcagtaa684
2
271
dna
cusr启动子
2
ggctgagtgagaactgctgcggcacgggcattgccggacgctgataatccggtgccagtg60
aacaaccggttagcgcaagggccacacaaaatggcagaagtttacaaggagacataggct120
cataatttctggtgattttataccgccaactttactcgccaggctctgattttccggtga180
caggaaaatgacaaaattgtcattttgccaataagcgattgccatctgatcccgctactc240
tagaattgcccgggcaacatgcggaggaaat271
3
1723
dna
人工序列
生物传感器功能片段核酸序列cusr-l-gfp
3
ggctgagtgagaactgctgcggcacgggcattgccggacgctgataatccggtgccagtg60
aacaaccggttagcgcaagggccacacaaaatggcagaagtttacaaggagacataggct120
cataatttctggtgattttataccgccaactttactcgccaggctctgattttccggtga180
caggaaaatgacaaaattgtcattttgccaataagcgattgccatctgatcccgctactc240
tagaattgcccgggcaacatgcggaggaaatatgaaactgttgattgtcgaagatgaaaa300
gaaaaccggagaatacttgaccaaagggttaaccgaagccggttttgtggtcgatttggc360
cgacaacgggctgaatggctaccatctggcgatgaccggtgattatgatctgataatcct420
cgatattatgctgccggacgtgaacggctgggatatcgtgcgcatgttacgctccgccaa480
taaagggatgccgattctgttgcttaccgcgcttggcaccattgaacatcgcgtcaaggg540
gctggagttgggggcagatgactacctggtgaagccattcgcttttgctgaactgctggc600
gcgggtgcgcacattactgcggcgcggggcggcggtgattatcgaaagtcagtttcaggt660
tgccgatttgatggtcgatctcgtcagccgcaaagtcacccgcagcggcacgcgcatcac720
tttgaccagtaaagagtttactctgctggagttcttccttcgccatcagggcgaagtgct780
gccccgctcgcttatcgcctcgcaggtatgggacatgaattttgacagcgataccaatgc840
tattgatgtggcggtgaagcggctgcgcggcaaaatcgacaacgactttgagccgaagct900
aattcagaccgtgcgcggcgtgggttacatgcttgaggtgccggatggtcagggtggtgg960
tggttctggtggtggtggatccggtggcggtggttctgtgagcaagggcgaggagctgtt1020
caccggggtggtgcccatcctggtcgagctggacggcgacgtaaacggccacaagttcag1080
cgtgtccggcgagggcgagggcgatgccacctacggcaagctgaccctgaagttcatctg1140
caccaccggcaagctgcccgtgccctggcccaccctcgtgaccaccctgacctacggcgt1200
gcagtgcttcagccgctaccccgaccacatgaagcagcacgacttcttcaagtccgccat1260
gcccgaaggctacgtccaggagcgcaccatcttcttcaaggacgacggcaactacaagac1320
ccgcgccgaggtgaagttcgagggcgacaccctggtgaaccgcatcgagctgaagggcat1380
cgacttcaaggaggacggcaacatcctggggcacaagctggagtacaactacaacagcca1440
caacgtctatatcatggccgacaagcagaagaacggcatcaaggtgaacttcaagatccg1500
ccacaacatcgaggacggcagcgtgcagctcgccgaccactaccagcagaacacccccat1560
cggcgacggccccgtgctgctgcccgacaaccactacctgagcacccagtccaagctgag1620
caaagaccccaacgagaagcgcgatcacatggtcctgctggagttcgtgaccgccgccgg1680
gatcactctcggcatggacgagctgtacaagtaaaagcttggg1723
- 还没有人留言评论。精彩留言会获得点赞!