一种利用高速逆流色谱法从细柱五加叶中分离制备三萜化合物的方法与流程
本发明涉及中药提取分离制备技术领域,尤其涉及一种利用高速逆流色谱法从细柱五加叶中分离制备三萜化合物的方法。
背景技术:
细柱五加(acanthopanaxgracilistylusw.w.smith)为五加科五加属植物,其根皮为其主要的药用部分,具有强筋壮骨、祛风除湿、利水消肿、补益肝肾、利水消肿之功效。经过近几十年科学工作者其根皮化学成分的研究,作为药用的细柱五加根皮含有紫丁香苷、β-谷甾醇、五加酸、刺五加苷b1、贝壳烯酸、胡萝卜苷、各种有机酸、色素、挥发油等成分。近年来,国内外正全方位开发该属植物,包括茎、叶和果实等,药理研究结果表明,细柱五加叶中丰富的羽扇豆烷型三萜类化合物可抑制脂多糖诱导的巨噬细胞raw264.7,炎症因子tnf-α、il-1β、hmgb1的分泌,其三萜化合物在抗炎药物、肝病药物等领域具有很好的开发前景,通过近10多年对细柱五加叶的系统研究,细柱五加叶中的化学成分已基本明晰,对细柱五加叶中三萜类化合物的纯化工艺研究、动物活性研究及药物系统开发是今后的主要研究方向。
高速逆流色谱是20世纪80年代发展起来的一种连续高效的液-液分配色谱技术。通过两相互不相溶的溶剂体系,在高速旋转的情况下,实现样品在两相中的分配。高速逆流色谱技术,有其独特的优势,它可以克服样品不可逆吸附、样品物质的稳定性、溶剂的浪费、制备时间过长、制备量不足的劣势,而且其应用极性范围很广的化合物的分离,在天然产物研究中发挥着重要作用。已有研究表明,hsccc可用于三萜类化合物的分离,如桔梗皂苷、科罗索酸、积雪草酸、熊果酸、人参皂苷等的分离,但对hsccc用于分离五加叶中羽扇豆烷型三萜类化合物的研究未见报道。基于hsccc的特性和优点,hsccc用于细柱五加叶中系列羽扇豆烷型化合物的分离,有望很好地解决现有分离工艺的不足,为其产业化生产提供一种新的方法。
目前细柱五加叶三萜化合物分离制备方法主要有组合色谱法,包括反复硅胶柱层析、ods柱层析、sephadex-lh20柱色谱、制备薄层色谱、半制备高效液相色谱等方法,这些方法不仅操作复杂,溶剂用量大,而且在分离过程中有吸附、损失和污染等现象,使整个分离过程效率不高。利用高速逆流色谱法从细柱五加叶中同时分离制备多种三萜化合物的方法未见报道。
技术实现要素:
针对以上问题,本发明的目的在于提供一种提取率高,操作简单,溶剂用量少,无样品吸附、损失和污染,单体纯度高的细柱五加叶三萜化合物的分离方法。高速逆流色谱(high-speedcounter-currentchromatography,hsccc)利用溶质在两种互不相溶的溶剂中分配系数的不同,将不同物质进行有效分离。此项技术不需要固相载体,只需要被分离物在两相中分配,避免了固相载体带来的大量样品吸附、损失与污染等问题,样品回收率高,预处理及后处理都简单易行,与其它分离方法相比,它不使用固相载体作固定相,能采用不同的溶剂系统和正反相洗脱方式,克服了固相载体带来的样品吸附、损失、污染、峰形拖尾等缺点。
本发明采用如下技术方案:
本发明的细柱五加叶三萜化合物分离制备具体操作步骤如下:
(1)细柱五加叶三萜粗提物的制备:
取细柱五加叶,用5-12倍体积的溶剂提取,静置,过滤,然后减压蒸馏回收溶剂得到细柱五加叶提取物浸膏;细柱五加叶提取物浸膏用水分散,经低极性溶剂萃取除去色素后用脂肪酸酯萃取得到三萜粗提物;
(2)高速逆流色谱法分离制备三萜化合物
高速逆流色谱法分离制备三萜化合物的两相溶剂系统由正己烷、脂肪酸酯、脂肪醇和水组成,四种组分体积比为1-2∶1.5-2.5∶0.8-2.5∶0.5-2,将该溶剂系统混合均匀静置后,分开上下相,超声20-40min,溶剂系统的上相为固定相,下相为流动相,以5-40ml/min的流速将上相泵入管路,待固定相充满整个管路后,停泵,启动主机,然后以0.6-3ml/min的流速泵入流动相,当上下相平衡时,记录固定相流出的体积,计算得到固定相的保留值,取步骤(1)制备的三萜粗提物,溶解于固定相中,进样,根据检测器检测谱图,收集各峰的组分,将各峰对应的收集液分别浓缩,干燥。
步骤(1)中,提取溶剂为甲醇、乙醇、乙酸乙酯中的一种或多种。
步骤(1)中,低极性溶剂为石油醚、正己烷、乙酸乙酯或甲酸乙酯。
步骤(2)中,脂肪酸酯为乙酸乙酯、甲酸乙酯或乙酸甲酯。
步骤(2)中,脂肪醇为甲醇、乙醇、异丙醇或正丁醇。
步骤(2)中,两相溶剂系统采用正己烷、乙酸乙酯、甲醇和水四种组分体积比为1∶2∶1.6∶1,临用前分开上下相,超声30min,以溶剂系统的上相为固定相,下相为流动相,以30ml/min的流速将上相泵入管路,带固定相充满整个管路后,停泵,启动主机,把转速调到800r/min,然后以2ml/min的流速泵入流动相,进样量为20ml,紫外检测波长为210nm,根据紫外检测谱图,收集各峰的组分,将各峰对应的收集液分别浓缩,干燥。本发明的优点如下:
本发明的分离制备方法具有提取率高,操作简单,溶剂用量少,无样品吸附、损失和污染,避免了萃取物在高温下热裂解,保护生理活性物质的活性等优点,本发明的分离制备方法可一次性分离得到五个三萜类化合物,经检测纯度均达98%以上。
附图说明
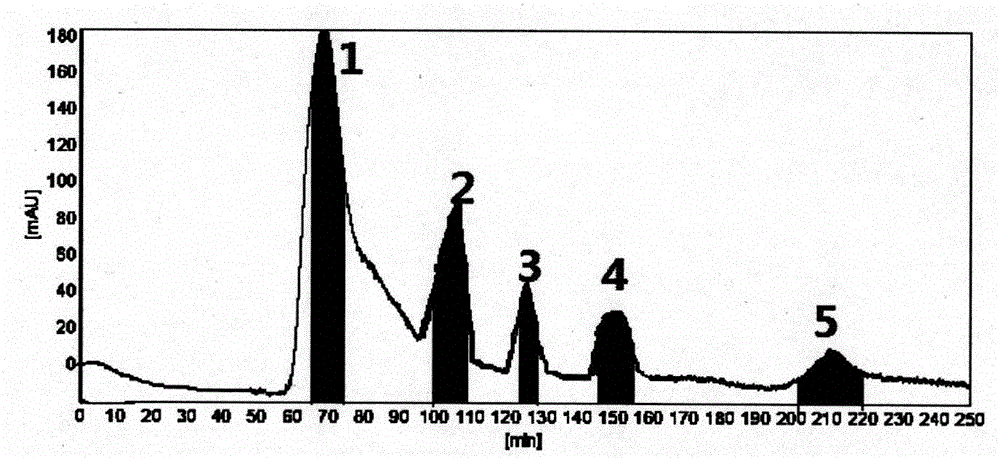
图1本发明分离制备三萜化合物的高速逆流色谱图
图2实施例1所得到的组分1对应化合物i的高效液相色谱图
图3实施例1所得到的组分2对应化合物ii的高效液相色谱图
图4实施例1所得到的组分3对应化合物iii的高效液相色谱图
图5实施例1所得到的组分4对应化合物iv的高效液相色谱图
图6实施例1所得到的组分5对应化合物v的高效液相色谱图
具体实施方式
下面的实施例是对本发明的进一步详细描述。
实施例1
(1)细柱五加叶三萜粗提物的制备:
称取细柱五加叶,用8倍体积的甲醇提取,静置,过滤,然后在水浴中减压蒸馏回收溶剂,制得细柱五加叶提取物浸膏;细柱五加叶提取物浸膏用水分散,用石油醚萃取除去色素,然后用乙酸乙酯萃取,得到细柱五加叶三萜粗提物;
(2)高速逆流色谱法分离制备三萜化合物:
两相溶剂系统采用正己烷∶乙酸乙酯∶甲醇∶水体积比为1∶2∶1.6∶1,将该溶剂系统混合均匀后静置,分开上下相,超声30min,其中溶剂系统的上相为固定相,下相为流动相,以30ml/min的流速将上相泵入管路,待固定相充满整个管路后,停泵,启动主机,把转速调到800r/min,然后以1.5ml/min的流速泵入流动相,当上下相平衡时,记录固定相流出的体积,计算得到固定相流出的体积,计算得到固定相的保留值,取步骤(1)制备的三萜粗提物,溶解于固定相中,进样量为20ml,以1.5ml/min的流速泵入流动相,紫外检测波长为210nm,根据检测器检测谱图,收集各峰的组分,依次命名为组分1、2、3、4、5,将各峰对应的收集液分别浓缩,干燥。
(3)纯度检测
仪器:lc-10at型高效液相色谱仪,spd-10a型紫外可见检测器,cbm-10a型色谱工作站,色谱柱:promosilc18(250mm×4.6mm,5μm);流动相∶乙腈-0.02%磷酸水(50∶50,v/v);流速1ml/min;柱温:30℃;分析样品用0.4μm滤头过滤。
(4)三萜化合物结构鉴定
组分1白色粉末;m.p.为274~276℃,liebermann-burchard反应和molish反应均呈阳性。1h-nmr(pyrindine-d5,400mhz)δ:0.90(1h,s,h-24),1.28(1h,s,h-23),1.70(1h,m,h-5),1.73(1h,m,h-18),1.77(1h,d,h-9),2.90(1h,dt,h-13),3.73(1h,brsh-3),3.54(1h,dt,h-19),4.21(1h,m,h-11),4.72(1h,brs,h-29a),4.90(1h,brs,h-29b);葡萄糖:4.91(1h,d,j=10.4hz,h-1),4.04(1h,t,j=8.0hz,h-2),4.25(1h,m,h-3),4.23(1h,m,h-4),3.96(1h,m,h-5),4.58(1h,dd,j=2.4hz,8.8hz,h-6)和甲基信号0.87(3h,s,h-27),1.11(3h,s,h-26),1.21(3h,s,h-25),1.74(3h,brs,h-30)。13c-nmr(pyrindine-d5,400mhz)δ:36.61(c-1),22.26(c-2),81.84(c-3),39.17(c-4),52.34(c-5),19.03(c-6),35.89(c-7),42.94(c-8),57.33(c-9),41.25(c-10),71.04(c-11),39.06(c-12),37.84(c-13),44.02(c-14),29.96(c-15),34.11(c-16),57.08(c-17),50.06(c-18),47.92(c-19),151.38(c-20),31.66(c-21),37.87(c-22),30.35(c-23),23.44(c-24),17.23(c-25),18.02(c-26),15.18(c-27),179.14(c-28),110.49(c-29),20.05(c-30)。葡萄糖碳信号:102.34(c-1),75.56(c-2),79.37(c-3),72.61(c-4),78.72(c-5),63.63(c-6).以上数据确定,组分1所对应的化合物i为3-o-β-d-glucopyranosyl-3α,11α-dihydroxylup-20(29)-en-28-oicacid,结构式如下。
组分2无色针状晶体;m.p.为182~184℃,liebermann-burchard反应呈阳性。1h-nmr(pyrindine-d5,400mhz)δ:4.02(1h,brs,h-3),2.58(1h,d,j=12.4hz,h-5),1.75(1h,m,h-18),和羟基相连的氢信号:4.26(1h,dt,j=5.2,16hz,h-11),3.53(1h,m,h-19)和3.70(1h,s,h-23),1.18(3h,s,h-24),1.05(3h,s,h-27),1.25(3h,s,h-25),1.13(3h,s,h-26),烯碳氢4.66(1h,brs,h-29a)和4.88(1h,brs,h-29b),1.71(3h,s,h-30)。13c-nmr(pyrindine-d5,400mhz)δ:36.34(c-1),27.55(c-2),76.32(c-3),41.57(c-4),44.27(c-5),18.68(c-6),36.00(c-7),43.13(c-8),56.62(c-9),40.03(c-10),70.30(c-11),38.79(c-12),38.04(c-13),43.25(c-14),30.54(c-15),33.24(c-16),56.94(c-17),49.78(c-18),47.92(c-19),151.25(c-20),31.63(c-21),38.02(c-22),72.32(c-23),19.02(c-24),16.94(c-25),17.86(c-26),15.18(c-27),179.24(c-28),110.47(c-29),19.90(c-30),δ179.24为羧基的碳信号峰。以上数据确定,组分2所对应的化合物ii为3α,11α,23-trihydroxy-23-oxo-lup-20(29)-en-28-oicacid,结构式如下。
组分3无色针状晶体(meoh),liebermann-burchard反应呈阳性。1h-nmr谱中5个甲基信号质子分别为:δ1.05,1.13,1.18,1.25和1.71,环外烯氢信号δ4.66和δ4.88,δ4.02(s)和4.26为连有羟基的碳上的质子。13c-nmr(pyrindine-d5,400mhz)δ:35.95(c-1),27.59(c-2),73.48(c-3),53.40(c-4),44.65(c-5),21.74(c-6),35.80(c-7),43.24(c-8),56.36(c-9),39.43(c-10),70.19(c-11),38.70(c-12),37.97(c-13),43.69(c-14),30.50(c-15),33.24(c-16),56.94(c-17),49.78(c-18),47.92c-19),151.25(c-20),31.64(c-21),37.80(c-22),210.50(c-23),15.35(c-24),17.17(c-25),18.18(c-26),15.18(c-27),179.24(c-28),110.50(c-29),19.92(c-30)。以上结果确定,组分3所对应的化合物iii为3α,11α-dihydroxy-23-oxo-lup-20(29)-en-28-oicacid,结构式如下。
组分4无色针状结晶,m.p.为232~234℃。liebermann-burchard反应呈阳性。1h-nmr谱中,6个与季碳相连的甲基质子信号δ0.97,1.02,1.15,1.26,1.26和1.71(3h,s),含有一对孤立的环外烯氢信号δ4.66和δ4.88,连接该烯丙基的氢信号δ3.53;13c-nmr(pyrindine-d5,400mhz)δ:36.61(c-1),27.35(c-2),75.59(c-3),38.90(c-4),49.93(c-5),18.92(c-6),36.31(c-7),43.14(c-8),56.54(c-9),40.23(c-10),70.25(c-11),38.78(c-12),38.03(c-13),43.30(c-14),30.53(c-15),33.26(c-16),56.94(c-17),49.79(c-18),47.90(c-19),151.24(c-20),31.63(c-21),37.81(c-22),30.27(c-23),23.30(c-24),17.19(c-25),18.10(c-26),15.14(c-27),179.23(c-28),110.47(c-29),19.91(c-30),δ70.25和δ75.59为两个连接有羟基的碳信号峰,δ179.23为羧基的碳信号峰,2个烯键碳δ151.24和δ110.47。以上数据确定,组分4所对应的化合物iv为impressicacid,结构式如下。
组分5无色针状结晶;m.p.为232~234℃,liebermann-burchard反应呈阳性。1h-nmr数据(400mhz,pyrindine-d5)δ:4.88(1h,brs,h-29a)和5.03(1h,brs,h-29b)烯碳上的质子,4.45(1h,brs,h-3)为连有羟基碳上质子信号,1.21(3h,h-26),1.57(1h,h-9),3.48(1h,h-19),2.68(1h,h-13),1.82(1h,h-18),2.66(1h,h-5),1.79(1h,h-11),1.56(3h,h-24),1.02(6h,h-25andh-27),1.84(3h,brs,h-30);13c-nmr数据(125mhz,pyrindine-d5):33.35(c-1),26.58(c-2),73.18(c-3)连有羟基碳的信号,53.03(c-4),46.01(c-5),20.89(c-6),34.78(c-7),41.93(c-8),50.98(c-9),38.04(c-10),21.86(c-11),27.06(c-12),39.04(c-13),42.86(c-14),31.33(c-15),32.85(c-16),57.08(c-17),49.97(c-18),47.83(c-19),150.66(c-20),32.67(c-21),38.01(c-22),180.12(c-23)为羰基碳,19.01(c-24),16.80(c-25),16.90(c-26),14.76(c-27),180.04(c-28)为羰基碳,109.34(c-29)为烯碳信号,20.06(c-30)为甲基信号。以上数据确定组分5所对应的化合物v为acankoreanogenin,结构式如下。
实施例2
(1)细柱五加叶三萜粗提物的制备:
称取细柱五加叶,用12倍体积的甲醇提取,静置,过滤,然后在水浴中减压蒸馏回收溶剂,制得细柱五加叶提取物浸膏,细柱五加叶提取物浸膏用水分散,用正己烷萃取除去色素,然后用乙酸乙酯萃取,得到细柱五加叶三萜粗提物;
(2)高速逆流色谱法分离制备三萜化合物:
两相溶剂系统采用正己烷∶乙酸乙酯∶乙醇∶水体积比为1.5∶2∶2.2∶1.2,将该溶剂系统混合均匀后静置,分开上下相,超声20min,其中溶剂系统的上相为固定相,下相为流动相,以25ml/min的流速将上相泵入管路,待固定相充满整个管路后,停泵,启动主机,把转速调到850r/min,然后以1.2ml/min的流速泵入流动相,当上下相平衡时,记录固定相流出的体积,计算得到固定相流出的体积,计算得到固定相的保留值,取步骤(1)制备的三萜粗提物,溶解于固定相中,进样量为20ml,以1.2ml/min的流速泵入流动相,紫外检测波长为210nm,根据检测器检测谱图,收集各峰的组分,将各峰对应的收集液分别浓缩,干燥。
实施例3
(1)细柱五加叶三萜粗提物的制备:
称取细柱五加叶,用5倍体积的乙醇提取,静置,过滤,然后在水浴中减压蒸馏回收溶剂,制得细柱五加叶提取物浸膏,细柱五加叶提取物浸膏用水分散,用石油醚萃取除去色素,再用乙酸乙酯萃取,得到细柱五加叶三萜粗提物;
(2)高速逆流色谱法分离制备三萜化合物:
两相溶剂系统采用正己烷∶乙酸甲酯∶甲醇∶水体积比为2∶2.5∶1.8∶1,将该溶剂系统混合均匀后静置,分开上下相,超声40min,其中溶剂系统的上相为固定相,下相为流动相,以25ml/min的流速将上相泵入管路,待固定相充满整个管路后,停泵,启动主机,把转速调到780r/min,然后以2ml/min的流速泵入流动相,当上下相平衡时,记录固定相流出的体积,计算得到固定相流出的体积,计算得到固定相的保留值,取步骤(1)制备的三萜粗提物,溶解于固定相中,进样量为20ml,以2ml/min的流速泵入流动相,紫外检测波长为210nm,根据检测器检测谱图,收集各峰的组分,将各峰对应的收集液分别浓缩,干燥。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!