一种检测胶基型嚼烟对细胞早期凋亡影响的方法与流程
本发明属于烟草及烟草制品安全性生物学评价技术领域,具体涉及一种检测胶基型嚼烟对细胞早期凋亡影响的方法。
背景技术:
烟草监管立法的日趋严格以及吸烟与健康研究的深入,导致了烟草公司寻求风险更低、无环境烟气的新型烟草制品。口含烟制品避免了传统卷烟制品燃烧所产生的复杂混合物所带来的危害,现阶段已成为国外烟草公司从传统卷烟制品转向的新方向之一。根据产品的组分及形态特点,口含烟制品分为传统含烟叶原料的Snus型口含烟和不含烟叶原料的新型口含烟(如胶基型嚼烟)。胶基型嚼烟是一种以烟草或烟草提取物为有效组分,以可食用胶基为载体,通过咀嚼方式向人体递送烟碱的新型烟草制品。咀嚼过程中烟草或烟草提取物及其他食品添加剂缓慢释放到唾液中,其释放方式有别于传统卷烟和含烟叶原料的Snus型口含烟。
对于卷烟细胞毒性的检测,目前通常采用中性红细胞毒性法,但存在一定的缺陷。中性红进入细胞并在细胞内聚集的过程要求有完整的细胞膜,而细胞凋亡早期细胞膜表面发生改变,带负电荷的磷脂酰丝氨酸(PS)从细胞膜内转移到细胞膜外,使PS暴露在细胞膜外表面。这种改变可能会影响中性红细胞毒性法的检测结果。细胞凋亡的概念是1972年由Kerr等三位科学家首次提出(Kerr JF,Wyllie AH,Currie AR. Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics.Br J ancer,1972,26:239–257.),虽然细胞凋亡(apoptosis)与细胞坏死(necrosis)的最终结果极为相似,但它们的过程与表现却有很大差别。细胞凋亡是一个主动过程,它涉及一系列基因的激活、表达以及调控等的作用,它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。因此,有必要开发一种用于检测胶基型嚼烟对细胞早期凋亡影响的方法,作为胶基型嚼烟细胞毒性检测的补充方法以区别制品对细胞坏死和凋亡的影响。
技术实现要素:
本发明的目的正是针对上述技术问题,对胶基型嚼烟细胞早期凋亡影响的流式检测法进行了综合研究,确定了胶基型嚼烟的检测剂量,以及胶基型嚼烟前处理方法,制定了一种适用于检测胶基型嚼烟对细胞早期凋亡影响的流式检测法。
为实现上述目的,本发明采用的技术方案如下:
一种检测胶基型嚼烟对细胞早期凋亡影响的方法,包括如下步骤:
步骤(1),样品前处理:将胶基型嚼烟制品加入到37℃的口腔角质细胞培养基中,胶基型嚼烟制品的质量与口腔角质细胞培养基的体积比为1g:10mL;之后于37℃下研磨10min,之后过滤,向滤液中加入血清,使得血清的最终体积百分浓度为10%,得到待测液;
步骤(2),单细胞悬液的制备:将人口腔角质细胞HOK于37℃、5%CO2培养箱中采用口腔角质细胞培养基培养,待细胞汇合率为80~90%时移除培养基,用pH值为7.2的磷酸缓冲液洗两次,弃洗液;加入浓度为0.25%(w/v)的胰蛋白酶溶液进行单层孵育1~2min,每25cm2生长面积的细胞需要加入浓度为0.25%(w/v)的胰蛋白酶溶液1~2mL,单层孵育后再加入口腔角质细胞培养基将细胞悬起,得到单细胞悬浮液;
步骤(3),单细胞悬浮液的细胞浓度计算:用血球计数板计数法对步骤(2)所得单细胞悬浮液的细胞浓度进行计算,计算出每毫升单细胞悬浮液的活细胞数;
步骤(4),细胞接种:将步骤(3)计数后的单细胞悬浮液用口腔角质细胞培养基稀释至1.0×105个/mL,再按接种量为2mL/孔接种到细胞培养板中,之后将细胞培养板置于37℃、5%CO2培养箱内培养24h;
步骤(5),受试物暴露:受试物分为两组:细胞对照组和样品测试组;移除步骤(4)中细胞培养板内的培养基,再按上述方法进行分组;在细胞对照组相应的孔内加入口腔角质细胞培养基;在样品测试组相应的孔内加入口腔角质细胞培养基和不同剂量步骤(1)所得待测液,至待测液的体积百分浓度在大于0%、小于等于60%的范围内;细胞对照组和样品测试组的终体积为2mL/孔;
步骤(6),孵育受试物:将步骤(5)加样后的细胞培养板置于37℃、5%CO2培养箱中孵育24h;
步骤(7),收集细胞:每孔分别收集细胞,具体的收集方式为:首先收集步骤(6)中的培养液,之后贴壁细胞用不含EDTA的0.25%的胰酶消化后连同收集的培养液一起于4℃下离心,弃上清液,收集细胞;
步骤(8),细胞早期凋亡影响率的计算:步骤(7)每孔所收集的细胞用预冷至4℃的PBS洗涤后,再加入100μL的Binding Buffer重悬细胞,加入5μL的Annexin V-FITC和5μL的PI染料,混匀,然后在避光、室温下反应10min,再加入400μL的Binding Buffer进行混匀得到检测样品,在1小时内用流式细胞仪检测,即得到细胞早期凋亡影响率;
将样品测试组的细胞早期凋亡影响率与细胞对照组的细胞早期凋亡影响率相比,如无显著差异,则为阴性结果,该胶基型嚼烟对细胞不会引起细胞凋亡;如有显著差异,且样品测试组的剂量与样品测试组的细胞早期凋亡影响率之间有剂量效应关系,需重复步骤(1)-步骤(7),如仍有显著差异且有剂量效应关系即可确认为阳性结果,该胶基型嚼烟会引起细胞凋亡;反之,则为阴性结果,该胶基型嚼烟不会引起细胞凋亡。
进一步,优选的是,步骤(1)所述的研磨方式具体为:研磨棒顺时针研磨1min后逆时针研磨1min,交替进行,研磨速度为30rpm/min。
进一步,优选的是,步骤(1)所述的过滤方法为先用定性滤纸进行初滤,再用0.45μm有机滤膜过滤。
进一步,优选的是,步骤(4)所述的细胞培养板为6孔细胞培养板。
进一步,优选的是,步骤(5)分组时,样品测试组的各个浓度和细胞对照组均设置3个复孔。
进一步,优选的是,步骤(7)所述的离心的速度为1000rpm/min,时间为5min。
进一步,优选的是,步骤(8)所述的洗涤次数为两次。
进一步,优选的是,步骤(8)所述的洗涤采用离心的方式进行;每次洗涤所采用的离心的速度为1000rpm/min,时间为5min。
本发明与现有技术相比,其有益效果为:
本发明对胶基型嚼烟细胞早期凋亡影响的流式检测法进行了综合研究,确定了胶基型嚼烟的检测剂量,以及胶基型嚼烟前处理方法,制定了一种适用于检测胶基型嚼烟对细胞早期凋亡影响的流式检测法,可作为胶基型嚼烟细胞毒性检测的补充方法以区别胶基型嚼烟对细胞坏死和凋亡的影响。本发明综合考察胶基型嚼烟的溶出方式、暴露途径、作用方式,建立了胶基型嚼烟样品前处理方法,样品的有效处理、检测剂量的优化设定以及靶细胞的正确选择,使得本方法能够准确有效的检测胶基型嚼烟对细胞早期凋亡的影响。
附图说明
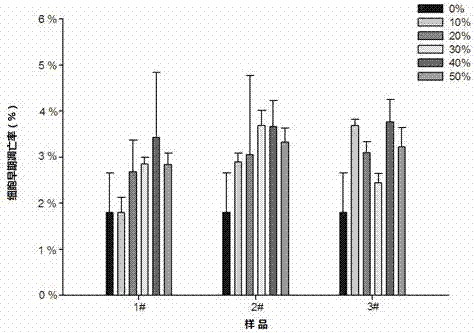
图1为本发明方法对三种胶基型嚼烟对细胞早期凋亡影响率的影响检测结果。
图2为201510193961.3方法对三种胶基型嚼烟对细胞早期凋亡影响率的影响检测结果。
具体实施方式
下面结合实施例对本发明作进一步的详细描述。
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用材料或设备未注明生产厂商者,均为可以通过购买获得的常规产品。
本发明所采用的口腔角质细胞培养基OKM、磷酸缓冲液、Binding Buffer均为普通的商品化产品。
本发明技术方案中的细胞早期凋亡影响率流式细胞仪会自动给出数值,不用人工计算。
本发明除非另有说明,否则百分号代表体积百分数,比例为体积比。
实施例1
一种检测胶基型嚼烟对细胞早期凋亡影响的方法,包括如下步骤:
步骤(1),样品前处理:将胶基型嚼烟制品加入到37℃的口腔角质细胞培养基中,胶基型嚼烟制品的质量与口腔角质细胞培养基的体积比为1g:10mL;之后于37℃下研磨10min,之后过滤,向滤液中加入血清,使得血清的最终体积百分浓度为10%,得到待测液;
步骤(2),单细胞悬液的制备:将人口腔角质细胞HOK于37℃、5%CO2培养箱中采用口腔角质细胞培养基培养,待细胞汇合率为80~85%时移除培养基,用pH值为7.2的磷酸缓冲液洗两次,弃洗液;加入浓度为0.25%(w/v)的胰蛋白酶溶液进行单层孵育1min,每25cm2生长面积的细胞需要加入浓度为0.25%(w/v)的胰蛋白酶溶液1mL,单层孵育后再加入口腔角质细胞培养基将细胞悬起,得到单细胞悬浮液;
步骤(3),单细胞悬浮液的细胞浓度计算:用血球计数板计数法对步骤(2)所得单细胞悬浮液的细胞浓度进行计算,计算出每毫升单细胞悬浮液的活细胞数;
步骤(4),细胞接种:将步骤(3)计数后的单细胞悬浮液用口腔角质细胞培养基稀释至1.0×105个/mL,再按接种量为2mL/孔接种到细胞培养板中,之后将细胞培养板置于37℃、5%CO2培养箱内培养24h;
步骤(5),受试物暴露:受试物分为两组:细胞对照组和样品测试组;移除步骤(4)中细胞培养板内的培养基,再按上述方法进行分组;在细胞对照组相应的孔内加入口腔角质细胞培养基;在样品测试组相应的孔内加入口腔角质细胞培养基和不同剂量步骤(1)所得待测液,至待测液的体积百分浓度在大于0%、小于等于60%的范围内;细胞对照组和样品测试组的终体积为2mL/孔;
步骤(6),孵育受试物:将步骤(5)加样后的细胞培养板置于37℃、5%CO2培养箱中孵育24h;
步骤(7),收集细胞:每孔分别收集细胞,具体的收集方式为:首先收集步骤(6)中的培养液,之后贴壁细胞用不含EDTA的0.25%的胰酶消化后连同收集的培养液一起于4℃下离心,弃上清液,收集细胞;
步骤(8),细胞早期凋亡影响率的计算:步骤(7)每孔所收集的细胞用预冷至4℃的PBS洗涤后,再加入100μL的Binding Buffer重悬细胞,加入5μL的Annexin V-FITC和5μL的PI染料,混匀,然后在避光、室温下反应10min,再加入400μL的Binding Buffer进行混匀得到检测样品,在1小时内用流式细胞仪检测,即得到细胞早期凋亡影响率;
将样品测试组的细胞早期凋亡影响率与细胞对照组的细胞早期凋亡影响率相比,如无显著差异,则为阴性结果,该胶基型嚼烟对细胞不会引起细胞凋亡;如有显著差异,且样品测试组的剂量与样品测试组的细胞早期凋亡影响率之间有剂量效应关系,需重复步骤(1)-步骤(7),如仍有显著差异且有剂量效应关系即可确认为阳性结果,该胶基型嚼烟会引起细胞凋亡;反之,则为阴性结果,该胶基型嚼烟不会引起细胞凋亡。
其中,步骤(1)所述的研磨方式具体为:研磨棒顺时针研磨1min后逆时针研磨1min,交替进行,研磨速度为30rpm/min;所述的过滤方法为先用定性滤纸进行初滤,再用0.45μm有机滤膜过滤。
实施例2
一种检测胶基型嚼烟对细胞早期凋亡影响的方法,包括如下步骤:
步骤(1),样品前处理:将胶基型嚼烟制品加入到37℃的口腔角质细胞培养基中,胶基型嚼烟制品的质量与口腔角质细胞培养基的体积比为1g:10mL;之后于37℃下研磨10min,之后过滤,向滤液中加入血清,使得血清的最终体积百分浓度为10%,得到待测液;
步骤(2),单细胞悬液的制备:将人口腔角质细胞HOK于37℃、5%CO2培养箱中采用口腔角质细胞培养基培养,待细胞汇合率为85~90%时移除培养基,用pH值为7.2的磷酸缓冲液洗两次,弃洗液;加入浓度为0.25%(w/v)的胰蛋白酶溶液进行单层孵育2min,每25cm2生长面积的细胞需要加入浓度为0.25%(w/v)的胰蛋白酶溶液2mL,单层孵育后再加入口腔角质细胞培养基将细胞悬起,得到单细胞悬浮液;
步骤(3),单细胞悬浮液的细胞浓度计算:用血球计数板计数法对步骤(2)所得单细胞悬浮液的细胞浓度进行计算,计算出每毫升单细胞悬浮液的活细胞数;
步骤(4),细胞接种:将步骤(3)计数后的单细胞悬浮液用口腔角质细胞培养基稀释至1.0×105个/mL,再按接种量为2mL/孔接种到6孔细胞培养板中,之后将细胞培养板置于37℃、5%CO2培养箱内培养24h;
步骤(5),受试物暴露:受试物分为两组:细胞对照组和样品测试组;移除步骤(4)中细胞培养板内的培养基,再按上述方法进行分组;在细胞对照组相应的孔内加入口腔角质细胞培养基;在样品测试组相应的孔内加入口腔角质细胞培养基和不同剂量步骤(1)所得待测液,至待测液的体积百分浓度在大于0%、小于等于60%的范围内;细胞对照组和样品测试组的终体积为2mL/孔;
步骤(6),孵育受试物:将步骤(5)加样后的细胞培养板置于37℃、5%CO2培养箱中孵育24h;
步骤(7),收集细胞:每孔分别收集细胞,具体的收集方式为:首先收集步骤(6)中的培养液,之后贴壁细胞用不含EDTA的0.25%的胰酶消化后连同收集的培养液一起于4℃下离心,弃上清液,收集细胞;
步骤(8),细胞早期凋亡影响率的计算:步骤(7)每孔所收集的细胞用预冷至4℃的PBS洗涤后,再加入100μL的Binding Buffer重悬细胞,加入5μL的Annexin V-FITC和5μL的PI染料,混匀,然后在避光、室温下反应10min,再加入400μL的Binding Buffer进行混匀得到检测样品,在1小时内用流式细胞仪检测,即得到细胞早期凋亡影响率;
将样品测试组的细胞早期凋亡影响率与细胞对照组的细胞早期凋亡影响率相比,如无显著差异,则为阴性结果,该胶基型嚼烟对细胞不会引起细胞凋亡;如有显著差异,且样品测试组的剂量与样品测试组的细胞早期凋亡影响率之间有剂量效应关系,需重复步骤(1)-步骤(7),如仍有显著差异且有剂量效应关系即可确认为阳性结果,该胶基型嚼烟会引起细胞凋亡;反之,则为阴性结果,该胶基型嚼烟不会引起细胞凋亡。
其中,步骤(1)所述的研磨方式具体为:研磨棒顺时针研磨1min后逆时针研磨1min,交替进行,研磨速度为30rpm/min;所述的过滤方法为先用定性滤纸进行初滤,再用0.45μm有机滤膜过滤。
步骤(7)所述的离心的速度为1000rpm/min,时间为5min。
实施例3
一种检测胶基型嚼烟对细胞早期凋亡影响的方法,包括如下步骤:
步骤(1),样品前处理:将胶基型嚼烟制品加入到37℃的口腔角质细胞培养基中,胶基型嚼烟制品的质量与口腔角质细胞培养基的体积比为1g:10mL;之后于37℃的恒温水浴锅中用研磨器研磨10min,之后过滤,向滤液中加入血清,使得血清的最终体积百分浓度为10%,得到待测液;
步骤(2),单细胞悬液的制备:将人口腔角质细胞HOK于37℃、5%CO2培养箱中采用口腔角质细胞培养基培养,待细胞汇合率为83~88%时移除培养基,用pH值为7.2的磷酸缓冲液洗两次,弃洗液;加入浓度为0.25%(w/v)的胰蛋白酶溶液进行单层孵育1.3min,每25cm2生长面积的细胞需要加入浓度为0.25%(w/v)的胰蛋白酶溶液1.8mL,单层孵育后再加入口腔角质细胞培养基将细胞悬起,得到单细胞悬浮液;
步骤(3),单细胞悬浮液的细胞浓度计算:用血球计数板计数法对步骤(2)所得单细胞悬浮液的细胞浓度进行计算,计算出每毫升单细胞悬浮液的活细胞数;
步骤(4),细胞接种:将步骤(3)计数后的单细胞悬浮液用口腔角质细胞培养基稀释至1.0×105个/mL,再按接种量为2mL/孔接种到6孔细胞培养板中,之后将细胞培养板置于37℃、5%CO2培养箱内培养24h;
步骤(5),受试物暴露:受试物分为两组:细胞对照组和样品测试组;移除步骤(4)中细胞培养板内的培养基,再按上述方法进行分组;在细胞对照组相应的孔内加入口腔角质细胞培养基;在样品测试组相应的孔内加入口腔角质细胞培养基和不同剂量步骤(1)所得待测液,至待测液的体积百分浓度在大于0%、小于等于60%的范围内;细胞对照组和样品测试组的终体积为2mL/孔;
步骤(6),孵育受试物:将步骤(5)加样后的细胞培养板置于37℃、5%CO2培养箱中孵育24h;
步骤(7),收集细胞:每孔分别收集细胞,具体的收集方式为:首先收集步骤(6)中的培养液,之后贴壁细胞用不含EDTA的0.25%的胰酶消化后连同收集的培养液一起于4℃下离心,弃上清液,收集细胞;
步骤(8),细胞早期凋亡影响率的计算:步骤(7)每孔所收集的细胞用预冷至4℃的PBS洗涤后,再加入100μL的Binding Buffer重悬细胞,加入5μL的Annexin V-FITC和5μL的PI染料,混匀,然后在避光、室温下反应10min,再加入400μL的Binding Buffer进行混匀得到检测样品,在1小时内用流式细胞仪检测,即得到细胞早期凋亡影响率;
将样品测试组的细胞早期凋亡影响率与细胞对照组的细胞早期凋亡影响率相比,如无显著差异,则为阴性结果,该胶基型嚼烟对细胞不会引起细胞凋亡;如有显著差异,且样品测试组的剂量与样品测试组的细胞早期凋亡影响率之间有剂量效应关系,需重复步骤(1)-步骤(7),如仍有显著差异且有剂量效应关系即可确认为阳性结果,该胶基型嚼烟会引起细胞凋亡;反之,则为阴性结果,该胶基型嚼烟不会引起细胞凋亡。
其中,步骤(1)所述的研磨方式具体为:研磨棒顺时针研磨1min后逆时针研磨1min,交替进行,研磨速度为30rpm/min;所述的过滤方法为先用定性滤纸进行初滤除渣,再用0.45μm有机滤膜过滤除菌。
步骤(5)分组时,样品测试组的各个浓度和细胞对照组均设置3个复孔,检测样品组的各个浓度、细胞对照组和阳性对照组的细胞早期凋亡影响率分别取平均值。
步骤(7)所述的离心的速度为1000rpm/min,时间为5min。
步骤(8)所述的洗涤采用离心的方式进行;每次洗涤所采用的离心的速度为1000rpm/min,时间为5min;离心后,弃上清液。
表1 细胞早期凋亡检测加样表
应用实例
分别采用本发明实施例3方法和201510193961.3方法对市售的三种胶基型嚼烟制品的进行细胞凋亡检测,其中1#样品中人为注射入细胞凋亡阳性物10μl/g,做两次平行实验,结果如表2和图1、2所示。细胞凋亡阳性物为商品化产品,购自生物技术有限公司,为细胞凋亡诱导阳性对照试剂盒中的产品。
表2 三种胶基型嚼烟在两种检测方法下对受试细胞凋亡的影响
其中,浓度为0%时为细胞对照组。
由以上结果可以看出,在本发明方法给出的样品处理方法、检测用细胞、检测剂量条件下,后两种胶基型嚼烟在受试剂量范围内与细胞对照组相比无显著差异,且检测剂量与细胞早期凋亡影响率间无剂量效应关系,表明这两种胶基型嚼烟对细胞不会引起细胞凋亡;而人为注射入细胞凋亡阳性物10μl/g的1#样品,在受试剂量范围内检测剂量与细胞早期凋亡影响率间有剂量效应关系,且与细胞对照组存在显著差异,表明该胶基型嚼烟对细胞会引起细胞凋亡;而采用201510193961.3发明中适合于Snus型口含烟的方法,3种胶基型嚼烟在受试剂量范围内检测剂量与细胞早期凋亡影响率间均无剂量效应关系,无法区分人为注射入细胞凋亡阳性物10μl/g的1#样品,这可能是由于采用201510193961.3方法,受试的三种胶基型嚼烟内含物释放不完全,不能真实反映其对细胞凋亡的影响。201710226545.8、201611056864.0方法亦是如此,无法区分人为注射入细胞凋亡阳性物10μl/g的1#样品,不能真实反映其对细胞凋亡的影响。
本发明对胶基型嚼烟细胞早期凋亡影响的流式检测法进行了综合研究,确定了胶基型嚼烟的检测剂量,以及胶基型嚼烟前处理方法,制定了一种适用于检测胶基型嚼烟对细胞早期凋亡影响的流式检测法,可作为胶基型嚼烟细胞毒性检测的补充方法以区别胶基型嚼烟对细胞坏死和凋亡的影响。
本发明综合考察了胶基型嚼烟的暴露途径,作用方式,建立了全新的胶基型嚼烟的前处理方法,且根据胶基型嚼烟作用靶细胞选取了人口腔角质细胞HOK作为胶基型嚼烟细胞早期凋亡试验检测用细胞,并确定了样品检测剂量,形成了适合胶基型嚼烟对细胞早期凋亡影响率影响的检测方法。样品的有效处理、检测剂量的优化设定以及靶细胞的正确选择,使得本发明方法能够准确有效地检测胶基型嚼烟对细胞早期凋亡影响率影响。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!