检测生物膜形成的方法及其应用和微流控芯片与流程
本发明涉及生物技术领域,尤其是涉及一种检测生物膜形成的方法及其应用和微流控芯片。
背景技术:
抗生素的发现和使用是20世纪医药健康领域最伟大的贡献之一,它在减少人类因细菌或病毒感染而带来的发病率和死亡率方面具有卓越的作用。然而,抗生素滥用也为人类带来了新的危机,据统计,截止到2002年每年使用的抗生素的量达到10万-20万吨,自二十世纪四十年代以来,抗生素的总产量超过了100万吨,这极大程度上促使了大量多药耐药的“超级细菌”的出现,宣告着人类已经正式进入了“后抗生素”时代。
多种因素都会影响到病原菌的耐药性,其中包括抗生素修饰酶的表达(如氨基糖苷类修饰酶、β-内酰胺酶等),抗生素外排泵的作用,细胞膜通透性改变等。生物膜形成是影响细菌耐药性的最主要机制之一。细菌生物膜的形成,可以使细菌逃逸抗生素的杀伤作用和机体免疫系统的清除,是临床上致病菌反复感染的重要原因。
治疗多药耐药病原菌感染是临床上亟需解决的科学难题,而益生菌不但可以调节宿主体内的微生态平衡,而且益生菌所分泌的各种活性因子,可以扰乱、减缓细菌耐药性的产生和扩散,是一种极具前景的可以部分或完全替代抗生素治疗多药耐药病原菌感染的“绿色疗法”。最新的研究表明,益生菌的培养上清可以抑制病原菌生物膜的形成。但是,现有的针对益生菌与病原菌相互作用的研究,绝大多数都是通过改变单一微生物的培养环境,导致无法很好的模拟自然环境中两种微生物间复杂的相互作用导致生物膜变化的过程。由于缺少合适的方法在实现益生菌与病原菌共培养的同时,可以对病原菌生物膜的形成过程进行实时观测,导致针对益生菌如何影响病原菌生物膜形成过程机制不明。而少数利用共培养方式研究益生菌与病原菌的相互作用是通过直接共混的方式实现的,但是这种方式培养过程不可控,并且培养结束后无法对两种微生物进行单独分离,不利于后续研究的开展。
因此,开发一种能够实时检测两种微生物共培养过程中生物膜的变化的方法十分必要。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供一种检测生物膜形成的方法,以缓解现有技术中存在的缺少通过对生物膜的动态监测的手段,从而无法阐明不同种微生物相互作用对生物膜形成的影响机制的技术问题。
本发明的第二个目的在于提供一种微流控芯片,以缓解现有技术中存在的缺少合适的微流控芯片作为工具,以实现益生菌与病原菌共培养的同时,实时动态的对病原菌生物膜形成过程进行检测的技术问题。
本发明的第三个目的在于提供上述的检测生物膜形成的方法在检测益生菌影响病原菌生物膜形成中的应用。
本发明提供了一种检测生物膜形成的方法,包括:
采用微流控芯片制备出包埋有第一微生物的水凝胶微球,并将制备出的包埋有第一微生物的水凝胶微球输送至所述微流控芯片中接种有第二微生物的区域内,进行共培养,同时监测生物膜形态的变化;
其中,所述第二微生物形成有生物膜结构。
进一步地,所述第一微生物为益体微生物,所述第二微生物为病原微生物;
优选地,所述益体微生物为益生菌,所述病原微生物为病原菌;
优选地,所述第二微生物的接种密度为102-106cfu/ml。
进一步地,所述包埋有第一微生物的水凝胶微球通过乳化内部凝胶化反应制备得到。
进一步地,包埋有第一微生物的水凝胶微球的制备方法包括以下步骤:
在微流控芯片中将第一微生物混悬在水相中,水相与油相混合形成油包水微液滴,微液滴在凝胶引发剂的作用下引发内部凝胶化反应,形成所述包埋有第一微生物的水凝胶微球;
优选地,所述水相为分散有难溶钙盐的高分子溶液;
优选地,所述高分子溶液的浓度为0.1-5g/l;难溶钙盐在高分子溶液中的浓度为1-50g/l;
优选地,所述高分子为海藻酸钠、果胶、明胶、琼脂或透明质酸中的一种或几种;
优选地,第一微生物在水相中的浓度为104-109cfu/ml;
优选地,所述油相包括液体石蜡、橄榄油或葡萄籽油中的一种或几种;
优选地,所述油相中含有表面活性剂;
优选地,所述表面活性剂的加入量为1-5%(v/v);
优选地,所述表面活性剂为吐温80、吐温20或司盘80中的一种或几种;
优选地,在油相中加入0.01-0.5%(v/v)的凝胶引发剂;
优选地,凝胶引发剂为冰醋酸;
优选地,水相与油相在微流控芯片中的流速为0.01-1ml/min。
进一步地,所述接种有第二微生物的区域为生物膜共培养室,生物膜共培养室内通入有培养基;
优选地,将制备出的包埋有第一微生物的水凝胶微球输送至微流控芯片中接种有第二微生物的生物膜共培养室内共培养2-12h。
进一步地,所述生物膜带有荧光标记,根据所述荧光标记测定荧光值来实时监测所述生物膜的变化。
本发明还提供了一种实现上述的检测生物膜形成的方法的微流控芯片,所述微流控芯片包括:水凝胶微球制备模块和生物膜共培养模块;
所述水凝胶微球制备模块用于制备包埋有第一微生物的水凝胶微球;
所述生物膜共培养模块用于共培养第二微生物与所述包埋有第一微生物的水凝胶微球;
所述水凝胶微球制备模块与所述生物膜共培养模块相连通;
优选地,所述水凝胶微球制备模块与所述生物膜共培养模块通过微流控通道相连通;
优选地,生物膜共培养模块的体积为100-10000mm3。
进一步地,所述水凝胶微球制备模块包括水相模块和油相模块;
所述水相模块包括水相进口,所述油相模块包括油相进口,所述水相进口、油相进口和微流控通道互相连通。
进一步地,所述生物膜共培养模块设有通孔,用于加入第二微生物和/或输出共培养后的包埋有第一微生物的水凝胶微球和第二微生物。
另外,本发明还提供了上述的检测生物膜形成的方法在检测益生菌影响病原菌生物膜形成中的应用。
本发明提供的检测生物膜形成的方法,采用微流控芯片制备出包埋有第一微生物的水凝胶微球,并将制备出的包埋有第一微生物的水凝胶微球输送至微流控芯片中接种有形成有生物膜结构的第二微生物的区域内,进行共培养,同时监测生物膜形态的变化。通过水凝胶微球包封技术将微生物包封于水凝胶微球中,并将包埋有微生物的微球与形成有生物膜的不同种微生物在生物膜共培养模块中混合进行共培养,能够有效的模拟自然环境中不同种微生物间复杂的相互作用导致生物膜变化的过程,为微生物类药物的开发提供有效手段。并且,在共培养结束后还能够将不同种微生物进行单独分离。利用微流控技术能够实现流速、培养条件、微生物密度等参数可控,以达到根据应用的微生物种类不同即时调整各参数的目的,使实验结果更准确。本发明提供的微流控芯片,包括用于制备包埋有第一微生物的水凝胶微球的水凝胶微球制备模块和用于共培养具有生物膜结构的第二微生物与所述包埋有第一微生物的水凝胶微球的生物膜共培养模块。通过该微流控芯片能够构建不同种微生物的共培养体系,并且设有的生物膜共培养模块有利于第二微生物形成稳定的生物膜结构。该芯片通过水凝胶微球制备模块与生物膜共培养模块相连通,能够将制备好的包埋有第一微生物的水凝胶微球输送至接种有第二微生物的共培养模块内,实现不同种微生物的共培养,同时,实时动态的对病原菌生物膜形成过程进行检测。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
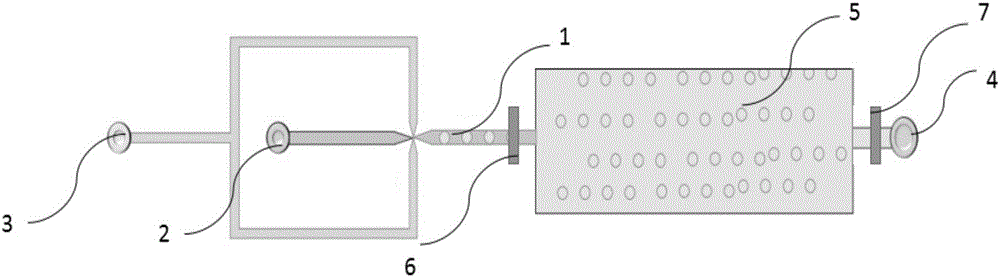
图1为本发明实施例1提供的微流控芯片的结构示意图;
图2为本发明实施例2提供的包埋有酿酒酵母菌的水凝胶微球的形态示意图;
图3为本发明实施例2提供的live/dead染色后大肠杆菌的生物膜形态及厚度的结果图(其中图3中a为live/dead染色存活的大肠杆菌的生物膜形态及厚度的结果图,b为live/dead染色死亡的大肠杆菌的生物膜形态及厚度的结果图);
图4为本发明实施例3提供的包埋有鼠李糖乳杆菌的水凝胶微球的形态示意图;
图5为本发明实施例3提供的live/dead染色后铜绿假单胞菌的生物膜形态及厚度的结果图(其中图5中a为live/dead染色后铜绿假单胞菌的生物膜的疏密程度的结果图,b为live/dead染色后铜绿假单胞菌的生物膜厚度的结果图)。
图标:1-微流控通道;2-水相进口;3-油相进口;4-通孔;5-生物膜共培养室;6-第一阀门;7-第二阀门。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
根据本发明的第一个方面,提供了一种检测生物膜形成的方法,包括以下步骤:
采用微流控芯片制备出包埋有第一微生物的水凝胶微球,并将制备出的包埋有第一微生物的水凝胶微球输送至微流控芯片中接种有第二微生物的区域内,进行共培养,同时监测生物膜形态的变化;其中,第二微生物形成有生物膜结构。
本发明提供的检测生物膜形成的方法,采用微流控芯片制备出包埋有第一微生物的水凝胶微球,并将制备出的包埋有第一微生物的水凝胶微球输送至微流控芯片中接种有形成有生物膜结构的第二微生物的区域内,进行共培养,同时监测生物膜形态的变化。通过水凝胶微球包封技术将微生物包封于水凝胶微球中,并将包埋有微生物的微球与形成有生物膜的不同种微生物在生物膜共培养模块中混合进行共培养,能够有效的模拟自然环境中不同种微生物间复杂的相互作用导致生物膜变化的过程,为微生物类药物的开发提供有效手段。并且,由于第一微生物以水凝胶微球的形式与第二微生物进行共培养,在共培养结束后还能够将不同种微生物进行单独分离。利用微流控技术能够实现流速、培养条件、微生物密度等参数可控,以达到根据应用的微生物种类不同即时调整各参数的目的,使实验结果更准确。
其中,第一微生物和第二微生物为不同种微生物,典型但非限制性的微生物例如为细菌、真菌、病毒、原生生物或显微藻类等。
在一个优选的实施方式中,第一微生物为益体微生物,第二微生物为病原微生物。选择益体微生物和病原微生物分别作为第一微生物和第二微生物,在共培养过程中能够实时监测益体微生物与病原微生物相互作用的影响和变化,为益体微生物类药物的开发提供有效手段。
在一个更优选的实施方式中,第一微生物为益生菌,第二微生物为病原菌。病原菌为了逃避不良环境的影响会形成生物膜,生物膜(biofilm)也称为生物被膜,是指附着于有生命或无生命物体表面被细菌胞外大分子包裹的有组织的细菌群体。生物膜细菌对抗生素和宿主免疫防御机制的抗性很强。益生菌可以干预病原菌生物膜的形成,然而其干预机制不明是阻碍该领域研究进展的主要原因。应用本发明提供的检测生物膜形成的方法,利用微流控芯片构建益生菌-病原菌共培养体系,有利于对益生菌与病原菌相互作用过程的研究。
在一个优选的实施方式中,第二微生物的接种密度为102-106cfu/ml,例如可以为,但不限于102cfu/ml、103cfu/ml、104cfu/ml、105cfu/ml或106cfu/ml。
在一个优选的实施方式中,包埋有第一微生物的水凝胶微球通过乳化内部凝胶化反应制备得到。
目前用注射器将海藻酸钠挤压滴入到钙离子溶液中形成凝胶微球是海藻酸钠包埋生物活性物质的主要方法。由于钙离子从液滴表面逐渐渗透到内部,因此该方法被称为外部凝胶化。内部凝胶化法是指将不溶钙盐(如碳酸钙)与海藻酸钠混合,然后在油相中形成稳定乳液,再加入油溶冰醋酸引发碳酸钙解离,释放钙离子,从液滴内部形成凝胶微球。该方法可以制备出粒径较小的凝胶微球,易于实现。
在一个优选的实施方式中,包埋有第一微生物的水凝胶微球的制备方法包括以下步骤:
在微流控芯片中将第一微生物混悬在水相中,水相与油相混合形成油包水微液滴,微液滴在凝胶引发剂的作用下引发内部凝胶化反应,形成所述包埋有第一微生物的水凝胶微球。
本发明提供的包埋有第一微生物的水凝胶微球上具有微孔,既不影响微生物的生物活性和相互作用,又能有效将微生物分离。
优选地,包埋有第一微生物的水凝胶微球的粒径为50-500μm,例如可以为,但不限于50μm、100μm、150μm、200μm、250μm、300μm、350μm、400μm、450μm或500μm。
优选地,水相为分散有难溶钙盐的高分子溶液。
典型的难溶钙盐为碳酸钙。
优选地,高分子溶液的浓度为0.1-5g/l;难溶钙盐在高分子溶液中的浓度为1-50g/l。
高分子溶液典型但非限定性的的浓度例如为0.1g/l、0.2g/l、0.5g/l、1g/l、2g/l、3g/l、4g/l或5g/l。
难溶钙盐在高分子溶液中的浓度例如为1g/l、5g/l、10g/l、15g/l、20g/l、25g/l、30g/l、35g/l、40g/l、45g/l或50g/l。
优选地,高分子为海藻酸钠、果胶、明胶、琼脂或透明质酸中的一种或几种。
优选地,微生物在水相中的浓度为104-109cfu/ml,优选107-108cfu/ml。
在一个优选的实施方式中,高分子溶液为天然高分子溶液。
应用天然高分子溶液作为水相,能够降低对微生物的外源刺激,减小实验误差,增加结果的准确性。
微生物在水相中的浓度典型但非限制性的例如为106cfu/ml、107cfu/ml或108cfu/ml。
优选地,油相包括液体石蜡、橄榄油或葡萄籽油中的一种或几种。
优选地,油相中含有表面活性剂。
优选地,表面活性剂的加入量为1-5%(v/v)。
此处v/v指表面活性剂的加入体积与油相体积之比,典型但非限制性的例如为1%、2%、3%、4%或5%。
优选地,表面活性剂为吐温80、吐温20或司盘80中的一种或几种。
优选地,在油相中加入0.01-0.5%(v/v)的凝胶引发剂。
此处v/v指凝胶引发剂的加入体积与油相体积之比,典型但非限制性的例如为0.01%、0.02%、0.05%、0.1%、0.2%、0.3%、0.4%或0.5%。
优选地,凝胶引发剂为冰醋酸。
通过油溶冰醋酸引发难溶钙盐解离,释放钙离子,从液滴内部形成凝胶微球。
优选地,水相与油相在微流控芯片中的流速为0.01-1ml/min,例如0.01ml/min、0.02ml/min、0.05ml/min、0.1ml/min、0.2ml/min、0.5ml/min、0.8ml/min或1ml/min。
微流控芯片中液体流速可以通过泵实现可控调节,通过控制流速等参数能够实现培养过程的可控。
在一个优选的实施方式中,接种有第二微生物的区域为生物膜共培养室,生物膜共培养室内通入有培养基。
优选地,将制备出的包埋有第一微生物的水凝胶微球输送至微流控芯片中接种有第二微生物的生物膜共培养室内共培养2-12h,例如可以为,但不限于2h、3h、4h、5h、6h、7h、8h、9h、10h、11h或12h。
在一个优选的实施方式中,生物膜带有荧光标记,根据荧光标记测定荧光值来实时监测生物膜的变化。
生物膜是一个复杂的微环境,包含有死活微生物细胞、多糖、蛋白和dna等多种结构,因此很难对生物膜的每一个部分进行完全的定量。通过应用荧光标记微生物,并利用荧光对细胞膜内微生物细胞的多少、死活来进行定量,利用细胞层的厚度间接反应生物膜的厚度和结构。应用此种方法对生物膜进行定量,具有准确、直观、操作简便等优点。
根据本发明的第二个方面,提供了一种微流控芯片,包括:水凝胶微球制备模块和生物膜共培养模块;
水凝胶微球制备模块用于制备包埋有第一微生物的水凝胶微球;
生物膜共培养模块用于共培养第二微生物与包埋有第一微生物的水凝胶微球;
其中,水凝胶微球制备模块与生物膜共培养模块相连通。
微流控芯片技术是把生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺度的芯片上,自动完成分析全过程。微流控芯片是实现微流控芯片技术的载体,微流控芯片是利用微米级流体通道来处理流体的器件。
本发明利用微流控芯片技术,通过水凝胶微球制备模块制备包埋有第一微生物的水凝胶微球,同时通过生物膜共培养模块培养第二微生物形成稳定的生物膜结构,通过液体的流动实现将制备出的包埋有第一微生物的水凝胶微球输送至接种有第二微生物的生物膜共培养模块内,实现在同一微流控芯片上共培养不同种微生物,进而检测不同种微生物相互作用的影响及变化。
其中,生物膜共培养模块为生物膜共培养室。
优选地,生物膜共培养模块的体积为100-10000mm3,例如可以为,但不限于100mm3、500mm3、1000mm3、2000mm3、3000mm3、4000mm3、5000mm3、6000mm3、7000mm3、8000mm3、9000mm3或10000mm3,优选为5000mm3。
在一个优选的实施方式中,水凝胶微球制备模块与生物膜共培养模块通过微流控通道相连通。流体在微流控的微通道中的行为与其在宏观尺度通道中不同,在微流控通道中的流体行为是微流控的重要特征和标志,具有方便、独特的特点。
在一个优选的实施方式中,水凝胶微球制备模块包括水相模块和油相模块;
其中,水相模块包括水相进口,油相模块包括油相进口,水相进口、油相进口和微流控通道互相连通。
当两相不互溶的液体(油和水)在微流控通道中流动时,在液/液界面张力和剪切力的作用下,其中一相流体会形成高度均一的间断流,即液滴。微流控能够以非常高的通量制备高度单分散性的液滴乳液,即包埋有第一微生物的水凝胶微球。
在一个优选的实施方式中,生物膜共培养模块设有通孔,用于加入第二微生物和/或输出共培养后的包埋有第一微生物的水凝胶微球和第二微生物。
生物膜共培养模块包括两个与外部相连通的通道,其中一个为微流控通道,另一个为通孔。设置至少两个通道能够保证包埋有第一微生物的水凝胶微球和第二微生物能够实现根据检测需要分别且可不同时地加入到生物膜共培养模块中,例如,通过微流控通道先将包埋有第一微生物的水凝胶微球加入到生物膜共培养模块中,培养一段时间后,再通过通孔加入第二微生物,进行共培养;或者通过通孔先将第二微生物加入到生物膜共培养模块中,培养一段时间后,再通过微流控通道加入包埋有第一微生物的水凝胶微球,进行共培养;或者通过微流控通道将包埋有第一微生物的水凝胶微球加入到生物膜共培养模块中,同时通过通孔将第二微生物加入到生物膜共培养模块中,进行共培养。根据不同微生物种类或实验的需要调整不同的加入时间,在避免污染的基础上,能够使结果更加准确,同时,适用多种微生物或多种实验,节约成本。
在一个优选的实施方式中,通过通孔先将第二微生物加入到生物膜共培养模块中,预先培养12-72h后,形成较稳定的生物膜结构,再通过微流控通道加入包埋有第一微生物的水凝胶微球,进行共培养。
在一个优选的实施方式中,微流控通道上设有第一阀门,通孔上设有第二阀门。通过阀门控制通道的开启与关闭,便于控制,可操作性强。
典型但非限制性的检测生物膜形成的实施方式包括如下步骤:
(a)制作pdms微流控芯片,使其满足:在水凝胶微球制备模块内,具有水相模块和油相模块,水相和油相在其中的流速为0.01-1.0ml/min;油相为液体石蜡、橄榄油、葡萄籽油等中的一种;表面活性剂为吐温80、吐温20、司盘80等中的一种,加入量为1-5%(v/v);水相为0.1%-5%海藻酸钠、果胶、明胶、琼脂、透明质酸等水溶液中的一种,难溶钙盐为纳米级碳酸钙粉末,所加入的纳米级碳酸钙粉末在水相中的浓度为1-50g/l;通过引入引发剂引发内部凝胶化反应,使水相与油相形成油包水液滴,引发剂在油相中的加入量为0.01-0.5%(v/v);生物膜共培养模块的体积为100-10000mm3;水凝胶微球制备模块与生物膜共培养模块通过微流控通道相连通,其中,微流控通道上还设有第一阀门。
(b)按106-108cfu/ml的接种密度,将益生菌混悬在0.1-5.0g/l的水相中,制备包埋益生菌的水凝胶微球,粒径范围为50-500μm。
(c)按102-106cfu/ml的接种密度,将病原菌接种于生物膜共培养模块中,静置培养一段时间,使其初步形成较稳定的生物膜结构。
(d)打开第一阀门,通过流体操控,将包埋有益生菌的水凝胶微球通过微流控通道输送至生物膜共培养模块中,同时向生物膜共培养模块中通入0.1-10ml培养基,培养2-12h后结束培养。利用荧光标记的方式,在激光共聚焦显微镜下实时动态观察病原菌生物膜形态的变化。
需要说明的是尽管上述步骤是以(a)、(b)、(c)和(d)顺序描述了本发明制备方法的操作,但是,这并非要求或者暗示必须按照该特定顺序来执行这些操作。步骤(a)、(b)、(c)和(d)的制备可以同时或者任意先后执行。
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
实施例1
如图1所示,本实施例提供了一种pdms微流控芯片,包括:水凝胶微球制备模块和生物膜共培养模块,上述水凝胶微球制备模块与生物膜共培养模块通过微流控通道1相连通。微流控通道1上还设有第一阀门6。
其中,水凝胶微球制备模块包括水相模块和油相模块;水相模块包括水相进口2,油相模块包括油相进口3,水相进口2、油相进口3和微流控通道1互相连通。生物膜共培养模块为生物膜共培养室5,生物膜共培养室5的体积为5000mm3。在生物膜共培养室5上还设有通孔4,通孔4上设有第二阀门7。
实施例2
本实施例提供了一种检测生物膜形成的方法,是基于本发明实施例1提供的微流控芯片实现的,具体步骤包括:
(a)应用微流控芯片中的水凝胶微球制备模块制备包埋有酿酒酵母菌的水凝胶微球。
水相模块中的水相包括分散有纳米级碳酸钙粉末和酿酒酵母菌的2%海藻酸钠溶液,其中,2%海藻酸钠溶液的浓度为2g/l,纳米级碳酸钙粉末在2%海藻酸钠溶液中的浓度为25g/l,酿酒酵母菌的接种密度为107cfu/ml。油相模块中的油相包括混有吐温80和冰醋酸的液体石蜡,其中,吐温80的加入量为2%(v/v),冰醋酸的加入量为0.25%(v/v)。
水相和油相的流速为0.5ml/min,在冰醋酸的作用下引发内部凝胶化反应,在微流控通道1中形成包埋有酿酒酵母菌的水凝胶微球。结果如图2所示,从图2中可以看出背景干净清晰,微球大小较为均一,球形度良好,说明该种包埋方法泄露率低,参数可控,重复性高。
(b)按104cfu/ml的接种密度在培养基中接种大肠杆菌,通过第二阀门7将大肠杆菌接种于生物膜共培养室5中,静置培养一段时间,使其初步形成较稳定的生物膜结构。
(c)通过流体操控,打开第一阀门6,将包埋有酿酒酵母菌的水凝胶微球通过微流控通道1输送至生物膜共培养室5中,通入5ml培养基,与大肠杆菌共培养8h后结束培养。
(d)利用荧光标记的方式,在激光共聚焦显微镜下实时动态观察大肠杆菌生物膜形态的变化。结果如图3所示,从图3中可以看出大肠杆菌在共培养模块中形成了稳定的生物膜结构,并可以利用三维重构的手段,对生物膜的厚度进行相对定量,说明本发明所述生物膜检测方法简单易行,结果可靠。
实施例3
本实施例提供了一种检测生物膜形成的方法,是基于本发明实施例1提供的微流控芯片实现的,具体步骤包括:
(a)应用微流控芯片中的水凝胶微球制备模块制备包埋有鼠李糖乳杆菌的水凝胶微球。
水相模块中的水相包括分散有纳米级碳酸钙粉末和鼠李糖乳杆菌的明胶溶液,其中,明胶溶液的浓度为0.1g/l,纳米级碳酸钙粉末在明胶溶液中的浓度为50g/l,鼠李糖乳杆菌的接种密度为106cfu/ml。油相模块中的油相包括混有吐温20和冰醋酸的橄榄油,其中,吐温20的加入量为5%(v/v),冰醋酸的加入量为0.01%(v/v)。
水相和油相的流速为0.01ml/min,在冰醋酸的作用下引发内部凝胶化反应,在微流控通道1中形成包埋有鼠李糖乳杆菌的水凝胶微球。结果如图4所示,从图4中可以看出微球球形度良好,粒径均一,说明该方法稳定性良好。
(b)按106cfu/ml的接种密度在培养基中接种铜绿假单胞菌,通过第二阀门7将铜绿假单胞菌接种于生物膜共培养室5中,静置培养一段时间,使其初步形成较稳定的生物膜结构。
(c)通过流体操控,打开第一阀门6,将包埋有鼠李糖乳杆菌的水凝胶微球通过微流控通道1输送至生物膜共培养室5中,通入0.1ml培养基,与铜绿假单胞菌共培养12h后结束培养。
(d)利用荧光标记的方式,在激光共聚焦显微镜下实时动态观察铜绿假单胞菌生物膜形态的变化。结果如图5所示,从图5中可以看出铜绿假单胞菌生物膜稀疏,结构松散,说明鼠李糖乳杆菌作为一种益生菌对具有致病性的铜绿假单胞菌生物膜结构有一定的干预作用。
综上所述,本发明提供的检测生物膜形成的方法,通过水凝胶微球包封技术将微生物包封于水凝胶微球中,并将包埋有微生物的微球与形成有生物膜的不同种微生物在生物膜共培养模块中混合进行共培养,能够有效的模拟自然环境中不同种微生物间复杂的相互作用导致生物膜变化的过程,为微生物类药物的开发提供有效手段。同时,利用微流控技术能够实现流速、培养条件、微生物密度等参数可控,以达到根据应用的微生物种类不同即时调整各参数的目的,使实验结果更准确。本发明提供的微流控芯片,能够构建不同种微生物的共培养体系,并且设有的生物膜共培养模块有利于第二微生物形成稳定的生物膜结构。该芯片通过水凝胶微球制备模块与生物膜共培养模块相连通,能够将制备好的包埋有第一微生物的水凝胶微球输送至接种有第二微生物的共培养模块内,实现不同种微生物的共培养,同时,实时动态的对病原菌生物膜形成过程进行检测。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!