牡丹PsMYB12转录因子及其编码基因与应用的制作方法
本发明涉及生物技术领域,尤其涉及牡丹psmyb12转录因子及其编码基因与应用。
背景技术:
牡丹(paeoniasuffruticosaandrews)为芍药科(paeoniaceae)、芍药属(paeonia)牡丹组(sec.moutandc)落叶亚灌木,因其花雍容华贵的姿态和丰富的色彩而成为中国的传统名花,在中国乃至世界花卉发展史上占有非常重要的地位。按传统的色系来划分,牡丹花色大致可分为红、粉、紫、白、黄、黑、绿、蓝、复色9大色系。牡丹花瓣基部的色斑是其重要的特色之一,除了极具观赏价值外,色斑已成为牡丹品种群分类和进化研究的重要依据。值得一提的是其野生种中的紫斑牡丹(p.rockii)和部分滇牡丹(p.delayvaii),以及相当一部分栽培品种(中原、日本和欧美品种群)的花瓣基部带有明显的色斑。西北牡丹品种斑色更加丰富,已见到黑、黑紫、棕红、紫红色等不同的色斑。
关于牡丹花斑呈色的化学基础研究的较深入。已有研究发现,西北牡丹多数品种花瓣的非斑部分花青素苷由pn3g5g、cy3g5g和cy3g组成,pn3g含量很低,几乎不含pg型色素;cy型色素在花瓣基部大量合成,推断cy的糖苷化、甲基化、高含量及其在花瓣基部生成,是引起西北品种群具有紫斑这一特征的重要原因。zhangetal.(2007)(zhangjj,wangls,shuqy,liuza,lich,zhangj,weixl,tiandk(2007)comparisonofanthocyaninsinnon-blotchesandblotchesofthepetalsofxibeitreepeony.scihortic114,104-111.)利用高效液相色谱技术分析了35个西北牡丹品种非斑与斑部的花青苷组成,斑与非斑中的花青苷种类相同,均检测出6种花青苷,分别是pn3g5g、pn3g、cy3g5g、cy3g、pg3g5g和pg3g;但色素的含量有较大差别,斑中的色素含量明显高于非斑;斑中以cy型糖苷为主要成分,以3g型色素为主;非斑中以pn型糖苷为主要成分,以3g5g型色素为主。cy型色素在牡丹花瓣基部大量合成,导致了斑色的形成。此外,赵娜和袁涛(2013)(赵娜,袁涛.西北牡丹品种瓣基色斑形态的初步研究(2013)中国农学通报29:192-197)对西北牡丹品种花瓣基部色斑形态进行了初步研究,包括色斑的颜色、位置、大小和形状等方面,为研究牡丹斑色形成的机制提供了形态学依据。
牡丹斑色形成的分子机制研究仅有少量报道,对牡丹带紫斑品种‘jinrong’转录组序列分析,获得了1573个斑与非斑中差异表达的基因,紫色斑中有933个上调表达基因,640个下调表达的基因,对其中花青素合成途径中的酶基因的在斑与非斑中表达进行荧光定量分析,结果表明pschs、psf3'h、psdfr和psans在斑中的表达显著高于非斑,推测这四个基因共同高表达导致斑色的形成。此外,对紫斑牡丹和‘凤丹’及其杂交种f1代花瓣转录组分析,推测chs、dfr、ans和gst可能在紫斑牡丹斑色形成中具有重要作用,2个r2r3-myb通过调控chs、ans和gst调控斑色的形成,但均缺乏试验证据。对斑色形成的基因尚未开展功能鉴定和研究,尤其是调控斑色形成的调控因子myb家族基因未见报道。
根据重复myb结构域的数量将其家族分为4类即1r-myb、r2r3-myb、3r-myb和4r-myb,其中r2r3-myb转录因子是植物中最大的转录因子家族之一,被证实广泛参与植物次生代谢、激素和环境因子的应答并对植物的生长发育及抗逆应答等具有重要调节作用;也是目前发现的参与调控花青苷合成及植物色斑形成相关的主要的调控因子。
myb转录因子对花青素合成相关酶基因的调控具有组织特异性;一个myb调控因子可以调控多个花青素合成途径中的酶基因,而某个花青素合成途径中的酶基因也可能受多个myb调控因子的调控;myb类调控因子对花青素合成多数是正调控,偶尔也有负调控;既可以和bhlh与wdr类转录因子共同作用形成mbw复合体来调控基因的表达,也可以单独进行调控。
技术实现要素:
为了弥补以上领域的不足,本发明提供了牡丹myb转录因子,名称为psmyb12,来源于牡丹品种‘青海湖银波’(paeoniasuffruticosa‘qinghaihuyinbo’)。
本发明所提供的牡丹转录因子psmyb12,是如下a)或b)的蛋白质:
a)由序列表中序列1所示的氨基酸序列组成的蛋白质;
b)将序列表中序列1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与牡丹色斑形成和/或花青苷合成相关的由a)衍生的蛋白质。
所述蛋白的编码基因也属于本发明的保护范围。
所述编码基因为如下1)或2)或3)或4)所示:
1)其核苷酸序列是序列表中序列2所示dna分子;
2)其核苷酸序列是序列表中序列3所示dna分子;
3)在严格条件下与1)或2)限定的dna分子杂交的dna分子;
4)与1)或2)或3)限定的dna分子具有90%以上的同源性的dna分子。
含有所述编码基因的表达盒、重组表达载体、转基因细胞系或重组菌也属于本发明的保护范围。
本发明还提供了一种制备转基因植物的方法,包括如下步骤:将所述的编码基因导入出发植物中,得到转基因植物;与出发植物相比,转基因植物的花瓣颜色改变和/或花瓣中类黄酮合成途径相关基因的表达量发生改变。
所述编码基因是通过重组表达载体导入的,所述重组表达载体是将所述编码基因插入出发载体pcxsn(t-载体)的多克隆位点得到的;
所述出发植物为对照烟草;所述转基因植物为转基因烟草。
所述转基因烟草与对照烟草相比,花瓣颜色变深;所述转基因烟草与对照烟草相比,花瓣中类黄酮合成途径相关基因ntchs和/或ntdfr和/或ntans的表达量提高。
鉴定牡丹类黄酮合成途径相关基因的vigs沉默体系也属于本发明的保护范围。
鉴定牡丹类黄酮合成途径相关基因的vigs沉默体系,包含:在vigs沉默载体上插入目的基因得到的重组载体;所述目的基因为序列表中序列2所示核苷酸序列和/或序列表中序列3所示核苷酸序列。
所述vigs沉默载体为烟草脆裂病毒trv2载体;所述牡丹类黄酮合成途径相关基因为pschs和/或pschi和/或psf3h和/或psf3'h和/或psfls和/或psans和/或pswd40和/或bhlh。
所述蛋白或所述编码基因在调控花青苷合成中的应用也属于本发明的保护范围。
本发明从紫斑牡丹品种‘青海湖银波’花瓣转录组中得到了一个myb家族基因的一部分序列,根据race技术克隆得到了全长命名为psmyb12,并通过荧光定量分析,此基因在牡丹斑中特异表达,在s2期表达量最高。将其构建真核表达载体,转化烟草,可以激活烟草中ntchs、ntdfr和ntans表达量,并提高烟草花瓣中花青苷含量,转基因烟草花瓣出现花色素不均匀分布。利用病毒介导的基因沉默psmyb12,可以降低类黄酮合成途径中关键酶基因包括pschs、pschi和psans等。由此证明该基因在牡丹花斑的形成中具有重要的作用。
牡丹花斑中特异表达的psmyb12属于r2r3-myb家族基因,其orf长834bp,推测编码278aa,与已知物种氨基酸序列同源性不是很高,最高达56%,聚类分析显示其属于s5亚家族,可能调控原花青素的合成。通过vigs沉默和异源过量转化分析,结果表明其可以调控花青苷合成途径中的关键酶基因表达。推测其在牡丹花斑中花青苷的合成和积累及色斑的形成中具有重要作用。本发明是首次克隆斑中特异表达基因并验证其功能,为斑色形成的分子机制奠定了基础,为深入解析牡丹花类黄酮合成与调控提供了技术依据和思路。
附图说明
图1为牡丹品种‘青海湖银波’花朵开放进程及斑着色情况。
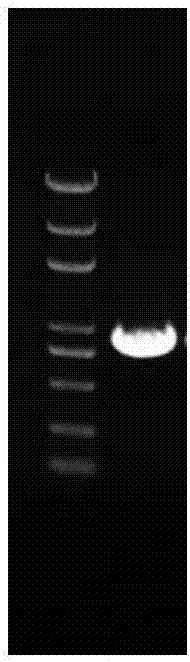
图2为orf扩增电泳检测图,左为dnamarker,右为目标基因orf-834bp。
图3为psmyb12同源氨基酸序列比对(下划线表示r2r3结构域)。
图4为psmyb12与公共数据库中其他物种同源序列聚类分析。
图5为psmyb12在‘青海湖银波’斑发育不同时期的表达情况。
图6为vigs沉默psmyb12的花瓣前后斑中类黄酮合成相关基因表达量分析;*为p<0.05;**为p<0.01。
图7为农杆菌介导的psmyb12基因转化烟草过程,其中a:共培养过程;b:诱导分化过程;c:分化六周丛芽;d:诱导生根过程。
图8为psmyb12转化烟草阳性植株的鉴定。lane1-6:转目的基因烟草,wt:野生型对照。
图9为转基因阳性株系叶和花中psmyb12的表达量分析结果。
图10为转基因和对照烟草花表型。ck为对照,no.3、no.5、no.7为转基因株系。
图11为转基因烟草和对照花瓣中类黄酮合成关键基因的表达。
具体实施方式
所用牡丹品种‘青海湖银波’(paeoniasuffruticosa‘qinghaihuyinbo’)来自中国科学院植物研究所北京植物园资源圃(记载过该牡丹品种‘青海湖银波’(p.suffruticosa‘qinghaihuyinbo’)的非专利文献是:zhangjj,wangls,shuqy,liuza,lich,zhangj,weixl,tiandk.2007.comparisonofanthocyaninsinnon-blotchesandblotchesofthepetalsofxibeitreepeony.scihortic,114:104-111))。不同发育时期的花瓣(s1-s4)。首先根据花瓣着色过程和花朵开放进程,将其分为4个时期(s1-s4)(图1),即s1期,整个花瓣呈黄绿色,此时斑没有出现;s2期,有浅红色桃形斑出现,非斑处的花瓣依然黄绿色;s3期,斑颜色变深呈紫红色,非斑处的花瓣变为白色;s4期,斑颜色依旧紫红色,形状呈纺锤形,非斑处的花瓣仍为白色。
本研究所用烟草nc89(nicotianatabacumcv.nc89)种子(记载过该烟草nc89(nicotianatabacumcv.nc89)的非专利文献是:duh,wuj,jikx,zengqy,bhuiyadmw,sus,shuqy,renhx,liuza,wangls.2015.methylationmediatedbyananthocyanino-methyltransferase,isinvolvedinpurpleflowercolorationinpaeonia.jexpbot66(21):6563-77),来自实验室保存。
实施例1、牡丹psmyb12基因的克隆
一、基因克隆
利用紫斑牡丹品种‘青海湖银波’s2期花瓣为材料,进行基因克隆。
(1)植物总rna提取
参照天根公司rnapreppureplantkit的产品说明书提取植物材料总rna,具体方法如下:
1)取50-100mgs2期的花瓣,在液氮中迅速充分研磨成粉末后,立刻倒入1.5ml的ep管中,加入500μl的sl(使用前加入5%巯基乙醇),立即涡旋剧烈振荡混匀;
2)12,000rpm离心2min;
3)将上清液移入收集管中的过滤柱cs上,12,000rpm离心2min,小心吸取收集管中的上清液至新的无rnase的1.5mlep管中,吸头尽量避免接触收集管中的细胞碎片沉淀;
4)缓慢加入0.4倍上清体积的无水乙醇,混匀(此时可能会出现沉淀),将得到的溶液和沉淀一起转入吸附柱cr3中,12,000rpm离心15s,倒掉收集管中的废液,将吸附柱cr3放到收集管中;
5)向吸附柱cr3中加入350μl去蛋白液rw1,12000rpm离心15s,倒掉收集管中的废液,将吸附柱cr3会放到收集管中;
6)dnasei工作液配置:取10μldnasei储备液放入新的无rnase的ep管中,加入70μlrdd溶液,轻柔混匀;
7)向吸附柱cr3中加入80μl的dnasei工作液,室温放置15min;
8)向吸附柱cr3中加入350μl的去蛋白液rw1,12000rpm离心15s,倒掉收集管中的废液,将吸附柱cr3放到收集管中;
9)向吸附柱cr3中加入500μl的漂洗液rw(使用前加入乙醇),12,000rpm离心15s,倒掉收集管中的废液,将吸附柱cr3放到收集管中;
10)重复步骤9;
11)12,000rpm离心2min,将吸附柱cr3放到一个新的无rnase的1.5ml的ep管中,向吸附膜中间部位悬空滴加30-50μl灭菌的depc-h2o,室温放置2min,12,000rpm离心1min,得到rna溶液;
12)琼脂糖电泳检测rna的质量(7-15kb的带为mrna和hnrna,5kb的带为28srrna,2kb的带为18srrna,0.1-0.3kb的带为5srrna。条带不明显表示rna发生了降解)。
13)rna最终浓度通过nanodrop2000(thermo)分光光度计测定,-70℃保存备用。
(2)反转录
反转录参照试剂盒说明书进行(smarterrace5′/3′kit,takara)。反转录体系和程序见表1、表2和表3。
表1反转录体系i
表2反转录体系ii
1)将反转录体系ii在72℃条件下反应3min后在42℃条件下反应2min。冷却后,简短离心使反应体系集中在管底。
表3反转录体系iii
2)将体系i、ii与体系iii混合,置于42℃条件下反应90min,后置于70℃条件下反应10min。反应完成后,加入tricine-edtabuffer90μl,置于-20℃保存备用。
3)获得基因3'和5'端序列后,通过高保真takaralataq聚合酶分别从花瓣斑和非斑中提取的rna反转录得到的cdna中扩增得到orf。扩增orf的引物如下:psmyb12f(forwardprimer(5'-3')):atgggaagggctccttgttgttcaaa;psmyb12r:ataagtgatatctactgctgctgctgctgc。pcr反应体系和程序见表4-1、表4-2和表5。
表4-1pcr反应体系i
表4-2pcr反应体系ii
表5pcr反应程序
二、目标dna条带回收与连接
(1)条带的回收
扩增后的目标条使用easypurequickgelextractionkit(全式金)回收,回收方法参照试剂盒说明书进行。具体方法如下:
1)切取琼脂糖凝胶中的目的dna条带,放入干净的1.5ml的离心管中,称取凝胶重量,如凝胶重100mg,可视为100μl,以此类推。
2)加入3倍体积的gsb凝胶溶液,置于55℃水浴中,使凝胶完全溶解,融化后可加入1倍体积的异丙醇;
3)待融化的凝胶降至室温,放入离心柱中,室温静置1min,10,000×g离心1min,弃去流出液;
4)加入650μlwb溶液,10,000×g离心1min,弃去流出液;
5)10,000×g离心2min,去除残留的wb溶液;
6)将吸附柱置于新的1.5ml离心管中,开盖静置1min,使残留的乙醇挥发干净,向柱的中央加入30μleb溶液(65℃预热),室温静置1min;
7)10,000×g离心1min洗脱dna,电泳检测回收结果如图2所示,放入-20℃冰箱备用
(2)目标dna条带的连接与转化
目标条带的连接转化参照厂家说明书,具体方法如下:
1)离心管中加入4.0μl回收产物,1.0μlpeasy-t3cloningvector(购自全式金生物技术有限公司),室温(20℃-37℃)反应5min,反应结束后,将离心管置于冰上。
2)将连接产物加入到含有50μltransl-t1大肠杆菌感受态细胞(购自全式金生物技术有限公司)中(在感受态细胞刚刚解冻时加入连接产物),轻弹混匀,冰浴30min。
3)42℃热激30s,立即置于冰上2min。
4)加300μl平衡至室温的lb培养基,200rpm,37℃孵育1h。
5)将300μl菌液均匀地涂于准备好的抗性培养基上,37℃过夜培养。
6)挑取白色单克隆菌落至400μl添加卡那霉素(kan)0.1mg/ml的lb培养基中,200rpm,37℃孵育2h。
lb培养基配方:
每1,000ml体系中,蛋白胨10g、酵母提取物5g、氯化钠10g,ph为7.0。若为固体培养基,再加入15g琼脂粉,高温高压灭菌即可。
三、pcr法鉴定阳性重组子及测序
取2μl菌液作为pcr反应体系的模板,用m13正向引物和反向引物(m13f:5'tgtaaaacgacggccagt3';m13r:5'caggaaacagctatgacc3')鉴定重组子,反应体系和程序分别见表6和表7。
表6鉴定重组子的pcr反应体系如下:
表7鉴定重组子的pcr反应程序
产物用1.0%琼脂糖电泳100v检测,eb染色。扩增后的目标条带进行切胶后使用easypurequickgelextractionkit(北京全式金生物技术有限公司)回收,取4μl回收产物,1μlpeasy-t3载体,25℃连接15min。连接完成后转化筛选阳性克隆,经pcr鉴定后用于测序。序列的准确性由10个独立的peasy-t3克隆的测序数据验证,其中5个以上克隆的测序数据一致即认为代表着正确的序列信息。
结果:获得的基因全长的cdna为1081bp,如序列表中序列2所示;其中,序列表中序列2自5’末端第1位到第834位为开放阅读框,开放阅读框部分为834bp,如序列表中序列3所示;其编码序列表中序列1所示的蛋白,序列1由278个氨基酸序列组成。将该基因命名为psmyb12,将其编码的蛋白命名为psmyb12。
利用网上在线软件(https://blast.ncbi.nlm.nih.gov/)将其氨基酸序列进行blastp分析,结果表明,其与已知物种相似性在56%以下,具体与野草莓(fragariavesca)(np_001295449)相似性达到56%,与可可(theobromacacao)tt2likemyb相似性为55%,与葡萄(vitisvinifera)mybpa1(np_001268160)相似性达到52%等。与已知物种包括拟南芥(arabidopsisthaliana)atmyb12(dq224277)、葡萄(vitisvinifera)vvmybf1(act88298)、苹果(malusdomestica)mdmyb22(aaz20438)、杂种百合(liliumhybrid)ljmyb12(baf74782)和非洲菊(gerberahybrid)ghmyb1(cad87007)同源氨基酸序列进行多重比较,它们均含有r2\r3domain(图3)。
将所克隆得到的牡丹psmyb12氨基酸序列与已知物种克隆得到的myb第5-7亚家族序列进行分析并构建系统进化树(图4),结果显示,这三个家族成员各自聚为一支,s7亚家族聚为一支,调控黄酮和黄酮醇的合成,表明了其同一家族成员之间的同源关系,s5亚家族成员分散的聚为三支,牡丹的psmyb12与葡萄vvmbpa1(nm_001281231)聚为一支,属于s5亚家族,推测调控原花青素(proanthocyanidins)的合成。
实施例2、psmyb12基因在牡丹花瓣发育不同阶段和不同组织中的表达水平比较
将紫斑牡丹品种‘青海湖银波’从无色期到盛开期过程分为4个阶段(图1),前两个时期每两周取样1次,后两个时期每一周取样一次。每次取3株不同植株的花瓣,作为3个独立的实验重复。将所有样品进行总rna的提取,并反转录成cdna,作为荧光定量pcr的模板。
一、rna提取
rna提取方法同上述实施例1。
二、反转录
反转录参照天根公司fastquantrtkit的产品说明书进行反转录,方法如下:
由于从多时期样品中提取的rna浓度不一致且差别较大,为使产物cdna浓度保持一致,预设最终反转量为800ng,建立20μl反应体系。
方法如下:
1)模板及试剂解冻
将模板rna在冰上解冻,5×gdnabuffer、fq-rtprimermix、10×fastrtbuffer、rnase-freeddh2o在室温(15-25℃)解冻,解冻后迅速置于冰上。使用前将每种溶液漩涡震荡混匀,简短离心以收集残留在管壁的液体。
2)准备基因组dna去除体系
按照表8的基因组dna去除体系在冰上配置混合液,彻底混匀。简短离心,并置于42℃。孵育3min。然后置于冰上放置。
表8gdna去除反应体系
3)反转录体系
按照表9的反转录反应体系配制混合液。
表9反转录反应体系
4)将反转录体系混合液加到gdna去除步骤的反应体系中,充分混匀。42℃孵育15min。
5)95℃孵育3min后置于冰上,cdna可用于后续实验,或低温保存。
三、荧光定量pcr
荧光定量分析使用superrealpremixplus(sybrgreen)试剂盒(购自天根生化科技(北京)有限公司)。通过ltsteponeplus(美国lifetechnologies公司)qpcr仪进行。mrna转录本的相对表达分析以牡丹pstublin基因(ef608942)为内参基因,分别进行三次技术重复和生物学重复。引物序列见表10。
表10牡丹psmyb12基因克隆和荧光定量分析所用引物列表
四、结果:
从‘青海湖银波’花瓣斑中得到了一个特异表达的myb家族基因命名为psmyb12,设计引物,对其在花瓣斑与非斑不同时期进行荧光定量分析,发现其在斑中特异表达,在s2期出现峰值,相对表达量达到1101±43.4(图5)。推测此psmyb12可能是调控斑色形成的重要调控基因。
实施例3、vigs沉默psmyb12
烟草脆裂病毒(trv)是由trv1和trv2两链组成的病毒。本发明所用vigs载体来自烟草脆裂病毒载体(tobaccorattlevirus,trv),trv1/trv2为中国农业大学观赏植物采后和逆境生理实验室马男教授馈赠(记载过该载体的非专利文献是:tianj,peihx,zhangs,chenjw,chenw,yangry,mengyl,youj,gaojp,man.2014.trv-gfp:amodifiedtobaccorattlevirusvectorforefficientandvisualizableanalysisofgenefunction.jexpbot,65:311-322.),其带有卡那筛选标记和35s启动子,ptrv2带有bamhi和xhoi等多克隆位点。改造的病毒用于进行相关研究。trv1在植物体内主要起到病毒运转的作用,trv2为表达载体,含有多个克隆位点。
将psmyb12克隆约200bp片段并添加bamhi和xhoi双酶切位点分别替换trv2载体上多克隆位点部分,构建trv2-psmyb12植物表达载体。转化大肠杆菌dh5α及农杆菌gv3101获得阳性克隆,并经过测序验证正确序列,证明构建成功。将花朵(s3期)从植株剪下用于抽真空侵染,侵染后4天,取样,将斑与非斑分开,用于荧光定量分析。具体方法如下:
(1)vigs表达载体的构建
根据目的基因psmyb12的cdna序列设计引物,克隆目的基因片段并在目的基因两端添加酶切位点bamhi和xhoi,引物myb12f/r序列见表10。
pcr扩增反应体系和程序与实施例中克隆完整orf相同。扩增得到的目的条带切胶回收后连接peasy-t3载体(购自全式金生物技术有限公司),转化transl-t1大肠杆菌感受态细胞(trans1-t1phageresistantchemicallycompetentcell,购自全式金生物技术有限公司),涂含amp(0.1mg/ml)的lb抗性平板,37℃条件下过夜培养,挑取白色单菌落,摇菌2h后进行pcr检测,并提质粒进行测序验证,验证序列正确后,用限制性内切酶bamhi和xhoi双酶切并回收。同时将vigs表达载体trv2进行bamhi和xhoi双酶切并回收,再将目的片段与线性载体通过t4dna连接酶连接,构建vigs表达载体。酶切连接体系和反应条件同表12,13。连接产物转化dh5α大肠杆菌细胞(购自康为世纪生物科技有限公司)后测序验证正确的表达载体质粒,用冻融法转化gv3101农杆菌感受态细胞(农杆菌感受态细胞购自北京博迈德基因技术有限公司),获得阳性单克隆农杆菌。菌液加入50%甘油混匀后于-80℃保存备用。
(2)抽气法侵染牡丹花蕾(参考tianj,peihx,zhangs,chenjw,chenw,yangry,mengyl,youj,gaojp,man(2014)trv-gfp:amodifiedtobaccorattlevirusvectorforefficientandvisualizableanalysisofgenefunction.jexpbot65,311-322.),具体方法为:
1)将保存的阳性单克隆菌液活化,按1:100的比例取活化菌液加入含kan(0.1mg/ml)和rif(0.05mg/ml)的lb液体培养基中,28℃,180rpm振荡培养至od600=1.0;
2)6,000rpm,室温离心5min,收集菌体,弃上清;
3)配置侵染液(10mmmgcl2,20mm乙酰丁香酮,10mmmes,ph5.6)重悬菌体,用枪吹吸菌体直至其均匀悬浮在侵染液中;
4)用侵染液调节使重悬菌液的od600=1.0,且ptrv2-myb12、ptrv1和ptrv2菌液的od600值相同;
5)将ptrv2-myb12和ptrv1,ptrv2和ptrv1菌液按体积比1﹕1分别混合,暗处静置4h;
6)牡丹花朵带5cm花柄剪下,随机分布于不同处理,浸没在菌液中,抽真空至0.7atm(大气压),负压处理10min,缓慢放气20min。每个处理三朵花即重复3次;
7)将抽吸后的花瓣用去离子水漂洗,去除多余菌液;
8)花柄没于去离子水中,8℃,湿度60%左右,暗培养1d;之后转移至23℃,湿度60%左右,培养3天;
9)侵染4天后采样,将花瓣的斑与非斑分开,作为rna提取检测样本,液氮速冻存于-80℃。之后检测基因的表达水平相对于空白对照的变化。psmyb12荧光定量引物参照表10中的引物psmyb12-qf/r,其他引物参照表11。反应体系和程序同实施例2。
表11vigs沉默psmyb12荧光定量分析所用引物列表
结果表明:利用vigs技术瞬时沉默psmyb12后,其表达水平降低了54.0%,pschs表达量降低了82.7%,pschi、psf3h、psf3'h、psfls、psans和pswd40分别降低了24.0%、39.4%、30.5%、48.4%、31.1%和28.6%;psdfr降低的最少,为2.1%。bhlh的表达量不仅没有降低,而且升高了8.8%。统计分析显示pschs、psfls和psans的在斑中表达量下调,且差异极显著;pschi和psf3h下调表达,差异显著(图6)。
实施例3、真核过量表达载体构建及转化烟草验证psmyb12基因功能
一、真核过量表达载体构建
真核过量表达载体为psn1301(公众可从中国科学院植物研究所获得,记载过该真核过量表达载体psn1301的非专利文献是:刘清、唐蛟、曾娟、黄明亮、童建华、黄志刚.2014.拟南芥atvq29基因的克隆与植物表达载体构建.现代生物医学进展,14(35):6814-6817.),携带有烟草花叶病毒启动子camv35s、潮霉素抗性标记基因、多克隆位点。根据目的基因序列设计引物,克隆目的基因片段orf并分别在5′/3′端添加xbai和kpni酶切位点,将空载体和dna片段分别进行双酶切,酶切反应体系见表12。扩增目的基因片段orf的引物如下:psmyb12f(forwardprimer(5'-3')):atgggaagggctccttgttgttcaaa;psmyb12r(reverseprimer(5'-3')):ataagtgatatctactgctgctgctgctgc。
表12双酶切体系组成和用量
反应条件为37℃,2-4h。
双酶切产物的回收同上述实施例1,在t4dna连接酶的作用下将目的基因连接到真核过量表达载体上,连接体系见表13。
表13连接体系组成和用量
反应条件为25℃,15min。
二、转化农杆菌获得阳性克隆和测序验证
测序验证正确的提取质粒,用冻融法转化农杆菌gv3101感受态细胞,获得阳性农杆菌单克隆,方法如下:
a.取-80℃保存的gv3101农杆菌感受态细胞于冰水浴或室温融化;
b.无菌条件下向刚刚化冻的感受态细胞悬液中加入1μg需要转化的质粒dna,轻轻混匀,冰浴静置10min;
c.将离心管置于液氮中速冻5min;
d.然后快速将离心管置于37℃水浴中保持5min;
e.将离心管放回冰中再保持5min;
f.无菌条件下加入800μl无抗生素的lb液体培养基于28℃振荡培养2-3h;
g.5,000rpm离心1min收集菌体,去掉600μl液体后重悬菌体,均匀涂在含有卡那霉素(kan)0.1mg/ml和利福平(rif)0.05mg/ml的固体培养基中,28℃培养48h;
h.挑取单克隆菌落在含有kan(0.1mg/ml)和rif(0.05mg/ml)的lb液体培养基中28℃振荡培养3h,进行pcr检测。pcr检测方法同实施例1。所用引物为myb12f/r见表10。
三、转化烟草
(1)烟草种子消毒步骤如下:
a.取一定量的种子放入5ml的无菌ep管中。
b.加3ml75%乙醇,上下颠倒混匀1min,去上清。
c.加3ml无水乙醇,上下颠倒混匀3min,去上清。重复三次。
以上步骤在无菌超净台进行。烟草种子直接接种于ms培养基中,置于组培室培养。
(2)叶盘法转化烟草
a.将保存的阳性单克隆菌液活化,按1:100的比例取活化菌液加入含kan(0.1mg/ml)和rif(0.05mg/ml)的lb液体培养基中,28℃,180rpm振荡培养至od600=0.5;
b.室温6,000rpm离心4min,收集菌体沉淀,用ms-1液体培养基重悬清洗,以除去残留的抗生素,离心后再将菌体重悬于等量ms-1液体培养基中,以备浸染叶片;
c.取生长良好的无菌烟草苗的叶片,切掉叶片边缘及主叶脉,将其余部分切成1cm2左右的小块;
d.将切好的烟草叶片小块放入ms-1悬浮的菌液中,浸染10min,轻轻摇晃利于菌液完全接触叶边缘伤口;
e.将浸染后的叶片放在无菌滤纸上,吸去残留的菌液;
f.把吸干菌液的叶片接到不含抗生素的共培养培养基ms-1平板上,置于23℃环境下遮光共培养2天;
g.共培养结束后,用含有200mg/ml头孢霉素(cef)和200mg/ml羧苄青霉素(carb)的无菌水清洗叶片表面残留的农杆菌,用无菌滤纸吸干水分后,将叶片转移至分化培养基ms-2上,26℃光照培养;
h.分化出丛生芽后,待分化苗长到2-3cm高时切下,转入1/2ms生根培养基中诱导生根。
ms-1培养基:ms基本成分+30g/l蔗糖,ph=5.8
ms-2分化培养基:ms-1+ba(1.0mg/l)+naa(0.2mg/l)+hyg(20mg/l)+cef(200mg/l)+carb(200mg/l),ph=5.8
生根培养基:1/2ms+20g/l蔗糖,ph=5.8。
(3)转化植株的pcr检测:
转化植株叶片dna提取采用改良的ctab法,具体步骤如下:
a.ctab提取液加0.6%(v/v)巯基乙醇后,放入65℃水浴锅中预热;
b.称取约0.2g叶片,用液氮研磨成粉末,加入约0.01g的聚乙烯吡咯烷酮(pvp),分装约100mg到2mlep管中;
c.每ep管加入800μl已预热的ctab提取液,剧烈振荡充分混匀后,放入65℃水浴锅60min,其间每隔10min轻摇一次;
d.取出ep管,冷至室温,加入800μl氯仿/异戊醇,充分摇匀10min,12,000rpm离心5min;
e.取离心后的上清液到新的2mlep管中,加入等体积的氯仿/异戊醇,充分摇匀10min,12,000rpm离心5min;
f.离心后,移出上清液至1.5mlep管,加入2/3体积的异丙醇(提前于-20℃冰箱预冷),轻轻摇匀后放在4℃冰箱里沉淀40min,然后12,000rpm离心10min;
g.离心后倒出上清液,加入1ml70%乙醇清洗沉淀,12,000rpm离心1min;
h.重复步骤7清洗一次;
i.倒出上清液,室温干燥dna,约20-30min后(不可过干),加入100μl双蒸水溶解dna。
j.dna浓度用紫外分光光度计测定,dna质量用1.0%琼脂糖凝胶电泳检测,eb染色后拍照记录。dna贮存于-20℃条件下备用。
pcr体系、程序同实施例1,pcr产物检测方法同2.4,检测引物为12gf/r,具体见表14所示:
表14转基因烟草植株中类黄酮合成途径相关基因荧光定量分析引物列表
结果:通过农杆菌介导法将带有psmyb12基因的真核载体psn1301转入野生型烟草,经过共培养、分化、诱导生根等过程(图7),用潮霉素筛选得到抗性烟草,经pcr鉴定获得转psmyb12基因阳性苗6株(图8)。
将阳性植株进行移栽成苗,对其叶和花中psmyb12表达量进行的荧光定量分析,得到了3株表达量较高的株系分别编号为no.3、no.5和no.7(图9)。证明外源牡丹的psmyb12能够在烟草中正常转录并且高表达,在转基因株系叶片中的相对表达量是对照未转基因的2403.9±235.7(no.3)、2235.8±585.6(no.5)和13871.0±949.5(no.7)倍;花瓣中的表达量是对照的6834.3±152.2倍(no.3)、3015.9±83.0(no.5),20074.5±776.4(no.7)。
转基因阳性植株花瓣中类黄酮合成途径基因的表达分析:
对转基因烟草和对对照花朵进行拍照观察,看到转基因株系花瓣中色素分布不均匀,如株系7中,一朵花中有2个花瓣颜色较深,3个花瓣较浅,花瓣之间连接处颜色较深,花色素沿着花筒有向下延伸的趋势,并在花筒出现不均匀分布(图10)。
转基因植株和对照植株花瓣中类黄酮合成途径相关基因的表达进行了荧光定量分析,发现过量表达psmyb12基因后,可以上调烟草花瓣中ntchs、ntdfr和ntans的表达量(图11)。
序列表
<110>中国科学院植物研究所
<120>牡丹psmyb12转录因子及其编码基因与应用
<130>p170843/zwy
<160>3
<170>patentinversion3.5
<210>1
<211>278
<212>prt
<213>牡丹品种'青海湖银波'(paeoniasuffruticosa'qinghaihuyinbo')
<400>1
metglyargalaprocyscysserlysvalglyleuhisargglypro
151015
trpthrproarggluaspthrleuleuserlystyrileglualahis
202530
glygluglyhistrplystyrleuprolyslysalaglyleuleuarg
354045
cysglylyssercysargleuargtrpmetasntyrleuargproasn
505560
ilelysargglyasnilethrproaspgluaspaspleuilemetarg
65707580
leuhisserleuleuglyasnargtrpserleuilealaglyargleu
859095
proglyargthraspasngluilelysasntyrtrpasnthrhisleu
100105110
serarglysleuglnasplyslyslysleuserleuproproglnpro
115120125
prolyslyslyslysargasnasplyslyslyslyslysasnthrthr
130135140
ilethrserargthrargglnthrglnvalilemetgluglulyshis
145150155160
thrilehisalaprolysalaileargilethrcysasnproasnile
165170175
thrserserilepheaspthrargservaltyrsercysalaserhis
180185190
alaglypheaspileileserthrgluglualavalasnasnileile
195200205
protrpsergluaspvalglyvalglytyrphealaglyaspaspasp
210215220
aspgluhishistyrleuvalasnserleusergluthrserleuleu
225230235240
valprothrasncysthrthrglnaspasnalaglnvalleugluarg
245250255
leutyrglnglutyrleuglnleuleulysthrglugluglugluasn
260265270
lysglnglnglnglngln
275
<210>2
<211>1081
<212>dna
<213>牡丹品种'青海湖银波'(paeoniasuffruticosa'qinghaihuyinbo')
<400>2
atgggaagggctccttgttgttcaaaggttggattgcacagaggtccatggactcccaga60
gaagacacattgctttcgaagtatattgaagctcatggtgaaggccactggaaatatttg120
cccaaaaaagctgggctacttagatgtggcaagagttgcaggttgagatggatgaactat180
ctaagaccaaatatcaagagagggaacataacccctgatgaggatgatctgataatgaga240
ttgcactcccttctgggaaaccgatggtcactcatcgctggaagactccctggtcgaacg300
gataacgagatcaagaattactggaacacccatctcagcagaaaactccaagacaaaaag360
aaattatctctgccaccgcaaccaccaaagaagaagaaaagaaacgacaagaagaagaag420
aagaacaccaccatcaccagtaggacgaggcagacgcaggtcataatggaggagaagcac480
acaatccacgctccaaaggccattaggattacttgtaacccaaatataacaagcagtata540
tttgacaccaggagtgtctactcttgtgcaagtcatgcagggtttgatataattagtacg600
gaagaagctgtcaataatattattccatggagtgaagatgtgggggttggatactttgct660
ggagatgatgatgatgaacatcactatcttgtcaacagcttgtcagagacaagtctacta720
gtacctactaattgtacaacacaagataacgcacaagtactggagaggctttaccaggaa780
tatctgcaactactcaagacagaagaagaagagaataagcagcagcagcagcagtagata840
tcacttatccatgatatccggtggacgccatatgtttttaaggtgggctttatttttatc900
ttcaccaataatcataccagtagcttattcgtccattgattgccaacttggacggcctct960
caacctttgaataaattagttaagagaactcccacattataattgtcaaaaaaaaaaaaa1020
aaaaaaaaaaaaaagtactctgcgttgataccactgcttgccctatagtgagtcgtatta1080
g1081
<210>3
<211>834
<212>dna
<213>牡丹品种'青海湖银波'(paeoniasuffruticosa'qinghaihuyinbo')
<400>3
atgggaagggctccttgttgttcaaaggttggattgcacagaggtccatggactcccaga60
gaagacacattgctttcgaagtatattgaagctcatggtgaaggccactggaaatatttg120
cccaaaaaagctgggctacttagatgtggcaagagttgcaggttgagatggatgaactat180
ctaagaccaaatatcaagagagggaacataacccctgatgaggatgatctgataatgaga240
ttgcactcccttctgggaaaccgatggtcactcatcgctggaagactccctggtcgaacg300
gataacgagatcaagaattactggaacacccatctcagcagaaaactccaagacaaaaag360
aaattatctctgccaccgcaaccaccaaagaagaagaaaagaaacgacaagaagaagaag420
aagaacaccaccatcaccagtaggacgaggcagacgcaggtcataatggaggagaagcac480
acaatccacgctccaaaggccattaggattacttgtaacccaaatataacaagcagtata540
tttgacaccaggagtgtctactcttgtgcaagtcatgcagggtttgatataattagtacg600
gaagaagctgtcaataatattattccatggagtgaagatgtgggggttggatactttgct660
ggagatgatgatgatgaacatcactatcttgtcaacagcttgtcagagacaagtctacta720
gtacctactaattgtacaacacaagataacgcacaagtactggagaggctttaccaggaa780
tatctgcaactactcaagacagaagaagaagagaataagcagcagcagcagcag834
- 还没有人留言评论。精彩留言会获得点赞!