水稻高光效基因CEO1及其应用的制作方法
本发明涉及水稻植株生长发育情况改进
技术领域:
,具体涉及一种水稻高光效基因ceo1及其应用。
背景技术:
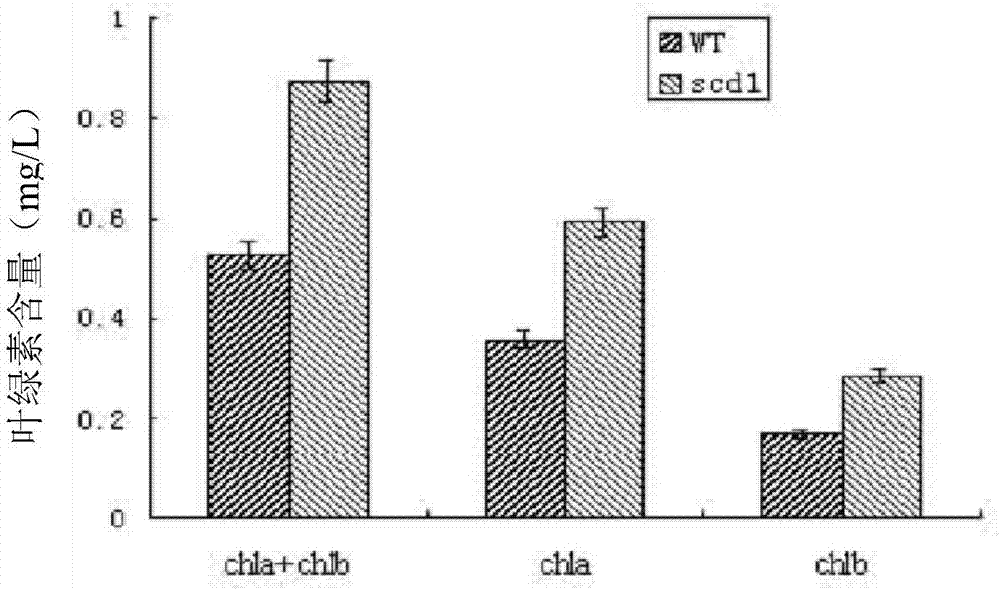
:在我国,粮食安全始终是重要问题之一。由于人口的增加和可耕地面积的不断减少,对于水稻这样重要的粮食作物,培育更加高产的品种始终是首要的育种目标。水稻产量每一次突破,都离不开新的有利资源的发现与利用。20世纪50年代,水稻矮秆资源的发现及矮化育种的成功,实现水稻产量第一次飞跃;20世纪60-70年代,水稻不育胞质的发现及三系成功配套,使我国的水稻产量实现第二次飞跃;20世纪末,超级杂交稻的培育成功使中国杂交稻的产量提高了20%。超级稻的成功培育主要利用了理想株型和杂种优势。在理想株型中,水稻叶片的适度卷曲是其考虑的一个重要因素之一,其作用已在高产和超高产育种中得到充分的体现。如两系超级杂交稻“两优培九”、培矮64s/e32的骨干亲本培矮64s,叶片卷曲度达60%,e32的剑叶卷曲度达39%;三系超级稻协优9308组合的剑叶卷曲度约15%。卷叶性状对叶片光合生理、群体生态效应及经济性状的影响的研究表明,适度卷叶对塑造个体良好的株型、改善生育后期群体质量、提高产量具有重要的作用。培育高光效作物是种植业的主要目标之一。当前,通过基因工程育种获得具有高光效品种是一种行之有效的方法,而该方法中最关键的技术瓶颈问题是与光合作用用相关基因的筛选与功能发现。利用构建的突变体库获得相关高光效突变体,克隆控制水稻重要农艺性状的功能基因,为水稻的育种及品种改良提供基础,并为水稻分子育种设计提供理论依据。然而,目前对控制水稻叶片性状的分子基础还知之甚少。技术实现要素:本发明的目的是提供一种水稻高光效基因ceo1及其应用。本发明提供的蛋白质,获自水稻,命名为ceo1,是如下(a)或(b):(a)由序列表中序列1所示的氨基酸序列组成的蛋白质;(b)将(a)经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与调控植物光合作用效率的由序列1衍生的蛋白质。为了使(a1)中的ceo1蛋白便于纯化和检测,可在由序列表中序列1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。表1标签的序列标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tagii8wshpqfekc-myc10eqkliseedl上述(a2)中的ceo1蛋白可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(a2)中的ceo1蛋白的编码基因可通过将序列表中序列2所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。编码所述ceo1蛋白的基因(ceo1基因)也属于本发明的保护范围。所述ceo1基因为如下(1)或(2)或(3):(1)编码区如序列表的序列2所示的dna分子;(2)在严格条件下与(1)限定的dna序列杂交且编码调控植物光合作用效率的蛋白质的dna分子;(3)与(1)或(2)限定的dna序列具有90%以上同源性且编码调控植物光合作用效率的蛋白质的dna分子。上述严格条件可为用0.1×sspe(或0.1×ssc),0.1%sds的溶液,在dna或者rna杂交实验中65℃下杂交并洗膜。含有所述ceo1基因的重组表达载体、表达盒、转基因细胞系或重组菌也属于本发明的保护范围。本发明还保护所述ceo1蛋白或ceo1基因的应用,为如下(c1)-(c5)中的至少一种:(c1)调控植物光合作用速率;(c2)调控植物光合作用效率;(c3)调控植物株高;(c4)调控植物叶片卷曲度;(c5)调控植物叶绿素含量。本发明还保护一种培育转基因植物的方法,是抑制目的植物中ceo1基因的表达,得到转基因植物;所述转基因植物光合作用速率和/或光合作用效率大于所述目的植物。所述方法中,所述“抑制目的植物中ceo1基因的表达”是通过干扰载体实现的。所述干扰载体可通过ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电导、农杆菌介导等常规生物学方法转化到目的植物中。所述干扰载体具体可为含有干扰片段的重组表达载体。所述干扰片段包括区段甲和区段乙。所述区段甲和所述区段乙为反向互补序列。所述区段甲的序列如序列表的序列3自5’端第15-309位所示。本发明还保护一种培育转基因植物的方法,是降低目的植物中ceo1蛋白的表达量和/或活性,得到转基因植物;所述转基因植物光合作用速率和/或光合作用效率大于所述目的植物。以上任一所述目的植物为单子叶植物或双子叶植物。所述单子叶植物可为禾本目植物。所述禾本目植物可为禾本科植物。所述禾本科植物可为稻属植物。所述稻属植物具体可为水稻,例如日本晴水稻。本发明还保护一种特异dna分子,包括区段甲和区段乙;所述区段甲和所述区段乙为反向互补序列;所述区段甲的序列如序列表的序列3自5’端第15-309位所示。本发明还保护一种干扰载体,是将所述特异dna分子导入表达载体得到的。本发明还保护ceo1蛋白,或,ceo1基因,或,以上任一所述方法,或,所述特异dna分子,或,所述干扰载体在植物育种中的引用。所述育种的目的是培育光合速率大的植物。以上任一所述植物具体为单子叶植物或双子叶植物。所述单子叶植物可为禾本目植物。所述禾本目植物可为禾本科植物。所述禾本科植物可为稻属植物。所述稻属植物具体可为水稻,例如日本晴水稻。本发明从构建的水稻t-dna插入突变体库中筛选获得了一个光合效率显著提高的突变体scd1,该突变体除了光合效率提高外,植物形态表现为半矮化(为野生型株高的3/4),叶片向内卷曲成半圆柱状,与野生型相比,叶绿素含量明显提高,进而提高植株的光合效率。遗传分析发现该突变性状是由隐性单基因控制的,用图位克隆方法分离出了控制该突变性状的基因,发现其野生型基因是一个ceo家族基因(命名为ceo1)。同时本发明用互补的方法对该基因进行了功能互补研究,恢复突变体的表型。实验证明,在正常生长状态下,降低目的植物中ceo1基因的表达量,能够明显提高植物的光合效率。本发明对培育高育高光效水稻材料具有重要的理论及实际意义。附图说明图1为突变体scd1和野生型的形态表型比较图。图2为突变体scd1与野生型植株叶绿素含量比较图。图3为基因图位克隆。图4为基因结构图。图5为实施例2检测结果。图6为实施例3检测结果。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。水稻日本晴(oryzasatival.ssp.japonica):中国农业科学院种子门市部。突变体scd1:突变体scd1是通过对水稻日本晴(oryzasatival.ssp.japonica)进行t-dna插入突变得到的,参考文献:wans,wuj,zhangz,etal.activationtagging,anefficienttoolforfunctionalanalysisofthericegenome[j].plantmolecularbiology,2009,69(2):69-80.;公众可以从中国农业科学院生物技术研究所获得。野生型籼稻品种dular(oryzasatival.ssp.indica):中国农业科学院种子门市部。实施例1、ceo1蛋白及其编码基因的获得一、突变体scd1的表型分析对突变体scd1和野生型水稻日本晴的株高和叶片卷曲度进行测定,同时检测叶绿素a含量、叶绿素b含量和光合速率。株高的测定:成熟期测定,从地表到单株最高穗的顶部(不含芒)的高度。各节数据也依此类推(节从上向下数)。卷曲度(leafrollingindexlri)=成熟期测定,[lw(展开后叶缘间距)-ln(在同一位点测量叶片到叶缘的自然距离)]/lw(展开后叶缘间距)×100%。光合速率测定:在始穗后一周,选择气温(日平均温度)高于30度的晴天,于每天的上午9:00开始对待测植株的剑叶进行光合速率测定,测定部位为剑叶叶片的前部l/3处;每个测定数据用时1分钟;每组材料限时1小时内测定完成;同日的13:00开始重复上午的测定;在后一周时间内再重复进行2次测定;光合测定系统为单台的美国生产的li-co6400便携式光合速率测定仪,使该仪器能自动测定净光合速率、光呼吸速率、胞间co2浓度。叶绿素含量测定:叶绿素含量的测定采用丙酮浸提法。具体如下:剪取相同生长部位的水稻叶片,准确称重后剪成2mm小碎块放于丙酮:乙醇=1:1的溶液(10ml)中浸泡。待浸泡24小时后,叶片发白,以丙酮和乙醇的混合提取液为空白对照,测定叶绿素提取液的od663nm和od645nm。叶绿素的提取和测定均在低温黑暗条件下进行.对照和转基因植株均设3个重复。根据lambert-beer定律,叶绿素溶液在663nm和645nm处的吸光度(a663和a645)与溶液中叶绿素a、b和总浓度可分别用下列方程式表示:叶绿素a含量用以下公式进行计算:chlorophylla(mg/l)=(12.7×a663nm-2.69×a645nm)×稀释倍数叶绿素b含量用以下公式进行计算:chlorophyllb(mg/l)=(22.9×a645nm-4.64×a663nm)×稀释倍数叶绿素总含量用以下公式进行计算:chlorophylla+b(mg/l)=(20.2×a645nm+8.02×a663nm)×稀释倍数。结果如图1、图2和表1所示。图1为株高和叶片卷曲度的结果。图1a为表型观察结果,图1b为野生型成熟期叶片横切图,图1c为突变体scd1成熟期叶片横切图图1d为株高统计结果(ⅰ-ⅳ是水稻茎各节数),图1e为叶片卷曲度统计结果。图2为叶绿素含量统计结果图。表1为光合效率、co2气孔导度和光呼吸速率统计结果。结果表明,突变体scd1株高为野生型(wt)的3/4(图1a和图1d),约70厘米。突变体scd1叶片卷曲度为14%(图1e)。突变体scd1的叶绿素a和叶绿素b含量与野生型(wt)相比显著提高(图2),突变体scd1的光合效率也显著提高(表2)。表2光合效率、co2气孔导度和光呼吸速率统计结果二、ceo1基因的定位克隆以突变体scd1和籼稻品种dular(oryzasatival.ssp.indica)为亲本,杂交得到f1代,f1代自交产生f2代分离群体。f2代植株生长90天后,取突变体植株叶片提取基因组dna进行基因定位。首先取100个f2突变体植株进行粗定位,在水稻12个连锁群上大约每隔约20cm选取多态性较好的分子标记,用40个突变体植株进行连锁分析,找到与scd1连锁的分子标记后,用200个突变体植株进一步验证。验证正确后,上大群体进行染色体步移,进一步精细定位目的基因。定位所用的分子标记如表3所示(5’-3’)。共用3000个f2突变体植株将scdl定位于45k区段内,在这个小区段内预测共有4个完整的orf,对4个orf进行基因结构分析并全部进行测序分析,确定候选基因。筛选过程及结果如图3和图4所示。图3中,粗横线代表染色体,短竖线代表染色体上的分子标记,indel1-1至indel1-4为初定位分子标记的名称,2252、2269、2285、2290、2301为精细定位的分子标记。ac018929、ac027037、和ac018727为水稻第4染色体上的bac克隆。图4中,图4a为目标基因结构图以及插入基因的位置。图4b为目标蛋白三个结构域及插入位点引起的氨基酸改变。表3定位所用的分子标记三、ceo1蛋白及其编码基因经过上述研究,发现了与植物光合速率相关的蛋白ceo1及其编码基因ceo1。将序列表的序列1所示的蛋白质命名为蛋白ceo1,由290个氨基酸残基组成。将蛋白ceo1的编码基因命名为ceo1基因。ceo1基因如序列表中序列2所示。实施例2、转基因互补表达植株的构建及其性状检测1、pcambia23a-ceo1重组表达载体:将pcambia23a载体(北京鼎国昌盛生物技术有限责任公司)的xbai和smai酶切位点间的小片段取代为了序列表的序列2所示的双链dna分子。2、将步骤1得到的pcambia23a-ceo1重组表达载体导入农杆菌agl1(北京鼎国昌盛生物技术有限责任公司)中,得到重组农杆菌。3、将步骤2得到的重组农杆菌通过电激方法导入转化突变体scd1,收获t0代植株。4、对野生型水稻日本晴、突变体scd1、步骤3构建的t0代植株(cp1、cp2和cp3)在开花期进行表型观察和ceo1基因表达量分析。ceo1基因表达量分析:提取植株总rna并反转录为cdna,以cdna为模板对各个植株中ceo1基因的表达量进行实时荧光定量pcr检测,采用actin基因作为内参基因,以野生型日本晴中ceo1基因的表达量的表达量作为1,计算其它各植株中ceo1基因的相对表达量。用于鉴定ceo1基因的引物序列如下:146dlf:5’-atgtaagcgtggcaatgca-3’;146dlr:5’-gagtaattcacacaggtattggagc-3’。用于鉴定actin基因的引物序列如下:actinf:5’-tgctatgtacgtcgccatccag-3’;actinr:5’-aatgagtaaccacgctccgtca-3’。结果如图5所示。图5a为表型观察结果。图5b为ceo1基因的相对表达量统计结果。结果表明,转基因植株cp1-cp3表型与野生型相同,ceo1基因的相对表达量无显著差异。实施例3、ceo1功能缺失转基因植株的建立和表型观察一、干扰植株的构建1、以野生型水稻日本晴的cdna为模板,采用引物p5utrf和引物p5utrr进行pcr扩增,得到pcr扩增产物(序列表的序列3)。p5utrf:5’-ggggtaccactagtgctttacctaagcgaattct-3’;p5utrr:5’-cgggatccgagctcatacattattaccatttcc-3’;引物p5utrf中,下划线标注为kpni和spei酶切位点;引物p5utrr中,下划线标注为bamhi和saci酶切位点。2、将步骤1得到的pcr扩增产物和peasy载体(北京鼎国昌盛生物技术有限责任公司)连接,得到连接产物peasy-ceo1。3、将步骤2的连接产物peasy-ceo1用spei和saci限制性内切酶双酶切,回收约0.3kbp的酶切产物。4、采用spei和saci限制性内切酶对ptck309载体(invitrogen公司)进行酶切,得到约8kbp的载体骨架。5、将步骤3得到的酶切产物与步骤4得到的载体骨架连接,得到重组质粒ptck309-x。6、将步骤2的连接产物peasy-ceo1用kpni+bamhi限制性内切酶双酶切,回收约0.3kbp的酶切产物。7、采用kpni+bamhi限制性内切酶对步骤5得到的重组质粒ptck309-x进行酶切,得到约8kbp的载体片段。8、将步骤6得到的酶切产物与步骤7得到的载体片段,得到干扰载体rnai-309。9、将步骤8得到的干扰载体rnai-309导入农杆菌agl1中,得到重组农杆菌。10、将步骤9得到的重组农杆菌通过电激法转化野生型水稻日本晴,收获t0代干扰植株。二、转空载体植株的构建采用ptck309载体替代干扰载体rnai-309,按照步骤一中的9、10进行操作,得到转空载体t0代植株。三、性状鉴定待测植株:野生型水稻日本晴、突变体scd1、步骤一构建的t0代干扰植株(rnai-1、rnai-2和rnai-3)和步骤二构建的转空载体植株。1、观测待测植株开花时期的表型。2、检测待测植株ceo1基因相对表达量。3、检测待测植株净光合速率、光呼吸速率、胞间co2浓度。结果如图6和表4所示。表4净光合速率、光呼吸速率、胞间co2浓度检测结果与野生型相比,干扰植株(rnai-1、rnai-2和rnai-3)均不同程度提高了光合速率,转空载体植株的光合效率与野生型无显著差异,结果表明抑制ceo1基因表达可以提高光合效率。<110>中国农业科学院生物技术研究所<120>水稻高光效基因ceo1及其应用<160>3<210>1<211>290<212>prt<213>水稻(oryzasativa)<400>1metalaalaglntyrthrglnaspglnserthrglupheargproglu151015leuaspgluproargargthrthrthrthrthrthrserthrthrgly202530serglyleugluasngluasnpheglyglytyrglyglyvalserglu354045asngluproproarghislysilehissergluaspgluproleupro505560lysprometserglythrtyrleuaspglugluglyalalysleuasp65707580glnaspseraspargserglyleuglyalaseraspleuglyargasp859095gluhisilemetprolysprothrsergluglytyrproalaglythr100105110proglnserthrglulystyrglngluhisargaspleugluprothr115120125argleuaspgluserprolysthrgluglupheglyalaalaasnala130135140serthrglyasppheaspargthrserseraspglyleuargthrasp145150155160lysthrproalasergluproargglypheargsergluaspthrala165170175prothrserglyglytyralaaspprothrseralapheproglyala180185190proileaspargargvalglugluproglytyrglytyraspglngln195200205thrsergluprothrserleugluserglythrglnhisserprolys210215220lysgluglyphemetthrlysleulysglulysleuproglyhishis225230235240lysthrprogluserglyvalgluhisglnglyalaglyvalgluhis245250255aspthrthraspalaproprolyslysglyleumetthrlysilelys260265270glulysleuproglyhishisserthralaproalaserthrthrthr275280285aspval290<210>2<211>702<212>dna<213>水稻(oryzasativa)<400>2atggctgggtacatgggtgaagagaggaagccggtgtcgacgtataatgcacatcaggat60gagtttgggttcaaggaggggaatgattatcctgcttctggaggtggatatggtgatcac120aggcatcatcgccctgatgtgccttcgagcactccaggtgaagggtatggtagacagggt180gtggagcatggttatggcgaccagagtgaagagacctttcaagatgctcctgagcggctg240actggctatggtgacactgacaacggtgttggaggtccgaaatctggttatggagattcg300agggaaggtactgcatatgaccgtgccacagatgagcaaacccagtttggtgtcggtggg360aaggaaaactcttatgagcttgaagggtctgaccctcaattaggaggaaccgatacaagt420tcatatgctgctgtggatccacaaaggttggactctgatcggtcgccgattagagctact480gagaccgtccctggtggagatggatgggggcctgaagatacatcgcgcatacacggtgcc540aagaaggacggactcatgaacaagatcaaggagaagttgcccggacatcacaacacagcc600cagggagaagtgagtgatccgaatgcactgccgaaaaagggcatgatggagaaaatcaag660gagaagctccctggacatgacagcggcagcgctgacgtgtaa702<210>3<211>323<212>dna<213>人工序列<220><223><400>3ggggtaccactagtgctttacctaagcgaattctgcttcgtcaaggtggtgaatggaaag60actttccaaagcaaattgtcaagcttgcccacagtgattttaggactaagaagacaatca120cagaaggtgaacaccagacccatctttttttgctggattttgtgcacatgacattcatag180actcaaagacaggccttcagaggccaatagcttggattgatgagaatgggaagcagtact240tcccagaattttttattgaagataagacactgtataggaaaaaggaattgggaaatggta300ataatgtatgagctcggatcccg323当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1