药学活性肽化合物,其制备方法和用途与流程
本发明的目的是药学活性肽化合物,特别是用作药物的合成肽和包含所述合成肽的组合物。此外,本发明涉及生产这种合成肽的方法。
发明背景
神经退行性病变是数量庞大的中枢神经系统(cns)疾病,表现为神经元细胞的慢性和选择性退变和死亡的共同特征。
在神经退行性疾病中,肌萎缩性脊髓侧索硬化症(als),也称为“葛雷克氏病(lougehrigdisease)”,“沙尔科病(charcoatdisease)”或“运动神经元病”,是成人中最常见的运动神经元疾病。als是一种进行性神经退行性疾病,其引起运动神经元,即控制随意肌的脑神经细胞和脊髓细胞的退化和死亡。该疾病的进展因患者而异,对患者的生活质量和预期寿命具有不可忽视的严重影响。患者将逐渐地且不可逆地丧失正常吞咽(吞咽困难),措辞(构音障碍),控制骨骼肌和不同程度的麻痹,达到呼吸肌阻滞,因此需要人工呼吸并导致最终的死亡(exitus)。
在过去的30年中,als的发病率(即新诊断病例的数量)已经提高。目前发病率为每10万人2-4例/年,西方国家的发病率为每10万人10例。在意大利,目前有6000名患者。
这种疾病的原因不明;然而,人们普遍认为als是一种多因素疾病。遗传因素在als中起重要作用:有超过30种基因,其突变与该疾病有关。怀疑其他环境因素和生活方式行为会增加疾病发作的风险系数。
已知sod1基因中的突变(映射到染色体21q22)与约10%的als病例相关。人sod1基因编码酶超氧化物歧化酶-1,hsod1,(ec1-15-1-1,omim#147450)。sod1是一种主要的细胞质抗氧化酶,在生物体中普遍表达且是氧化还原酶类的一员。sod1在各种细胞区室中的生理作用是将由各种途径产生的超氧自由基(o2-)代谢成分子氧(o2)和过氧化氢(h2o2),从而提供针对阴离子超氧化物毒性的防御。
已将sod1基因中超过160个点突变与als相关联,并且已经概述了至少5种不同的遗传谱系。最广泛接受的突变sod1毒性机制与酶错误折叠(即新合成蛋白质的错误折叠)有关,导致运动神经元中不溶性聚集体的积累。在疾病期间,蛋白质聚集体在运动神经元细胞溶质中逐渐累积,最终导致细胞死亡。在als中发现的这种致病机制与在其他神经退行性疾病中发现的相似。同样描述了表达突变的sod1的转基因小鼠中的运动神经元中的类似蛋白质聚集,并且这导致als样综合征:因此,这种突变的sod1小鼠品系成为普遍认可的als的动物模型。特别地,过表达g93a突变体sod1(sod1-g93a)的转基因小鼠是最常用于治疗性靶向药物筛选的als动物模型。
als的病理生理学中涉及的分子途径是多种多样的,例如:错误折叠的蛋白质的聚集,线粒体功能障碍,兴奋性,凋亡,自噬,氧化应激,改变的轴突运输,rna合成调节和编辑。在细胞水平上该疾病最核心的中心之一是线粒体功能障碍,因为线粒体是能量生产,代谢,ca2+稳态和信号转导,凋亡决策物网络中的关键实体。因此,已经确定线粒体损伤是神经退变(包括als,帕金森症和阿尔茨海默病)的主要原因之一。事实上,已发现线粒体变性是运动神经元变性的早期症状,出现得比临床症状早得多。
突变体sod1分子由于其错误折叠倾向,很容易聚集形成与线粒体外膜(omm)的细胞质侧结合的不溶性物质。这种现象是运动神经元特异性的。突变体sod1蛋白聚集体阻塞了膜的渗透性,阻断了膜两侧之间离子和代谢物的正常交换:这种积累进而影响细胞器的正常生物能量学特征并导致其功能障碍和退化(ship.等,jalzheimer’sdis(2010)20suppl2:s311-24;ship.等,biochimbiophysacta(2010)1月;1802(1):45–51;tanw等,biochimbiophysacta(2014)1842:1295-1301)。
已知突变体sod1而非野生型(即非突变体)sod1(sod1wt)与位于omm中的主要蛋白质vdac1结合。vdac是omm的跨膜成孔蛋白,具有允许膜对小代谢物,核苷酸,离子,水具有渗透性的重要作用。在表征omm与突变的sod1之间或vdac1与突变的sod1之间的相互作用的研究中,发现突变的sod1在als小鼠中特异性结合脊髓中但非其他神经学区域(如脑)中的vdac1。此外,在突变的sod1存在下,在体外系统中显示出对vdac1的导电能力的直接影响,证实了该酶与通道蛋白的结合。这种结合特异于突变的sod1,因为wtsod1无法表现出相同的抑制作用。这是在疾病的症状前阶段出现的作用。突变体sod1对vdac1导电的抑制的程度与完全缺失vdac1基因所致的抑制程度相同。
vdac1基因的失活加速了疾病的发作,使als小鼠sod1g37r/vdac1+/-(一种表达带有突变g37r的sod1和杂合形式的vdac1的小鼠),以及als小鼠sod1g37r/vdac1-/-(一种完全没有任何vdac1表达的小鼠)的存活缩短了两个月。
目前还没有针对als的治疗方法。
目前正在研究一些被认为是针对als的潜在治疗剂的分子,但它们显示出伴随有利活性的相关的缺点。
例如,右旋普拉克索(dexpramipexole)是一种用于帕金森病的药物,已用于对抗线粒体功能障碍和氧化应激。然而,临床试验表明,右旋普拉克索在als患者中缺乏任何功效,甚至无法减缓疾病并减轻任何症状。用其他分子如油肟和肌酸作为线粒体功能刺激物显示出类似的不成功结果。
除了代谢紊乱之外,神经炎症似乎在als(和其他神经退行性疾病)病因中也起着普遍作用。在als患者的脑和脊髓中确实已经发现了小胶质细胞的晚期炎症和血液来源的免疫细胞的存在。这些细胞经刺激以释放参与运动神经元死亡的细胞毒性分子。此外,巨噬细胞在入侵ncs时也会损伤运动神经元,在那里它们也会释放出毒性分子。巨噬细胞还可以募集tcd4淋巴细胞,其是b和cd8淋巴细胞介导的针对神经元的免疫反应的驱动因子。目前正在进行几项针对t淋巴细胞,小胶质细胞或巨噬细胞的分子的临床或临床前试验。其中,芬戈莫德(fingolimid)是一种批准用于治疗多发性硬化症(ms)的药物,在als中未显示任何活性。对t淋巴细胞具有相似活性的其他药物是cdp7657(t细胞调节剂,抗cd40l)和托珠单抗,一种批准用于类风湿性关节炎的生物药:它们在偶发形式的als(sals)中显示出相互矛盾的结果。另一个示例是np001,减少巨噬细胞活化,和碳酸锂,一种经典的无机化合物,用于对抗双相情感障碍和抑郁症,已发现其在als中的使用对疾病进展和存活没有影响。马赛替尼(靶向促进性(staminal)细胞因子(csf)的ckit受体的激酶抑制剂,用于阻止细胞因子产生和肥大细胞迁移)和盐酸法舒地尔(rock,rho相关蛋白激酶的抑制剂,被证明能减少星形胶质细胞和小胶质细胞向脊髓的迁移)已经被用于治疗炎症性疾病,包括ms,但被证实在als中无效。gsk2606414(perk,蛋白激酶r样激酶的抑制剂,由此通过抑制tdp43积累导致神经元死亡),克纳普(kenapullone)(几种细胞周期蛋白依赖性激酶,如gsk3,一种减少神经细胞凋亡和突变的sod1积累的糖原合成酶激酶的抑制剂),neurimmuneni204(针对运动神经元中错误折叠的sod1积累的mab)也正处于针对als的研究中。
在另一类分子中,已经提出sod1rx(一种靶向突变的sod1mrna的反义rna)和c9orf72(一种针对c9orf72基因中的序列重复的反义寡核苷酸)可以用于als中以减少错误折叠蛋白质的积累。然而,这些化合物存在严重的局限性,因为它们不能对非常短的重复事件起作用,或者不幸的是,它们在降低靶基因表达水平方面没有显示出任何有效的结果。其他待测化合物是奎尼丁(nuedexta)(它靶向神经元的σi受体)和gm604,一种分子调节剂,都被认为保护神经元。
当前,人们相当关注细胞疗法。这些疗法的策略之一是通过正常星形胶质细胞或神经促进性细胞(neuralstaminalcell)(nsc)的移植来替代毒性星形胶质细胞。在这种治疗中,预期向脊髓中注入成纤维细胞分化的星形胶质细胞或甚至人胚胎衍生的星形胶质细胞。来自运动神经元以及从als患者皮肤成纤维细胞分化的星形胶质细胞的实验共培养物的结果表明,毒性星形胶质细胞仅在一些偶发形式的als中可能具有致死性。设想的细胞疗法可能非常复杂并且非常昂贵。nsc疗法的临床试验表明,在治疗过程中使用的抗排斥药物具有潜在的积极作用。因此,也正在研究用于als治疗的免疫抑制剂。不幸的是,这些最后的化合物似乎不能被患者很好地耐受。
正在研究其他病理-血管生成机制作为als中可能的治疗靶标,并且已经进行了更多的临床预试验或试验。已经开创了奥扎尼珠单抗在als中对抗神经肌肉连接退化的功效。奥扎尼珠单抗是一种靶向nogo-a的单克隆抗体,nogo-a是一种反轴突生长的蛋白质,已发现其表达在als中增强。
其他分子正在考虑之中,因为它们可改善患者的生存条件或存活期望。这被认为是通过直接或间接改善神经元健康状况来实现的。一些分子似乎限制了对神经元的额外损害,以这种方式减缓疾病进展。美西仑(mexitilene)可抑制钠通道,从而减少其过度兴奋。特拉伏(tirasemvit)是肌钙蛋白的选择性激活剂和骨骼肌收缩的调节剂,因此能够提高钙敏感性。因此提出特拉伏可以改善几种骨骼肌力量,特别是那些负责呼吸的骨骼肌:不幸的是,als模型小鼠的实验没有证实这种能力。
迄今为止,美国食品和药物管理局(fda)批准的唯一一种针对als的药物是利鲁唑(riluzone),其给药能够延长仅几个月的预期寿命,对骨骼肌力量损失没有任何效果。利鲁唑可能减少谷氨酸释放:谷氨酸超负荷是运动神经元退变的机制之一。不幸的是,统计分析显示利鲁唑给药的最佳结果是寿命预期延长约三个月。
总体上可以得出结论,现在很少有(如果有的话)在研临床试验具有对于als的合理影响概率。因此,迫切需要新的策略和新的治疗方法来开发针对als和一般神经退行性疾病的治疗作用,这是科学界的责任。
发明目的
本发明的目的是提供一种药学活性化合物,用于治疗肌萎缩侧索硬化症(als),和在成年出现的如帕金森病(pd)和阿尔茨海默病(ad)的一般神经退行性疾病。
本发明的目的还在于提供一种药学活性化合物,其有效地改善患有神经退行性疾病,特别是als的患者的预期寿命。
本发明的另一个目的是提供一种药学活性化合物,其有效减轻患有神经退行性疾病,特别是als的患者的症状。
本发明的另一个目的是提供一种药学活性化合物,其有效减缓患有神经退行性疾病,特别是als的患者的疾病进展。
本发明的另一个目的是提供一种在神经退行性疾病,特别是als中有效的药学活性化合物,其生产简单,快速且经济。
技术实现要素:
在下面的描述中将更详细说明的这些和其它目的是通过药学活性肽化合物,特别是序列iaaqllayyft(seqidno.1)的合成肽实现的。
优选地,本发明的合成肽具有与序列iaaqllayyft(seqidno.1)具有至少70%,优选至少80%,更优选至少90%序列同一性或同源性的氨基酸序列。
在本发明特别优选的实施方式中,所述合成肽与序列iaaqllayyft(seqidno.1)具有95%至99%之间的序列同一性。
实际上,在本发明中令人惊讶地观察到具有序列iaaqllayyft(seqidno.1)的肽,也称为“nhk1”,能够抵消线粒体蛋白vdac1和突变形式的sod1之间的结合,防止与vdac1-mutsod1结合相关的线粒体变性,并因此防止als或其他神经退行性疾病如帕金森病(pd)和阿尔茨海默病(ad)的出现。
实际上已经发现,根据本发明的具有氨基酸序列iaaqllayyft(seqidno.1)的合成肽及其上述定义的同源物能够阻碍突变的sod1和vdac1之间的相互作用,并且它能够抵消其中线粒体功能已被sod1的突变形式和这些突变分子与vdac1的结合破坏的细胞的活力丧失。
在本发明的一个实施方式中,合成肽的特征在于具有11至21个氨基酸,优选11至15个氨基酸的长度。当根据本发明的肽长21个氨基酸时,其序列如下:miaaqllayyftelkddqvkk(seqidno.9)。当根据本发明的肽长15个氨基酸时,其序列如下:miaaqllayyftelk(seqidno.10)。在这些描述中,氨基酸序列以从n-末端到c-末端的方向记录;例如,在序列iaaqllayyft(seqidno.1)中,残基“i”(异亮氨酸)是n-末端残基,而残基“t”(苏氨酸)是c-末端残基。
在本发明的一个实施方式中,在合成过程中,合成肽用可检测探针标记。
认为“可检测探针”是可用现有技术检测和定位的分子;例如,发射性的放射性同位素,荧光团(蛋白质和非蛋白质型)和蛋白质标签。这些可检测探针特别有用,因为它们允许以特异性,精确性和简便性定位结合的肽,从而允许更简单的纯化和/或使其在体外和体内的研究更简单。
例如,在细胞中,根据本发明,可检测探针将允许用可用技术“追踪”合成肽。在本发明的一个优选实施方式中,合成肽与选自ha标签(血凝素(hemoagglutinin)-标签),生物素和异硫氰酸荧光素(fitc)的可检测探针结合。
本发明的目的还涉及根据本发明的肽(即具有序列iaaqllayyft(seqidno.1))合成的方法:这种方法将利用在c-末端向n-末端的方向上的至少一个延伸步骤。为清楚起见,合成方法将在下文中称为“化学方法”或“化学合成”。
在化学方法中,合成肽的合成从c-末端向n-末端进行,即在与核糖体合成方向(从n-末端向c-末端)相反的方向上进行。
根据本发明,从c-末端到n-末端的化学合成将遵循以下步骤:
1)第一氨基酸与固体支持物的结合;与固体支持物的优选结合通过第一氨基酸的α-羧基进行;
2)肽从c-末端向n-末端的延伸,通过在每个添加的氨基酸的α-羧基与在前的氨基酸的α-氨基之间形成共价键从而形成生长肽的n-末端而进行;和
3)合成肽与固体支持物的脱离。
最后,在合成结束时,在阶段1)中与固体支持物结合的氨基酸将是合成肽的c-末端残基。
作为根据优选实施方式的示例,在本发明中,合成肽从c-末端向n-末端的化学合成将遵循以下步骤:
1)第一氨基酸与固体支持物的结合;与固体支持物的优选结合通过氨基酸的α-羧基进行;
2a)第二氨基酸与第一氨基酸的结合,在第二和第一氨基酸之间形成肽键;换句话说,第二氨基酸的α-羧基与第一氨基酸的α-氨基形成共价键;
2b)在第二氨基酸之后顺序添加氨基酸:每个氨基酸的α-羧基与在前的氨基酸的α-氨基形成共价键;
3)合成肽与固体支持物的脱离。
在该最后一个实例中,从c-末端向n-末端方向的延伸包括如上所述的步骤2a)和2b);对于第一个(与固体支持物结合)之后的每个氨基酸循环重复步骤2a)和2b),直至获得经编写的氨基酸序列。
在本发明中用于从c-末端向n-末端进行合成肽合成的化学方法中使用的优选固体支持物是惰性聚合物树脂。
优选的树脂的示例是2-氯三苯甲基氯(cl树脂),或通常,聚苯乙烯-或peg,或聚丙烯酰胺型树脂。
优选地,在从c-末端向n-末端导向的合成方法中使用的氨基酸具有由共价结合基团保护的n-末端α-氨基。在这种情况下,接下来可除去保护基团,从而允许与后面的氨基酸反应。优选的反应期望在氨基酸与待合成的肽中在前的残基结合后立即从该氨基酸除去保护基团。
保护基团的优选示例是:9-芴基甲氧基羰基(fmoc)或叔丁氧基羰基(t-boc)。根据本发明的肽的优选合成方法是固相肽合成方法(spps)(r.b.merrifield,“固相肽合成。四肽合成”,journaloftheamericanchemicalsociety,1963,85(14):2149,doi:10.1021/ja00897a025)。
本发明的另一个目的是合成具有序列iaaqllayyft(seqidno.1)的肽化合物的方法:所述优选方法包括至少一个步骤,其中将至少一个表达载体置入至少一个细胞中,该载体包含编码具有序列iaaqllayyft(seqidno.1)的合成肽的核苷酸序列。该方法将在下文中称为“生物技术过程”或“生物技术合成”。
在根据本发明的肽的“生物技术合成”中使用的优选细胞选自真核细胞和/或原核细胞,特别优选真核细胞。
预期优选生物技术合成包括至少一个步骤:用至少一种表达载体转染真核细胞,所述表达载体包含编码所述合成肽的核苷酸序列。
真核细胞优选是哺乳动物细胞。
真核细胞优选来自稳定的细胞系,例如hela,nsc34,sh-sy5y,hek293细胞;作为替代方案,也可以使用ipsc细胞。提供从成体人细胞起始的ipsc细胞,所述成体人细胞经重新编程为干细胞并诱导成运动神经元。还可以使用ips,即诱导型多能干细胞。ips细胞是有用的疾病模型,因为它们是从患者获得的,因此携带与疾病相关的一种或多种遗传突变。
根据本发明,表达载体可以是任何来源的可用于基因克隆的任何载体。根据本发明的表达载体是质粒和病毒载体。优选的载体是质粒载体。
当合成肽具有序列iaaqllyyft(seqidno.1)时,表达载体至少包含编码具有氨基酸序列iaaqllyyft(seqidno.1)的肽的核苷酸序列。
编码具有氨基酸序列iaaqllyyft(seqidno.1)的肽的优选核苷酸序列是:5'-atcgccgcgagctcctggcctattacttcacgtga-3'(seqidno.2)。
由于遗传密码是简并的,不同于seqidno.2的其他核苷酸序列可以同等用于编码序列iaaqllayyft(seqidno.1)。
优选地,用已知技术进行至少一种表达载体的置入,所述表达载体包含在至少一种细胞(优选真核细胞)中编码合成肽的核苷酸序列。
本发明的另一个目的是药物组合物,其包含具有序列iaaqllayyft(seqidno.1)的至少一种合成肽。
优选地,本发明的药物组合物包含通常用于制药技术的其他填充剂和/或添加剂。
本发明还涉及用作药(药物)的合成肽iaaqllayyft(seqidno.1)。
本发明还涉及合成肽iaaqllayyft(seqidno.1),其用于治疗肌萎缩侧索硬化症(als),或者一般治疗神经退行性疾病如帕金森病或阿尔茨海默病。
如先前所述的,具体地,作为本发明目的的所述合成肽在抵消线粒体蛋白vdac1和蛋白质sod1的突变形式之间的结合,从而防止由于这两种蛋白质之间相互作用引起的线粒体变性方面显示出令人惊讶的功效。
因此,本发明的合成肽可有利地用于治疗肌萎缩侧索硬化症(als)。因此,本发明涉及具有序列iaaqllayyft(seqidno.1)的合成肽,其用作治疗神经退行性疾病(优选als)的药(药物)。
本发明还涉及用于治疗神经退行性疾病如帕金森病或阿尔茨海默病的合成肽iaaqllayyft(seqidno.1)。
如先前所报道的,具体地,作为本发明目的的所述合成肽在保护线粒体,防止线粒体变性方面显示出令人惊讶的功效,所述线粒体变性涉及几种神经退行性疾病,例如als,帕金森病或阿尔茨海默病。
本发明还涉及用于癌症治疗的合成肽iaaqllayyft(seqidno.1)。
如先前所述的,具体地,作为本发明目的的合成肽显示出与线粒体蛋白vdac1的惊人相互作用,其能够在肿瘤细胞中产生促凋亡作用,导致肿瘤细胞的细胞死亡,从而阻止它们增殖。
本发明的另一个目的是用作药(药物)的药物混合物,其包含本发明的合成肽。
同样,本发明的一个目的是包含本发明的合成肽的药物组合物,其用作治疗神经退行性疾病(特别是治疗als)的药(药物)。
本发明还涉及包含本发明的合成肽的药物组合物,其用作用于癌症治疗的药(药物)。
将参考以下实验部分详细描述本发明,仅作为解释性目的,但不限于此。
实验结果在附图中详述。
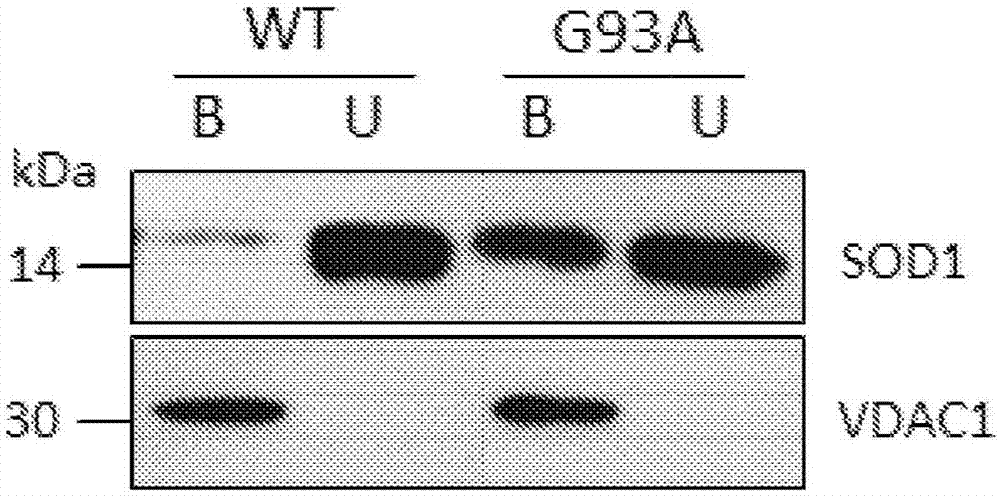
-图1显示了在携带与sod1-g93a(突变体sod1g93a)或sod1wt(野生型表型)相互作用的vdac1分子的磁珠之间进行的相互作用测定的免疫印迹实验。b:与vdac1结合的sod1;u:未结合到vdac1的sod1。
-图2显示了在肽nhk1存在下携带与sod1-g93a相互作用的vdac1分子的磁珠之间进行的相互作用测定的免疫印迹实验,所述肽nhk1即本发明的所述合成肽物质并具有序列iaaqllayyft(seqidno.1)。b:与vdac1结合的sod1;u:未结合到vdac1的sod1。
-图3显示了在添加肽nhk1之前和之后,在1mkcl中施加电压+25mv的人工平面脂质双层中掺入vdac1的代表性(n=3)电生理学迹线。施加电压后,vdac1电导低(闭合状态);加入本发明的所述合成肽物质(nhk1)引起通道电导的有意义的不稳定性,其随各种大小的不同事件打开和关闭。
-图4显示了在60μm肽nhk1存在下从具有sod1-g93a的nsc34细胞分离的线粒体之间进行的相互作用测定的免疫印迹实验,所述肽nhk1即本发明所述的合成肽物质,具有序列iaaqllayyft(seqidno.1)。在合成肽存在下,sod1-g93a结合线粒体的程度要小得多。s:上清液部分,即含有未与线粒体结合的分子的部分;m:线粒体部分,即含有线粒体和与它们结合的分子的部分。
-图5显示:图a)通过对过表达wtsod1(左侧)或sod1-g93a(右侧)的nsc34细胞进行共聚焦镜检获得的代表性图像,两者均与egfp融合。只有sod1-g93a诱导细胞内聚集体的形成。图b)sod1的过表达影响nsc34细胞活力。在表达sod1wt的细胞中,即使在非常高的水平,也没有特别的变化。相反,在转染后24小时,在表达sod1-g93a的细胞中,细胞活力降低约20%(与对照相比)。
-图6显示了在用作对照肽的肽nhk1或序列打乱(scramble)的肽表达后nsc34-sod1wt或sod1-g93a中的细胞活力改变。
实验部分
实验1-合成肽nhk1的合成(方法)。
实验1a-合成肽nhk1的化学合成。_
本发明的合成肽nhk1,具有序列nh2-iaaqllayyft-cooh(seqidno.1),或异亮氨酸-丙氨酸-丙氨酸-谷氨酰胺-亮氨酸-亮氨酸-丙氨酸-酪氨酸-酪氨酸-苯丙氨酸-苏氨酸,分子量为1,273.42,pi=5,50,已经在自动合成仪中通过固相肽合成(spps)的标准化学方法合成。与核糖体中的天然合成不同,spps在从c末端向n末端的方向上合成肽。因此,nhk1肽的合成从c-末端氨基酸苏氨酸(thr或t)向n-末端氨基酸异亮氨酸(ile或i)发生。序列中加入的每个氨基酸的n-末端被9-芴基甲氧基羰基(fmoc)保护。肽键在通过其c-末端固定至固相(不溶性树脂)的肽的n-末端氨基和n-末端由fmoc基团保护的接入的氨基酸之间形成。在下一步骤中,fmoc基团被切割,氨基酸被去保护,新的n-末端可用于结合新的氨基酸。因此,在每次反应后,采用适当溶剂进行多个洗涤步骤,目的是从液相和偶联相的生物产物中完全除去试剂,同时生长的肽与不溶性树脂共价结合。
因此,spps是重复反应的循环过程,其中:与生长的肽结合的氨基酸经去保护-洗涤步骤-接入(下一个)氨基酸的添加及其与去保护的氨基酸的反应,和,由新氨基酸提供生长的肽的延伸-洗涤步骤。
这些是spps合成所述肽nhk1的技术步骤:
i)第一fmoc保护的氨基酸(fmoc-苏氨酸)与2-氯三苯甲基氯树脂(cl-树脂)的结合:用作氨基酸偶联活化剂的试剂是二异丙基碳二亚胺(dic)和1-羟基苯并三唑(hobt);
ii)用n,n-二甲基甲酰胺(dmf)中的25%哌啶去保护fmoc基团;
iii)中和暴露的氨基;
iv)如i)中那样结合下一个fmoc保护的氨基酸(fmoc-aa)。有一个例外:由于合成问题,肽序列-aqll(seqidno.11)需要通过n,n-二异丙基乙胺(diea)和n-[(二甲基氨基)-1h-1,2,3-三唑并[4,5-b]吡啶-1-基亚甲基]-n-甲基六氟磷酸甲铵n-氧化物(hatu)激活偶联反应;
v)释放fmoc基团;
vi)通过三氟乙酸(tfa)从结合树脂释放肽和侧链残基的去保护也被阻断。
对于序列中引入的每个新氨基酸,以循环方式重复步骤ii)至iv)。步骤v)和vi)是肽合成的最后步骤,一旦完成所需的序列就进行。
步骤iii)优选用三乙胺进行氨基中和。氨基中和使质子化胺转化成游离胺,因此作为亲核试剂,并且能够在下一反应中攻击对称酸酐(步骤iv)。
以这种方式,获得了具有序列iaaqllayyft(seqidno.1)的名为nhk1的合成肽,其为本发明的目标。
实验1b-通过在哺乳动物细胞中表达进行合成肽nhk1的生物技术合成。_
通过在稳定细胞系(特别是稳定细胞系hela和nsc-34)中真核启动子控制下表达包含核苷酸序列5'-atcgccgcgcagctcctggcctattacttcacgtga-3'(seqidno.2)的质粒载体,产生具有序列iaaqllayyft(seqidno.1)的本发明目标的所述肽nhk1。
在第一步中,化学合成了具有以下序列的两个互补寡核苷酸:
5’-ctagcatgatcgccgcgcagctcctggcctattacttcacgtgag-3’(seq.idno.3);
3’-gtactagcggcgcgtcgaggaccggataatgaagtgcactcagct-5’(seq.idno.4).
寡核苷酸含有与限制性位点ndei和sali(下划线)相容的序列。这两个寡核苷酸序列之间的退火产生双链dna(dsdna-nhk1),其含有编码本发明的肽nhk1的序列,其侧接分别对应于限制性位点ndei和sali消化后获得的那些的单链序列。
接下来,将序列dsdna-nhk1克隆到真核细胞pcmsmtred的质粒表达载体中,pcmsmtred是经修饰的pcms-egfp(克隆泰克公司(clontech)),在从人细胞色素c氧化酶亚基viii基因获得的线粒体靶向序列后,其egfp转染标志物被融合的珊瑚(discosomaspp)红色荧光蛋白(rfp)序列取代;该序列将荧光蛋白表达至线粒体并且是转染标志物[tomasellof.等,在完整细胞中检测到的线粒体外膜中的电压依赖性阴离子选择性通道1(vdac1)拓扑图(thevoltage-dependentanionselectivechannel1(vdac1)topographyinthemitochondrialoutermembraneasdetectedinintactcell).plosone2013;8:e81522]。该构建体已命名为pcmsmtred-nhk1。
此外,产生了本发明目标的所述肽nhk1的另一种形式,在其c-末端融合了血凝素序列(ha-标签)(nhk1-ha)。用作标签的ha序列对应于流感病毒血凝素的氨基酸序列98-106,血凝素是位于病毒表面上并且为病毒感染所需的一种糖蛋白。ha标签的核苷酸序列如下:5'-tacccatacgatgttccagattacgct-3'(seqidno.5);相应的氨基酸序列如下:ypydvpdya(seqidno.6)(氨基酸序列是从n-末端(残基y)向c-末端(残基a)的方向)。已充分确定ha标签的添加不会对其融合的蛋白质的活性或靶向产生任何干扰。
为了提供融合蛋白nhk1-ha,合成第二对互补寡核苷酸,其对应于编码在其c-末端与序列ha融合的序列nhk1的dsdna。该dsdna分别含有限制性位点ndei和sali,每个末端一个:
5’ctagcatgatcgccgcgcagctcctggcctattacttcacgtgatacccatacgatgttccagattacgctg-3’(seq.idno.7)
3’gtactagcggcgcgtcgaggaccggataatgaagtgcactatgggtatgctacaaggtctaatgcgacagct-5’(seq.idno.8)。
寡核苷酸含有与限制性位点ndei和sali相容的序列(下划线)和编码ha标签的序列(粗体)。
这两个寡核苷酸序列之间的退火产生双链dna(dsdna-nhk1-ha)。将序列dsdna-nhk1-ha克隆到质粒表达载体pcms-mtdsred的限制性位点ndei和sali,并将该构建体命名为pcms-mtdsred-nhk1-ha。
所述nhk1肽对复合物vdac1/sod1-g93a,即由蛋白质vdac1与突变酶sod1(确切地说是突变体g93a,其中甘氨酸93被丙氨酸取代)之间的相互作用形成的复合物的作用通过体外和细胞内实验,即在nsc34细胞系中评价。nsc34是通过将小鼠运动神经元与神经母细胞瘤细胞融合而获得的杂交细胞系。nsc34细胞系被广泛认为是运动神经元的细胞模型,并且在用突变的sod1转染后,它被认为是als的参考模型[cashmannr等,神经母细胞瘤x脊髓(nsc)杂交细胞系类似发育中的运动神经元(neuroblastomaxspinalcord(nsc)hybridcelllinesresembledevelopingmotorneurons).dev.dyn.(1992)194:209–21;durhamhd等,评估脊髓神经元x神经母细胞瘤杂交细胞系nsc-34作为神经毒性测试的模型(evaluationofthespinalcordneuronxneuroblastomahybridcelllinensc-34asamodelforneurotoxicitytesting).neurotoxicology(1993)14:387–395]。
实验2-生产和纯化vdac1,sod1-g93a,sod1wt。
在体外实验中,肽nhk1的作用已在试管中针对由重组蛋白和纯化蛋白的相互作用形成的复合物vdac1/sod1-g93a直接测定。初步产生并纯化人蛋白质vdac1,sod1-g93a和sod1wt。人sod1(突变体和wt)和人vdac1在大肠杆菌bl21(de3)中表达,其c-末端融合strep标签(sod1-g93a和sod1wt)或his标签(vdac1)。首先将人sod1(突变体sod1和sod1wt,基因id:6647)克隆到pet52b(+)载体中,产生构建体pet-sod1wt和pet-sod1g93a。以相同的方式,将人vdac1序列(基因id:7461)克隆到pet21a(+)载体中,产生构建体pet-vdac1。
用strep-tactin树脂(凯杰公司(qiagen))通过亲和层析纯化sod1-g93a和sod1wt,并用ni-nta树脂(凯杰公司)通过亲和层析纯化vdac1。
两个纯化程序均遵循制造商的方案(凯杰公司)进行。
将纯化的vdac1(一种膜蛋白)在含有1%月桂基-二甲基-胺-n-氧化物(ldao)的缓冲溶液中再折叠。重组vdac1的正确折叠通过其在平面脂质双层(plb)中的成孔特征的电生理学表征来检查[checchettov.等,重组人电压依赖性阴离子选择性通道同种型3(hvdac3)形成具有非常小导电性的孔(recombinanthumanvoltagedependentanionselectivechannelisoform3(hvdac3)formsporeswithaverysmallconductance).cellphysiolbiochem(2014)34(3):842–853]。plb测定中的实验条件如下:膜组成:二植烷酰-磷脂酰胆碱/正癸烷;将膜用水中的1mkcl两侧浸泡;施加到膜上的电位是10mv;恒定t=25℃。
在这些体外实验中,评估了合成肽nhk1对复合物vdac1/sod1-g93a的干扰作用。
实验3-vdac1与sod1-g93a和sod1wt的结合。
在以下实验条件下测定sod1-g93a和sod1wt结合vdac1的能力:将30μm纯化并再折叠的vdac1以其天然构象与50μl来自凯杰公司的涂有ni-nta树脂(镍-次氮基三乙酸)的顺磁性微珠一起孵育。树脂特异性结合位于vdac1c-末端的6xhis-标签,用vdac1蛋白本身包被珠。与顺磁珠结合的vdac1以显著的亲和力与纯化的人sod1-g93a相互作用,其以6.5μm的浓度添加到vdac1包被的微珠。在相同条件下,sod1wt与vdac1包被的微珠没有结合(图1)。
该结果与文献一致,即突变体sod1而非sod1wt具有与vdac1(体内)相互作用的特定能力[israelsona.等,错误折叠突变体sod1直接抑制小鼠遗传als模型中的vdac1导电性(misfoldedmutantsod1directlyinhibitsvdac1conductanceinamousemodelofinheritedals).neuron(2010)8月26日;67(4):575–587]。
实验4-合成肽nhk1对复合物vdac1/sod1-g93a的作用。
在升高浓度的合成肽nhk1(浓度范围为0至25μm)存在下,重复如实验3所述的相同实验。将肽以与50μl磁珠结合的30μm的浓度添加至vdac1。接下来,添加6.5μmsod1-g93a(或者作为对照的sod1wt)。在分离结合/未结合的组分后,通过用抗sod1抗体进行免疫印迹来评估相互作用。我们发现与vdac1结合的sod1-g93a随肽nhk1浓度的增加平行降低,并且在最大施加肽浓度下几乎消失(图2)。
具体地,我们注意到在10μmnhk1存在下与vdac1结合的sod1-g93a减少了40%,并且在25μmnhk1存在下减少了80%。
实验5-合成肽nhk1对vdac1孔(porine)的导电性的影响
在vdac1导电性记录的单通道实验中,在比色皿顺式(cis)加入合成肽nhk1之前和之后观察vdac1的成孔活性(ben-haild,shoshan-barmatzv.将纯化的vdac1重构为脂质双层和通道导电性记录(reconstitutionofpurifiedvdac1intoalipidbilayerandrecordingofchannelconductance).coldspringharbprotoc.2014年1月1日;2014(1):100-5.doi:10.1101/pdb.prot073148.pubmedpmid:24371316)。
图3显示了在加入合成肽nhk1之前和之后,在恒定施加电压+25mv下1mmc1中vdac1导电性的代表性迹线。在施加的电压下,vdac1通道以所谓的(部分)“闭合”状态存在,如文献中所定义。在加入15μm合成肽nhk1后,闭合状态不稳定,显示出快速波动,其范围为达到更高的电导水平和几种不同的闭合状态。
实验6-合成肽nhk1的细胞定位。
合成肽nhk1的定位通过nsc34-g93a细胞(即过表达突变体sod1-g93a的nsc34细胞)中的两种不同荧光探针来评估。
实验6a-用生物素标记的合成肽nhk1。_
肽nhk1通过用生物素标记其n-末端氨基来合成并修饰。在由转染试剂chariot(活性基序公司(activemotif))驱动的将生物素化的肽内化到nsc34-g93a细胞中之后,在生物素与用荧光探针alexa594(分子探针-热科学公司(molecularprobes-thermoscientific))标记的链霉亲和素的特异性相互作用后,在荧光显微镜下观察生物素化的nhk1肽的定位。在该实验中,使用6μl非细胞毒性转染试剂chariot以允许细胞摄取生物素化的合成肽(100-400ng肽/孔)。chariot是一种2,843da的肽,能够与蛋白质或肽形成非共价复合物:以这种方式,它保护待摄取的肽在转染过程期间免于降解过程。一旦进入细胞内,chariot-肽复合物就会解离,从而肽可以到达其目的地。摄取独立于内体途径,因此肽结构在内化期间不被改变。
按照生产商说明进行chariot实验。
实验6b-用异硫氰酸荧光素(fitc)标记的合成肽nhk1。_
肽nhk1通过用荧光探针异硫氰酸荧光素(fitc)标记其n-末端氨基来合成并修饰。在由转染试剂chariot(活性基序公司)驱动将修饰的肽内化到的nsc34-g93a细胞中后,在荧光显微镜下直接观察nhk1-fitc肽的定位。
在实验6a中,通过间接免疫荧光获得肽nhk1的细胞定位。在实验6b中,通过直接免疫荧光进行观察,因为fitc是荧光分子。
实验6a和6b产生重叠的结果图案:通过落射荧光显微镜(leicadm6000)获得图像,并显示两种nhk1肽(用生物素或用fitc标记)明显定位于线粒体(数据未在图中显示)。
实验7-合成肽nhk1在体外阻碍复合物vdac1/sod1-g93a形成。
用从nsc34细胞纯化的线粒体证实合成肽nhk1阻碍复合物vdac1/sod1-g93a形成的能力。在这样的实验中,将2μg的sod1-g93a(或作为对照的sod1wt)与从107个nsc34细胞起始获得的完整线粒体一起孵育。注意到只有sod1-g93a能够与线粒体表面相互作用,与sod1wt不一致,后者不能与线粒体相互作用(图4)。在图4中,“s”表示上清液部分,其含有未与线粒体结合的sod1,而“m”表示线粒体部分,即存在与线粒体结合的sod1-g93a。
在相同的实验中,在添加60μmnhk1后,与对照样品相比,与线粒体结合的sod1-g93a减少约90%(图4)。
实验8-合成肽nhk1在细胞内的作用。
已经确定蛋白质聚集是神经退行性疾病的典型特征,特别是突变体sod1聚集体是有毒的并且与als疾病直接相关。
初步实验表明,在nsc34细胞中,突变的sod1-g93a诱导蛋白质的细胞内毒性聚集的形成。相反,sod1的生理形式(sod1wt)不会诱导这种有毒聚集体。图5a显示了在共聚焦显微镜下获得的nsc34细胞的代表性图像,其中表达了与egfp融合的sod1wt(左侧)或sod1-g93a(右侧)。引人注目的是,只有sod1-g93a表达与细胞内聚集体的存在相关,该聚集体对细胞寿命有毒。
在用前面定义的质粒pcmsmtred-nhk1或pcmsmtred-nhk1-ha通过lipofectamine3000(英杰公司(invitrogen))转染后,在nsc34-g93a细胞中测定nhk1肽的作用。通过该操作,细胞中可能有比采用直接肽转染更大量的肽。此外,与采用chariot进行的肽的直接摄取相比,可以使对于转染的细胞反应持续更长时间(甚至更多天)。
我们注意到使用mtt测定[mosmannt,针对细胞生长和存活的快速比色测定法:增殖和细胞毒性测定应用(rapidcolorimetricassayforcellulargrowthandsurvival:applicationtoproliferationandcytotoxicityassays).jimmunolmethods(1983)65:55–63],与未转染的相同细胞相比,用sod1wt-egfp转染后nsc34细胞活力没有变化。相反,24小时后,与用sod1wt-egfp转染的相同细胞相比,用sod1-g93a-egfp转染后nsc34细胞活力下降约20%(图5b)。将数据针对仅用egfp转染的nsc34细胞进行标准化。使用anova单向检验进行统计分析。在图5b中,星号(*)表示该值相对于sod1wt具有显著性p<0.001(0.00014005)。用一式三份样品进行至少三次实验。
在表达sod1-g93a或sod1wt的nsc34细胞中评估nhk1肽的作用。
在该实验中,我们确实向nsc34细胞共转染了相同浓度的pet-sod1g93a(或对照中的pet-sod1wt)以及pcmsmtred-nhk1(或pcmsmtred-nhk1-ha);24小时后,我们进行了活力mtt测试。
mtt测定法是一种比色测定法,旨在定量脱氢酶将黄色的3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑还原成紫蓝色的甲
将细胞以80,000个细胞/孔的密度接种在24孔板上,孵育24小时,然后用表达sod1wt或sod1-g93a的质粒pegfp-n1或模拟物瞬时转染。转染试剂是lipofectamine3000(生命技术公司(lifetechnologies))。在每次转染中,使用1μg质粒dna。孵育24小时后读取mtt测定。将实验一式三份重复至少四次。
在nhk1肽存在下重复相同的活力测定。用质粒pegfp-n1+pcms-mtdsred-nhk1或pegfp-n1-sod1wt+pcms-mtdsred-nhk1(均作为对照)或pegfp-n1-sod1g93a+pcms-mtdsred-nhk1共转染nsc34。在每次转染中,使用1μg总质粒dna。孵育24小时后读取mtt测定。在六个平行样品中重复该实验至少三次。将数据针对用sod1-g93a-egfp转染的nsc34细胞标准化,其被认为是细胞活力最大下降(100%)的条件。因此得出结论,鉴于由突变体sod1-g93a导致的nsc34细胞活力下降100%,肽nhk1在相同条件下能够使活力下降减少42%,具有p<0.01的统计学显著性(0.003),如图6中的星号(*)所示。相反,在对照实验中,未观察到明显的活力丧失。具体且非常重要的是,egfp与肽nhk1的共转染显示该肽对细胞完全没有毒性(图6)。
当用“序列打乱的”肽作为对照(图6中的“序列打乱”)共转染nsc34-sod1-g93a细胞时,没有发现细胞活力下降的有意义恢复。序列打乱的肽具有序列:faqltialayy(seqidno.12)(与nhk1肽seqidno.1有18%序列同一性)。使用anova单向检验进行统计分析。
上述实验的结果使我们能够在实验上突出本发明相对于已知技术的优点。已经观察到本发明的合成肽物质(合成肽nhk1)能够脱离与vdac1结合或与从nsc34细胞纯化的线粒体结合的sod1-g93a。此外,在nsc34-sod1-g93a转基因细胞中的实验表明,该合成肽提供了相对于该技术和现有技术中已知的额外优势:首先,它能够抵消与运动神经元中的突变的sod1-g93a表达相关的死亡率;它进一步增强了作用于线粒体功能的细胞活力(正如mtt测定所证实的那样,其最终是线粒体活性测定)[sanchezns和
最后,肽nhk1的另一个优点及细胞对它的耐受性在癌症治疗中有利,因为它在稳定的肿瘤细胞(即hela细胞)中表现出促凋亡作用。
序列表
<110>安吉拉·安娜·梅西纳(messina,angelaanna)
维托·尼古拉·德平托(depinto,vitonicola)
安德里亚·马格里(magri',andrea)
西蒙娜·雷纳(reina,simona)
弗朗西斯卡·玛利亚·瓜里诺(guarino,francescamaria)
生物医学与生物技术科学学院(dipartimentodiscienzebiomedicheebiotecnologiche)
生物地质和环境科学学院(dipartimentodiscienzebiologiche,geologicheeambientali)
<120>药学活性肽化合物,其制备方法和用途
<130>170156ac45
<160>12
<170>patentinversion3.5
<210>1
<211>11
<212>prt
<213>人工序列
<220>
<223>合成肽(nhk1)
<400>1
ilealaalaglnleuleualatyrtyrphethr
1510
<210>2
<211>36
<212>dna
<213>人工序列
<220>
<223>合成肽的编码序列(nhk1)
<400>2
atcgccgcgcagctcctggcctattacttcacgtga36
<210>3
<211>45
<212>dna
<213>人工序列
<220>
<223>用于产生质粒的寡核苷酸
<400>3
ctagcatgatcgccgcgcagctcctggcctattacttcacgtgag45
<210>4
<211>45
<212>dna
<213>人工序列
<220>
<223>用于产生质粒的寡核苷酸。该序列以3'-5'方向显示
<400>4
gtactagcggcgcgtcgaggaccggataatgaagtgcactcagct45
<210>5
<211>27
<212>dna
<213>人工序列
<220>
<223>编码ha-标签的序列
<400>5
tacccatacgatgttccagattacgct27
<210>6
<211>9
<212>prt
<213>人工序列
<220>
<223>ha-标签
<400>6
tyrprotyraspvalproasptyrala
15
<210>7
<211>72
<212>dna
<213>人工序列
<220>
<223>用于产生质粒的寡核苷酸
<400>7
ctagcatgatcgccgcgcagctcctggcctattacttcacgtgatacccatacgatgttc60
cagattacgctg72
<210>8
<211>72
<212>dna
<213>人工序列
<220>
<223>用于产生质粒的寡核苷酸。该序列以3'-5'方向显示
<400>8
gtactagcggcgcgtcgaggaccggataatgaagtgcactatgggtatgctacaaggtct60
aatgcgacagct72
<210>9
<211>21
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>9
metilealaalaglnleuleualatyrtyrphethrgluleulysasp
151015
aspglnvallyslys
20
<210>10
<211>15
<212>prt
<213>人工序列
<220>
<223>合成肽
<400>10
metilealaalaglnleuleualatyrtyrphethrgluleulys
151015
<210>11
<211>4
<212>prt
<213>人工序列
<220>
<223>肽片段
<400>11
alaglnleuleu
1
<210>12
<211>11
<212>prt
<213>人工序列
<220>
<223>对照肽"序列打乱"
<400>12
phealaglnleuthrilealaleualatyrtyr
1510
- 还没有人留言评论。精彩留言会获得点赞!