TREM2切割调节剂及其用途的制作方法
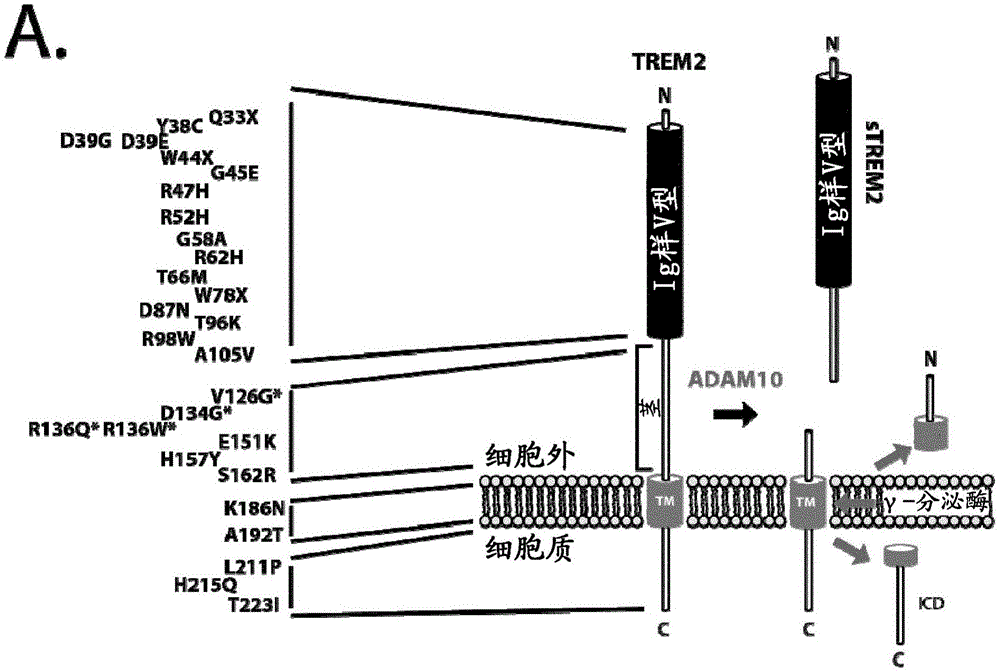
神经变性对应于主要影响神经元的任何病理情况,其代表具有不同临床和病理表达的一大群神经障碍,影响特定功能性解剖系统中特定神经元亚群的功能和存活[1]。脑部驻留免疫细胞(brainresidentimmunecell)的炎症和活化是许多神经障碍的常见标识,并且长久以来已经认识到特定的小胶质细胞增生在神经变性障碍中的关键作用[2,3]。
现在通过鉴定在髓样细胞2(trem2)上表达的触发受体中的序列变体进一步支持小胶质细胞功能在疾病发病机理中的主要作用。纯合trem2变体引起plosl/nasuhakola疾病[4]或ftd样痴呆[5],而杂合trem2变体与多种神经和神经变性疾病如阿尔茨海默病(ad)、额颞叶变性(ftld)、帕金森病、ftld样综合征和肌萎缩性侧索硬化症(als)的风险增加有关[5-11](也参见ulrich,2016,acschem.neurosci.7:420-427)。在脑中,trem2仅在小胶质细胞中表达,并且在功能上是必需的,例如细胞碎片的吞噬[12,13]。trem2是1型膜蛋白,其穿梭于细胞质膜[14],在那里其可以发挥其生物学功能。trem2经历调节的膜内蛋白水解(rip)[15,16](参见例如图1a)。通过金属蛋白酶(包括adam10和adam17(含有解联蛋白和金属蛋白酶结构域的蛋白质)和可能的mmp(基质金属蛋白酶))使全长trem2脱落,在细胞表面上启动rip。脱落导致可溶性trem2(strem2)的分泌,其可在人脑脊液(csf)中检测到[15,17-19]。随后通过γ-分泌酶的膜内切割清除膜保留的c-末端片段(ctf)(参见例如kleinberger等人[15]图1a)[16,20]。
已经功能性地研究了trem2的几个突变。ig样结构域内的突变如p.t66m和p.y38c导致trem2的错误折叠和未成熟蛋白在内质网内的保留[15,21]。结果,观察到细胞表面trem2减少,并且脱落显著减少。与此一致,具有纯合trem2p.t66m突变的患者在血清和csf中具有极低或甚至检测不到的strem2[15,18]。
降低的细胞表面trem2导致吞噬活性降低[15]。尽管最初在trem2功能缺失对淀粉样斑块块病理学的影响方面报道了矛盾的结果[22,23],但现在看来很清楚trem2的缺失导致模糊淀粉样斑块的积累,表明缺乏斑块体(plaquehallow)的吞噬清除或降低的淀粉样斑块生长的预防[24,25]。为了支持减少的吞噬斑块降解,最近已经表明,在没有trem2的情况下,通过吞噬的淀粉样斑块免疫治疗剂的清除降低[26]。迄今为止功能性地研究的突变位于trem2的ig样结构域内(参见例如kleinberger等人[15]图1a)。该结构域的错误折叠、保留和因此减少的脱落看起来是这种trem2变体的常见结果。最近的遗传学研究表明,先前描述的编码变体(p.h157y;[9,27,28])与汉族人群中的ad显著相关[29]。有趣的是,该变体(p.h157y)位于ig样结构域之外的茎区内(参见例如kleinberger等人[15]图1a)。
神经障碍,如神经变性障碍,有几个共同的特征,包括非典型蛋白质组装和/或诱导的进行性细胞死亡[30,31]。可以在许多不同水平的神经元环路中发现神经变性,其导致分子和系统缺陷。存在旨在降低神经变性障碍的发作和/或进展的某些治疗方法。然而,不幸的是,神经变性障碍仍然是无法治愈的,导致神经元细胞的进行性变性和/或死亡。
因此,本发明所要解决的技术问题是提供治疗和/或预防包括神经变性疾病在内的神经疾病的手段和方法。
通过提供本文描述的以及如权利要求中表征的实施方案解决该技术问题。
因此,本发明涉及在trem2的胞外域内具有结合位点的结合分子,其中该结合分子抑制trem2切割。
如下文和所附实施例中所记载的,令人惊讶地鉴定了发生trem2脱落(shedding)的精确切割位点。特别地,在本发明的背景下,已发现trem2胞外域的切割发生在trem2的氨基酸序列的第157位(his157)组氨酸的c-末端,例如,如seqidno:1或4所示。本发明的结合分子在该位置阻断trem2胞外域的切割。因此,本文提供的结合分子稳定或增加表面结合的trem2的量,从而保留和刺激小胶质细胞的活性。因此,本文提供的结合分子可有效地有助于预防淀粉样斑块的积累和消极作用;因此,提供了治疗和/或预防各种神经障碍的新方法,包括神经变性障碍,如阿尔茨海默病(ad)。
已经在trem2内鉴定的切割位点(即his157)正是ad相关的trem2变体p.h157y所在的位点。在现有技术中已经描述了trem2突变对神经变性疾病发展的作用。然而,p.h157y导致ad或其他神经变性障碍的机制尚不清楚。所附实施例令人惊讶地证明突变变体p.h157y导致更高的trem2脱落,该发现与针对在ig样结构域内的突变(如p.t66m和p.y38c)所观察到的减少的脱落相反[15]。如所附实施例所证明的,trem2p.h157y的增强脱落导致细胞表面全长trem2减少和吞噬活性降低。因此,出乎意料地,位于ig样结构域或茎区内的突变通过完全不同的细胞机制影响trem2依赖性吞噬活性。因此,现有技术中对trem2突变(如p.h157y变体)的存在的描述决不表明trem2切割恰好发生在该位置。
在现有技术中已知几种特异性结合trem2的分子,如抗trem2抗体。然而,没有公开的数据显示能够抑制trem2胞外域脱落(即切割)的结合分子。所附实施例令人惊讶地证明trem2胞外域脱落(即trem2切割)发生在trem2的his157处。因此,切割酶(例如adam10、adam17或基质金属蛋白酶)必须接近该氨基酸以切割trem2。因此,所附实施例表明阻断his157的结合分子可成功抑制trem2的切割。可以通过直接结合his157来阻断切割酶对his157的接近。另外或可替代地,可以通过与位于与his157非常接近(例如具有至多10个氨基酸的距离)的氨基酸结合而在空间上阻断切割酶对his157的接近。例如,与位于与his157非常接近的氨基酸结合的抗体或小分子可以在空间上阻断切割酶与his157的接近,从而抑制该位点的trem2切割。
因此,本发明提供了抑制(优选防止)trem2切割的结合分子。更具体地,在本发明的背景下,trem2胞外域的切割(即脱落)被本发明的结合分子抑制。
本文提供的结合分子在trem2的胞外域内具有结合位点。本文中术语“结合位点”是指通过本文提供的结合分子识别(即结合)的trem2的部分。如果本发明的结合分子是抗体,则结合位点对应于所述抗体的表位。本文提供的结合分子的结合位点可以位于相应切割酶(例如adam10)的切割位点内的任何位置。adam10的切割位点与trem2的跨膜结构域的距离为10-30个氨基酸。所附实施例证明trem2内的adam10切割位点位于his157位置(即距离人trem2跨膜结构域18个氨基酸)。此外,在leu163、leu164和glu165位置(即距离人trem2跨膜结构域10-12个氨基酸)发现了次要的优选切割位点。因此,可以预测adam10的最小切割位点位于由人膜结合的trem2的氨基酸序列的第145-174位组成的氨基酸序列内。因此,可以预测adam10的最小切割位点在氨基酸段gesesfedahvehsisrsllegeipfppts(seqidno:16)内。因此,本发明的结合分子可以在trem2(例如人或小鼠trem2)的第145-174位的任何氨基酸处结合trem2。
然而,在茎区内的任何位置结合trem2可能导致抑制trem2与切割酶的相互作用,因此可抑制trem2切割。trem2的茎区位于人膜结合的trem2的氨基酸第113-174位(例如,如seqidno:1所示),或位于鼠膜结合的trem2的氨基酸第113-171位(例如,如seqidno:4所示)。因此,本发明的结合分子可以在人膜结合的trem2的第113-174位的氨基酸段内,和/或在鼠膜结合的trem2的第113-171位的氨基酸段内的任何位置结合人trem2。
例如,本发明的结合分子可以结合trem2的第148-166位的任何一个氨基酸,例如,如seqidno:1-6中的任一个所示。在本发明的背景下,本文提供的结合分子抑制膜结合的trem2的切割。因此,结合分子可以与膜结合的trem2的第148-166位的任何一个氨基酸结合,例如,如seqidno:1或4所示。优选地,本文提供的结合分子抑制人trem2的切割(即脱落)。因此,结合分子可以结合人trem2的第148-166位的任何一个氨基酸,例如,如seqidno:1-3所示。甚至更优选地,本发明的结合分子抑制膜结合的人trem2的切割。因此,本发明的结合分子可以与人膜结合的trem2的第148-166位的任何一个氨基酸结合,例如,如seqidno:1所示。因此,本发明的一个方面涉及本文提供的结合分子,其中结合位点包含选自以下的人膜结合trem2的至少一个位置:
人膜结合trem2的第148位的谷氨酸(glu148);
人膜结合trem2的第149位的丝氨酸(ser149);
人膜结合trem2的第150位的苯丙氨酸(phe150);
人膜结合trem2的第151位的谷氨酸(glu151);
人膜结合trem2的第152位的天冬氨酸(asp152);
人膜结合trem2的第153位的丙氨酸(ala153);
人膜结合trem2的第154位的组氨酸(his154);
人膜结合trem2的第155位的缬氨酸(val155);
人膜结合trem2的第156位的谷氨酸(glu156);
人膜结合trem2的第157位的组氨酸(his157);
人膜结合trem2的第158位的丝氨酸(ser158);
人膜结合trem2的第159位的异亮氨酸(ile159);
人膜结合trem2的第160位的丝氨酸(ser160);
人膜结合trem2的第161位的精氨酸(arg161);
人膜结合trem2的第162位的丝氨酸(ser162);
人膜结合trem2的第163位的亮氨酸(leu163);
人膜结合trem2的第164位的亮氨酸(leu164);
人膜结合trem2的第165位的谷氨酸(glu165);和
人膜结合trem2的第166位的甘氨酸(gly166)。
在本发明的背景下,可能需要设计抑制非人动物的trem2裂解的结合分子。这种结合分子可以例如用于临床前动物研究。例如,本发明的结合分子可以与小鼠、大鼠、兔、山羊、绵羊、豚鼠、白鼬(ferret)和/或猴的trem2结合(并抑制其裂解)。在本发明的优先方面,本文提供的结合分子结合并抑制鼠trem2的切割。这种结合分子可以与鼠trem2的第148-166位的任何一个氨基酸结合,例如,如seqidno:4或5所示。本文中更优先考虑的是,本发明的结合分子抑制膜结合的鼠trem2的切割。因此,本发明的结合分子可以结合鼠膜结合的trem2的第148-166位的任何一个氨基酸,例如,seqidno:4所示。因此,本发明的一个方面涉及本文提供的结合分子,其中结合位点包含选自以下的鼠膜结合的trem2的至少一个位置:
鼠膜结合trem2的第148位的丝氨酸(ser148);
鼠膜结合trem2的第149位的丝氨酸(ser149);
鼠膜结合trem2的第150位的苯丙氨酸(phe150);
鼠膜结合trem2的第151位的谷氨酸(glu151);
鼠膜结合trem2的第152位的甘氨酸(gly152);
鼠膜结合trem2的第153位的丙氨酸(ala153);
鼠膜结合trem2的第154位的谷氨酰胺(gln154);
鼠膜结合trem2的第155位的缬氨酸(val155);
鼠膜结合trem2的第156位的谷氨酸(glu156);
鼠膜结合trem2的第157位的组氨酸(his157);
鼠膜结合trem2的第158位的丝氨酸(ser158);
鼠膜结合trem2的第159位的苏氨酸(thr159);
鼠膜结合trem2的第160位的丝氨酸(ser160);
鼠膜结合trem2的第161位的精氨酸(arg161);
鼠膜结合trem2的第162位的天冬酰胺(asn162);
鼠膜结合trem2的第163位的谷氨酰胺(gln163);
鼠膜结合trem2的第164位的谷氨酸(glu164);
鼠膜结合trem2的第165位的苏氨酸(thr165);和
鼠膜结合trem2的第166位的丝氨酸(ser166)。
为了将在人类治疗中使用的相同结合分子用于临床前研究,可能希望本发明的结合分子在膜结合的人和膜结合的小鼠trem2中结合相同的氨基酸。因此,本文提供的结合分子可结合人膜结合和鼠膜结合的trem2(例如,分别如seqidno:1和4所示)的第149-151、153、155-158、160、161和166位的任何一个氨基酸。
然而,如上所述,本文提供的结合分子可以与trem2的第148-166位的任何一个氨基酸结合。优选地,结合分子与trem2的第153-166位、更优选trem2的第153-162位的任何一个氨基酸结合。如上所述,优选本发明的结合分子结合并抑制人或鼠trem2的切割,优选结合并抑制膜结合的人或鼠trem2的切割,最优选结合并抑制膜结合的人trem2的切割。
本文提供的结合分子可以结合trem2内的构象结合位点或线性结合位点。如果结合分子是抗体,则这些结合位点分别称为构象表位和线性表位。构象结合位点由trem2的氨基酸序列的不连续区段组成。这种结合位点基于3-d结构表面特征,即trem2的三级结构,与结合分子相互作用。
相反,线性结合位点基于trem2的氨基酸序列的一级结构与结合分子相互作用。因此,线性结合位点由trem2的连续氨基酸序列形成。例如,本文提供的结合分子的trem2内结合位点可包含以下多肽或与以下多肽重叠:由trem2的第148-157或157-166位、优选149-158或156-165、更优选150-159或155-164、甚至更优选151-165或154-163、甚至更优选152-161或153-162、和甚至更优选153-162位的氨基酸组成的任一种多肽。例如,结合位点可以包含以下多肽或与以下多肽重叠:由trem2的第152-156或158-162位的氨基酸组成的多肽。然而,本文提供的结合分子也可以使用3-5个氨基酸的较小结合位点。例如,本文提供的结合分子在trem2内的结合位点可包含以下多肽或与以下多肽重叠:由第148-150或164-166、优选149-151或163-165、更优选150-152或162-164、甚至更优选151-153或161-163、甚至更优选152-154或160-162、甚至更优选153-155或159-161、甚至更优选154-156或158-160、甚至更优选155-157和/或157-159、和甚至更优选156-158位的氨基酸组成的任一种多肽。如上所述,优选本发明的结合分子结合并抑制人或鼠trem2的切割,优选结合并抑制膜结合的人或鼠trem2的切割,最优选结合并抑制膜结合的人trem2的切割。
如上所述,在本发明的背景下,令人惊讶地鉴定了trem2在his157处特异性切割。因此,本发明的结合分子直接结合his157或空间抑制his157位的切割。因此,导致抑制trem2切割的优选结合位点集中在his157位处的切割位点周围。结合分子(例如抗体、纳米抗体或小分子)在trem2的茎区中抑制trem2与切割酶(例如adam或基质金属蛋白酶,mmp)相互作用的的任何结合可用于本发明背景下。trem2的茎区位于人trem2(例如,如seqidno:1所示)的第113-174位;或位于鼠trem2(例如,如seqidno:4所示)的第113-171位。在本发明的一个方面,本文提供的结合分子的结合位点包含以下多肽或与以下多肽重叠:具有seqidno:7-15、21和22中任一个所示氨基酸序列的任一种多肽。优选地,结合位点在seqidno:7的氨基酸序列内。
如所附实施例所示,蛋白酶adam10在his157位和ser158位之间切割trem2。因此,在本发明的背景下特别优选的是,本文提供的结合分子的结合位点包含his157和/或ser158。如所附实施例所示,ad相关的trem2变体p.h157y导致trem2的脱落增加,表明his157在trem2切割的调节中起关键作用。因此,在本发明的背景下最优选的是,本文提供的结合分子的结合位点包含trem2的his157,特别是人或鼠膜结合的trem2的his157。因此,本发明的一个方面涉及本文提供的结合分子,其中结合位点包含trem2的第157位的组氨酸。
本文提供的结合分子通过抑制切割酶接近trem2来抑制trem2切割。本领域已知几种测定法可用于定量trem2的切割。这些方法可用于本发明的背景下,以测定(即定量)本文提供的结合分子对trem2切割的抑制。例如,可以通过使用本领域已知的以及例如在kleinberger等人[15]中描述的以下测定法来测试(特别是定量)trem2切割的抑制:
1.)表达人和/或小鼠trem2的细胞的膜级分或蛋白质裂解物的免疫印迹。可以通过分析较高分子量(“成熟”)条带来测试trem2切割的效率(参见,例如,kleinberger等人[15]和1c)。
2.)来自表达人和/或小鼠trem2的细胞的上清的免疫印迹(参见,例如,[15],图1b、1c和4b)。
3.)来自表达人和/或小鼠trem2的细胞的上清中可溶性trem2的基于elisa的定量(参见,例如,[15],图1b、4c和7a)。
4.)通过表面生物素化测定法定量膜结合(即细胞表面暴露的)trem2(参见,例如,kleinberger等人[15],图2f)。
5.)通过流式细胞术定量人和/或小鼠细胞系和原代细胞上膜结合(即细胞表面暴露的)trem2。
6.)通过基于细胞的elisa技术定量人和/或小鼠细胞系和原代细胞上膜结合(即细胞表面暴露的)trem2。
7.)通过表面免疫细胞化学定量人和/或小鼠细胞系和原代细胞上细胞表面(即膜)暴露的trem2(参见例如[16])。
8.)基于elisa定量来自人和/或小鼠的组织和/或体液(例如来自脑、肝、脾、血清、血浆、脑脊液和/或尿)的可溶性trem2(strem2)。
9.)来自人和/或小鼠来源的组织和/或体液(例如来自脑、肝、脾、血清、血浆、脑脊液和/或尿)的trem2的免疫印迹。
任一种上述方法可用于本发明的背景下,用于测试特定结合分子是否抑制trem2切割。因此,本发明的一个方面涉及本文提供的结合分子,其中通过免疫印迹、基于elisa定量可溶性trem2、通过表面生物素化测定法定量表面结合的trem2、通过流式细胞术定量表面结合的trem2、通过表面免疫细胞化学定量表面结合的trem2和/或通过基于细胞的elisa技术定量表面结合的trem2来测定trem2切割的抑制。
结合分子对trem2切割的抑制与膜结合的trem2的量相关。因此,与不存在结合分子的情况下膜结合的trem2的量相比,在结合分子存在的情况下膜结合的trem2的量增加。例如,如通过上述任一种测定法,特别是通过免疫印迹或流式细胞术所测定的,如果在所述结合分子存在下,膜结合的trem2的量是在不存在结合分子的情况下膜结合的trem2的量的至少110%、优选至少120%、更优选至少150%、甚至更优选至少200%、甚至更优选至少250%,结合分子可以被认为是抑制trem2切割的结合分子。在这样的测定法中,可以使用包含trem2切割酶的细胞。
相应地,例如,如通过上述任一种测定法,特别是通过免疫印迹或流式细胞术所测定的,如果在所述结合分子存在下,膜结合的trem2的量比不存在结合分子的情况下膜结合的trem2的量多至少10%、优选至少20%、更优选至少50%、甚至更优选至少100%、甚至更优选至少150%,结合分子可以被认为是抑制trem2切割的结合分子。如上所述,上述任一种测定法,特别是免疫印迹或基于elisa定量strem2,可用于定量本文提供的结合分子的trem2切割的抑制。在这样的测定法中,可以使用包含trem2切割酶的细胞。
本文中,术语“膜结合的trem2”(也称为“膜结合的trem2”)是指包括其胞外域的全长trem2蛋白被糖基化并与膜结合,特别是与小胶质细胞的质膜结合。
与不存在结合分子的情况下strem2的量相比,存在结合分子时结合分子对trem2切割的抑制程度与可溶性trem2(strem2)的量负相关。例如,如通过上述任一种测定法所测定的,特别是通过基于elisa的strem2定量所测定的,如果在所述结合分子存在时,strem2的量是不存在结合分子的情况下strem2的量的0-90%、优选0-80%、更优选0-70%、甚至更优选0-60%、甚至更优选0-50%、甚至更优选0-20%,则结合分子可以被认为是抑制trem2切割的结合分子。
所附实施例显示抗体克隆14d3使trem2切割减少约70%,同时使成熟trem2的水平增加高达5倍。因此,与未处理的细胞(即不包含本发明的结合分子的细胞)相比,优选结合分子使trem2切割减少至少60%或最优选减少约70%。如上所述,可以通过elisa测定trem2切割的量,对于定量,elisa是比western印迹定量结果更稳定的测定法。
所附实施例显示adam蛋白酶在his157位切割(即脱落)trem2。然而,在现有技术中已经表明,即使在施用adam蛋白酶抑制剂后,trem2也在一定程度上发生切割[15]。这些数据表明除了adam蛋白酶之外的蛋白酶也切割trem2。然而,通过本文提供的结合分子可以抑制切割trem2的任何蛋白酶在his157位(或在非常接近该位置的位置)对trem2的切割(即脱落)。因此,在本发明的背景下,切割酶可以是任何金属蛋白酶。例如,所述金属蛋白酶可以是含有解联蛋白和金属蛋白酶结构域的蛋白质(adam),或基质金属蛋白酶(mmp)。因此,在本发明的一个方面,结合分子干扰切割酶与trem2的结合,其中切割酶是adam或mmp。在现有技术中已经描述了adam10和adam17参与trem2脱落[15,16,32]。因此,文中adam可以是adam10和/或adam17。在本发明的背景下优选切割酶是adam10。
通过抑制trem2切割,本文提供的结合分子保留和/或刺激小胶质细胞的活性,和/或其他trem2表达细胞的活性。优选地,本文提供的结合分子保留和/或刺激小胶质细胞的活性。小胶质细胞的所述活性可以是吞噬活性、移动、钙信号传导、syk活化和/或增殖。trem2还调节炎性细胞因子的产生和小胶质细胞的存活。因此,小胶质细胞的所述活性也可以是炎性细胞因子产生和/或存活的调节。优选地,本文提供的结合分子保留和/或稳定小胶质细胞的吞噬活性。本领域已知几种可用于测量细胞吞噬活性的测定法。例如,为了测试给定的结合分子是否保留和/或稳定细胞的吞噬活性,可以如kleinberger等人[15]和xiang等人[26]所述测试吞噬。可以使用[33]中描述的方法在体内测试吞噬活性的增加。本领域已知以及在例如[20]中描述了几种用于测试给定的结合分子是否保留和/或稳定细胞的钙信号传导手段和方法。
本文提供的结合分子可以是抗体(如纳米抗体)或小分子。“小分子”可以是任何种类,包括肽、折叠体(foldamer)、蛋白质模拟物(proteomimetic)和衍生自具有低分子量(<900道尔顿)的有机合成的化合物。小分子可以有助于调节生物过程,并且通常具有大约10-10m数量级的尺寸。许多药物都是小分子。
在所附实施例中,预测了trem2茎区的二级结构。如图4所示,trem2胞外域的c-末端主要显示α螺旋结构。因此,为了获得抑制trem2被金属蛋白酶如adam或mmp切割的小分子,可以设计抑制α-螺旋介导的蛋白质-蛋白质相互作用的小分子(trem2-adam;trem2-mmp)。可以通过设计约束α-螺旋肽或蛋白质模拟物来设计这样的小分子,所述蛋白质模拟物通过模拟其热点残基的空间取向来匹配α螺旋的形貌。这些方法在本领域中是已知的并且在例如[34]中综述了。可以例如通过有机合成来制备设计的小分子。
蛋白质的“热点残基”是帮助蛋白质发挥其功能的基本界面残基。大多数蛋白质-蛋白质结合能仅与分子间蛋白质界面上的一组几个氨基酸(热点)相关(参见,例如,zerbe,2012,jcheminfmodel.,52(8):2236-2244)。在蛋白质-蛋白质相互作用的背景下,术语“热点”是指对如通过丙氨酸扫描诱变测定的结合自由能起主要作用的残基或残基簇。相反,在药物研究中,热点是靶蛋白上具有高度配体结合倾向的位点,因此其对于药物发现可能是重要的。
因此,如果本文提供的结合分子是小分子,则它可以是约束α-螺旋肽、折叠体或蛋白质模拟物,所述蛋白质模拟物通过模拟其热点残基的空间取向来匹配trem2茎区α-螺旋的形貌。
本文中,术语“肽”、“寡肽”、“多肽”和“蛋白质”可互换使用,并且涉及包含至少一个氨基酸链的分子,其中氨基酸残基通过肽(酰胺)键连接。术语“肽”、“寡肽”、“多肽”和“蛋白质”还包括包含除20种基因编码的氨基酸之外的氨基酸的分子,如硒代半胱氨酸。本文中术语“肽”、“寡肽”、“多肽”和“蛋白质”还包括具有修饰的分子,如糖基化、乙酰化、磷酸化、泛素化、sumolyation等。这样的修饰在本领域中已充分描述。
本文中,术语“蛋白质模拟物”是指模拟蛋白质(或多肽、或寡肽或肽)表面区域的结构和功能的任何化合物。
然而,如上所述,本发明的结合分子也可以是抗体。优选地,抗体是单克隆抗体。抗体也可以是抗体片段,如纳米抗体、fab片段、fab’片段、fab’-sh片段、f(ab’)2片段、fd片段、fv片段、scfv片段、或分离的互补决定区(cdr)。抗体或抗体片段可以是人源化抗体/抗体片段、全人抗体/抗体片段、小鼠抗体/抗体片段、大鼠抗体/抗体片段、兔抗体/抗体片段、仓鼠抗体/抗体片段、山羊抗体/抗体片段、豚鼠抗体/抗体片段、白鼬抗体/抗体片段、猫抗体/抗体片段、狗抗体/抗体片段、鸡抗体/抗体片段、绵羊抗体/抗体片段、牛抗体/抗体片段、马抗体/抗体片段、骆驼抗体/抗体片段、或猴抗体/抗体片段,如灵长类动物抗体/抗体片段。优选抗体是人源化抗体/抗体片段、全人抗体/抗体片段、小鼠抗体/抗体片段、大鼠抗体/抗体片段、兔抗体/抗体片段、仓鼠抗体/抗体片段、山羊抗体/抗体片段、豚鼠抗体/抗体片段、白鼬抗体/抗体片段、鸡抗体/抗体片段、绵羊抗体/抗体片段、或猴抗体/抗体片段,如灵长类动物抗体/抗体片段。甚至更优选抗体是人源化抗体/抗体片段、全人抗体/抗体片段、小鼠抗体/抗体片段或大鼠抗体/抗体片段。因此,本文提供的结合分子可以是人源化抗体片段,如人源化纳米抗体。本文提供的结合分子还可以是嵌合抗体和/或双特异性抗体。
在所附实施例中,已经制备了与trem2切割位点(例如seqidno:7的肽内的表位,如包含his157和/或ser158的表位)结合的抗体。所附实施例显示这些抗体降低trem2切割。已经设计了所有活跃抑制trem2切割的抗体的共有序列(参见图8)。本发明的一个方面涉及本文提供的结合分子,其中结合分子是对应于所述共有序列的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:32的序列,轻链可变区包含seqidno:42的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:32具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:42具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:52的氨基酸序列;重链可变区的cdr2包含seqidno:62的氨基酸序列;重链可变区的cdr3包含seqidno:72的氨基酸序列;轻链可变区的cdr1包含seqidno:82的氨基酸序列;轻链可变区的cdr2包含seqidno:92的氨基酸序列;轻链可变区的cdr3包含seqidno:102的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:52具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:62具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:72具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:82具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:92具有至少60%、优选100%同一性的氨基酸序列;和轻链可变区的cdr3包含与seqidno:102具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
如所附实施例中所证明的,显示抑制trem2切割的最佳活性的抗体克隆是抗体克隆14d3。因此,本发明最优选的方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆14d3的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:23的序列,轻链可变区包含seqidno:33的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:23具有至少85%同一性的序列,轻链可变区包含与seqidno:33具有至少85%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:43的氨基酸序列;重链可变区的cdr2包含seqidno:53的氨基酸序列;重链可变区的cdr3包含seqidno:63的氨基酸序列;轻链可变区的cdr1包含seqidno:73的氨基酸序列;轻链可变区的cdr2包含seqidno:83的氨基酸序列;轻链可变区的cdr3包含seqidno:93的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:43具有至少70%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:53具有至少70%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:63具有至少70%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:73具有至少70%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:83具有至少60%同一性的氨基酸序列;轻链可变区的cdr3包含与seqidno:93具有至少70%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。所附实施例显示抗体克隆14d3使trem2切割减少约70%,同时使成熟trem2的水平增加高达5倍。因此,与未处理的细胞(即不包含上文定义的抗体的细胞)相比,优选上文定义的抗体使trem2切割降低至少60%或最优选降低约70%。上述抗体的抗体片段也包括在本发明中。
本发明的这个最优选的方面还涉及本文提供的结合分子,其中所述结合分子是抗体,并且其中所述抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含与seqidno:23具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:33具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区的cdr1包含与seqidno:43具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:53具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:63具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:73具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:83具有至少60%、优选100%同一性的氨基酸序列;轻链可变区的cdr3包含与seqidno:93具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(1)和(2)中定义的抗体具有抑制trem2切割的活性,其等同于具有包含seqidno:23的序列的重链可变区和包含seqidno:33的序列的轻链可变区的抗体的活性。优选地,与未处理的细胞(即不包含上文定义的抗体的细胞)相比,上文定义的抗体降低trem2切割至少60%或最优选约70%。上述抗体的抗体片段也包括在本发明中。
所附实施例表明抗体克隆14d8具有非常高的抑制trem2切割的活性。因此,本发明特别优选的方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆14d8的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:24的序列,轻链可变区包含seqidno:34的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:24具有至少85%同一性的序列,轻链可变区包含与seqidno:34具有至少85%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:44的氨基酸序列;重链可变区的cdr2包含seqidno:54的氨基酸序列;重链可变区的cdr3包含seqidno:64的氨基酸序列;轻链可变区的cdr1包含seqidno:74的氨基酸序列;轻链可变区的cdr2包含seqidno:84的氨基酸序列;轻链可变区的cdr3包含seqidno:94的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:44具有至少70%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:54具有至少70%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:64具有至少70%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:74具有至少70%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:84具有至少60%同一性的氨基酸序列;并且轻链可变区的cdr3包含与seqidno:94具有至少70%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
本发明的这个特别优选的方面还涉及本文提供的结合分子,其中所述结合分子是抗体,并且其中所述抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含与seqidno:24具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:34具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区的cdr1包含与seqidno:44具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:54具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:64具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:74具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:84具有至少60%、优选100%同一性的氨基酸序列;轻链可变区的cdr3包含与seqidno:94具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(1)和(2)中定义的抗体具有抑制trem2切割的活性,其等同于具有包含seqidno:24的序列的重链可变区和包含seqidno:34的序列的轻链可变区的抗体的活性。上述抗体的抗体片段也包括在本发明中。
本发明的一个方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆7a12的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:25的序列,轻链可变区包含seqidno:35的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:25具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:35具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:45的氨基酸序列;重链可变区的cdr2包含seqidno:55的氨基酸序列;重链可变区的cdr3包含seqidno:65的氨基酸序列;轻链可变区的cdr1包含seqidno:75的氨基酸序列;轻链可变区的cdr2包含seqidno:85的氨基酸序列;轻链可变区的cdr3包含seqidno:95的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:45具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:55具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:65具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:75具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:85具有至少60%、优选100%同一性的氨基酸序列;和轻链可变区的cdr3包含与seqidno:95具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
本发明的一个方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆8a11的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:26的序列,轻链可变区包含seqidno:36的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:26具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:36具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:46的氨基酸序列;重链可变区的cdr2包含seqidno:56的氨基酸序列;重链可变区的cdr3包含seqidno:66的氨基酸序列;轻链可变区的cdr1包含seqidno:76的氨基酸序列;轻链可变区的cdr2包含seqidno:86的氨基酸序列;轻链可变区的cdr3包含seqidno:96的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:46具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:56具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:66具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:76具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:86具有至少60%、优选100%同一性的氨基酸序列;和轻链可变区的cdr3包含与seqidno:96具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
本发明的一个方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆21a3的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:27的序列,轻链可变区包含seqidno:37的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:27具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:37具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:47的氨基酸序列;重链可变区的cdr2包含seqidno:57的氨基酸序列;重链可变区的cdr3包含seqidno:67的氨基酸序列;轻链可变区的cdr1包含seqidno:77的氨基酸序列;轻链可变区的cdr2包含seqidno:87的氨基酸序列;轻链可变区的cdr3包含seqidno:97的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:47具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:57具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:67具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:77具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:87具有至少60%、优选100%同一性的氨基酸序列;轻链可变区的cdr3包含与seqidno:97具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
本发明的一个方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆10c3的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:28的序列,轻链可变区包含seqidno:38的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:28具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:38具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:48的氨基酸序列;重链可变区的cdr2包含seqidno:58的氨基酸序列;重链可变区的cdr3包含seqidno:68的氨基酸序列;轻链可变区的cdr1包含seqidno:78的氨基酸序列;轻链可变区的cdr2包含seqidno:88的氨基酸序列;轻链可变区的cdr3包含seqidno:98的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:48具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:58具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:68具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:78具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:88具有至少60%、优选100%同一性的氨基酸序列;轻链可变区的cdr3包含与seqidno:98具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
本发明的一个方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆18f9的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:29的序列,轻链可变区包含seqidno:39的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:29具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:39具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:49的氨基酸序列;重链可变区的cdr2包含seqidno:59的氨基酸序列;重链可变区的cdr3包含seqidno:69的氨基酸序列;轻链可变区的cdr1包含seqidno:79的氨基酸序列;轻链可变区的cdr2包含seqidno:89的氨基酸序列;轻链可变区的cdr3包含seqidno:99的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:49具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:59具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:69具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:79具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:89具有至少60%、优选100%同一性的氨基酸序列;和轻链可变区的cdr3包含与seqidno:99具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
本发明的一个方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆15c5的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:30的序列,轻链可变区包含seqidno:40的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:30具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:40具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:50的氨基酸序列;重链可变区的cdr2包含seqidno:60的氨基酸序列;重链可变区的cdr3包含seqidno:70的氨基酸序列;轻链可变区的cdr1包含seqidno:80的氨基酸序列;轻链可变区的cdr2包含seqidno:90的氨基酸序列;轻链可变区的cdr3包含seqidno:100的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:50具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:60具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:70具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:80具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:90具有至少60%、优选100%同一性的氨基酸序列;轻链可变区的cdr3包含与seqidno:100具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
本发明的一个方面涉及本文提供的结合分子,其中结合分子是对应于抗体克隆1g6的抗体。因此,本文提供的结合分子可以是抗体,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:31的序列,轻链可变区包含seqidno:41的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:31具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列,轻链可变区包含与seqidno:41具有至少85%、优选至少90%、更优选至少95%、甚至更优选至少98%、最优选至少99%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:51的氨基酸序列;重链可变区的cdr2包含seqidno:61的氨基酸序列;重链可变区的cdr3包含seqidno:71的氨基酸序列;轻链可变区的cdr1包含seqidno:81的氨基酸序列;轻链可变区的cdr2包含seqidno:91的氨基酸序列;轻链可变区的cdr3包含seqidno:101的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:51具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:61具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:71具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:81具有至少70%、优选至少75%、更优选至少80%、甚至更优选至少85%、最优选至少90%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:91具有至少60%、优选100%同一性的氨基酸序列;轻链可变区的cdr3包含与seqidno:101具有至少70%、优选至少75%、更优选至少80%、最优选至少85%同一性的氨基酸序列;其中抗体抑制trem2切割。
优选地,如上面项目(2)-(4)中定义的抗体具有抑制trem2切割的活性,其等同于项目(1)中定义的抗体的活性。上述抗体的抗体片段也包括在本发明中。
根据本发明,可以根据imgt标准进行cdr确定(ehrenmann等人,第2章,r.kontermann和s.dübel(编辑),antibodyengineeringvol.2,springer-verlagberlinheidelberg2010)。
用于产生靶位点特异性抗体(即结合特定结合位点的抗体)的几种技术是本领域公知的。例如,可以通过用包含胞外域或trem2内的期望结合位点的肽免疫小鼠或大鼠来产生特异性结合trem2胞外域内的特定结合位点的抗体。例如,seqidno:7-15、21和22中所示的任一种肽可用于免疫。更具体地,为了产生可以在本发明的背景下使用的针对人trem2的抗体,可以使用如seqidno:7(ahvehsisrs)、seqidno:8(edahveh)、seqidno:9(sisrsl)和/或seqidno:21(gesesfedahv)中所示的肽免疫。最优选地,使用如seqidno:7中所示的肽。为了产生针对鼠trem2的抗体,可以使用如seqidno:10(aqvehstsrn)、seqidno:11(egaqveh)、seqidno:12(stsrnq)和/或seqidno:22(ehstsrnqetsfp)中所示的肽免疫。为了产生针对大鼠trem2的抗体,可以使用如seqidno:13(aqvehstssq)、seqidno:14(egaqveh)或seqidno:15(stssqv)中所示的肽免疫。可以购得几种用于进行这样的免疫以产生抗体的工具。
在如上所述通过免疫动物产生抗体后,可以进行表位制图。表位制图是实验鉴定抗体在其靶抗原上的结合位点(即表位)的方法。用于表位制图的几种方法是本领域已知的。
例如,在本发明的背景下,可以通过elisa进行表位制图。因此,可以在培养的细胞中表达trem2胞外域的截短形式(例如茎区的截短形式),并通过使用elisa测试的抗体/纳米抗体检测(参见例如[15])。
另外或可替代地,可以通过免疫印迹进行表位制图。因此,可以在培养的细胞中表达截短形式的trem2胞外域(例如茎区的截短形式),并通过使用免疫印迹测试的抗体/纳米抗体检测。另外,可以通过免疫印迹分析trem2的缺失构建体(例如茎区缺失)。
另外或可替代地,可以通过流式细胞术进行表位制图。因此,可以通过流式细胞术评估与细胞表面上的trem2结合的待测试抗体/纳米抗体的检测。通过使用该方法,可以通过使用trem2缺失构建体(例如具有顺序缺失茎区的构建体)或trem2突变体进行表位制图。
此外,可以在本发明的背景下应用的几种表位制图方法总结于reineke和schutkowski(编辑),methodsofmolecularbiology,epitopemappingprotocols,第524卷,2008,humana出版社。例如,也可以通过以下进行表位制图:重叠肽的蛋白质序列源扫描(肽扫描);用于鉴定抗体结合所需的最小肽长度的截短分析;鉴定对抗体结合重要的关键残基的完全取代分析;和/或顺序c-末端截短的可溶性trem2的表达。
为了鉴定根据本发明的结合分子,可以进行靶接合。靶接合是给定化合物在体内与所需靶相互作用并产生所需结果(例如减少生物标志物如strem2)的验证。因此,可以进行靶接合以验证给定的结合分子(例如,如上所述产生的抗体)在体内,最优选在靶组织中抑制trem2切割,在该情况下可能是中枢神经系统。存在可以用于实现靶接合的几种手段和方法。
例如,在本发明的背景下,可以通过评估组织和/或体液(例如血液、血清、血浆、csf和/或尿液)中可溶性trem2的水平来进行靶接合。因此,可以使用人、小鼠,或人和小鼠二者的组织和/或体液。可以通过使用elisa评估可溶性trem2的水平,例如,如[15]和[17]中所述。
另外或可替代地,可以通过评估组织样品(例如血液、脑、肝和/或脾)中的trem2成熟来进行靶接合。因此,可以使用人、小鼠或二者的组织样品。可以通过使用免疫沉淀和/或免疫印迹来评估trem2成熟。
另外或可替代地,可通过评估待测试结合分子与未暴露于结合分子的对照细胞相比是否增加trem2的表面表达的流式细胞术进行靶接合。
因此,如果在所述结合分子存在下,与未暴露于结合分子的一种或多种对照体液相比,一种或多种体液中的可溶性trem2的量降低,则证明给定结合分子的靶接合;参见例如[15]中描述的方法。另外或可替代地,如果在所述结合分子存在下,与未暴露于结合分子的一种或多种对照组织相比,一种或多种组织中的成熟trem2的量增加,则证明给定结合分子的靶接合;参见例如[15]中描述的方法。
本文中,术语“trem2”是指包含以下或由以下组成的多肽:
(i)seqidno:1-6中任一个的氨基酸序列;或者
(ii)与(i)的氨基酸序列具有至少80%、优选至少90%、更优选至少95%、甚至更优选至少98%、甚至更优选至少99%同一性的氨基酸序列,其中多肽具有诱导小胶质细胞的吞噬、移动和/或存活的活性。
本文提供的结合分子抑制膜结合的trem2的切割。因此,本发明的一个方面涉及本文提供的结合分子,其中trem2是包含以下的多肽或是由以下组成的多肽:
(i)seqidno:1或4的氨基酸序列;或者
(ii)与(i)的氨基酸序列具有至少80%、优选至少90%、更优选至少95%、甚至更优选至少98%、甚至更优选至少99%同一性的氨基酸序列,其中多肽具有促进小胶质细胞(适当)的吞噬、移动、增殖和/或存活的活性。
优选地,结合分子具有促进小胶质细胞(适当)的吞噬的活性。分析给定结合分子是否促进细胞(适当)的吞噬活性的方法是本领域已知的,并且描述于例如[15]中。
本文中术语“trem2的胞外域”是指包含以下或由以下组成的多肽:
(i)seqidno:17或18的氨基酸序列;或者
(ii)与(i)的氨基酸序列具有至少80%、优选至少90%、更优选至少95%、甚至更优选至少98%、甚至更优选至少99%同一性的氨基酸序列,其中当与trem2的细胞内结构域组合时,该多肽具有促进小胶质细胞(适当)的吞噬、移动和/或存活的活性。优选地,该活性是促进小胶质细胞(适当)的吞噬。
his157位于trem2的胞外域/细胞外结构域的所谓茎区。因此,在本发明的背景下设想本文提供的结合分子的结合位点在trem2的茎区内。如本领域已知的,trem2的茎区是ig样结构域和跨膜结构域之间的区域。
本文中术语“trem2的细胞内结构域”是指包含以下或由以下组成的多肽:
(i)seqidno:19或20的氨基酸序列;或者
(ii)与(i)的氨基酸序列具有至少80%、优选至少90%、更优选至少95%、甚至更优选至少98%、甚至更优选至少99%同一性的氨基酸序列,其中当与trem2的胞外域组合时,该多肽具有促进小胶质细胞(适当)的吞噬、移动、增殖和/或存活的活性。优选地,该活性是促进小胶质细胞(适当)的吞噬。
如上所述,本文提供的结合分子适用于治疗和/或预防(优选治疗)神经障碍,如神经变性障碍。因此,本发明的一个方面涉及本文提供的结合分子用于治疗和/或预防神经障碍。本发明还包括药物组合物,其用于治疗和/或预防神经障碍,其中所述药物组合物包含
(i)本发明的结合分子;和
(ii)任选的可药用载体。
因此,本发明提供了用于治疗和/或预防神经障碍的方法,其中该方法包括向需要这种治疗的个体施用有效量的本文提供的结合分子。
为了保证本文提供的结合分子或本文提供的药物组合物在脑中有效,可以应用本领域已知的几种手段和方法。例如,本文提供的结合分子或本文提供的药物组合物可以通过使用渗透泵(例如,
多种神经变性障碍(如ad)的发病机制被认为是由淀粉样-β肽(a-β)的积累引起的,这是由于例如由小胶质细胞过量产生a-β和/或清除机制的失败。a-β自聚集成寡聚体,其可具有各种大小,并在脑实质和血管中形成弥漫性和神经炎斑块(即淀粉样斑块)。a-β寡聚体和斑块是有效的突触毒素(synaptotoxin),其阻断蛋白酶体功能、抑制线粒体活性、改变细胞内ca2+水平并刺激炎症过程。a-β与调节微管相关蛋白tau的磷酸化的信号传导通路相互作用。tau的过度磷酸化破坏了其调节轴突运输的正常功能,并导致积累神经元纤维缠结和可溶性tau的毒性物质。此外,a-β的作用抑制蛋白酶体对过度磷酸化的tau的降解。因此,用本文提供的结合分子活化小胶质细胞的功能代表了治疗和/或预防具有炎性成分的神经障碍;以及与淀粉样斑块积累和/或tau的过度磷酸化相关的障碍的策略。
因此,可用本文提供的结合分子、药物组合物或治疗方法治疗和/或预防的神经障碍可以是具有炎性成分的神经障碍。可用本文提供的结合分子、药物组合物或治疗方法治疗和/或预防的神经障碍优选为神经变性障碍。所述神经变性障碍的特征在于小胶质细胞的功能受损。所述神经变性障碍的特征还在于淀粉样斑块的积累和/或tau的过度磷酸化。例如,用本文提供的结合分子、药物组合物或治疗方法治疗和/或预防的神经变性障碍可以是阿尔茨海默病(ad)、额颞叶变性(ftld)、ftld样综合征、帕金森病、nasu-hakola疾病、多发性硬化(ms)、亨廷顿舞蹈病、免疫介导的神经病或肌萎缩性侧索硬化(als)。可使用本文提供的结合分子、药物组合物或治疗方法治疗和/或预防的神经变性疾病也可以是吉-巴综合征、慢性炎性脱髓鞘性多发性神经病或沙-马-图病。优选地,通过本文提供的手段和方法治疗和/或预防ad。
本文提供的结合分子或药物组合物还可以以联合治疗的形式施用。因此,本发明的一个方面涉及本文提供的结合分子、药物组合物或治疗方法,其中治疗和/或预防是联合治疗,其中所述结合分子或所述药物组合物将同时施用或与另一活性剂顺序施用。其他活性剂优选是用于治疗和/或预防神经障碍如神经变性障碍的药物。例如,所述其他活性剂可以是乙酰胆碱酯酶抑制剂、n-甲基-d-天冬氨酸受体(nmdar)拮抗剂或免疫治疗剂(即抗体)。
已经显示对神经变性障碍如ad具有一定作用的几种乙酰胆碱酯酶抑制剂是本领域已知的,包括他克林(tacrine)、利凡斯的明(rivastigmine)、加兰他敏(galantamine)和多奈哌齐(donepezil)。已经用于治疗神经变性障碍的nmdar拮抗剂是美金刚(memantine)。然而,优选本文提供的结合分子或药物组合物用于与免疫治疗剂的联合治疗中。所述免疫治疗剂可以是a-β免疫治疗剂。例如,所述a-β免疫治疗剂可包含对淀粉样-β肽特异的抗体。在临床试验中存在许多用于淀粉样蛋白相关免疫治疗剂的药物,例如aab-003、aci-24、an-1792、aducanumab、affitopead02、ban2401、bapineuzumab、cad106、crenezumab、gsk933776、
在本发明的一个方面,在患者中治疗和/或预防神经(例如神经变性)障碍,与健康对照者的csf相比所述患者脑脊液(csf)具有增加水平的可溶性trem2(strem2)、总tau和/或磷酸化-tau。另外或可替代地,可以在患者中治疗和/或预防神经(例如神经变性)障碍,与健康对照者的血清相比所述患者血清具有增加水平的可溶性trem2(strem2)、总tau和/或磷酸化-tau。因此,可以在患者中治疗和/或预防神经(例如神经变性)障碍,分别与健康对照者的血清和/或csf相比所述患者血清和/或csf具有增加水平的可溶性trem2(strem2)。如上所述,trem2和tau在神经障碍过程中的变化在本领域中是公知的,并且描述于例如[17-19,36,37]中。
为了鉴定将用本文提供的结合分子或药物组合物治疗的患者,也可以使用成像技术。例如,先进的医学成像与计算机断层扫描(ct)或磁共振成像(mri),或单光子发射计算机断层扫描(spect)或正电子发射断层扫描(pet)可用于帮助诊断神经障碍,如神经变性障碍。
如上所述,p.h157y突变的携带者遭受增加的trem2脱落。因此,抑制his157位上的trem2切割可以特别受益于本文提供的结合分子或药物组合物的施用。因此,本发明的一个方面涉及本文提供的结合分子、药物组合物、治疗方法,其中在携带trem2的p.h157y突变的患者中治疗和/或预防神经变性障碍。
本发明的某些方面由以下项目限定。
1.在髓样细胞2(trem2)上表达的触发受体的胞外域内具有结合位点的结合分子,其中结合分子抑制trem2切割。
2.项目1的结合分子,其中结合位点包含选自以下的至少一个人膜结合trem2的位置:
第148位的谷氨酸(glu148);
第149位的丝氨酸(ser149);
第150位的苯丙氨酸(phe150);
第151位的谷氨酸(glu151);
第152位的天冬氨酸(asp152);
第153位的丙氨酸(ala153);
第154位的组氨酸(his154);
第155位的缬氨酸(val155);
第156位的谷氨酸(glu156);
第157位的组氨酸(his157);
第158位的丝氨酸(ser158);
第159位的异亮氨酸(ile159);
第160位的丝氨酸(ser160);
第161位的精氨酸(arg161);
第162位的丝氨酸(ser162);
第163位的亮氨酸(leu163);
第164位的亮氨酸(leu164);
第165位的谷氨酸(glu165);和
第166位的甘氨酸(gly166)。
3.项目1的结合分子,其中结合位点包含选自以下的至少一个鼠膜结合trem2的位置:
第148位的丝氨酸(ser148);
第149位的丝氨酸(ser149);
第150位的苯丙氨酸(phe150);
第151位的谷氨酸(glu151);
第152位的甘氨酸(gly152);
第153位的丙氨酸(ala153);
第154位的谷氨酰胺(gln154);
第155位的缬氨酸(val155);
第156位的谷氨酸(glu156);
第157位的组氨酸(his157);
第158位的丝氨酸(ser158);
第159位的苏氨酸(thr159);
第160位的丝氨酸(ser160);
精氨酸位于161位(arg161);
第162位的天冬酰胺(asn162);
第163位的谷氨酰胺(gln163);
第164位的谷氨酸(glu164);
第165位的苏氨酸(thr165);和
第166位的丝氨酸(ser166)。
4.项目1-3中任一项的结合分子,其中结合位点包含有具有seqidno:7-15、21和22中任一所示氨基酸序列的任一种多肽,或与具有seqidno:7-15、21和22中任一所示氨基酸序列的任一种多肽重叠。
5.项目1-4中任一项的结合分子,其中结合位点包含trem2的第157位的组氨酸。
6.项目1-5中任一项的结合分子,其中结合分子通过抑制切割酶接近trem2来抑制trem2切割。
7.项目1-6中任一项的结合分子,其中通过免疫印迹、基于elisa定量可溶性trem2、通过表面生物素化测定法定量表面结合的trem2、通过流式细胞术定量表面结合的trem2、通过表面免疫细胞化学定量表面结合的trem2和/或通过基于细胞的elisa技术定量表面结合的trem2来测定trem2切割的抑制。
8.项目1-7中任一项的结合分子,其中在所述结合分子存在下,膜结合的trem2的量比不存在结合分子的情况下膜结合的trem2的量多至少10%。
9.项目6-8中任一项的结合分子,其中切割酶是金属蛋白酶。
10.项目6-9中任一项的结合分子,其中结合分子干扰切割酶与trem2的结合,其中切割酶是含有解联蛋白和金属蛋白酶结构域的蛋白质(adam),或基质金属蛋白酶(mmp)。
11.项目10的结合分子,其中adam是adam10和/或adam17。
12.项目1-11中任一项的结合分子,其中结合分子保留和/或刺激小胶质细胞的活性,和/或其他trem2表达细胞的活性。
13.项目12的结合分子,其中小胶质细胞和/或其他trem2表达细胞的活性是吞噬活性、移动、钙信号传导、syk活化、增殖、炎性细胞因子产生和/或存活的调节。
14.项目1-13中任一项的结合分子,其中结合分子是抗体或小分子。
15.项目14的结合分子,其中抗体是单克隆抗体。
16.项目14或15的结合分子,其中抗体是抗体片段。
17.项目16的结合分子,其中抗体片段是纳米抗体、fab片段、fab’片段、fab’-sh片段、f(ab’)2片段、fd片段、fv片段、scfv片段或分离的互补决定区(cdr)。
18.项目15-17中任一项的结合分子,其中抗体或抗体片段是人源化抗体/抗体片段、全人抗体/抗体片段、小鼠抗体/抗体片段、大鼠抗体/抗体片段、兔抗体/抗体片段、仓鼠抗体/抗体片段、山羊抗体/抗体片段、豚鼠抗体/抗体片段、白鼬抗体/抗体片段、鸡抗体/抗体片段、绵羊抗体/抗体片段或猴抗体/抗体片段。
19.项目15-18中任一项的结合分子,其中抗体是嵌合抗体和/或双特异性抗体。
20.项目14-19中任一项的结合分子,其中抗体是以下抗体中的任一种:
(1)抗体,其中重链可变区包含seqidno:32的序列,轻链可变区包含seqidno:42的序列;其中抗体抑制trem2切割;
(2)抗体,其中重链可变区包含与seqidno:32具有至少85%同一性的序列,轻链可变区包含与seqidno:42具有至少85%同一性的序列;其中抗体抑制trem2切割;
(3)抗体,其中重链可变区的cdr1包含seqidno:52的氨基酸序列;重链可变区的cdr2包含seqidno:62的氨基酸序列;重链可变区的cdr3包含seqidno:72的氨基酸序列;轻链可变区的cdr1包含seqidno:82的氨基酸序列;轻链可变区的cdr2包含seqidno:92的氨基酸序列;轻链可变区的cdr3包含seqidno:102的氨基酸序列;其中抗体抑制trem2切割;或者
(4)抗体,其中重链可变区的cdr1包含与seqidno:52具有至少70%同一性的氨基酸序列;重链可变区的cdr2包含与seqidno:62具有至少70%同一性的氨基酸序列;重链可变区的cdr3包含与seqidno:72具有至少70%同一性的氨基酸序列;轻链可变区的cdr1包含与seqidno:82具有至少70%同一性的氨基酸序列;轻链可变区的cdr2包含与seqidno:92具有至少60%同一性的氨基酸序列;和轻链可变区的cdr3包含与seqidno:102具有至少70%同一性的氨基酸序列;其中抗体抑制trem2切割。
21.项目1-20中任一项的结合分子,其中trem2是包含以下的多肽或是由以下组成的多肽:
(i)seqidno:1-6中任一个的氨基酸序列;或者
(ii)与(i)的氨基酸序列具有至少80%同一性的氨基酸序列,其中所述多肽具有促进小胶质细胞和/或其他trem2表达细胞的适当吞噬、移动和/或存活的活性。
22.项目1-21中任一项的结合分子,其中trem2的胞外域是包含以下的多肽或是由以下组成的多肽:
(i)seqidno:17或18的氨基酸序列;或者
(ii)与(i)的氨基酸序列具有至少80%同一性的氨基酸序列,其中当与trem2的细胞内结构域组合时,该多肽具有促进小胶质细胞和/或其他trem2表达细胞适当的吞噬、移动、增殖和/或存活的活性。
23.项目22的结合分子,其中trem2的细胞内结构域是包含以下的多肽或是由以下组成的多肽:
(i)seqidno:19或20的氨基酸序列;或者
(ii)与(i)的氨基酸序列具有至少80%同一性的氨基酸序列,其中当与trem2的胞外域组合时,该多肽具有促进小胶质细胞和/或其他trem2表达细胞适当的吞噬、移动、增殖和/或存活的活性。
24.项目1-23中任一项的结合分子,其用于治疗和/或预防神经障碍。
25.一种用于治疗和/或预防神经障碍的药物组合物,其中所述药物组合物包含
(i)项目1-23中任一项的结合分子;和
(ii)任选的可药用载体。
26.用于治疗和/或预防神经障碍的方法,其中该方法包括向需要这种治疗的个体施用有效量的项目1-23中任一项的结合分子。
27.根据项目24的用途的结合分子、根据项目25的用途的药物组合物或项目26的方法,其中所述神经障碍是具有炎性成分的神经障碍。
28.根据项目24或27的用途的结合分子、根据项目25或27的用途的药物组合物,或项目26或27的方法,其中所述神经障碍是神经变性障碍。
29.根据项目28的用途的结合分子、根据项目28的用途的药物组合物、或项目28的方法,其中神经变性障碍的特征在于小胶质细胞和/或其他trem2表达细胞的功能降低。
30.根据项目28或29的用途的结合分子、根据项目28或29的用途的药物组合物、或项目28或29的方法,其中所述神经变性障碍的特征在于淀粉样斑块和/或过度磷酸化的tau的积累。
31.根据项目28-30中任一项的用途的结合分子、根据项目28-30中任一项的用途的药物组合物、或项目28-30中任一项的方法,其中所述神经变性障碍是阿尔茨海默病(ad)、额颞叶变性(ftld)、ftld样综合征、帕金森病、nasu-hakola病、多发性硬化(ms)、亨廷顿舞蹈病、免疫介导的神经病或肌萎缩性侧索硬化(als)。
32.根据项目24和27-31中任一项的用途的结合分子、根据项目25和27-31中任一项的用途的药物组合物、或项目26-31中任一项的方法,其中治疗和/或预防是联合治疗,其中所述结合分子或所述药物组合物与另一活性剂同时或顺序施用。
33.根据项目32的用途的结合分子、根据项目32的用途的药物组合物、或项目32的方法,其中所述其他活性剂是乙酰胆碱酯酶抑制剂、n-甲基-d-天冬氨酸受体(nmdar)拮抗剂或免疫治疗剂。
34.根据项目33的用途的结合分子、根据项目33的用途的药物组合物、或项目33的方法,其中所述免疫治疗剂是a-β免疫治疗剂。
35.根据项34的用途的结合分子、根据项34的用途的药物组合物、或项目34的方法,其中所述a-β免疫治疗剂包含对淀粉样-β肽特异的抗体。
36.根据项目24和27-35中任一项的用途的结合分子、根据项目25和27-35中任一项的用途的药物组合物、或项目26-35中任一项的方法,其中治疗和/或预防患者中的神经障碍,与健康对照者的csf相比,所述患者脑脊液(csf)具有增加水平的可溶性trem2(strem2)、总tau和/或磷酸化tau。
37.根据项目24和27-36中任一项的用途的结合分子、根据项目25和27-36中任一项的用途的药物组合物、或项目26-37中任一项的方法,其中治疗和/或预防携带trem2的p.h157y突变的患者中的神经变性障碍。
本文中术语“抗体”包括衍生自、模拟或基本上由一种或多种免疫球蛋白基因或其片段编码的肽或多肽,其能够特异性结合抗原或表位,参见例如[38-40]。术语“抗体”包括保留结合抗原(如trem2)能力的抗原结合部分,即“抗原结合位点”(例如,片段、子序列或互补决定区(cdr)),其包括或替代地由以下组成:例如,(i)fab片段,即由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab’)2片段,即包含在铰链区通过二硫键连接的两个fab片段的二价片段;(iii)fab’片段,即如果f(ab’)2片段通过温和还原分裂,则为所形成的两个片段之一;(iv)fab’-sh片段,即含有游离巯基的fab’片段;(v)由vh和ch1结构域组成的fd片段;(vi)由抗体单臂的vl和vh结构域组成的fv片段;(vii)scfv片段,即单链可变片段,其中重链和轻链的可变区融合在一起;或(viii)分离的互补决定区(cdr)。本文提供的抗体片段也可以是(ix)dab片段,其由vh结构域组成(参见例如ward等人[41])。
本文提供的抗体片段也可以是单结构域抗体sdab。单结构域抗体也称为纳米抗体;参见,例如,gibbs,2005,“nanobodies”,scientificamericanmagazine。sdab或纳米抗体是由单个单体可变抗体结构域组成的抗体片段。分子量仅为12-15kda,单结构域抗体比由两条重链蛋白链和两条轻链组成的常见抗体(150-160kda)小得多,甚至比fab片段(~50kda,一条轻链和半条重链)和单链可变片段(~25kda,两个可变结构域,一个来自轻链,一个来自重链)还要小;参见例如[42]。
本领域已知各种方法可以用于产生这样的抗体和/或片段(参见,例如,[43])。文中缩写“vl”、“vh”、“cl”和“ch”分别指抗体轻链的可变结构域、抗体重链的可变结构域、抗体轻链的恒定结构域和抗体重链的恒定结构域。
例如,可以通过重组技术或全抗体的酶促或化学切割来制备抗体片段。为了产生单链fv(scfv),可以使用重组方法通过合成的接头连接fv片段的两个结构域vl和vh,使得它们能够制成vl和vh区配对以形成单价分子的单个蛋白链(参见,例如,bird等人[44]和[45]。例如[46]和us4,946,778描述了用于产生单链抗体的其他技术。
产生和分离(多克隆和单克隆)抗体的免疫方法是本领域技术人员已知的并且描述在科学和专利文献中(参见,例如,[47-50])。例如,作为使用动物的传统体内方法的补充或替代,也可以通过使用表达重组抗体结合位点的噬菌体展示文库在体外产生抗体(参见例如hoogenboom[51]和katz[52])。
可以通过使用本领域技术人员熟悉的任意各种方法来测定抗体结合抗原(如trem2的胞外域)的能力。例如,可以通过用可检测标记物(如荧光剂、酶标记物或放射性同位素)标记抗体来测定结合。或者,可以通过使用其上具有这样的可检测标记物的二抗来检测抗体与抗原的结合。具体的测定法包括elisa测定法、夹心测定法、放射免疫测定法、免疫组化方法和蛋白质印迹。
例如,可以如下进行针对trem2切割位点的单克隆抗体的产生和选择。包含trem2切割位点的肽(例如包含氨基酸序列ahvehsisrs,seqidno:7的肽)可以在n-末端与卵清蛋白(ova)偶联。可以用ova偶联的肽和不完全弗氏佐剂免疫如小鼠或大鼠的非人动物。6周后,可在融合前3天给予不含不完全弗氏佐剂的加强免疫。可以根据标准方法使用聚乙二醇1500进行骨髓瘤细胞系p3x63-ag8.653与免疫脾细胞的融合(koehler和milstein,nature.1975,256:495-497)。可以在酶联免疫测定法中使用结合抗生物素蛋白包被的板的肽的生物素化形式,测试杂交瘤上清与肽(例如seqidno:7的肽)的结合。可以用针对igg同种型的抗体检测结合的抗体。
可以筛选trem2反应性杂交瘤上清在稳定过表达人野生型trem2的hek293flp-in细胞的细胞表面上检测trem2的能力。kleinberger等人2014描述了该方法。具体地,可以将表达人全长trem2或空载体(对照)的hek293flp-in细胞与相应的trem2反应性上清孵育。可以使用同种型特异性抗体可视化trem2反应性上清的结合。在实施例中给出了产生和选择针对trem2切割位点的单克隆抗体的详细描述。
可用于本发明上下文的抗体可以是例如多克隆或单克隆抗体。如本文所用的术语“单克隆抗体”是指从基本上同质的抗体群获得的抗体,即除了可能以少量存在的可能天然发生的突变之外,构成群的各个抗体是相同的。单克隆抗体是高度特异性的,针对单个抗原位点。单克隆抗体的优点在于它们可以通过杂交瘤培养物合成,基本上不被其他免疫球蛋白污染。修饰语“单克隆”表示抗体的特征是基本上同质的抗体群,而不应解释为需要通过任何特定方法产生抗体。为了制备单克隆抗体,可以使用通过连续细胞培养提供抗体的几种技术。实例包括杂交瘤技术[50]、三源杂交瘤(trioma)技术、人b细胞杂交瘤技术[53]和ebv杂交瘤技术[54]。例如,根据本发明使用的单克隆抗体可以通过kohler和milstein[50]首次描述的杂交瘤方法制备,或者可以通过重组方法(例如,如美国专利号4,816,567中所述)制备。用于本发明的单克隆抗体也可以从噬菌体抗体文库中分离,例如,使用clackson等人[55]以及marks等人[56]描述的技术。
如本文所用的术语“多克隆抗体”是指在一种或多种其他不同抗体中或在其存在下产生的抗体。通常,在几种产生不同抗体的其他b淋巴细胞的存在下,从b淋巴细胞产生多克隆抗体。通常,直接从免疫动物获得多克隆抗体。
本文中,术语“抗体”还包含二克隆和寡克隆抗体。术语“二克隆抗体”是指针对靶蛋白(如trem2的胞外域)的至少两种抗体的制剂。通常,不同的抗体结合不同的表位。术语“寡克隆抗体”是指针对靶蛋白(如trem2的胞外域)的3至100种不同抗体的制剂。通常,这种制剂中的抗体结合一系列不同的表位。
术语“抗体”还涉及双特异性(即双功能)抗体。如本文所用的术语“双特异性抗体”是指具有两个不同重/轻链对和两个不同结合位点的人工杂合抗体。双特异性抗体可以通过多种方法产生,包括杂交瘤的融合或fab’片段的连接(参见,例如,songsivilai等人[57]和kostelny等人[58])。此外,双特异性抗体可以形成为“双抗体”[59]或“janusins”[60]和[61]。术语“抗体”也涉及“三功能抗体”。
本文提供的抗体还可以是全人抗体、小鼠抗体或大鼠抗体。如本文所用的术语“全人抗体”是指仅包含人免疫球蛋白序列的抗体。如果在小鼠、小鼠细胞或源自小鼠细胞的杂交瘤中产生,则全人抗体可含有鼠糖链。或者,如果在大鼠、大鼠细胞、源自大鼠细胞的杂交瘤中产生,则“全人抗体”可含有大鼠糖链。类似地,“(全)小鼠抗体”或“(全)鼠抗体”是指仅包含小鼠(鼠)免疫球蛋白序列的抗体。术语“(全)大鼠抗体”是指仅包含大鼠免疫球蛋白序列的抗体。与此一致,术语“(全)兔抗体”、“(全)仓鼠抗体”、“(全)山羊抗体”、“(全)豚鼠抗体”、“(全)白鼬抗体”、“(全)猫抗体”、“(全)狗抗体”、“(全)鸡抗体”、“(全)绵羊抗体”、“(全)牛抗体”、“(全)马抗体”、“(全)骆驼抗体”和“(全)猴抗体”是指分别只包含兔、仓鼠、山羊、豚鼠、白鼬、猫、狗、鸡、绵羊、牛、马、骆驼或猴子免疫球蛋白序列的抗体。
例如,可以通过噬菌体展示产生全人抗体,噬菌体展示是广泛使用的筛选技术,其能够产生和筛选全人抗体。因此,噬菌体抗体也可用于本发明的背景下。噬菌体展示方法描述于例如us5,403,484、us5,969,108和us5,885,793中。另一种能够开发全人抗体的技术涉及小鼠杂交瘤技术的改进。使小鼠转基因以含有交换其自身小鼠基因的人免疫球蛋白基因座(参见,例如,us5,877,397)。可以类似地产生(全)小鼠或(全)大鼠抗体。
本文提供的抗体也可以是嵌合抗体。术语“嵌合抗体”是指包含与来自另一人或非人物种(例如,小鼠、马、兔、狗、奶牛、鸡)的抗体区(例如,恒定区)融合或嵌合的人或非人物种的可变区的抗体。
本文中,术语“抗体”还涉及重组人抗体、异源抗体和异源杂合抗体。术语“重组人抗体”包括通过重组方法制备、表达、产生或分离的所有人序列抗体,如从人免疫球蛋白基因转基因的动物(例如小鼠)分离的抗体;使用转染到宿主细胞中的重组表达载体表达的抗体;从重组、组合人抗体文库中分离的抗体;或通过任何其他方法(包括将人免疫球蛋白基因序列剪接到其他dna序列)制备、表达、产生或分离的抗体。此类重组人抗体具有源自人种系免疫球蛋白序列的可变区和恒定区(如果存在)。然而,可以对此类抗体进行体外诱变(或者,当使用人ig序列的转基因动物时,进行体内体细胞诱变);因此,重组抗体的vh和vl区的氨基酸序列是源自人种系vh和vl序列并与其相关的序列,其可能不是天然存在于体内的人抗体种系库中。
“异源抗体”是相对于产生这种抗体的转基因非人生物定义的。该术语是指具有对应于不是由转基因非人动物组成的生物体中发现的氨基酸序列或编码核酸序列的抗体,并且所述氨基酸序列或编码核酸序列通常来自不同于转基因非人动物的物种。术语“异源杂合抗体”是指具有不同生物体的轻链和重链的抗体。例如,具有与鼠轻链结合的人重链的抗体是异源杂合抗体。异源杂合抗体的实例包括嵌合和人源化抗体。
本文提供的抗体也可以是人源化抗体。非人(例如鼠或兔)抗体的“人源化”形式是嵌合免疫球蛋白、免疫球蛋白链或其片段(如fv、fab、fab’、fab’-sh、f(ab’)2、fd、scfv、或抗体的其他抗原结合子序列),其含有源自非人免疫球蛋白的最小序列。通常,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体的互补决定区(cdr)的残基被具有所需特异性、亲和力和能力的来自非人物种(例如小鼠、大鼠或兔)的cdr(供体抗体)的残基取代。在一些情况下,人免疫球蛋白的fv框架残基被相应的非人残基取代。人源化抗体可包含残基,其既不存在于受体抗体中也不存在于导入的cdr或框架序列中。进行这些修饰以进一步改进和优化抗体性能。通常,人源化抗体将包含至少一个、通常两个可变结构域的基本上全部,其中所有或基本上所有cdr区对应于非人免疫球蛋白的区,并且所有或基本上所有fr区是人免疫球蛋白共有序列的那些区。人源化抗体还可以包含(通常是人免疫球蛋白的)免疫球蛋白恒定区(fc)的至少一部分。有关详细信息,参见,例如jones等人[62]、riechmann等人[63]和presta等人[64]。而且,转基因动物可用于表达人源化抗体。用于抗体人源化的常用方法包括cdr嫁接,其中来自非人’供体’抗体的功能性抗原结合位点被嫁接到人‘受体’抗体上。cdr嫁接方法是本领域已知的,并描述于例如us5,225,539、us5,693,761和us6,407,213中。另一种相关方法是从转基因动物产生人源化抗体,所述转基因动物经遗传工程化以含有一个或多个人源化免疫球蛋白基因座,其能够进行基因重排和基因转换(参见,例如,us7,129,084)。
因此,在本发明的背景下,术语“抗体”涉及完整的免疫球蛋白分子以及这些免疫球蛋白分子的部分。此外,如上所述,该术语涉及修饰的和/或改变的抗体分子。该术语还涉及重组或合成产生/合成的抗体。该术语还涉及完整抗体及其抗体片段,如分离的轻链和重链、fab、fab’、fab’-sh、fab/c、fv、fd、scfv、di-scfv、sdab、fab’、f(ab’)2、或分离的cdr。本文提供的抗体还可以是双功能抗体、三功能抗体、全人抗体、小鼠抗体、大鼠抗体、兔抗体、嵌合抗体、人源化抗体或抗体构建体,如scfv-或抗体融合蛋白。如上所述,用于产生抗体的技术是本领域熟知的,并总结于例如petering等人[65]。此外,描述了几种用于产生抗体的技术,例如,在harlow"antibodies,alaboratorymanual",cshpress,coldspringharbor,1988中描述的。
本发明的结合分子可以是天然存在的分子,例如,天然存在的抗体。然而,本发明的结合分子也可以是非天然存在的分子。例如,本发明的结合分子可以是具有与天然存在的抗体不同的氨基酸序列的抗体,或者可以是包含至少一个非天然存在的氨基酸残基的抗体,如提供相似侧链功能的合成氨基酸。例如,芳族氨基酸可以被d-或l-萘基丙氨酸、d-或l-苯基甘氨酸、d-或l-2-噻吩基丙氨酸、d-或l-1-、2-、3-或4-芘基丙氨酸、d-或l-3-噻吩基丙氨酸、d-或l-(2-吡啶基)-丙氨酸、d-或l-(3-吡啶基)-丙氨酸、d-或l-(2-吡嗪基)-丙氨酸、d-或l-(4-异丙基)-苯基甘氨酸、d-(三氟甲基)-苯基甘氨酸、d-(三氟甲基)-苯丙氨酸、d-p-氟苯丙氨酸、d-或l-联苯丙氨酸、d-或l-p-甲氧基联苯丙氨酸、d-或l-2-吲哚(烷基)丙氨酸和d-或l-烷基丙氨酸,其中烷基选自取代或未取代的甲基、乙基、丙基、己基、丁基、戊基、异丙基、异丁基和异戊基。可以制备非羧酸化氨基酸以带负电荷,如膦酰基或硫酸化氨基酸所提供的,其被认为是非限制性实例。其他非天然氨基酸是烷基化氨基酸,其通过将烷基与任何天然氨基酸组合制备。碱性天然氨基酸如赖氨酸和精氨酸可以在胺(nh2)官能团处被烷基取代。非天然氨基酸的其他取代包括天冬酰胺或谷氨酰胺的腈衍生物(例如,含有cn-部分代替conh2官能团)和甲硫氨酸的亚砜衍生物。
本文提供的抗体也可以是高亲和力抗体。术语抗体的“高亲和力”是指至少约107m-1、至少约108m-1、至少约109m-1、至少约1010m-1、至少约1011m-1或至少约1012m-1或更高的平衡结合常数(ka),例如,高达1013m-1或1014m-1或更高的平衡结合常数(ka)。然而,“高亲和力”结合可以在抗体同种型之间有所不同。如本文所用,术语“ka”意指特定抗体-抗原相互作用的平衡结合常数。该常数的单位为1/m。“高亲和力抗体”通常是经历广泛超突变、亲和力成熟和适当同种型转换为适用同种型(如优选igg)的抗体。
优选地,本文提供的结合分子特异性结合trem2的胞外域。当提及结合分子时,短语“特异性结合”或“特异性结合”是指专门或主要对靶分子(如trem2的胞外域)具有中等或高结合亲和力的结合分子。短语“特异性结合”是指在异源蛋白群和其他生物制剂存在下测定靶蛋白(如trem2的胞外域)存在的结合反应。因此,在指定的测定条件下,指定的结合分子优先结合特定的靶蛋白(例如trem2的胞外域),并且不会以显著的量结合测试样品中存在的其他组分。在这样的条件下与靶蛋白的特异性结合可能需要选择结合分子对特定靶蛋白的特异性。可以使用多种测定形式来选择与特定靶蛋白特异性反应的结合分子。例如,固相elisa免疫测定法、免疫沉淀、biacore和蛋白印迹可用于鉴定特异性结合trem2胞外域的结合分子。通常,特异反应或选择性反应将是背景信号或噪声的至少两倍,更通常是背景的10倍以上。鉴于结合分子是抗体,短语“特异性结合”是指在异源蛋白群和其他生物制剂中测定抗原(如trem2的胞外域)存在的结合反应。通常,特异性结合其抗原的抗体以至少约1×106m-1或107m-1、或约108m-1至109m-1、或约1010m-1至1011m-1或更高的结合常数(ka)结合所述抗原;和/或以比其对除预定抗原或密切相关抗原之外的非特异性抗原(例如bsa、酪蛋白)的亲和力高至少两倍的亲和力结合预定抗原(例如trem2的胞外域)。
如上所述,本发明涉及用于治疗和/或预防神经障碍如神经变性障碍的结合分子;和包含所述结合分子的药物组合物。所述药物组合物(即药物)任选地包含可药用载体。所述药物组合物可进一步包含治疗上可接受的稀释剂或赋形剂。
通过混合本文提供的结合分子和载体或赋形剂来制备根据本发明的典型药物组合物。合适的载体和赋形剂是本领域技术人员熟知的,并且在例如[66-68]中详细描述。制剂还可包括一种或多种缓冲剂、稳定剂、表面活性剂、润湿剂、润滑剂、乳化剂、悬浮剂、防腐剂、抗氧化剂、不透明剂、助流剂、加工助剂、着色剂、甜味剂、芳香剂、调味剂、稀释剂和其他已知可改善药物外观或有助于制造药物产品(即药物)的添加剂。例如,可以通过将本发明的结合分子在环境温度下,在合适的ph下,以所需的纯度与生理学上可接受的载体(即在所采用的剂量和浓度下对受体无毒的载体)混合,将本发明的药物组合物配制成合适的施用形式。本发明的药物组合物可以是无菌的。
根据本发明的结合分子可以以可药用盐形式存在。术语“可药用盐”是指常规的酸加成盐或碱加成盐,其保留本发明化合物的生物有效性和性质,并且由合适的无毒有机或无机酸或有机或无机碱形成。例如,酸加成盐包括衍生自无机酸的那些和衍生自有机酸的那些,所述无机酸例如盐酸、氢溴酸、氢碘酸、硫酸、氨基磺酸、磷酸和硝酸,所述有机酸例如对甲苯磺酸、水杨酸、甲磺酸、草酸、琥珀酸、柠檬酸、苹果酸、乳酸、富马酸等。碱加成盐包括衍生自铵、钾、钠和季铵氢氧化物的那些,例如氢氧化四甲基铵。将药物化合物化学修饰成盐是药物化学家熟知的技术,以获得改善的化合物的物理和化学稳定性、吸湿性、流动性和溶解性。例如在[69]或[70]中描述。例如,本文提供的化合物的可药用盐可以是钠盐。
以符合良好医学实践的方式配制、给药和施用本发明的药物组合物。在此背景下考虑的因素包括所治疗的特定哺乳动物、个体患者的临床状况、药剂的递送部位、施用方法、施用方案、患者的年龄和性别以及医生已知的其他因素。本文中,“有效量”(也称为“(治疗)有效量”)是指医生或其他临床医师所寻求的引起个体生物或医学反应的化合物的量。本发明的结合分子或本发明的药物组合物的“有效量”将受这些考虑因素控制,并且是抑制待治疗神经障碍的症状所必需的最小量。例如,这样的量可低于对受体细胞或整个哺乳动物有毒的量。
可以通过任何合适的方式施用本发明的结合分子或本发明的药物组合物,包括口服、局部(包括口腔和舌下)、直肠、阴道、经皮、肠胃外、皮下、腹膜内、肺内、皮内、鞘内和硬膜外和鼻内,以及如果需要局部治疗,病灶内施用。肠胃外输注包括肌内、静脉内、动脉内、腹膜内或皮下施用。如上所述,渗透泵可用于将本发明的结合分子或药物组合物直接递送到cns中,例如大脑中。
本发明的结合分子或本发明的药物组合物可以任何方便的施用形式施用,例如片剂、粉剂、胶囊剂、溶液、分散剂、混悬剂、糖浆、喷雾剂、栓剂、凝胶、乳剂、贴剂等。此类组合物可含有药物制剂中的常规组分,例如稀释剂、载体、ph调节剂、甜味剂、填充剂和其他活性剂。
如上所述,本发明的结合分子或本发明的药物组合物可用于预防和/或治疗包括神经变性障碍的神经障碍,如ad。本文使用的术语“治疗(treatment)”、“治疗(treating)”、“治疗(treats)”等通常意指获得所需的药理学和/或生理学效果。就部分或完全治愈疾病和/或归因于疾病的副作用而言,该效果是治疗性的。本文所用的术语“治疗”涵盖对个体疾病的任何治疗,包括:(a)抑制疾病,即阻止其发展,如抑制淀粉样斑块的形成;或(b)改善(即缓解)疾病,即引起疾病消退,如淀粉样斑块的消退。因此,治疗神经障碍如神经变性障碍的化合物是改善和/或抑制神经障碍如神经变性障碍的化合物。优选地,如本文所用的术语“治疗”涉及医学干预已经表现出的神经障碍,如治疗已经明确并表现出的神经变性障碍。本文中术语“预防(preventing)”、“预防(prevention)”或“预防(prevents)”涉及预防性治疗,即其目的是预防而不是治愈疾病的措施或步骤。预防意味着获得所需的药理学和/或生理学效果,其就完全或部分预防疾病或其症状而言是预防性的。因此,本文“预防神经/神经变性障碍”包括预防个体发生神经/神经变性障碍,以及预防神经/神经变性障碍症状的发生。
出于本发明的目的,“个体”(或“患者”)可以是脊椎动物。在本发明的背景下,术语“个体”包括人和其他动物,特别是哺乳动物和其他生物。因此,本文提供的手段和方法适用于人类治疗和兽医应用。因此,本文个体可以是动物,如小鼠、大鼠、仓鼠、兔、山羊、豚鼠、白鼬、猫、狗、鸡、绵羊、牛科物种、马、骆驼或猴子如灵长类动物。优选地,个体是哺乳动物。更优选地,个体是小鼠或人。最优选地,个体是人。
本文中,术语“多肽”包括包含通过肽(酰胺)键连接的氨基酸单体或由其组成的所有分子。因此,术语“多肽”包括所有氨基酸序列,如肽、寡肽、多肽和蛋白质。本文描述的“多肽”可以是天然存在的多肽或非天然存在的多肽。与天然存在的对应物相比,非天然存在的多肽可包含至少一个突变(例如氨基酸取代、氨基酸缺失或氨基酸添加)。非天然存在的多肽也可以克隆到载体中和/或有效连接到不是所述多肽的天然启动子的启动子上。所述启动子可以是组成型活性启动子。本文所用的术语“氨基酸”或“残基”包括天然存在的氨基酸以及其他氨基酸(例如,非天然存在的氨基酸、不是由核酸序列编码的氨基酸、合成氨基酸等)的l-和d-异构体。天然存在的氨基酸的实例是丙氨酸(ala;a)、精氨酸(arg;r)、天冬酰胺(asn;n)、天冬氨酸(asp;d)、半胱氨酸(cys;c)、谷氨酰胺(gln;q)、谷氨酸(glu;e)、甘氨酸(gly;g)、组氨酸(his;h)、异亮氨酸(ile;i)、亮氨酸(leu;l)、赖氨酸(lys;k)、蛋氨酸(met;m)、苯丙氨酸(phe;f)、脯氨酸(pro;p)、丝氨酸(ser;s)、苏氨酸(thr;t)、色氨酸(trp;w)、酪氨酸(tyr;y)、缬氨酸(val;v)。翻译后修饰的天然存在的氨基酸是脱氢酪氨酸(dhb)和labionin(lab)。以上描述了非天然存在的氨基酸的实例。与多肽天然存在形式的氨基酸序列相比,非天然存在的多肽可包含一个或多个非氨基酸取代基或异源氨基酸取代基,例如与氨基酸序列共价或非共价结合的报告分子或另一配体。
在本发明的背景下,术语“同一性”或“同一性百分比”是指氨基酸或核苷酸序列与本文所示序列,例如seqidno:1-6或17-20的那些序列具有至少80%、优选至少90%、更优选至少95%、甚至更优选至少98%、甚至更优选至少99%同一性,其中较高的同一性值优于较低的同一性值。根据本发明,在两个或更多个核酸或氨基酸序列的背景下,术语“一种或多种同一性”或“一种或多种同一性百分比”是指如使用本领域已知的序列比较算法或通过手动比对和目测检查所测量的,当在比较窗口上或在指定区域上比较和比对最大对应性时,两个或更多个相同或具有指定百分比的相同氨基酸残基或核苷酸(例如,与例如seqidno:1-6或17-20的氨基酸序列至少80%、至少90%、至少95%、至少98%或至少99%同一性)的序列。优选地,所描述的同一性存在于本文提供序列的所有氨基酸的长度上。
具有本领域技术的人员将知道如何使用例如基于clustalw计算机程序[71]或fastdb[72]的算法来确定序列之间/中的百分比同一性,如本领域中已知的。本领域技术人员也可以获得blast和blast2.0算法[73-75]。例如,代表基本局部比对搜索工具blast的blast2.0[73-75],可用于搜索局部序列比对。如上所述,blast产生核苷酸和氨基酸序列的比对以确定序列相似性。由于比对的局部性质,blast在确定精确匹配或鉴定相似序列时特别有用。使用blast[73-75]的类似计算机技术用于在核苷酸数据库(如genbank或embl)中搜索相同或相关的分子。
通过参考以下非限制性图、表和实施例进一步描述本发明。
附图和表说明:
图1.trem2胞外域切割位点的鉴定
(a)膜结合的trem2的图示。被adam10脱落后,剩余trem2的c-末端残余部分(stub)被γ-分泌酶在膜内切割。显示了鉴定的导致氨基酸变化的trem2变体。
(b)在hek293细胞中稳定表达的c-末端flag标记的trem2用于鉴定胞外域切割位点。为了富集trem2c-末端片段,在蛋白质提取之前用10μmdapt处理细胞。右图显示了在dapt处理后,通过maldi-tof质谱鉴定的his157之后具有切割的一个突出峰。用adam抑制剂(gm,广谱adam抑制剂;gi,adam10选择性抑制剂)治疗显示没有识别的峰(下图)。
(c)鉴定trem2胞外域切割位点的替代策略。在trem2的氨基酸140之后引入其后带有flag-标签的tev-蛋白酶切割位点。从上清中纯化可溶性trem2。通过tev-蛋白酶切割除去含有ig样v-型结构域的n-末端部分,使用抗-flag抗体纯化剩余的c-末端肽,并通过maldi-tof质谱分析。右图显示了对应于his157后切割的肽的单峰。
(d)pma处理后adam17活性的增加显示单峰,证实h157处的切割而不诱导主要的替代切割产物。
(e)h157位的主要trem2胞外域切割位点的图示。在l163、l164和e165检测到次要的替代切割位点。具有深灰色背景的氨基酸表明trem2跨膜结构域的起始。用框表示用于免疫大鼠以产生切割位点特异性抗体的包含胞外域切割位点的十聚体肽。
图2.患者相关的trem2h157y变体的脱落增加
(a)来自表达ad相关变体p.h157y的细胞的上清中strem2的抗-ha免疫印迹显示与野生型(wt)对照相比增加的strem2水平。ftd样相关trem2突变p.t66m用作减少脱落的对照[15]。
(b)膜结合的trem2的免疫印迹显示成熟trem2水平的降低(未成熟条带上方模糊)。注意,c-末端片段在表达h157y的细胞中也显示降低的水平。9d11抗体用于对人trem2c末端特异的免疫印迹。
(c)strem2水平的定量。
(d)成熟/未成熟trem2水平的定量。
(e)strem2/成熟trem2水平的定量。
(f)未成熟trem2的定量。
(g)trem2ctf/未成熟trem2水平的定量。
(h)成熟的表面暴露的突变体trem2的表面生物素化显示表面结合的p.h157ytrem2的水平降低。ftd样相关trem2突变t66m用作降低细胞表面trem2表达的对照(参见[15])。
(i)通过基于细胞的elisa定量表面结合的trem2显示p.t66m和p.h157ytrem2的表面表达降低。
(j)trem2变体h157y不改变胞外域切割位点的位置。图显示maldi-tof质谱中对应于y157后切割产物的单峰。
图3.表达trem2h157y变体的细胞中吞噬受损
稳定表达trem2-dap12融合构建体的hek293flp-in细胞中phrodo大肠杆菌的吞噬显示与表达野生型(wt)的细胞相比,在孵育1h(灰色)和2h(黑色)后,表达h157y的细胞中吞噬摄取减少。细胞松弛素d(10μm)用作抑制吞噬的阴性对照。ev,空载体对照。
图4.trem2(seqidno:1)的氨基酸149-174的二级结构(s2d方法)的预测。
黑线表示鉴定的切割位点。
图5.trem2(seqidno:1)的氨基酸158-175的二级结构(s2d方法)的预测。
切割的c-末端氨基酸序列(=剩余ctf的n-末端部分)。
图6.trem2(seqidno:1)的氨基酸132-157的二级结构(s2d方法)的预测。
切割的n-末端氨基酸序列(=可溶性trem2的c-末端部分)。
图7.使用切割位点特异性抗体抑制trem2的胞外域脱落
(a)使用所示克隆(50μg/ml终浓度),在24小时抗体处理后,来自条件培养基的可溶性trem2(strem2)和来自稳定过表达wttrem2的hek细胞的膜级分的成熟/未成熟trem2的抗-ha免疫印迹。用灰色框表示选择的最强减少胞外域脱落的抗体克隆。免疫印迹代表两个独立的实验。
(b)elisa介导的strem2定量(n=2)显示针对胞外域切割位点选择的抗体克隆(14d3和14d8,灰色方框)导致strem2水平降低,与adam10抑制剂gi254023x(阳性对照)相当。
(c)成熟trem2(n=2)的免疫印迹的定量分析显示,选择的抗体克隆(14d3和14d8,灰色框)导致成熟trem2的水平增加,与adam10抑制剂gi254023x(阳性对照)相当或甚至更高。
图7b和c中的strem2和成熟trem2的水平表示为平均值±sem,并且归一化至从免疫印迹定量的未成熟trem2的水平。使用对人trem2的c末端特异的单克隆抗体作为阴性对照。notr.:没有处理。
图8.来自产生的一些抗体的可变区的氨基酸序列的比对。
(a)来自可变重链的氨基酸序列的比对。cdr区域被加框。各个抗体克隆之间的序列变异以灰色表示。显示氨基酸编号并根据imgt标准确定cdr。使用clcmain工作台6.9.1生成共有序列、保守百分比和序列标识。*,各个抗体克隆之间氨基酸序列变异的位置。
(b)来自可变轻链的氨基酸序列的比对。cdr区域被加框。各个抗体克隆之间的序列变异以灰色表示。显示氨基酸编号并根据imgt标准确定cdr。使用clcmain工作台6.9.1生成共有序列、保守百分比和序列标识。*,各个抗体克隆之间氨基酸序列变异的位置。
图9.抗体克隆的氨基酸序列以及各自的共有序列。粗体大写字母表示100%的比较序列在该位置具有相同的氨基酸。粗体小写字母表示>50%的比较序列在该位置具有相同的氨基酸。非粗体大写字母表示>80%的比较序列在该位置具有相同的氨基酸。*表示没有确定的共有序列。因此,*可以是任何氨基酸。cdr序列加下划线。
表1.
鉴定的肽列表以及观察到的肽质量与计算的质量的比较。[m+h]+表示单电荷肽。
表2.
鉴定的肽以及观察到的肽质量与计算的质量的比较。[m+h]+表示单电荷肽。
实施例说明了本发明。
实施例1:阿尔茨海默相关的trem2变体发生在adam切割位点并影响脱落和吞噬功能
材料和方法
cdna构建体
通过pcr从cdna克隆(clone693;
细胞培养和同基因细胞系的生成
在含有glutamaxi的dulbecco改良eagle培养基(dmem)中培养flp-in293细胞(hek293flp-in;lifetechnologies),该培养基补充有10%(v/v)胎牛血清(fcs)、zeocin(200mg/ml)和青霉素/链霉素(paalaboratories)。根据制造商的推荐,使用lipofectamine2000进行互补dna(cdna)构建体的转染。为了稳定过表达人trem2cdna构建体,用trem2cdna构建体和pog44(flp-重组酶表达载体;lifetechnologies)共转染hek293flp-in细胞,并用潮霉素b(200mg/ml)选择。如果没有另外说明,用于细胞培养实验的产品获自lifetechnologies。
抗体
对于免疫印迹检测,使用以下抗体:与hrp缀合的大鼠单克隆抗ha(3f10;1:2,000;roche)和针对人trem2的c末端的大鼠单克隆抗体(1:5,dr.kremmer/dr.feederleserviceunitmonoclonalantibodies,helmholtzzentrummünchen提供)。二抗是hrp缀合的山羊抗大鼠igg(1:10,000,santacruzbiotechnology)。
细胞表面生物素化
使用在聚-l-赖氨酸包被的培养皿上过夜生长的稳定过表达trem2cdna构建体的hek293flp-in细胞进行表面生物素化。用冷pbs洗涤细胞三次,并在室温下与含有0.5mg/mlez-link硫代-nhs-lc生物素(pierce)的pbs孵育30分钟。用pbs洗涤细胞三次,并用含有1%牛血清白蛋白(bsa)的50mmnh4cl的pbs溶液在室温下淬灭10分钟。在pbs中另外三次洗涤步骤后,在pbs中收获细胞并在细胞裂解缓冲液(150mmnacl、50mmtris-hcl、ph7.6,2mmedta、1%triton-x100)中在冰上裂解20分钟,该细胞裂解缓冲液新鲜补充有蛋白酶抑制剂混合物(sigma)。使用二喹啉甲酸(bca)方法(pierce)测量蛋白质浓度,并在4℃下对等量蛋白质过夜进行使用链霉亲和素琼脂糖凝胶(gehealthcare)的沉淀。用1ml各sten-nacl(500mmnacl,50mmtris-hcl,ph7.6,2mmedta,0.2%np-40)、sten-sds(150mmnacl,50mmtris-hcl,ph7.6,2mmedta,0.2%np-40,0.1(w/v)sds)、sten(150mmnacl,50mmtris-hcl,ph7.6,2mmedta,0.2%np-40)洗涤链霉亲和素琼脂糖一次,并通过在补充有β-巯基乙醇的2xlaemmli样品缓冲液中在95℃下煮沸10分钟来洗脱蛋白质。注意,在链霉亲和素沉淀的样品的免疫印迹上没有检测到钙联接蛋白反应性,证实了在表面生物素化过程中细胞的完整性。
条件培养基、细胞裂解物和免疫印迹的制备
将稳定过表达trem2或trem2-dap12cdna构建体的hek293flp-in细胞以1.5×105/cm2的密度接种,并在接种48小时后更换培养基。18-20小时后收集条件培养基,立即在冰上冷却,在4℃以13,000rpm离心20分钟,并将上清在-20℃冷冻直至分析。将上清直接进行标准的15%sds-page。为制备膜级分,将细胞用冰冷的pbs洗涤两次,重悬于冰冷的低渗缓冲液(0.01mtris,ph7;1mmedta;1mmegta)中,新鲜补充蛋白酶抑制剂(sigma)并在冰上孵育30分钟。在液氮中快速冷冻以及解冻后,将破环的细胞在4℃以13,000rpm离心45分钟。
将得到的沉淀重悬于ste裂解缓冲液(150mmnacl、50mmtris-hcl、ph7.6,2mmedta、1%triton-x100),在冰上孵育20分钟,并通过在4℃以13,000rpm离心30分钟澄清。使用bca方法测量蛋白质浓度,将等量的蛋白质与补充有β-巯基乙醇的laemmli样品缓冲液混合,通过sds-page分离并转移到聚偏二氟乙烯膜(hybondp;amershambiosciences,aylesbury,uk)上。使用增强的化学发光技术(pierce)通过相应的hrp缀合的二抗可视化结合的抗体。在las-4000图像读取器上进行免疫印迹的定量,并使用multi-gaugev3.0软件(均为fujifilmlifescience)进行分析。
吞噬测定法
使用稳定表达野生型或突变体trem2-dap12融合构建体的hek293flp-in细胞分析荧光大肠杆菌颗粒(phrodogreen,molecularprobes)的吞噬。简而言之,将细胞以2×105(hek293flp-in)个细胞的密度铺板在24-孔板中并培养24至48小时。将phrodo大肠杆菌生物颗粒溶解在pbs中至浓度为1mg/ml,每种条件加入总共50mg的生物颗粒,并在37℃孵育60或120分钟。作为阴性对照,用10mm细胞松弛素d抑制吞噬,在加入phrodo大肠杆菌生物颗粒前30分钟加入该细胞松弛素d。通过胰蛋白酶消化收获细胞,用facs样品缓冲液洗涤两次,并在macsquantvyb流式细胞仪(miltenyibiotec)上通过流式细胞术分析。使用macsquantify软件(miltenyibiotec)进行数据分析。
基于细胞的elisa
将稳定表达空载体(pcdna5tm/frt/to)或trem2cdna(野生型或相应的突变体)的hek293flp-in细胞以15,000个细胞/孔的浓度接种在聚-l-赖氨酸包被的96孔板上。接种后一天,使用含10%bsa的dmem细胞培养基在冰上封闭非特异性结合20分钟。使用hrp偶联的抗ha(3f10;稀释度1:400)在补充有5%bsa的dmem中在冰上染色表面暴露的trem2持续90分钟。通过用dmem和磷酸盐缓冲盐水(pbs)洗涤四次洗去未结合的抗体,并通过加入含100μg/ml四甲基联苯胺(tmb)的底物稀释缓冲液(0.05mna2hpo4,0.025m柠檬酸,ph=5.5;补充有0.75%h2o2)中开始显色反应。加入2nh2so4终止显色反应,用自动读板仪在450nm读取吸光度。
胞外域切割的maldi-tof质谱分析
在pbs中收获稳定表达wt和h157ytrem2的hek293flp-in细胞。将细胞沉淀在-20℃冷冻直至使用。将细胞在含有蛋白酶抑制剂混合物(sigma-aldrich)的裂解缓冲液(4%ddm、0.1%n-辛烷基葡糖苷、10mmtris-hcl,ph8.0、5mmedta和140mmnacl)中在冰上裂解20分钟。在13,000g澄清旋转20分钟后,以100,000g离心1小时对上清进行第二次澄清旋转,并通过在4℃下旋转与抗flagm2-琼脂糖(sigma-aldrich)过夜孵育。用ip/ms缓冲液(0.1%n-辛烷基葡糖苷、10mmtris-hcl,ph8.0、5mmedta和140mmnacl)洗涤珠子四次,并用水洗涤两次。将珠子储存在-20℃直至ip/ms分析。
将trem2wttev-flag构建体瞬时转染到hek293flp-in细胞中。24小时后加入新鲜培养基。72小时后,收集上清并离心以除去细胞碎片。使用1mtris/hcl将上清的ph调节至ph=8.0,加入0.5medta(ph=8.0)(3.75mm终浓度),并通过在4℃旋转将上清与抗flagm2-琼脂糖(sigma-aldrich)过夜孵育。用ip/ms缓冲液(0.1%n-辛烷基葡糖苷、10mmtris-hcl,ph8.0、5mmedta和140mmnacl)洗涤珠子四次,并用水洗涤两次。使用100mm甘氨酸,ph=2.5从珠子上洗脱trem2胞外域,并在冰上孵育10分钟。离心(1,200g,5分钟)后,通过加入1/8体积的1mtris/hclph=8.0迅速中和上清。加入edta、dtt(终浓度分别为0.5mm和1mm)和罗氏完全蛋白酶抑制剂后。加入10单位的actev(lifetechnologies)并在4℃下消化过夜。加入1mlip/ms缓冲液后,加入抗flagm2-琼脂糖(sigma-aldrich),并在4℃下进行免疫沉淀1小时。用ip/ms缓冲液(0.1%n-辛烷基葡糖苷、10mmtris-hcl,ph8.0、5mmedta和140mmnacl)洗涤珠子三次并用水洗涤三次。将珠子储存在-20℃直至ip/ms分析。
如前所述,使用voyagerdestr(appliedbiosystems)进行ip/ms分析。用α-氰基-4-羟基肉桂酸饱和的tfa/ch3cn/水(1:20:20)洗脱免疫沉淀的肽。将溶解的样品在不锈钢板上干燥并进行maldi-tofms分析。
结果与讨论
trem2是i型跨膜糖蛋白,最近与发生迟发性阿尔茨海默病的风险增加有关。图1a给出了迄今为止在文献中报道的trem2变体的概述。已经在生物化学上更详细地研究的变体定位于ig样结构域并且明显通过类似机制发挥其作用(如y38c和t66m,kleinberger等人,2014)。本文已经研究了位于茎区的变体是否对胞外域脱落有影响。开始确定胞外域切割位点。在第一个实验中,免疫沉淀c-末端flag标记的c-末端片段(ctf)。使用dapt作为抑制剂,通过γ-分泌酶抑制实现ctf富集。maldi-tof质谱显示对应于his157的切割c-末端的单个突出峰,而使用gm和gi抑制剂的adam抑制时的质谱未显示任何预期的峰(图1b)。在第二个独立实验中,将tev-flag位点插入茎区,并且在tev消化后免疫沉淀带有n-末端flag标签的短肽。maldi-tof质谱再次鉴定出对应于his157的胞外域切割c-末端的单个突出峰,因此证实了来自第一个实验的发现(图1c)。重要的是,用佛波醇12-豆蔻酸13-乙酸酯(pma)(其导致另外的蛋白酶活化和加速的脱落)处理后,没有鉴定出主要的替代性切割位点(图1d)。图1e显示了茎区内胞外域切割位点的位置。
在迄今为止报道的trem2变体中,有趣的是精确定位于切割位点的一个变体,即h157y。因此分析了该变体对trem2生物化学和功能的影响。图2a、c显示该变体显著增加strem2的水平。此外,膜级分的蛋白质印迹定量揭示了与wt水平相比,显著更少的成熟trem2(图2b,d),表明变体h157y的胞外域脱落的增加甚至更显著(图2e)。定量还揭示了与wt水平相比,大约两倍的未成熟trem2(图2f)。出乎意料的是,观察到变体h157y的ctf水平降低(图2g),而脱落明显升高。蛋白酶抑制剂处理实验将显示该观察结果是否来自早期切割,即溶酶体ctf降解。与观察到的成熟trem2水平的降低一致(图2d),与wt水平相比,细胞表面生物素化显示较低水平的膜结合的全长trem2(图2h)。此外,在基于细胞的elisa中,再次观察到膜结合的trem2水平显著降低(图2i)。maldi-tof质谱显示当使用dapt进行ctf富集时对应于y157的切割c-末端的单个突出峰,表明胞外域切割发生在与wt蛋白完全相同的位点(图2j)。在下文中,在吞噬测定法中研究了膜结合的全长trem2水平降低和strem2水平升高的功能性结果。大肠杆菌phrodo的摄取揭示变体h157y与wttrem2相比的吞噬活性显著受损(图3),这支持了全长膜结合的trem2是发生吞噬所必需的观点。
表1
表2
实施例2:预测trem2茎区的二级结构
材料和方法
为了预测trem2茎区的二级结构,使用如p.sormanni、c.camilloni、p.fariselli和m.vendruscolo所述的s2d方法。具体地,s2d方法基于蛋白质中有序和无序区域的统计群的基于序列的同时预测,并且更详细地描述在sormanni等人[76]中。
结果和讨论
对trem2茎区中二级结构群的预测揭示了蛋白质的该区域显示出显著比例的α-螺旋结构,特别是在切割位点的c末端。因此,抑制α-螺旋介导的蛋白质-蛋白质相互作用(trem2-adam;trem2-mmp)的小分子可以通过如下设计:设计约束α-螺旋肽或通过模拟其热点残基的空间取向匹配α螺旋形貌的蛋白质模拟物,该热点残基即是介导相互作用必不可少的那些残基。这些方法在本领域中是已知的并且在例如azzaritov等人[34]中综述。
trem2茎区的二级结构预测的结果如图4-6所示。在图4中,胞外域切割位点由黑色垂直线表示。
实施例3:对trem2切割位点特异的抗体抑制trem2切割
材料和方法
生成和选择针对trem2切割位点的单克隆抗体
合成包含人trem2同种型1的氨基酸ahvehsisrs(seqidno:7)的肽,并在n-末端与卵清蛋白或生物素偶联(peps4ls,heidelberg,德国)。用含50μgova偶联肽的500μlpbs、5nmolcpg2006(tibmolbiol,berlin,德国)和500μl不完全弗氏佐剂的混合物皮下(s.c.)和腹膜内(i.p.)免疫lou/c大鼠。6周后,腹膜内和皮下给予不含弗氏佐剂的加强免疫,3天后融合。根据标准方法(koehler和milstein,nature.1975,256:495-497)使用聚乙二醇1500进行骨髓瘤细胞系p3x63-ag8.653与大鼠免疫脾细胞的融合。融合后,使用含有20%胎牛血清、青霉素/链霉素、谷氨酰胺、丙酮酸盐和补充有hathybrimax培养基补充剂(sigma)的非必需氨基酸的rpmi1640将细胞铺板在96孔板中。使用与抗生物素蛋白包被的板结合的生物素化肽(0.2μg/ml)在酶联免疫测定法中测试杂交瘤上清。用pbs/2%fcs封闭后,加入杂交瘤上清30分钟。用pbs洗涤一次后,用针对四种大鼠igg同种型的hrp缀合的mab混合物检测结合的抗体。用即用型tmb底物(1-steptmultratmb-elisa,thermo)可视化hrp。
随后筛选trem2反应性上清在稳定过表达人野生型trem2的hek293flp-in细胞的细胞表面上检测trem2的能力(kleinberger等人,2014)。将表达人全长trem2或空载体(=对照)的hek293flp-in细胞在96孔组织培养板中培养,用pbs洗涤两次,用含2%牛血清白蛋白(bsa)的pbs封闭,并在冰上与相应的trem2反应性上清(在封闭缓冲液中1:2稀释)孵育保持60分钟。随后用pbs洗涤细胞三次,在室温下用4%多聚甲醛固定20分钟并用pbs洗涤三次。使用同种型特异性小鼠抗大鼠二抗可视化trem2反应性上清的结合,然后与偶联alexa-488(lifetechnologies)的山羊抗小鼠三抗孵育。使用4’,6-二脒基-2-苯基吲哚(dapi,lifetechnologies)作为核复染剂。使用cytation多检测读取器(biotek)自动获取图像。
通过有限稀释将能够选择性结合细胞表面上的trem2的trem2反应性上清的杂交瘤细胞克隆至少两次。通过elisa测定法测定igg亚类,其中小鼠抗大鼠κ轻链抗体用作捕获抗体和hrp偶联的小鼠抗大鼠igg亚类特异性抗体用于检测。
图8中显示了一些产生的抗体的可变重链和可变轻链的氨基酸序列的比对。相应的序列也显示在图9中。
使用对胞外域切割位点特异的抗体处理稳定过表达wttrem2的hekflp-in细胞
在6孔格式中接种1×106-1.5×106个细胞。24小时后,向细胞中加入新鲜培养基。同时加入由feederle博士(helmholtzcentermunich,corefacilitymonoclonalantibodydevelopment)生成的抗体克隆,即过夜处理(约24小时),终浓度为50μg/ml。第二天,如“条件培养基、细胞裂解物和免疫印迹的制备”中所述收集和处理条件培养基和细胞。
adam10抑制剂gi254023x(5μm终浓度)和对人trem2的c末端特异的对照单克隆抗体分别用作阳性和阴性对照。
strem2elisa
为了定量细胞培养物上清中strem2的水平,使用mesoscalediscoverysectorimager2400建立人strem2的elisa。将链霉亲和素包被的96孔板在4℃下在含有0.5%牛血清白蛋白(bsa)和0.05%tween20的pbs(ph7.4)(封闭缓冲液)中封闭过夜。为了检测人strem2,将板在室温下与在封闭缓冲液中稀释的生物素化多克隆山羊抗人trem2捕获抗体(0.25mg/ml;r&dsystems)振荡1小时。随后用含有0.05%tween20的pbs(洗涤缓冲液)洗涤板四次,并且在室温下与在含有0.25%bsa和0.05%tween20的补充有蛋白酶抑制剂(sigma)的pbs(ph7.4)(测定缓冲液)中以1:4稀释的样品孵育2小时。将重组人trem2蛋白(
结果
trem2在质膜上表达,因此介导小胶质细胞功能,如吞噬和趋化性。由于促进小胶质细胞的吞噬或趋化活性的细胞外因子需要与trem2的细胞外结构域结合以启动下游细胞内信号传导,因此小胶质细胞活性与细胞表面上的全长(即未切割的)trem2的水平相关。本文已经确定了胞外域切割位点,并且推断通过生成针对切割位点的单克隆抗体,将可能可以抑制胞外域切割,从而增加细胞表面上的全长trem2的水平。这反过来会导致增强的trem2相关小胶质细胞的活性。
作为第一步,用组氨酸157和丝氨酸158之间具有切割位点的十体肽(153ahvehsisrs162)(seqidno:7)免疫大鼠。在下文中,从杂交瘤上清中纯化抗体克隆以能够测试细胞培养实验中不同的抗体浓度。具体地,用终浓度50μg/ml的9个不同的抗体克隆处理稳定过表达wttrem2的hek细胞24小时。我们包括单克隆抗体作为阴性对照,其与trem2的c末端结合,因此不应干扰胞外域脱落。我们包括adam10抑制剂gi254023x作为阳性对照,已知其强烈抑制切割(kleinberger等人,2014)。收集条件培养基并进行免疫印迹以研究不同抗体克隆对胞外域切割的影响(图7a)。
如图7a的顶部印迹中所示的strem2水平清楚地显示选择的抗体克隆强烈地降低胞外域切割的程度。这对于克隆14d3和14d8(用方框突出显示)尤其明显。如预期地并且在底部印迹中所显示,对胞外域切割的抑制导致膜级分中成熟trem2的水平相应增加,对于克隆14d3和14d8,与adam10抑制剂gi254023x所见的增加是相当的(如果不高于adam10抑制剂gi254023x所见的增加)。
western印迹仅显示单个实验的结果,其代表了大多数抗体的作用。为了测量每种抗体更稳健的作用,我们然后使用我们先前建立的strem2elisa(kleinberger等人,2014)进行strem2水平的定量。图7b显示从两个独立实验获得的归一化至未成熟trem2水平的elisa数据。与我们的免疫印迹观察一致(图7a),我们使用抗体克隆14d3和14d8鉴定了降低的strem2水平。值得注意的是,克隆14d3减少了约70%的脱落,而用adam10抑制剂gi254023x处理减少了约60%的脱落。对于一些其余抗体克隆(7a12、10c3、15c5、18f9和21a3),我们观察到strem2水平降低的轻微趋势,然而,与克隆14d3和14d8相比不太明显。如所预期的,阴性对照(检测人trem2的c末端的对照抗体)中的strem2水平与未处理细胞的上清中的数量级相同。
我们还定量分析了来自免疫印迹的成熟trem2的水平。图7c显示从两个独立实验获得的膜级分中归一化至未成熟trem2水平的成熟trem2水平。与strem2的减少非常一致(图7b),我们鉴定了抗体克隆14d3和14d8的膜级分中成熟trem2水平的增加。更具体地,显示strem2最强降低的克隆14d3在膜级分中表现出最强增加成熟trem2。此外,对于克隆7a12、8a11和10c3另外检测到膜级分中trem2水平的增加。如所预期地,在测试的所有条件下gi处理产生增加水平的成熟trem2。
总之,可以得出结论,使用本文提供的针对胞外域切割位点的抗体克隆可以抑制胞外域脱落。特别地,克隆14d3使strem2减少约70%,同时使成熟trem2的水平增加高达五倍。克隆14d8给出了类似的结果,然而,与克隆14d3相比,其更温和。
本发明涉及以下核苷酸和氨基酸序列:
seqidno:1:人trem2,膜结合的
>sp|q9nzc2-1|trem2_human在髓样细胞2上表达的触发受体os=人(homosapiens)gn=trem2pe=1sv=1
seqidno:2:人trem2,可选择的剪接变体(分泌trem2)
>sp|q9nzc2-2|trem2_human髓样细胞2上表达的触发受体的同种型2os=人gn=trem2
seqidno:3:人trem2,可选择的剪接变体(分泌trem2)
>sp|q9nzc2-3|trem2_human在髓样细胞2上表达的触发受体的同种型3os=人gn=trem2
seqidno:4:鼠trem2,膜结合
>sp|q99nh8|trem2_mouse在髓样细胞2上表达的触发受体os=小鼠(musmusculus)gn=trem2pe=1sv=1
seqidno:5:鼠trem2,可选择的剪接变体(分泌trem2)>sp|q99nh8-2|trem2_mouse在髓样细胞2上表达的触发受体的同种型2os=小鼠gn=trem2
mgplhqfllllitalsqalnttvlqgmagqslrvsctydalkhwgr
seqidno:6:大鼠trem2
>tr|d3zz89|d3zz89_rat蛋白质trem2os=大鼠(rattusnorvegicus)gn=trem2pe=4sv=1
seqidno:7:用于免疫以生成针对人trem2的抗体的肽
ahvehsisrs
seqidno:8:用于免疫以生成针对人trem2的抗体的肽
edahveh
seqidno:9:用于免疫以生成针对人trem2的抗体的肽
sisrsl
seqidno:10:用于免疫以生成针对鼠trem2的抗体的肽
aqvehstsrn
seqidno:11:用于免疫以生成针对鼠trem2的抗体的肽
egaqveh
seqidno:12:用于免疫以生成针对鼠trem2的抗体的肽
stsrnq
seqidno:13:用于免疫以生成针对大鼠trem2的抗体的肽
aqvehstssq
seqidno:14:用于免疫以生成针对大鼠trem2的抗体的肽
egaqveh
seqidno:15:用于免疫以生成针对大鼠trem2的抗体的肽
stssqv
seqidno:16:人trem2内的氨基酸段,其中可以预测adam10的最小切割位点
seqidno:17:人trem2的胞外域
seqidno:18:鼠trem2的胞外域
seqidno:19:人trem2的细胞内结构域
seqidno:20:鼠trem2的细胞内结构域
seqidno:21:用于免疫以生成针对人trem2的抗体的肽
gesesfedahv
seqidno:22:用于免疫以生成针对鼠trem2的抗体的肽
ehstsrnqetsfp
进一步的序列如图9所示。
参考文献列表
1.przedborski,s.,m.vila和v.jackson-lewis,neurodegeneration:whatisitandwherearewe?jclininvest,2003.111(1):第3-10页。
2.lyman,m.等人,neuroinflammation:theroleandconsequences.neuroscires,2014.79:第1-12页。
3.villegas-llerena,c.等人,microglialgenesregulatingneuroinflammationintheprogressionofalzheimer’sdisease.curropinneurobiol,2016.36:第74-81页。
4.klunemann,h.h.等人,thegeneticcausesofbasalgangliacalcification,dementia,andbonecysts:dap12andtrem2.neurology,2005.64(9):第1502-7页。
5.guerreiro,r.j.等人,usingexomesequencingtorevealmutationsintrem2presentingasafrontotemporaldementia-likesyndromewithoutboneinvolvement.jamaneurol,2013.70(1):第78-84页。
6.borroni,b.等人,heterozygoustrem2mutationsinfrontotemporaldementia.neurobiolaging,2014.35(4):第934e7-10页。
7.cady,j.等人,trem2variantp.r47hasariskfactorforsporadicamyotrophiclateralsclerosis.jamaneurol,2014.71(4):第449-53页。
8.cuyvers,e.等人,investigatingtheroleofrareheterozygoustrem2variantsinalzheimer’sdiseaseandfrontotemporaldementia.neurobiolaging,2014.35(3):第726e11-9页。
9.guerreiro,r.等人,trem2variantsinalzheimer’sdisease.nengljmed,2013.368(2):第117-27页。
10.jonsson,t.等人,variantoftrem2associatedwiththeriskofalzheimer’sdisease.nengljmed,2013.368(2):第107-16页。
11.rayaprolu,s.等人,trem2inneurodegeneration:evidenceforassociationofthep.r47hvariantwithfrontotemporaldementiaandparkinson’sdisease.molneurodegener,2013.8:第19页。
12.colonna,m.andy.wang,trem2variants:newkeystodecipheralzheimerdiseasepathogenesis.natrevneurosci,2016.17(4):第201-7页。
13.ulrich,j.d.andd.m.holtzman,trem2functioninalzheimer’sdiseaseandneurodegeneration.acschemneurosci,2016.7(4):第420-7页。
14.prada,i.等人,triggeringreceptorexpressedinmyeloidcells2(trem2)traffickinginmicroglialcells:continuousshuttlingtoandfromtheplasmamembraneregulatedbycellstimulation.neuroscience,2006.140(4):第1139-48页。
15.kleinberger,g.等人,trem2mutationsimplicatedinneurodegenerationimpaircellsurfacetransportandphagocytosis.scitranslmed,2014.6(243):第243ra86页。
16.wunderlich,p.等人,sequentialproteolyticprocessingofthetriggeringreceptorexpressedonmyeloidcells-2(trem2)proteinbyectodomainsheddingandgamma-secretase-dependentintramembranouscleavage.jbiolchem,2013.288(46):第33027-36页。
17.suarez-calvet,m.等人,strem2cerebrospinalfluidlevelsareapotentialbiomarkerformicrogliaactivityinearly-stagealzheimer’sdiseaseandassociatewithneuronalinjurymarkers.embomolmed,2016.8(5):第466-76页。
18.piccio,l.等人,cerebrospinalfluidsolubletrem2ishigherinalzheimerdiseaseandassociatedwithmutationstatus.actaneuropathol,2016.131(6):第925-33页。
19.heslegrave,a.等人,increasedcerebrospinalfluidsolubletrem2concentrationinalzheimer’sdisease.molneurodegener,2016.11:第3页。
20.glebov,k.等人,functionalinvolvementofgamma-secretaseinsignalingofthetriggeringreceptorexpressedonmyeloidcells-2(trem2).jneuroinflammation,2016.13:第17页。
21.park,j.s.等人,disease-associatedmutationsoftrem2altertheprocessingofn-linkedoligosaccharidesinthegolgiapparatus.traffic,2015.16(5):第510-8页。
22.jay,t.r.等人,trem2deficiencyeliminatestrem2+inflammatorymacrophagesandamelioratespathologyinalzheimer’sdiseasemousemodels.jexpmed,2015.212(3):第287-95页。
23.wang,y.等人,trem2lipidsensingsustainsthemicroglialresponseinanalzheimer’sdiseasemodel.cell,2015.160(6):第1061-71页。
24.wang,y.等人,trem2-mediatedearlymicroglialresponselimitsdiffusionandtoxicityofamyloidplaques.jexpmed,2016.213(5):第667-75页。
25.yuan,p.等人,trem2haplodeficiencyinmiceandhumansimpairsthemicrogliabarrierfunctionleadingtodecreasedamyloidcompactionandsevereaxonaldystrophy.neuron,2016.90(4):第724-39页。
26.xiang,x.等人,trem2deficiencyreducestheefficacyofimmunotherapeuticamyloidclearance.embomolmed,2016页。
27.jin,s.c.等人,codingvariantsintrem2increaseriskforalzheimer’sdisease.hummolgenet,2014.23(21):第5838-46页。
28.jin,s.c.等人,trem2isassociatedwithincreasedriskforalzheimer’sdiseaseinafricanamericans.molneurodegener,2015.10:第19页。
29.jiang,t.等人,ararecodingvariantintrem2increasesriskforalzheimer’sdiseaseinhanchinese.neurobiolaging,2016.42:第217e1-3页。
30.rubinsztein,d.c.,therolesofintracellularprotein-degradationpathwaysinneurodegeneration.nature,2006.443(7113):第780-6页。
31.bredesen,d.e.,r.v.rao和p.mehlen,celldeathinthenervoussystem.nature,2006.443(7113):第796-802页。
32.piccio,l.等人,identificationofsolubletrem-2inthecerebrospinalfluidanditsassociationwithmultiplesclerosisandcnsinflammation.brain,2008.131(pt11):第3081-91页。
33.heneka,m.t.等人,nlrp3isactivatedinalzheimer’sdiseaseandcontributestopathologyinapp/ps1mice.nature,2013.493(7434):第674-8页。
34.azzarito,v.等人,inhibitionofalpha-helix-mediatedprotein-proteininteractionsusingdesignedmolecules.natchem,2013.5(3):第161-73页。
35.rissiek,b.,f.koch-nolte和t.magnus,nanobodiesasmodulatorsofinflammation:potentialapplicationsforacutebraininjury.frontcellneurosci,2014.8:第344页。
36.mattsson,n.等人,csfproteinbiomarkerspredictinglongitudinalreductionofcsfbeta-amyloid42incognitivelyhealthyelders.translpsychiatry,2013.3:第e293页。
37.bateman,r.j.等人,clinicalandbiomarkerchangesindominantlyinheritedalzheimer’sdisease.nengljmed,2012.367(9):第795-804页。
38.we,p.,fundamentalimmunology,thirdedition.thirdeditioned,ed.w.e.paul.1993:ravenpress,n.y.页。
39.wilson,k.m.等人,simplifiedconjugationchemistryforcouplingpeptidestof(ab’)fragments:autologousredcellagglutinationassayforhiv-1antibodies.jimmunolmethods,1994.175(2):第267-73页。
40.yarmush,m.l.,x.m.lu和d.m.yarmush,couplingofantibody-bindingfragmentstosolid-phasesupports:site-directedbindingoff(ab’)2fragments.jbiochembiophysmethods,1992.25(4):第285-97页。
41.ward,e.s.等人,bindingactivitiesofarepertoireofsingleimmunoglobulinvariabledomainssecretedfromescherichiacoli.nature,1989.341(6242):第544-6页。
42.harmsen,m.m.andh.j.dehaard,properties,production,andapplicationsofcamelidsingle-domainantibodyfragments.applmicrobiolbiotechnol,2007.77(1):第13-22页。
43.harlow,antibodies,alaboratorymanual.1988:coldspringharborpublications,newyork页。
44.bird,r.e.等人,single-chainantigen-bindingproteins.science,1988.242(4877):第423-6页。
45.huston,j.s.等人,proteinengineeringofantibodybindingsites:recoveryofspecificactivityinananti-digoxinsingle-chainfvanalogueproducedinescherichiacoli.procnatlacadsciusa,1988.85(16):第5879-83页。
46.pluckthun,thepharmacologyofmonoclonalantibodies.vol.113.1994:rosenburgandmooreeds.springer-verlag,n.y页。
47.coligan,currentprotocolsinimmunology.1991:wiley/greene,n.y页。
48.stites,basicandclinicalimmunology.7theded.:langemedicalpublications,losaltos,calif.(“stites”页。
49.goding,monoclonalantibodies:principlesandpractice.2deded.1986:academicpress,newyork,n.y页。
50.kohler,g.andc.milstein,continuousculturesoffusedcellssecretingantibodyofpredefinedspecificity.nature,1975.256(5517):第495-7页。
51.hoogenboom,h.r.,designingandoptimizinglibraryselectionstrategiesforgeneratinghigh-affinityantibodies.trendsbiotechnol,1997.15(2):第62-70页。
52.katz,b.a.,structuralandmechanisticdeterminantsofaffinityandspecificityofligandsdiscoveredorengineeredbyphagedisplay.annurevbiophysbiomolstruct,1997.26:第27-45页。
53.kozbor,d.andj.c.roder,theproductionofmonoclonalantibodiesfromhumanlymphocytes.immunoltoday,1983.4(3):第72-9页。
54.cole,monoclonalantibodiesandcancertherapy.1985:alanr.liss,inc页。
55.clackson,t.等人,makingantibodyfragmentsusingphagedisplaylibraries.nature,1991.352(6336):第624-8页。
56.marks,j.d.等人,by-passingimmunization.humanantibodiesfromv-genelibrariesdisplayedonphage.jmolbiol,1991.222(3):第581-97页。
57.songsivilai,s.andp.j.lachmann,bispecificantibody:atoolfordiagnosisandtreatmentofdisease.clinexpimmunol,1990.79(3):第315-21页。
58.kostelny,s.a.,m.s.cole和j.y.tso,formationofabispecificantibodybytheuseofleucinezippers.jimmunol,1992.148(5):第1547-53页。
59.holliger,p.,t.prospero和g.winter,"diabodies":smallbivalentandbispecificantibodyfragments.procnatlacadsciusa,1993.90(14):第6444-8页。
60.traunecker,a.,a.lanzavecchia和k.karjalainen,bispecificsinglechainmolecules(janusins)targetcytotoxiclymphocytesonhivinfectedcells.emboj,1991.10(12):第3655-9页。
61.traunecker,a.,a.lanzavecchia和k.karjalainen,janusin:newmoleculardesignforbispecificreagents.intjcancersuppl,1992.7:第51-2页。
62.jones,p.t.等人,replacingthecomplementarity-determiningregionsinahumanantibodywiththosefromamouse.nature,1986.321(6069):第522-5页。
63.riechmann,l.等人,reshapinghumanantibodiesfortherapy.nature,1988.332(6162):第323-7页。
64.presta,l.g.,antibodyengineering.curropinbiotechnol,1992.3(4):第394-8页。
65.petering,j.,p.mcmanamny和j.honeyman,antibodytherapeutics-theevolvingpatentlandscape.nbiotechnol,2011.28(5):第538-44页。
66.ansel,ansel’spharmaceuticaldosageformsanddrugdeliverysystems.2004:philadelphia:lippincott,williams&wilkins页。
67.gennaroandremington,thescienceandpracticeofpharmacy.2000:philadelphia:lippincott,williams&wilkins页。
68.rowe,handbookofpharmaceuticalexcipients.2005:chicago,pharmaceuticalpress页。
69.bastin,r.,m.bowker和b.slater,saltselectionandoptimisationproceduresforpharmaceuticalnewchemicalentities.org.proc.res.dev.,2000.4(5):第427–435页。
70.ansel,pharmaceuticaldosageformsanddrugdeliverysystems.6thed.ed.1995页。
71.thompson,j.d.,d.g.higgins和t.j.gibson,clustalw:improvingthesensitivityofprogressivemultiplesequencealignmentthroughsequenceweighting,position-specificgappenaltiesandweightmatrixchoice.nucleicacidsres,1994.22(22):第4673-80页。
72.brutlag,d.l.等人,improvedsensitivityofbiologicalsequencedatabasesearches.computapplbiosci,1990.6(3):第237-45页。
73.altschul,s.f.等人,gappedblastandpsi-blast:anewgenerationofproteindatabasesearchprograms.nucleicacidsres,1997.25(17):第3389-402页。
74.altschul,s.f.,aproteinalignmentscoringsystemsensitiveatallevolutionarydistances.jmolevol,1993.36(3):第290-300页。
75.altschul,s.f.等人,basiclocalalignmentsearchtool.jmolbiol,1990.215(3):第403-10页。
76.sormanni,p.等人,thes2dmethod:simultaneoussequence-basedpredictionofthestatisticalpopulationsoforderedanddisorderedregionsinproteins.jmolbiol,2015.427(4):第982-96页。
- 还没有人留言评论。精彩留言会获得点赞!