抗TIM-3抗体及其使用方法与流程
本申请案要求2016年5月27日提交的美国临时申请第62/342,610号和2016年11月10提交的美国临时申请第62/420,276号的权益,其各自通过引用整体并入本文。
2.技术领域
本公开涉及与tim-3(例如人tim-3)特异性结合的抗体及其使用方法。
3.
背景技术:
蛋白t细胞免疫球蛋白和粘蛋白结构域-3(tim-3)是免疫球蛋白(ig)超家族的i型膜蛋白。其具有胞外ig可变样(igv)结构域、胞外粘蛋白样结构域和具有6个保守性酪氨酸残基的胞质结构域(monney等人(2002)nature415:536-41)。tim-3在活化的1型辅助性t(th1)淋巴细胞和cd8+t(tc1)淋巴细胞、一些巨噬细胞(monney等人(2002)nature415:536-41)、活化自然杀伤(nk)细胞(ndhlovu等人(2012)blood119(16):3734-43)及生成il-17的th17细胞(nakae等人(2007)jleukocbiol81:1258-68)上表达。
研究已经表明tim-3起到抑制t细胞、骨髓细胞和nk细胞介导的应答和促进免疫耐受性的作用。例如,与免疫球蛋白结构域融合,结合并中和tim-3配体的tim-3igv肽,在免疫小鼠中引起th1细胞过度增殖和th1细胞因子释放(sabatos等人(2003)natimmunol4:1102-10)。实际上,体内施用抗tim-3抗体增强实验性自身免疫性脑脊髓炎(即多发性硬化动物模型)的病理严重程度(monney等人(2002)nature415:536-41)。而且,在癌症患者的cd8+t细胞中tim-3表达上调。例如,晚期黑素瘤患者中大约30%的ny-eso-1特异性cd8+t细胞表现出tim-3表达上调(fourcade等人(2010)jexpmed207:2175–86)。
鉴于人tim-3在调节免疫应答方面的明显作用,设计为拮抗tim-3信号传导的治疗剂对治疗涉及tim-3介导的免疫抑制的疾病很有希望。
4.发明概要
本公开提供了与tim-3(例如,人tim-3)特异性结合并拮抗tim-3功能,例如tim-3介导的免疫抑制的抗体。还提供了包含这些抗体的药物组合物,编码这些抗体的核酸,用于制备这些抗体的表达载体和宿主细胞,及使用这些抗体治疗受试者的方法。本文公开的抗体对于增加响应于抗原(例如,肿瘤抗原或感染性疾病抗原)的t细胞活化和/或降低treg介导的免疫抑制特别有用,并且因此对于治疗受试者癌症或对于治疗或预防受试者的感染性疾病特别有用。
因此,一方面,本公开提供了一种抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中:
(a)cdrh1包含x1x2x3x4x5s(seqidno:48)的氨基酸序列,其中
x1为r、s、a、g、k、m或t,
x2为q、s、a、g、r或t,
x3为n、y、g或q,
x4为a或q,并且
x5为w、m、a、s或t;
(b)cdrh2包含wvsaisgsggsty(seqidno:2)的氨基酸序列;
(c)cdrh3包含akggdyggnyfd(seqidno:3)的氨基酸序列;
(d)cdrl1包含x1asqsvx2ssyla(seqidno:52)的氨基酸序列,其中
x1为r或g,并且
x2不存在或为s;
(e)cdrl2包含x1asx2rat(seqidno:53)的氨基酸序列,
其中
x1为d或g,并且
x2为n、s或t;并且
(f)cdrl3包含qqygsspx1t(seqidno:54)的氨基酸序列,其中x1为l或i。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中:
(a)cdrh1包含x1x2x3x4x5s(seqidno:48)的氨基酸序列,其中
x1为r、s、a、g、k、m或t,
x2为q、s、a、g、r或t,
x3为n、y、g或q,
x4为a或q,并且
x5为w、m、a、s或t;
(b)cdrh2包含wvsaisgsggsty(seqidno:2)的氨基酸序列;
(c)cdrh3包含akggdyggnyfd(seqidno:3)的氨基酸序列;
(d)cdrl1包含x1asqsvx2ssyla(seqidno:52)的氨基酸序列,其中
x1为r或g,并且
x2不存在或为s;
(e)cdrl2包含x1asx2rat(seqidno:53)的氨基酸序列,
其中
x1为d或g,并且
x2为n、s或t;并且
(f)cdrl3包含qqygsspx1t(seqidno:54)的氨基酸序列,其中x1为l或i。
另一方面,本公开提供了一种抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区具有互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区具有互补决定区cdrl1、cdrl2和cdrl3,其中所述抗体在与表达人tim-3的细胞结合后内化,并且其中cdrh3包含akggdyggnyfd(seqidno:3)的氨基酸序列。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含重链可变区和轻链可变区,所述重链可变区具有互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区具有互补决定区cdrl1、cdrl2和cdrl3,其中所述抗体在与表达人tim-3的细胞结合后内化,并且其中cdrh3包含akggdyggnyfd(seqidno:3)的氨基酸序列。
在某些实施方案中:
(a)cdrh1包含x1x2x3x4x5s(seqidno:48)的氨基酸序列,其中
x1为r、s、a、g、k、m或t,
x2为q、s、a、g、r或t,
x3为n、y、g或q,
x4为a或q,并且
x5为w、m、a、s或t;
(b)cdrh2包含wvsaisgsggsty(seqidno:2)的氨基酸序列;
(c)cdrl1包含x1asqsvx2ssyla(seqidno:52)的氨基酸序列,其中
x1为r或g,并且
x2不存在或为s;
(d)cdrl2包含x1asx2rat(seqidno:53)的氨基酸序列,
其中
x1为d或g,并且
x2为n、s或t;并且
(e)cdrl3包含qqygsspx1t(seqidno:54)的氨基酸序列,其中x1为l或i。
在某些实施方案中,cdrh1包含x1x2naws(seqidno:49)的氨基酸序列,其中:x1为r或a;并且x2为q或r。在某些实施方案中,cdrh1包含x1x2gqx3s(seqidno:50)的氨基酸序列,其中:x1为k、m或g;x2为a或s;并且x3为s或t。在某些实施方案中,cdrh1包含x1x2qqas(seqidno:51)的氨基酸序列,其中:x1为s、r、t或g;并且x2为a、s、t或g。在某些实施方案中,cdrh1包含选自seqidno:1和4-12的氨基酸序列。
在某些实施方案中,cdrl1包含选自seqidno:13-16的氨基酸序列。在某些实施方案中,cdrl2包含选自seqidno:17-21的氨基酸序列。在某些实施方案中,cdrl3包含选自seqidno:22和23的氨基酸序列。
在某些实施方案中,cdrh1、cdrh2和cdrh3分别包含seqidno:1、2和3;4、2和3;5、2和3;6、2和3;7、2和3;8、2和3;9、2和3;10、2和3;11、2和3;或12、2和3中所列的cdrh1、cdrh2和cdrh3氨基酸序列。
在某些实施方案中,cdrl1、cdrl2和cdrl3分别包含seqidno:13、17和22;14、17和22;15、18和22;14、19和22;14、20和22;14、21和22;16、20和22;或14、17和23中所列的cdrl1、cdrl2和cdrl3氨基酸序列。
在某些实施方案中,cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:1、2、3、14、21和22;4、2、3、14、21和22;5、2、3、14、21和22;6、2、3、14、21和22;7、2、3、14、21和22;8、2、3、14、21和22;9、2、3、14、21和22;10、2、3、14、21和22;11、2、3、14、21和22;或12、2、3、14、21和22中所列的氨基酸序列。
另一方面,本公开提供了一种抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:1、2、3、14、21和22中所列的氨基酸序列。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:1、2、3、14、21和22中所列的氨基酸序列。
另一方面,本公开提供了一种抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:5、2、3、14、21和22中所列的氨基酸序列。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:5、2、3、14、21和22中所列的氨基酸序列。
另一方面,本公开提供了一种抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:9、2、3、14、21和22中所列的氨基酸序列。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:9、2、3、14、21和22中所列的氨基酸序列。
另一方面,本公开提供了一种抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:1、2、3、15、18和22中所列的氨基酸序列。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其包含重链可变区和轻链可变区,所述重链可变区包含互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含互补决定区cdrl1、cdrl2和cdrl3,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3分别包含seqidno:1、2、3、15、18和22中所列的氨基酸序列。
在某些实施方案中,所述抗体在与表达人tim-3的细胞结合后内化。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其中所述抗体在与表达人tim-3的细胞结合后内化。
在某些实施方案中,在包括以下步骤的测定中,在所述抗体存在下比在1944w(igg1n297a)存在下相比存活的所述表达人tim-3的细胞的百分比低:(a)按每孔2x104个细胞将所述表达人tim-3的细胞铺板在组织培养板中;(b)按100μl/孔的最终体积,添加1111ng/ml的αhfc-nc-dm1和1111ng/ml的所述抗体或pab1944w(igg1n297a);(c)在37℃和5%co2下孵育72小时;(d)测量所述表达人tim-3的细胞的存活;并且(e)计算相对于未经处理的表达人tim-3的细胞的细胞存活百分比。在某些实施方案中,在所述抗体存在下的细胞存活百分比比在pab1944w(igg1n297a)存在下的细胞存活百分比低至少50%。在某些实施方案中,所述表达人tim-3的细胞是kasumi-3细胞。在某些实施方案中,所述表达人tim-3的细胞是kasumi-3细胞(
在某些实施方案中,在包括以下步骤的测定中,在所述抗体存在下比在hum11(igg4s228p)存在下存活的所述表达人tim-3的细胞的百分比低:(a)按每孔2x104个细胞将所述表达人tim-3的细胞铺板在组织培养板中;(b)按100μl/孔的最终体积,添加1111ng/ml的αhfc-nc-dm1和1111ng/ml的所述抗体或hum11(igg4s228p);(c)在37℃和5%co2下孵育72小时;(d)测量所述表达人tim-3的细胞的存活;并且(e)计算相对于未经处理的表达人tim-3的细胞的细胞存活百分比。在某些实施方案中,在所述抗体存在下的细胞存活百分比比在hum11(igg4s228p)存在下的细胞存活百分比低至少50%。在某些实施方案中,所述表达人tim-3的细胞是kasumi-3细胞。在某些实施方案中,所述表达人tim-3的细胞是kasumi-3细胞(
在某些实施方案中,所述抗体包含含有seqidno:55的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含重链可变区,所述重链可变区包含与选自seqidno:24-35的氨基酸序列至少75%、80%、85%、90%、95%或100%相同的氨基酸序列。在某些实施方案中,所述重链可变区包含选自seqidno:24-35的氨基酸序列。在某些实施方案中,所述重链可变区包含seqidno:25的氨基酸序列。在某些实施方案中,所述重链可变区包含seqidno:28的氨基酸序列。在某些实施方案中,所述重链可变区包含seqidno:32的氨基酸序列。在某些实施方案中,如本文所述的抗体的重链可变区的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
在某些实施方案中,所述抗体包含含有seqidno:56的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含轻链可变区,所述轻链可变区包含与选自seqidno:36-47的氨基酸序列至少75%、80%、85%、90%、95%或100%相同的氨基酸序列。在某些实施方案中,所述轻链可变区包含选自seqidno:36-47的氨基酸序列。在某些实施方案中,所述轻链可变区包含seqidno:46的氨基酸序列。在某些实施方案中,如本文所述的抗体的轻链可变区的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
另一方面,本公开提供了一种抗体或分离的抗体,其包含含有选自seqidno:24-35的氨基酸序列的重链可变区。在某些实施方案中,所述重链可变区包含seqidno:25的氨基酸序列。在某些实施方案中,所述重链可变区包含seqidno:28的氨基酸序列。在某些实施方案中,所述重链可变区包含seqidno:32的氨基酸序列。在某些实施方案中,所述抗体包含含有seqidno:58的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:61的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:65的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:70、71、72、73、74或75的氨基酸序列的重链。在某些实施方案中,如本文所述的抗体重链的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含含有选自seqidno:24-35的氨基酸序列的重链可变区。在某些实施方案中,所述重链可变区包含seqidno:25的氨基酸序列。在某些实施方案中,所述重链可变区包含seqidno:28的氨基酸序列。在某些实施方案中,所述重链可变区包含seqidno:32的氨基酸序列。在某些实施方案中,所述抗体包含含有seqidno:58的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:61的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:65的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:70、71、72、73、74或75的氨基酸序列的重链。
另一方面,本公开提供了一种抗体或分离的抗体,其包含含有选自seqidno:36-47的氨基酸序列的轻链可变区。在某些实施方案中,所述轻链可变区包含seqidno:46的氨基酸序列。在某些实施方案中,所述轻链可变区包含seqidno:69的氨基酸序列。在某些实施方案中,所述抗体包含含有seqidno:76或77的氨基酸序列的轻链。在某些实施方案中,如本文所述的抗体轻链的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含含有选自seqidno:36-47的氨基酸序列的轻链可变区。在某些实施方案中,所述轻链可变区包含seqidno:46的氨基酸序列。在某些实施方案中,所述轻链可变区包含seqidno:69的氨基酸序列。在某些实施方案中,所述抗体包含含有seqidno:76或77的氨基酸序列的轻链。
另一方面,本公开提供了一种抗体或分离的抗体,其包含重链可变区和轻链可变区,其中所述重链可变区和所述轻链可变区分别包含seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46中所列的氨基酸序列。在某些实施方案中,所述重链可变区和所述轻链可变区分别包含seqidno:25和46中所列的氨基酸序列。在某些实施方案中,所述重链可变区和所述轻链可变区分别包含seqidno:28和46中所列的氨基酸序列。在某些实施方案中,所述重链可变区和所述轻链可变区分别包含seqidno:32和46中所列的氨基酸序列。在某些实施方案中,如本文所述的抗体重链可变区的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换和/或所述抗体的轻链可变区的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
另一方面,本公开提供了一种抗体或分离的抗体,其包含重链可变区和轻链可变区,其中所述重链可变区和所述轻链可变区的氨基酸序列分别由seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46中所列的氨基酸序列组成。在某些实施方案中,所述重链可变区和所述轻链可变区的氨基酸序列分别由seqidno:25和46中所列的氨基酸序列组成。在某些实施方案中,所述重链可变区和所述轻链可变区的氨基酸序列分别由seqidno:28和46中所列的氨基酸序列组成。在某些实施方案中,所述重链可变区和所述轻链可变区的氨基酸序列分别由seqidno:32和46中所列的氨基酸序列组成。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含重链可变区和轻链可变区,其中所述重链可变区和所述轻链可变区分别包含seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46中所列的氨基酸序列。在某些实施方案中,所述重链可变区和所述轻链可变区分别包含seqidno:25和46中所列的氨基酸序列。在某些实施方案中,所述重链可变区和所述轻链可变区分别包含seqidno:28和46中所列的氨基酸序列。在某些实施方案中,所述重链可变区和所述轻链可变区分别包含seqidno:32和46中所列的氨基酸序列。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含重链可变区和轻链可变区,其中所述重链可变区和所述轻链可变区的氨基酸序列分别由seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46中所列的氨基酸序列组成。在某些实施方案中,所述重链可变区和所述轻链可变区的氨基酸序列分别由seqidno:25和46中所列的氨基酸序列组成。在某些实施方案中,所述重链可变区和所述轻链可变区的氨基酸序列分别由seqidno:28和46中所列的氨基酸序列组成。在某些实施方案中,所述重链可变区和所述轻链可变区的氨基酸序列分别由seqidno:32和46中所列的氨基酸序列组成。
另一方面,本公开提供了一种抗体或分离的抗体,其包含含有seqidno:58的氨基酸序列的重链和含有seqidno:69的氨基酸序列的轻链。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含含有seqidno:58的氨基酸序列的重链和含有seqidno:69的氨基酸序列的轻链。
另一方面,本公开提供了一种抗体或分离的抗体,其包含含有seqidno:61的氨基酸序列的重链和含有seqidno:69的氨基酸序列的轻链。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含含有seqidno:61的氨基酸序列的重链和含有seqidno:69的氨基酸序列的轻链。
另一方面,本公开提供了一种抗体或分离的抗体,其包含含有seqidno:65的氨基酸序列的重链和含有seqidno:69的氨基酸序列的轻链。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含含有seqidno:65的氨基酸序列的重链和含有seqidno:69的氨基酸序列的轻链。
在某些实施方案中,如本文所述的抗体重链的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换和/或所述抗体的轻链的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
在某些实施方案中,所述抗体包含具有源自人ighv3-23种系序列的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有源自人种系序列的氨基酸序列的轻链可变区,所述种系序列选自igkv1-27、igkv3-11、igkv3-20和igkv3d-20。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,所述抗体包含具有源自人ighv3-23种系序列的氨基酸序列的重链可变区和具有源自选自igkv1-27、igkv3-11、igkv3-20和igkv3d-20的人种系序列的氨基酸序列的轻链可变区。
在某些实施方案中,所述抗体包含选自人igg1、igg2、igg3、igg4、iga1和iga2的重链恒定区。在某些实施方案中,所述重链恒定区为igg1。在某些实施方案中,igg1的氨基酸序列包含根据eu编号系统编号的n297a突变。在某些实施方案中,所述抗体包含含有seqidno:72的氨基酸序列的重链恒定区。在某些实施方案中,igg1的氨基酸序列包含根据eu编号系统编号的n297q突变。在某些实施方案中,所述igg1为非岩藻糖化igg1。在某些实施方案中,所述重链恒定区为igg4。在某些实施方案中,igg4的氨基酸序列包含根据eu编号系统编号的s228p突变。在某些实施方案中,所述抗体包含含有seqidno:74的氨基酸序列的重链恒定区。
在某些实施方案中,所述抗体包含选自人iggκ和iggλ的轻链恒定区。在某些实施方案中,所述轻链恒定区为iggκ。在某些实施方案中,所述抗体包含含有seqidno:76的氨基酸序列的轻链恒定区。在某些实施方案中,所述轻链恒定区为iggλ。
另一方面,本公开提供了一种抗体或分离的抗体,其与本文所公开的抗体交叉竞争结合人tim-3。在某些实施方案中,本公开提供了一种抗体或分离的抗体,其与包含分别如seqidno:55和56中所列的重链和轻链可变区氨基酸序列的抗体交叉竞争结合人tim-3。在某些实施方案中,本公开提供了一种抗体或分离的抗体,其与包含分别如seqidno:25和46中所列的重链和轻链可变区氨基酸序列的抗体交叉竞争结合人tim-3。在某些实施方案中,本公开提供了一种抗体或分离的抗体,其与包含分别如seqidno:28和46中所列的重链和轻链可变区氨基酸序列的抗体交叉竞争结合人tim-3。在某些实施方案中,本公开提供了一种抗体或分离的抗体,其与包含分别如seqidno:32和46中所列的重链和轻链可变区氨基酸序列的抗体交叉竞争结合人tim-3。
另一方面,本公开提供了一种抗体或分离的抗体,其与本文所公开的抗体结合人tim-3的相同表位。在某些实施方案中,本公开提供了一种抗体或分离的抗体,其与包含分别如seqidno:55和56中所列的重链和轻链可变区氨基酸序列的抗体结合人tim-3的相同表位。在某些实施方案中,本公开提供了一种抗体或分离的抗体,其与包含分别如seqidno:25和46中所列的重链和轻链可变区氨基酸序列的抗体结合人tim-3的相同表位。在某些实施方案中,本公开提供了一种抗体或分离的抗体,其与包含分别如seqidno:28和46中所列的重链和轻链可变区氨基酸序列的抗体结合人tim-3的相同表位。在某些实施方案中,本公开提供了一种抗体或分离的抗体,其与包含分别如seqidno:32和46中所列的重链和轻链可变区氨基酸序列的抗体结合人tim-3的相同表位。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其中所述抗体以比对具有seqidno:79的氨基酸序列的野生型tim-3蛋白低的亲和力与具有seqidno:101的氨基酸序列的变体tim-3蛋白特异性结合。
另一方面,本公开提供了一种与本发明的抗体结合人tim-3的相同表位的抗体或分离的抗体。在一个实施方案中,所述抗体以比对具有seqidno:79的氨基酸序列的野生型tim-3蛋白低的亲和力与具有seqidno:101的氨基酸序列的变体tim-3蛋白特异性结合。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其中所述抗体不与具有seqidno:101的氨基酸序列的变体tim-3蛋白特异性结合。
另一方面,本公开提供了一种与本发明的任何抗体特异性结合人tim-3的相同表位的抗体或分离的抗体。在一个实施方案中,所述抗体不与具有seqidno:101的氨基酸序列的变体tim-3蛋白特异性结合。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其中相对于所述抗体与具有seqidno:79的氨基酸序列的野生型tim-3蛋白之间的结合,所述抗体与具有seqidno:101的氨基酸序列的变体tim-3蛋白之间的结合大幅减弱。
另一方面,本公开提供了一种与本发明的任何抗体特异性结合人tim-3的相同表位的抗体或分离的抗体。在一个实施方案中,相对于所述抗体与具有seqidno:79的氨基酸序列的野生型tim-3蛋白之间的结合,所述抗体与具有seqidno:101的氨基酸序列的变体tim-3蛋白之间的结合大幅减弱。
另一方面,本公开提供了一种与人tim-3特异性结合的抗体或分离的抗体,其中和与具有seqidno:79的氨基酸序列的野生型tim-3蛋白的结合相比,所述抗体表现出与具有seqidno:101的氨基酸序列的变体tim-3蛋白的结合减少或不存在。
另一方面,本公开提供了一种与本发明的任何抗体特异性结合人tim-3的相同表位的抗体或分离的抗体。在一个实施方案中,和与具有seqidno:79的氨基酸序列的野生型tim-3蛋白的结合相比,所述抗体表现出与具有seqidno:101的氨基酸序列的变体tim-3蛋白的结合减少或不存在。
另一方面,本公开提供了一种与人tim-3的表位结合(例如特异性结合)的抗体或分离的抗体。在某些实施方案中,所述抗体与seqidno:79的残基40结合。
另一方面,本公开提供了一种与本发明的任何抗体特异性结合人tim-3的相同表位的抗体或分离的抗体。在某些实施方案中,所述抗体与seqidno:79的残基40结合。
另一方面,本公开提供了一种与人tim-3的表位结合(例如特异性结合)的抗体或分离的抗体。在某些实施方案中,所述抗体与位于由seqidno:93的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:94的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:95的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:96的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:97的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:98的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:99的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:100的氨基酸序列组成的人tim-3区域内的表位结合。
另一方面,本公开提供了一种与本发明的任何抗体特异性结合人tim-3的相同表位的抗体或分离的抗体。在某些实施方案中,所述抗体与位于由seqidno:93的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:94的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:95的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:96的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:97的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:98的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:99的氨基酸序列组成的人tim-3区域内的表位结合。在某些实施方案中,所述抗体与位于由seqidno:100的氨基酸序列组成的人tim-3区域内的表位结合。
另一方面,本公开提供了一种抗体,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:93中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:93中所列的氨基酸序列组成的区域中的氢/氘交换。另一方面,本公开提供了一种抗体,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:94中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:94中所列的氨基酸序列组成的区域中的氢/氘交换。另一方面,本公开提供了一种抗体,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:95中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:95中所列的氨基酸序列组成的区域中的氢/氘交换。另一方面,本公开提供了一种抗体,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:96中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:96中所列的氨基酸序列组成的区域中的氢/氘交换。另一方面,本公开提供了一种抗体,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:97中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:97中所列的氨基酸序列组成的区域中的氢/氘交换。另一方面,本公开提供了一种抗体,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:98中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:98中所列的氨基酸序列组成的区域中的氢/氘交换。在一些实施方案中,例如如本文在实施例中所述,使用氢-氘交换法(hdx)测量氢/氘交换的减少。
另一方面,本公开提供了一种与本发明的任何抗体特异性结合人tim-3的相同表位的抗体或分离的抗体。在某些实施方案中,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:93中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:93中所列的氨基酸序列组成的区域中的氢/氘交换。在某些实施方案中,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:94中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:94中所列的氨基酸序列组成的区域中的氢/氘交换。在某些实施方案中,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:95中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:95中所列的氨基酸序列组成的区域中的氢/氘交换。在某些实施方案中,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:96中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:96中所列的氨基酸序列组成的区域中的氢/氘交换。在某些实施方案中,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:97中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:97中所列的氨基酸序列组成的区域中的氢/氘交换。在某些实施方案中,正如通过氢/氘测定所确定的那样,相对于所述抗体不存在时由seqidno:98中所列的氨基酸序列组成的区域中的氢/氘交换,所述抗体在与包含seqidno:102的氨基酸序列的人tim-3蛋白或其片段结合时,减少由seqidno:98中所列的氨基酸序列组成的区域中的氢/氘交换。在一些实施方案中,例如如本文在实施例中所述,使用氢-氘交换法(hdx)测量氢/氘交换的减少。
另一方面,本公开提供了一种与本发明的任何抗体结合(例如特异性结合)人tim-3的相同表位的抗体或分离的抗体,其中通过例如实施例中所述的氢-氘交换法(hdx),通过例如实施例中所述的肽扫描分析(pepscananalysis),或通过例如实施例中所述的丙氨酸扫描法来确定表位。
在某些实施方案中,所述抗体包含为野生型人igg重链恒定区变体的人igg重链恒定区,其中所述变体人igg重链恒定区与人fcγ受体结合的亲和力比野生型人igg重链恒定区与人fcγ受体结合的亲和力低。在某些实施方案中,所述人fcγ受体选自fcγri、fcγrii和fcγriii。在某些实施方案中,所述变体人igg重链恒定区为包含n297a突变的igg1恒定区。
在某些实施方案中,所述抗体为人抗体。在某些实施方案中,所述抗体拮抗人tim-3。在某些实施方案中,所述抗体灭活、降低或抑制人tim-3活性。在某些实施方案中,所述抗体抑制人tim-3与磷脂酰丝氨酸的结合。在某些实施方案中,所述抗体诱导经葡萄球菌肠毒素a(sea)刺激的外周血单核细胞(pbmc)生成ifnγ。在某些实施方案中,所述抗体诱导经抗cd3和抗cd28抗体刺激的肿瘤浸润淋巴细胞(til)生成ifnγ或tnfα。
在某些实施方案中,所述抗体在与表达人tim-3的细胞结合后内化。
另一方面,本公开提供了与细胞毒性剂缀合的如本文所公开的抗体或分离的抗体。
另一方面,本公开提供了与细胞抑制剂缀合的如本文所公开的抗体或分离的抗体。
另一方面,本公开提供了与毒素缀合的如本文所公开的抗体或分离的抗体。
另一方面,本公开提供了与放射性核素缀合的如本文所公开的抗体或分离的抗体。
另一方面,本公开提供了与可检测标记缀合的如本文所公开的抗体或分离的抗体。
另一方面,本公开提供了一种药物组合物,其包含如本文所公开的抗体和药学上可接受的载体或赋形剂。
另一方面,本公开提供了一种多核苷酸或分离的多核苷酸,其编码如本文所公开的抗体的重链和/或轻链。另一方面,本公开提供了一种包含所述多核苷酸的载体。另一方面,本公开提供了一种包含所述多核苷酸的重组宿主细胞。另一方面,本公开提供了一种包含所述载体的重组宿主细胞。另一方面,本公开提供了一种生成如本文所公开的抗体的方法,所述方法包括培养所述宿主细胞,使得所述多核苷酸表达并生成所述抗体。在一个实施方案中,所述方法是一种体外方法。
在一个实施方案中,本发明涉及用作药物的本发明的抗体,或本发明的药物组合物,或本发明的多核苷酸,或本发明的载体,或本发明的重组宿主细胞。
在一个实施方案中,本发明涉及用作诊断剂的本发明的抗体,或本发明的药物组合物,或本发明的多核苷酸,或本发明的载体,或本发明的重组宿主细胞。
另一方面,本公开提供了一种增加响应于受试者抗原的t细胞活化的方法,所述方法包括向所述受试者施用有效量的如本文所公开的抗体或药物组合物。另一方面,本公开提供了一种治疗受试者癌症的方法,所述方法包括向所述受试者施用有效量的如本文所公开的抗体或药物组合物。在前述方法的某些实施方案中,所述抗体或药物组合物经皮下施用。在前述方法的某些实施方案中,所述抗体或药物组合物经静脉内施用。在前述方法的某些实施方案中,所述抗体或药物组合物经瘤内施用。在前述方法的某些实施方案中,所述抗体或药物组合物递送至肿瘤引流淋巴结。在前述方法的某些实施方案中,所述抗体或药物组合物经动脉内施用。
一方面,本发明涉及用于增加响应于抗原的t细胞活化的方法中的本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物。
一方面,本发明涉及用于增加响应于受试者抗原的t细胞活化的方法中的本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物。
一方面,本发明涉及用于增加响应于受试者抗原的t细胞活化的方法中的本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物,所述方法包括向所述受试者施用有效量的本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物。
一方面,本发明涉及用于治疗癌症的方法中的本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物。
一方面,本发明涉及用于治疗受试者癌症的方法中的本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物。
一方面,本发明涉及用于治疗受试者癌症的方法中的本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物,所述方法包括向所述受试者施用有效量的本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物。
在供本发明使用的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物的一个实施方案中,所述抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物经皮下或静脉内施用。在供本发明使用的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物的另一个实施方案中,所述抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物经瘤内或动脉内施用。
在某些实施方案中,前述方法还包括向所述受试者施用附加治疗剂。因此,在用于本发明方法中的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物的一个实施方案中,所述方法还包括向所述受试者施用附加治疗剂。
一方面,本发明涉及用作药物的(a)本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物和(b)附加治疗剂。
一方面,本发明涉及用于治疗癌症的方法中的(a)本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物和(b)附加治疗剂。
一方面,本发明涉及药物组合物、药盒或分药盒(kit-of-parts),其包含(a)本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物和(b)附加治疗剂。
在某些实施方案中,所述附加治疗剂为化疗剂。在某些实施方案中,所述附加治疗剂为放疗剂。
在某些实施方案中,所述附加治疗剂为检查点靶向剂。在某些实施方案中,所述检查点靶向剂选自拮抗剂抗pd-1抗体、拮抗剂抗pd-l1抗体、拮抗剂抗pd-l2抗体、拮抗剂抗ctla-4抗体、拮抗剂抗tim-3抗体、拮抗剂抗lag-3抗体、拮抗剂抗ceacam1抗体、激动剂抗cd137抗体、拮抗剂抗tigit抗体、拮抗剂抗vista抗体、激动剂抗gitr抗体和激动剂抗ox40抗体。在某些实施方案中,所述附加治疗剂为抗pd-1抗体。在某些实施方案中,抗pd-1抗体为派姆单抗(pembrolizumab)。在某些实施方案中,抗pd-1抗体为纳武单抗(nivolumab)。
在某些实施方案中,所述附加治疗剂为吲哚胺-2,3-双加氧酶(ido)抑制剂。在某些实施方案中,所述抑制剂选自epacadostat、f001287、indoximod和nlg919。在某些实施方案中,所述抑制剂为epacadostat。在某些实施方案中,所述抑制剂为f001287。在某些实施方案中,所述抑制剂为indoximod。在某些实施方案中,所述抑制剂为nlg919。
在某些实施方案中,所述附加治疗剂为疫苗。在某些实施方案中,所述疫苗包含热休克蛋白肽复合物(hsppc),其包含与抗原肽复合的热休克蛋白。在某些实施方案中,所述热休克蛋白为hsc70并且与肿瘤相关抗原肽复合。在某些实施方案中,所述热休克蛋白为gp96蛋白并且与肿瘤相关抗原肽复合,其中所述hsppc源自从受试者获得的肿瘤。在某些实施方案中,所述附加治疗剂包含tcr。在某些实施方案中,所述附加治疗剂为可溶性tcr。在某些实施方案中,所述附加治疗剂是表达tcr的细胞。在某些实施方案中,所述附加治疗剂是表达嵌合抗原受体的细胞。在某些实施方案中,所述附加治疗剂是与肽-mhc复合物特异性结合的抗体。在某些实施方案中,所述附加治疗剂为佐剂。一方面,本发明涉及用作药物,例如用于治疗癌症的方法中的(a)本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物和(b)疫苗,任选地其中所述疫苗包含热休克蛋白肽复合物(hsppc),其包含与抗原肽复合的热休克蛋白。一方面,本发明涉及一种药物组合物、药盒或分药盒,其包含(a)本发明的抗体、多核苷酸、载体、重组宿主细胞和/或药物组合物和(b)疫苗,任选地其中所述疫苗包含热休克蛋白肽复合物(hsppc),其包含与抗原肽复合的热休克蛋白。
5.附图简述
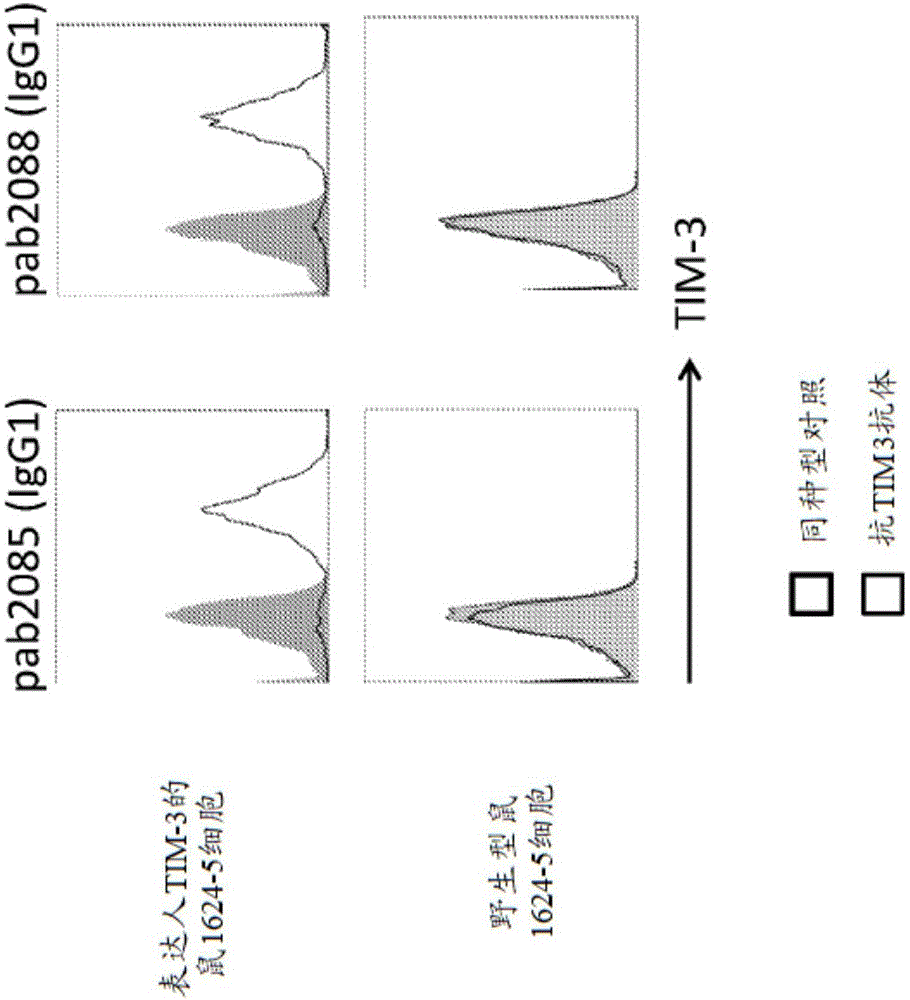
图1是显示通过流式细胞术所测量的,抗tim-3抗体pab2085(igg1)和pab2088(igg1)或同种型对照抗体与野生型鼠1624-5细胞或经工程化以表达人tim-3的1624-5细胞的结合的一组直方图。
图2a和2b是显示通过luminex测定所测量的,抗tim-3抗体pab2085(igg1)(图2a)和pab2088(igg1)(图2b)与重组人tim-1his(rhtim-1his)、重组人tim-4his(rhtim-4his)、重组人tim-3his(rhtim-3his)、重组人tim-3fc(rhtim-3fc)和重组食蟹猴tim-3fc(rcmtim-3fc)的结合的一对图表。根据抗体浓度绘制中位荧光强度(mfi)值曲线。
图3a、3b、3c和3d是显示通过流式细胞术所测量的,抗tim-3抗体或同种型对照抗体与经工程化以表达人tim-3(图3a和3b)或食蟹猴tim-3(图3c和d)的鼠1624-5细胞的结合的一组直方图。该研究中测试的抗tim-3抗体包括pab2173、pab2174、pab2175、pab2176、pab2177、pab2178、pab2179、pab2180、pab2181、pab2182、pab2183、pab2184、pab2185、pab2186、pab2187、pab2188、pab2189、pab2190、pab2191和pab2192,其全部含igg1fc区。
图4是显示通过流式细胞术所测量的,抗tim-3抗体pab2085、轻链优化变体(pab2184、pab2186、pab2187、pab2188、pab2189、pab2190、pab2191和pab2192)或同种型对照抗体与经抗cd3和抗cd28抗体活化的人原代cd8+t细胞的结合的图表。轻链优化变体含igg1变体fc区。根据测试的一系列抗体浓度绘制mfi值曲线。
图5是显示通过流式细胞术所测量的,抗tim-3抗体pab2188(igg1变体)或同种型对照抗体与食蟹猴原代cd11b+骨髓细胞的结合的图表。根据抗体浓度绘制mfi值曲线。
图6a和6b是显示在存在抗tim-3抗体或igg1同种型对照抗体剂量滴定时,经辐照的表达磷脂酰丝氨酸的wr19l鼠淋巴瘤细胞与重组人tim-3fc(图6a)或重组食蟹猴tim-3fc(图6b)之间的结合百分比的图表。该研究中测试的抗tim-3抗体为pab2085(igg1)和pab2188(igg1变体)。
图7是显示葡萄球菌肠毒素a(sea)刺激后,人外周血单核细胞(pbmc)中抗tim-3抗体或igg1同种型对照抗体与抗pd-1抗体派姆单抗组合诱导的ifnγ产量的柱状图。该研究中测试的抗tim-3抗体包括轻链优化变体pab2175(igg1)、pab2176(igg1)、pab2180(igg1)、pab2182(igg1)、pab2183(igg1变体)、pab2184(igg1变体)、pab2186(igg1变体)、pab2187(igg1变体)、pab2188(igg1变体)、pab2189(igg1变体)、pab2190(igg1变体)、pab2191(igg1变体)和pab2192(igg1变体)。
图8a、8b、8c、8d、8e和8f是显示sea刺激后,来自六个不同供体的人pbmc中,抗tim-3抗体pab2188w(igg1n297a)或igg1n297a同种型对照抗体(单独的或与抗pd-1抗体派姆单抗组合)诱导的ifnγ产量的一组柱状图。图8a-8f中描绘的该研究所用的方案由图7中描绘的研究所用的方案修改而成。
图9a、9b、9c、9d、9e和9f是显示抗tim-3抗体与表达tim-3的细胞的结合的图表或直方图。图9a、9b、9e和9f中,根据测试的一系列抗体浓度绘制mfi值曲线。图9c和9d是显示抗tim-3抗体与表达tim-3的细胞的结合的一组直方图。测试的抗tim-3抗体包括pab2188w(igg1n297a)、am-1(igg1n297a)、am-2(igg1n297a)、am-3(igg1n297a)、am-4(igg1n297a)、am-5(igg1n297a)、am-6(igg1n297a)、am-7(igg1n297a)、am-8(igg1n297a)和am-9(igg1n297a)。测试的细胞是异位表达人tim-3的jurkat细胞(图9a),内源性表达tim-3的人急性骨髓性白血病细胞系kasumi-3(图9b),经葡萄球菌肠毒素a(sea)刺激的人cd8+t细胞(图9c),经sea刺激的食蟹猴cd8+t细胞(图9d),及人(图9e)和食蟹猴(图9f)原代cd14+骨髓细胞。
图10a、10b、10c和10d是显示通过luminex测定所测量的,抗tim-3抗体或igg1n297a同种型对照抗体与重组人tim-3his(rhtim-3his)、重组食蟹猴tim-3fc(rcmtim-3fc)、重组小鼠tim-3fc(rmtim-3fc)、重组人tim-1his(rhtim-1his)、重组人tim-4his(rhtim-4his)、重组人ox40his(rhox40his)、重组人gitrfc(rhgitrfc)、重组人dr3fc(rhdr3fc)和重组人cd137fc(rhcd137fc)的结合的图表。根据抗体浓度绘制mfi值曲线。该研究中测试的抗tim-3抗体包括pab2188w(igg1n297a)(图10b)、am-2(igg1n297a)(图10c)和am-6(igg1n297a)(图10d)。
图11a和11b是显示在存在抗tim-3抗体或igg1n297a同种型对照抗体的剂量滴定时,重组人tim-3fc(图11a)或重组食蟹猴tim-3fc(图11b)与表达磷脂酰丝氨酸的wr19l细胞的结合百分比的图表。该研究中测试的抗tim-3抗体包括pab2188w(igg1n297a)、am-2(igg1n297a)和am-6(igg1n297a)。
图12a和12b是显示sea刺激后,来自两个不同供体的人pbmc中,抗tim-3抗体或igg1n297a同种型对照抗体(单独的或与抗pd-1抗体派姆单抗组合)诱导的ifnγ产量的柱状图。测试的抗tim-3抗体包括pab2188w(igg1n297a)、am-1(igg1n297a)、am-2(igg1n297a)、am-3(igg1n297a)、am-4(igg1n297a)、am-5(igg1n297a)、am-6(igg1n297a)、am-7(igg1n297a)和am-8(igg1n297a)。
图13a、13b、13c、13d、13e和13f是显示抗tim-3抗体或igg1n297a同种型对照抗体(单独的或与抗pd-1抗体派姆单抗组合)诱导的原代肿瘤浸润淋巴细胞(til)的ifnγ或tnfα产量的图表。til分离自非小细胞肺癌(nsclc)(图13a和13b)、胆囊腺癌(图13c和13d)或乳腺癌(图13e和13f)肿瘤并且用抗cd3/cd28微珠活化。该研究中测试的抗tim-3抗体包括pab2188w(igg1n297a)、am-2(igg1n297a)和am-6(igg1n297a)。
图14a、14b和14c是显示用抗tim-3抗体或igg1n297a同种型对照抗体孵育后,相对于未处理对照组的细胞存活百分比的图表。图14a和14b显示用指定抗体与二抗药物缀合物αhfc-nc-dm1组合进行处理。测试的细胞是经工程化以过表达tim-3的jurkat细胞(图14a)或kasumi-3细胞,即内源性表达tim-3的急性骨髓性白血病细胞系(图14b)。图14c显示用指定抗体作为与单甲基澳瑞他汀e(monomethylauristatine,mmae)的缀合物进行处理。该研究中测试的抗tim-3抗体包括pab2188w(igg1n297a)、am-2(igg1n297a)、am-6(igg1n297a),及参考抗体hum11(igg4s228p)和pab1944w(igg1n297a)。
图15是显示用10μg/ml的抗tim-3抗体am-2或同种型对照抗体孵育时,在不同时间点(即,在0-3.5小时),通过活细胞共聚焦荧光显微镜术所测定的,表达halotag-tim-3融合蛋白的jurkat细胞中的tim-3内化的一系列图表。黑点表示对于每种条件而言,在给定时间点所观察到的平均荧光水平。
6.发明详述
本公开提供了与tim-3(例如,人tim-3)特异性结合并拮抗tim-3功能,例如tim-3介导的免疫抑制的抗体。还提供了包含这些抗体的药物组合物,编码这些抗体的核酸,用于制备这些抗体的表达载体和宿主细胞,及使用这些抗体治疗受试者的方法。本文公开的抗体对于增加响应于抗原(例如,肿瘤抗原或感染性疾病抗原)的t细胞活化特别有用,并且因此对于治疗受试者癌症或对于治疗或预防受试者的感染性疾病特别有用。另外将本文所述“分离的抗体”的所有实例考虑为可以分离,但不需要分离的抗体。另外将本文所述“分离的多核苷酸”的所有实例考虑为可以分离,但不需要分离的多核苷酸。另外将本文所述“抗体”的所有实例考虑为可以分离,但不需要分离的抗体。另外将本文所述“多核苷酸”的所有实例考虑为可以分离,但不需要分离的多核苷酸。
6.1定义
如本文中所用,术语“约”和“大约”,在用于修饰数值或数值范围时,表示比该值或范围高5%至10%(例如,高5%至10%)和低5%至10%(例如,低5%至10%)的偏差仍然在列举的值或范围的预期含义。
如本文中所用,术语“tim-3”是指在人类中由havcr2基因编码的t细胞免疫球蛋白和粘蛋白结构域-3(也称为含t细胞免疫球蛋白和粘蛋白结构域-3的蛋白或甲型肝炎病毒细胞受体2(havcr2))。swiss-prot登录号q8tdq0-1提供了示例性人tim-3氨基酸序列。人tim-3的非成熟氨基酸序列作为seqidno:78提供。人tim-3的成熟氨基酸序列作为seqidno:79提供。如本文中所用,术语“人tim-3”是指包含seqidno:79的氨基酸序列的tim-3。
如本文中所用,术语“抗体”和“(多种)抗体”包括全长抗体、全长抗体的抗原结合片段和包含抗体cdr、vh区或vl区的分子。抗体的实例包括单克隆抗体、重组生成的抗体、单特异性抗体、多特异性抗体(包括双特异性抗体)、人抗体、人源化抗体、嵌合抗体、免疫球蛋白、合成抗体、包含两个重链分子和两个轻链分子的四聚抗体、抗体轻链单体、抗体重链单体、抗体轻链二聚体、抗体重链二聚体、抗体轻链-抗体重链对、胞内抗体(intrabody)、异源缀合(heteroconjugate)抗体、抗体-药物缀合物、单域抗体、单价抗体、单链抗体或单链fv(scfv)、骆驼化抗体、亲和体(affybody)、fab片段、f(ab’)2片段、二硫键连接的fv(sdfv)、抗-独特型(抗-id)抗体(包括,例如抗-抗-id抗体)及上述任一种的抗原结合片段。在某些实施方案中,本文所述的抗体是指多克隆抗体群体。抗体可以是免疫球蛋白分子的任何类型(例如,igg、ige、igm、igd、iga或igy)、任何类别(例如,igg1、igg2、igg3、igg4、iga1或iga2)或任何亚类(例如,igg2a或igg2b)。在某些实施方案中,本文所述的抗体为igg抗体或其分类(例如,人igg1或igg4)或其亚类。在具体实施方案中,抗体为人源化单克隆抗体。在另一具体实施方案中,抗体为人单克隆抗体。
如本文中所用,术语“vh区”和“vl区”分别是指单一抗体重链和轻链可变区,其包含fr(框架区)1、2、3和4及cdr(互补决定区)1、2和3(参见kabat等人,(1991)sequencesofproteinsofimmunologicalinterest(nih公布第91-3242号,bethesda),其通过引用整体并入本文)。
如本文中所用,术语“cdr”或“互补决定区”意指在重链和轻链多肽两者的可变区内发现的非相邻抗原结合位点。kabat等人,j.biol.chem.252,6609-6616(1977)和kabat等人,sequencesofproteinofimmunologicalinterest.(1991),chothia等人,j.mol.biol.196:901-917(1987),以及maccallum等人,j.mol.biol.262:732-745(1996)已经描述了这些特定区域,其全部通过引用整体并入本文,其中定义包括相互比较时氨基酸的重叠或亚组。在某些实施方案中,术语“cdr”是maccallum等人,j.mol.biol.262:732-745(1996)和martina.“proteinsequenceandstructureanalysisofantibodyvariabledomains,”在antibodyengineering,kontermann中以及dübel编辑,第422-439页第31章,springer-verlag,berlin(2001)所定义的cdr。在某些实施方案中,术语“cdr”是kabat等人,j.biol.chem.252,6609-6616(1977)和kabat等人,sequencesofproteinofimmunologicalinterest.(1991)所定义的cdr。在某些实施方案中,使用不同公约定义抗体的重链cdr和轻链cdr。例如,在某些实施方案中,根据maccallum(同上)定义重链cdr,并且根据kabat(同上)定义轻链cdr。cdrh1、cdrh2和cdrh3指重链cdr,并且cdrl1、cdrl2和cdrl3指轻链cdr。
如本文中所用,术语“框架(fr)氨基酸残基”是指免疫球蛋白链骨架区中的氨基酸。如本文中所用的术语“框架区”或“fr区”包括是可变区的一部分,但不是cdr的一部分的氨基酸残基(例如,使用cdr的kabat或maccallum定义)。
如本文中所用,术语“可变区”和“可变结构域”可互换使用并且是本领域常见的。可变区通常是指抗体的一部分,通常是轻链或重链的一部分,通常是成熟重链中氨基末端的约110至120个氨基酸或110至125个氨基酸和成熟轻链中约90至115个氨基酸,其在抗体之间序列上是广泛不同的并且用于特定抗体对其特定抗原的结合和特异性中。序列可变性集中在称为互补决定区(cdr)的那些区域中,而可变结构域中更高度保守的区域称为框架区(fr)。不希望受任何特定机理或理论约束,据信轻链和重链的cdr是造成抗体与抗原的相互作用和特异性的主要原因。在某些实施方案中,可变区为人可变区。在某些实施方案中,可变区包含啮齿动物或鼠cdr和人框架区(fr)。在特定实施方案中,可变区为灵长类(例如,非人灵长类)可变区。在某些实施方案中,可变区包含啮齿动物或鼠cdr和灵长类(例如,非人灵长类)框架区(fr)。
术语“vl”和“vl结构域”可互换用于指抗体的轻链可变区。
术语“vh”和“vh结构域”可互换用于指抗体的重链可变区。
如本文中所用,术语“恒定区”和“恒定结构域”可互换并且是本领域中常见的。恒定区为抗体部分,例如轻链和/或重链中不直接参与抗体与抗原的结合,但是可以表现出各种效应功能,诸如与fc受体(例如fcγ受体)相互作用的羧基端部分。免疫球蛋白分子的恒定区通常具有相对于免疫球蛋白可变结构域更保守的氨基酸序列。
如本文中所用,术语“重链”关于抗体使用时可以指基于恒定结构域氨基酸序列的任何不同类型,例如alpha(α)、delta(δ)、epsilon(ε)、gamma(γ)和mu(μ),分别产生iga、igd、ige、igg和igm类抗体,包括igg亚类,例如igg1、igg2、igg3和igg4。
如本文中所用,术语“轻链”关于抗体使用时可以指基于恒定结构域氨基酸序列的任何不同类型,例如kappa(κ)或lambda(λ)。轻链氨基酸序列是本领域公知的。在具体实施方案中,轻链为人轻链。
如本文中所用,术语“eu编号系统”是指抗体恒定区的eu编号规定,如edelman,g.m.等人,proc.natl.acad.usa,63,78-85(1969)和kabat等人,sequencesofproteinsofimmunologicalinterest,u.s.dept.healthandhumanservices,1991年第5版所述,其各自通过引用整体并入本文。
“结合亲和力”通常是指分子(例如,抗体)的单一结合位点与其结合伴侣(例如,抗原)之间非共价相互作用的总计强度。除非另外指明,否则如本文中所用,“结合亲和力”是指反映结合对(例如,抗体和抗原)成员之间的1:1相互作用的固有结合亲和力。分子x对于其伴侣y的亲和力通常可以用解离常数(kd)表示。亲和力可以以本领域中已知的多种方式测量和/或表示,包括但不限于平衡解离常数(kd)和平衡缔合常数(ka)。kd由koff/kon的商计算,而ka由kon/koff的商计算。kon是指例如抗体与抗原的缔合速率常数,而koff是指例如抗体与抗原的解离速率常数。kon和koff可以通过本领域普通技术人员已知的技术测定,诸如
如本文中所用,术语“特异性结合”、“特异性识别”、“免疫特异性结合”和“免疫特异性识别”是抗体背景下的类似术语并且是指分子与抗原(例如表位或免疫复合物),如同本领域技术人员所理解的此类结合方式结合。例如,与抗原特异性结合的分子可以与其它肽或多肽结合,通常通过例如免疫测定、
在另一个具体实施方案中,与抗原特异性结合的分子在相似结合条件下不与其它蛋白交叉反应。在另一个具体实施方案中,与tim-3特异性结合的分子不与其它非tim-3蛋白交叉反应。在一个具体实施方案中,本文提供了以比对另一无关抗原高的亲和力与tim-3(例如,人tim-3)结合的抗体。在某些实施方案中,本文提供了一种与tim-3(例如,人tim-3)结合的抗体,通过例如放射免疫测定法、表面质子共振或动力学排除测定法(kineticexclusionassay)测量,其亲和力比对另一无关抗原高20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更高。在一个具体实施方案中,通过例如放射免疫测定法测量,本文提供的抗tim-3抗体与无关的非tim-3蛋白的结合程度比所述抗体与tim-3蛋白的结合低10%、15%或20%。
如本文中所用,fc背景下的术语“非岩藻糖化”或“非岩藻糖化的”是指实质性缺乏与根据eu编号系统编号的人igg1fc区残基297或非igg1或非人igg1免疫球蛋白中的相应残基直接或间接共价连接的岩藻糖。因此,在包含多种非岩藻糖化抗体的组合物中,至少70%的抗体不会在抗体fc区的残基297处被直接或间接岩藻糖化(例如,通过插入糖),并且在一些实施方案中至少80%、85%、90%、95%或99%不会在fc区的残基297处被直接或间接岩藻糖化。
如本文中所用,“表位”是本领域中的术语并且是指抗体可以特异性结合的抗原局部区域。表位可以是,例如,多肽的连续氨基酸(线性或连续表位)或者表位可以,例如,从一个或多个多肽的两个或更多个非连续区域集合到一起(构象、非线性、不连续或非连续表位)。在某些实施方案中,抗体结合的表位可以通过,例如nmr光谱法、x-射线衍射晶体学研究、elisa测定、氢/氘交换联同质谱分析(例如,液相色谱电喷雾质谱)、基于阵列的寡肽扫描测定(例如,使用clips(肽与支架化学连接)对非连续或构象表位作图而约束肽)和/或诱变作图(例如,定点诱变作图)确定。对于x-射线晶体分析法,结晶可以使用本领域中的任何已知方法完成(例如,giegér等人,(1994)actacrystallogrdbiolcrystallogr50(pt4):339-350;mcphersona(1990)eurjbiochem189:1-23;chayenne(1997)structure5:1269-1274;mcphersona(1976)jbiolchem251:6300-6303,其各自通过引用整体并入本文)。抗体:抗原晶体可以使用公知的x-射线衍射技术进行研究并且可以使用计算机软件精制,诸如x-plor(yaleuniversity,1992,由molecularsimulations,inc.派发;参见例如,methenzymol(1985)第114和115卷,wyckoffhw等人编辑;u.s.2004/0014194)和buster(bricogneg(1993)actacrystallogrdbiolcrystallogr49(pt1):37-60;bricogneg(1997)methenzymol276a:361-423,cartercw编辑;roversip等人,(2000)actacrystallogrdbiolcrystallogr56(pt10):1316-1323),其各自通过引用整体并入本文。诱变作图研究可以使用本领域技术人员已知的任何方法完成。对于诱变技术的描述,包括丙氨酸扫描诱变技术,参见例如champem等人(1995)jbiolchem270:1388-1394和cunninghambc&wellsja(1989)science244:1081-1085,其各自通过引用整体并入本文。clips(肽与支架化学连接)是呈现处于结构约束构象中的一个或多个肽以起到复杂蛋白结构域的功能模拟物的作用的技术。参见,例如,美国公开us2008/0139407a1和us2007/099240a1号及美国专利第7,972,993号,其各自通过引用整体并入本文。在一个具体实施方案中,使用丙氨酸扫描诱变研究确定抗体的表位。在一个具体实施方案中,使用氢/氘交换联同质谱分析确定抗体的表位。在一个具体实施方案中,使用来自pepscantherapeutics的clips表位作图技术确定抗体的表位。
如本文中所用,术语“位于人tim-3”区域内的表位”,由特定氨基酸序列或一组氨基酸残基组成,是指包含指定区域的一个或多个氨基酸残基的表位,其中指定区域包括人tim-3区域的第一个指定氨基酸残基和最后一个指定氨基酸残基。在某些实施方案中,所述表位包括位于指定区域内的每一个氨基酸残基。在某些实施方案中,人tim-3在指定区域外的一个或多个附加氨基酸残基与具有位于指定区域内的表位的抗体结合在一起。
如本文中所用,术语“t细胞受体”和“tcr”可互换使用并且是指全长杂二聚体αβ或γδtcr,全长tcr的抗原结合片段,及包含tcrcdr或可变区的分子。tcr的实例包括但不限于全长tcr、全长tcr的抗原结合片段、缺乏跨膜和胞质区的可溶性tcr、包含通过柔性接头连接的tcr可变区的单链tcr、通过工程化二硫键连接的tcr链、单特异性tcr、多特异性tcr(包括双特异性tcr)、tcr融合体、人tcr、人源化tcr、嵌合tcr、重组产生的tcr和合成tcr。该术语涵盖野生型tcr和遗传工程化tcr(例如,包含嵌合tcr链的嵌合tcr,其包括来自第一物种的tcr的第一部分和来自第二物种的tcr的第二部分)。
如本文中所用,术语“主要组织相容性复合物”和“mhc”可互换使用并且是指mhci类分子和/或mhcii类分子。
如本文中所用,术语“肽-mhc复合物”是指具有肽结合在本领域公认的mhc肽结合袋中的mhc分子(mhci类或mhcii类)。
如本文中所用,术语“治疗”是指本文中所述的治疗性或预防性措施。“治疗”的方法采用向患有疾病或病症或易患此类疾病或病症的受试者施用抗体,以便预防、治愈、延迟疾病或病症,减轻疾病或病症的严重程度或改善疾病或病症的一种或多种症状或疾病或病症的复发,或以便延长受试者的存活期超过在没有此类治疗的情况下的预期存活期。
如本文中所用,术语“有效量”在向受试者施用疗法的背景下是指达到所需的预防或治疗效应的治疗量。
如本文中所用,术语“受试者”包括任何人或非人动物。在一个实施方案中,受试者为人或非人哺乳动物。在一个实施方案中,受试者为人。
两个序列(例如,氨基酸序列或核酸序列)之间的“百分比同一性”的测定可以使用数学算法完成。用于比较两个序列的数学算法的特定、非限制性实例是karlins&altschulsf(1990)pnas87:2264-2268的算法,如在karlins&altschulsf(1993)pnas90:5873-5877中进行修改的,其各自通过引用整体并入本文。此类算法并入到altschulsf等人(1990)jmolbiol215:403的nblast和xblast程序中,其通过引用整体并入本文。blast核苷酸搜索可以用nblast核苷酸程序参数集进行,例如评分=100,字长=12,以获得与本文所述核酸分子同源的核苷酸序列。blast蛋白搜索可以用xblast程序参数集进行,例如评分50,字长=3,以获得与本文所述蛋白分子同源的氨基酸序列。为获得带空位的比对用于比较目的,可以如altschulsf等人(1997)nucacidsres25:3389-3402中所述利用gappedblast,其通过引用整体并入本文。或者,可以使用psiblast进行迭代搜索,检测分子之间的远缘关系(同上)。当利用blast、gappedblast和psiblast程序时,可以使用相应程序(例如,xblast和nblast)的默认参数(参见,例如,万维网上的nationalcenterforbiotechnologyinformation(ncbi),ncbi.nlm.nih.gov)。用于序列比较的数学算法的另一特定、非限制性实例为myers和miller,1988,cabios4:11-17的算法,其通过引用整体并入本文。此类算法并入到align程序(2.0版)中,其是gcg序列比对软件包的一部分。利用align程序用于比较氨基酸序列时,可以使用pam120权重残差表、空位长度罚分12和空位罚分4。
可以使用与如上所述的那些相似的技术(在允许或不允许空位的情况下)测定两个序列之间的百分比同一性。在计算百分比同一性时,通常仅计算精确匹配。
如本文中所用,术语“内化”或“内化的”是指抗体与细胞表面表达的抗原结合后,将抗体摄取到细胞内隔室中。
6.2抗tim-3抗体
一方面,本公开提供了与tim-3(例如,人tim-3)特异性结合并拮抗tim-3功能的抗体。本文表1-4中列出了示例性抗体的氨基酸序列。
表1.示例性抗tim-3抗体的氨基酸序列
*重链cdr根据maccallum编号系统定义而轻链cdr根据kabat编号系统定义。
表2.示例性抗tim-3抗体的重链cdr氨基酸序列。
*根据maccallum编号系统定义。
表3.示例性抗tim-3抗体的轻链cdr氨基酸序列。
*根据kabat编号系统定义。
表4.示例性抗tim-3抗体。
表5.最近种系基因
表6.tim-3的示例性序列。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含vh结构域,其包含本文表1中所列vh结构域的一个、两个或全部三个cdr。在某些实施方案中,所述抗体包含表1中所列其中一个vh结构域的cdrh1。在某些实施方案中,所述抗体包含表1中所列其中一个vh结构域的cdrh2。在某些实施方案中,所述抗体包含表1中所列其中一个vh结构域的cdrh3。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含vl结构域,其包含本文表1中所列vl结构域的一个、两个或全部三个cdr。在某些实施方案中,所述抗体包含表1中所列其中一个vl结构域的cdrl1。在某些实施方案中,所述抗体包含表1中所列其中一个vl结构域的cdrl2。在某些实施方案中,所述抗体包含表1中所列其中一个vl结构域的cdrl3。
在某些实施方案中,根据通过引用整体并入本文的maccallumrm等人,(1996)jmolbiol262:732-745,确定抗体的cdr。还请参见,例如martina.“proteinsequenceandstructureanalysisofantibodyvariabledomains”,在antibodyengineering中,kontermann和dübel编辑,第31章,第422-439页,springer-verlag,berlin(2001),其通过引用整体并入本文。在某些实施方案中,抗体的重链cdr根据maccallum确定而抗体的轻链cdr根据不同方法确定。
在某些实施方案中,根据kabat等人,j.biol.chem.252,6609-6616(1977)和kabat等人,sequencesofproteinofimmunologicalinterest(1991)确定抗体cdr,其各自通过引用整体并入本文。在某些实施方案中,抗体的轻链cdr根据kabat确定而抗体的重链cdr根据maccallum确定(同上)。
在某些实施方案中,抗体cdr可以根据chothia编号方案来确定,其涉及免疫球蛋白结构环的定位(参见例如,chothiac和leskam,(1987),jmolbiol196:901-917;al-lazikanib等人,(1997)jmolbiol273:927-948;chothiac等人,(1992)jmolbiol227:799-817;tramontanoa等人,(1990)jmolbiol215(1):175-82;和美国专利第7,709,226号,其全部通过引用整体并入本文)。通常,当使用kabat编号规定时,chothiacdrh1环存在于重链氨基酸26至32、33或34处,chothiacdrh2环存在于重链氨基酸52至56处,并且chothiacdrh3环存在于重链氨基酸95至102处,而chothiacdrl1环存在于轻链氨基酸24至34处,chothiacdrl2环存在于轻链氨基酸50至56处,并且chothiacdrl3环存在于轻链氨基酸89至97处。chothiacdrh1环的末端在使用kabat编号规定来编号时,根据该环的长度在h32和h34之间变化(这是因为kabat编号方案在h35a和h35b置有插入;如果35a和35b都不存在,则该环结束于32处;如果仅存在35a,则该环结束于33处;如果35a和35b都存在,则该环结束于34处)。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含本文表1中公开的vh的chothiavhcdr。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含本文表1中公开的vl的chothiavlcdr。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含本文表1中公开的抗体的chothiavhcdr和chothiavlcdr。在某些实施方案中,与tim-3(例如,人tim-3)特异性结合的抗体包含一个或多个cdr,其中chothia和kabatcdr具有相同的氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合并且包含kabatcdr和chothiacdr的组合的分离的抗体。
在某些实施方案中,抗体的cdr可以根据如lefrancm-p,(1999)theimmunologist7:132-136和lefrancm-p等人,(1999)nucleicacidsres27:209-212中描述的imgt编号系统来确定,其各自通过引用整体并入本文。根据imgt编号方案,cdrh1处于位置26至35处,cdrh2处于位置51至57处,cdrh3处于位置93至102处,cdrl1处于位置27至32处,cdrl2处于位置50至52处,并且cdrl3处于位置89至97处。
在某些实施方案中,本公开提供了与tim-3(例如,人tim-3)特异性结合的抗体并且抗体包含例如同上lefrancm-p(1999)和同上lefrancm-p等人(1999)所述,通过imgt编号系统确定的表1中公开的抗体cdr。
在某些实施方案中,抗体的cdr可以根据abm编号方案确定,其涉及表示kabatcdr和chothia结构环之间的折衷的abm超变区,并且被oxfordmolecular的abm抗体建模软件(oxfordmoleculargroup,inc.)使用,其通过引用整体并入本文。在一个特定实施方案中,本公开提供了与tim-3(例如,人tim-3)特异性结合的抗体并且抗体包含通过abm编号方案确定的表1中公开的抗体cdr。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含重链可变区和轻链可变区,所述重链可变区包含seqidno:24、25、26、27、28、29、30、31、32、33、34或35中列出的vh结构域的cdrh1、cdrh2和cdrh3区氨基酸序列,所述轻链可变区包含seqidno:36、37、38、39、40、41、42、43、44、45、46或47中列出的vl结构域的cdrl1、cdrl2和cdrl3区氨基酸序列,其中每个cdr根据maccallum定义、kabat定义、chothia定义、kabat定义和chothia定义的组合、imgt编号系统或cdr的abm定义来定义。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含:
(a)cdrh1,包含x1x2x3x4x5s(seqidno:48)的氨基酸序列,其中
x1为r、s、a、g、k、m或t,
x2为q、s、a、g、r或t,
x3为n、y、g或q,
x4为a或q,并且
x5为w、m、a、s或t;和/或
(b)cdrh2,包含wvsaisgsggsty(seqidno:2)的氨基酸序列;和/或
(c)cdrh3,包含akggdyggnyfd(seqidno:3)的氨基酸序列;和/或
(d)cdrl1,包含x1asqsvx2ssyla(seqidno:52)的氨基酸序列,其中
x1为r或g,并且
x2不存在或为s;和/或
(e)cdrl2,包含x1asx2rat(seqidno:53)的氨基酸序列,
其中
x1为d或g,并且
x2为n、s或t;和/或
(f)cdrl3,包含qqygsspx1t(seqidno:54)的氨基酸序列,其中x1为l或i。
在某些实施方案中,cdrh1包含x1x2naws(seqidno:49)的氨基酸序列,其中:x1为r或a;并且x2为q或r。在某些实施方案中,cdrh1包含x1x2gqx3s(seqidno:50)的氨基酸序列,其中:x1为k、m或g;x2为a或s;并且x3为s或t。在某些实施方案中,cdrh1包含x1x2qqas(seqidno:51)的氨基酸序列,其中:x1为s、r、t或g;并且x2为a、s、t或g。在某些实施方案中,cdrh1包含选自seqidno:1和4-12的氨基酸序列。在某些实施方案中,cdrl1包含选自seqidno:13-16的氨基酸序列。在某些实施方案中,cdrl2包含选自seqidno:17-21的氨基酸序列。在某些实施方案中,cdrl3包含选自seqidno:22和23的氨基酸序列。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含的vh结构域包含seqidno:1、2和3;4、2和3;5、2和3;6、2和3;7、2和3;8、2和3;9、2和3;10、2和3;11、2和3;或12、2和3中分别列出的cdrh1、cdrh2和cdrh3氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含的vh结构域包含seqidno:1、2和3中分别列出的cdrh1、cdrh2和cdrh3氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含的vh结构域包含seqidno:5、2和3中分别列出的cdrh1、cdrh2和cdrh3氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含的vh结构域包含seqidno:9、2和3中分别列出的cdrh1、cdrh2和cdrh3氨基酸序列。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含的vl结构域包含seqidno:13、17和22;14、17和22;15、18和22;14、19和22;14、20和22;14、21和22;16、20和22;或14、17和23中分别列出的cdrl1、cdrl2和cdrl3氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含的vl结构域包含seqidno:14、21和22中分别列出的cdrl1、cdrl2和cdrl3氨基酸序列。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含重链可变区和轻链可变区,所述重链可变区包含cdrh1、cdrh2和cdrh3区,所述轻链可变区包含cdrl1、cdrl2和cdrl3区,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3区包含seqidno:1、2、3、14、21和22;4、2、3、14、21和22;5、2、3、14、21和22;6、2、3、14、21和22;7、2、3、14、21和22;8、2、3、14、21和22;9、2、3、14、21和22;10、2、3、14、21和22;11、2、3、14、21和22;或12、2、3、14、21和22中分别列出的氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含重链可变区和轻链可变区,所述重链可变区包含cdrh1、cdrh2和cdrh3区,所述轻链可变区包含cdrl1、cdrl2和cdrl3区,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3区包含seqidno:1、2、3、14、21和22中分别列出的氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含重链可变区和轻链可变区,所述重链可变区包含cdrh1、cdrh2和cdrh3区,所述轻链可变区包含cdrl1、cdrl2和cdrl3区,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3区包含seqidno:5、2、3、14、21和22中分别列出的氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中所述抗体包含重链可变区和轻链可变区,所述重链可变区包含cdrh1、cdrh2和cdrh3区,所述轻链可变区包含cdrl1、cdrl2和cdrl3区,其中cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3区包含seqidno:9、2、3、14、21和22中分别列出的氨基酸序列。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含的重链可变区包含seqidno:55的氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含的重链可变区包含与seqidno:24、25、26、27、28、29、30、31、32、33、34或35中列出的氨基酸序列至少75%、80%、85%、90%、95%或100%(例如,至少86、87、88、89、90、91、92、93、94、95、96、97、98或99%)相同的氨基酸序列。在某些实施方案中,所述抗体包含具有seqidno:24、25、26、27、28、29、30、31、32、33、34或35中列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:24列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:25列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:26列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:27列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:28列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:29列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:30列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:31列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:32列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:33列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:34列出的氨基酸序列的重链可变区。在某些实施方案中,所述抗体包含具有seqidno:35列出的氨基酸序列的重链可变区。在某些实施方案中,如本文所述的抗体重链可变区的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含的轻链可变区包含seqidno:56的氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含的轻链可变区包含与seqidno:36、37、38、39、40、41、42、43、44、45、46或47中列出的氨基酸序列至少75%、80%、85%、90%、95%或100%(例如,至少86、87、88、89、90、91、92、93、94、95、96、97、98或99%)相同的氨基酸序列。在某些实施方案中,所述抗体包含具有seqidno:36、37、38、39、40、41、42、43、44、45、46或47中列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:36列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:37列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:38列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:39列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:40列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:41列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:42列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:43列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:44列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:45列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:46列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:47列出的氨基酸序列的轻链可变区。在某些实施方案中,如本文所述的抗体轻链可变区的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含的重链可变区包含seqidno:55的氨基酸序列和并且其包含的轻链可变区包含seqidno:56的氨基酸序列。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含的重链可变区包含与seqidno:24、25、26、27、28、29、30、31、32、33、34或35中列出的氨基酸序列至少75%、80%、85%、90%、95%或100%(例如,至少86、87、88、89、90、91、92、93、94、95、96、97、98或99%)相同的氨基酸序列,并且其包含的轻链可变区包含与seqidno:36、37、38、39、40、41、42、43、44、45、46或47中列出的氨基酸序列至少75%、80%、85%、90%、95%或100%(例如,至少86、87、88、89、90、91、92、93、94、95、96、97、98或99%)相同的氨基酸序列。在某些实施方案中,所述抗体包含具有seqidno:24、25、26、27、28、29、30、31、32、33、34或35中列出的氨基酸序列的重链可变区,和具有seqidno:36、37、38、39、40、41、42、43、44、45、46或47中列出的氨基酸序列的轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:24和36中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:24和38中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:26和42中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:24和42中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:24和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:24和43中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:26和43中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:26和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:26和41中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:24和41中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和39中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:24和47中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和40中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:26和47中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和37中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和45中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和44中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和42中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和41中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和43中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:25和47中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:27和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:28和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:29和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:30和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:31和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:32和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:33和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:34和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,所述抗体包含具有seqidno:35和46中分别列出的氨基酸序列的重链可变区和轻链可变区。在某些实施方案中,如本文所述的抗体重链可变区的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换和/或如本文所述的抗体轻链可变区的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含具有源自人ighv3-23种系序列(例如,ighv3-23*04,例如具有seqidno:84的氨基酸序列)的氨基酸序列的重链可变区。选自框架1、框架2、框架3、cdrh1和cdrh2的一个或多个区域(例如,这些区域中的两个、三个、四个或五个)可源自人ighv3-23种系序列(例如,ighv3-23*04,例如具有seqidno:84的氨基酸序列)。在一个实施方案中,框架1、框架2、框架3、cdrh1和cdrh2全部源自人ighv3-23种系序列(例如,ighv3-23*04,例如具有seqidno:84的氨基酸序列)。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含具有源自人种系序列的氨基酸序列的轻链可变区,所述种系序列选自igkv1-27(例如,igkv1-27*01,例如具有seqidno:85的氨基酸序列)、igkv3-11(例如,igkv3-11*01,例如具有seqidno:86的氨基酸序列)、igkv3-20(例如,igkv3-20*01,例如具有seqidno:87的氨基酸序列)和igkv3d-20(例如,igkv3d-20*01,例如具有seqidno:88的氨基酸序列)。选自框架1、框架2、框架3、cdrl1和cdrl2的一个或多个区域(例如,这些区域中的两个、三个、四个或五个)可源自人种系序列,所述种系序列选自igkv1-27(例如,igkv1-27*01,例如具有seqidno:85的氨基酸序列)、igkv3-11(例如,igkv3-11*01,例如具有seqidno:86的氨基酸序列)、igkv3-20(例如,igkv3-20*01,例如具有seqidno:87的氨基酸序列)和igkv3d-20(例如,igkv3d-20*01,例如具有seqidno:88的氨基酸序列)。在一个实施方案中,框架1、框架2、框架3、cdrl1和cdrl2全部源自人种系序列,所述种系序列选自igkv1-27(例如,igkv1-27*01,例如具有seqidno:85的氨基酸序列)、igkv3-11(例如,igkv3-11*01,例如具有seqidno:86的氨基酸序列)、igkv3-20(例如,igkv3-20*01,例如具有seqidno:87的氨基酸序列)和igkv3d-20(例如,igkv3d-20*01,例如具有seqidno:88的氨基酸序列)。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其包含具有源自人ighv3-23种系序列(例如,ighv3-23*04,例如具有seqidno:84的氨基酸序列)的氨基酸序列的重链可变区,和具有源自下述人种系序列的氨基酸序列的轻链可变区,所述种系序列选自igkv1-27(例如,igkv1-27*01,例如具有seqidno:85的氨基酸序列)、igkv3-11(例如,igkv3-11*01,例如具有seqidno:86的氨基酸序列)、igkv3-20(例如,igkv3-20*01,例如具有seqidno:87的氨基酸序列)和igkv3d-20(例如,igkv3d-20*01,例如具有seqidno:88的氨基酸序列)。
在某些实施方案中,本公开提供了一种分离的抗体,其与包含seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46中分别列出的重链和轻链可变区氨基酸序列的抗体交叉竞争结合tim-3(例如,人tim-3)。
在某些实施方案中,本公开提供了一种分离的抗体,其与本文所述的抗体结合tim-3的相同或重叠表位(例如,人tim-3的表位),本文所述的抗体例如,包含seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46中分别列出的重链和轻链可变区氨基酸序列的抗体。在某些实施方案中,抗体的表位可以通过,例如nmr光谱法、表面等离子体共振
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:57、58、59、60、61、62、63、64、65、66、67或68中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:57中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:58中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:59中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:60中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:61中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:62中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:63中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:64中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:65中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:66中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:67中列出的氨基酸序列的重链。在某些实施方案中,所述抗体包含含有seqidno:68中列出的氨基酸序列的重链。在某些实施方案中,如本文所述的抗体的重链的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:69中列出的氨基酸序列的轻链。在某些实施方案中,如本文所述的抗体的轻链的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:57的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:58的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:59的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:60的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:61的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:62的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:63的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:64的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:65的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:66的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:67的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:68的氨基酸序列的重链;和含有seqidno:69的氨基酸序列的轻链。在某些实施方案中,如本文所述的抗体的重链的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换和/或抗体的轻链的n端谷氨酸(e)残基被焦谷氨酸(pe)残基置换。
任何ig恒定区均可用于本文公开的抗体中。在某些实施方案中,ig区为人igg、ige、igm、igd、iga或igy免疫球蛋白分子,任何类别(例如,igg1、igg2、igg3、igg4、iga1和iga2)或任何亚类(例如,igg2a和igg2b)的免疫球蛋白分子。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:70、71、72、73、74或75的氨基酸序列的重链恒定区。在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:76或77的氨基酸序列的轻链恒定区。
在某些实施方案中,向本文所述抗体的fc区(例如,ch2结构域(人igg1的残基231-340)和/或ch3结构域(人igg1的残基341-447)和/或铰链区引入根据eu编号系统编号的一个、两个或更多个突变(例如,氨基酸取代),以改变所述抗体的一种或多种功能特性,诸如血清半衰期、补体固定、fc受体结合和/或抗原依赖性细胞毒性。
在某些实施方案中,向fc区的铰链区(ch1结构域)引入一个、两个或更多个突变(例如,氨基酸取代),使得铰链区中的半胱氨酸残基数量改变(例如,增加或减少),如例如通过引用整体并入本文的美国专利第5,677,425号中所述。可以改变ch1结构域铰链区中的半胱氨酸残基数量,例如以促进轻链和重链的组装,或改变(例如,提高或降低)抗体的稳定性。
在一个具体实施方案中,向igg恒定结构域或其fcrn结合片段(优选fc或铰链-fc结构域片段)引入一个、两个或更多个氨基酸突变(例如,取代、插入或缺失),以改变(降低或增加)体内抗体的半衰期。将会改变(降低或增加)体内抗体半衰期的突变的实例,参见,例如国际公布第wo02/060919、wo98/23289和wo97/34631号;和美国专利第5,869,046、6,121,022、6,277,375和6,165,745号,其全部通过引用整体并入。在一些实施方案中,向igg恒定结构域或其fcrn结合片段(优选fc或铰链-fc结构域片段)引入一个、两个或更多个氨基酸突变(例如,取代、插入或缺失),以降低体内抗体的半衰期。在其它实施方案中,向igg恒定结构域或其fcrn结合片段(优选fc或铰链-fc结构域片段)引入一个、两个或更多个氨基酸突变(例如,取代、插入或缺失),以增加体内抗体的半衰期。在一个具体实施方案中,所述抗体在第二恒定(ch2)结构域(人igg1的残基231-340)和/或第三恒定(ch3)结构域(人igg1的残基341-447)处可具有根据eu编号系统编号的一个或多个氨基酸突变(例如,取代)。在一个具体实施方案中,本文所述抗体的igg1的恒定区包含根据eu编号系统编号位置252的甲硫氨酸(m)至酪氨酸(y)取代,位置254的丝氨酸(s)至苏氨酸(t)取代,和位置256的苏氨酸(t)至谷氨酸(e)取代。参见美国专利第7,658,921号,其通过引用整体并入本文。已经证实称为“yte突变体”的这类突变igg与相同抗体的野生型形式相比,会展示出增加四倍的半衰期(参见dall’acquawf等人,(2006)jbiolchem281:23514-24,其通过引用整体并入本文)。在某些实施方案中,抗体包含含有根据eu编号系统编号的位置251-257、285-290、308-314、385-389和428-436的氨基酸残基的一个、两个、三个或更多个氨基酸取代。
在一些实施方案中,向本文所述抗体的fc区(例如,ch2结构域(人igg1的残基231-340)和/或ch3结构域(人igg1的残基341-447)和/或铰链区引入根据eu编号系统编号的一个、两个或更多个突变(例如,氨基酸取代),以提高或降低抗体对效应细胞表面的fc受体(例如活化fc受体)的亲和力。抗体fc区中降低或提高抗体对fc受体的亲和力的突变和将此类突变引入fc受体或其片段中的技术是本领域技术人员已知的。可以在抗体fc区中产生以改变抗体对fc受体的亲和力的突变的实例在例如smithp等人,(2012)pnas109:6181-6186,美国专利第6,737,056号和国际公布第wo02/060919、wo98/23289和wo97/34631号中有描述,其全部通过引用整体并入本文。
在另一实施方案中,向igg恒定结构域fc区中引入一个、两个或更多个氨基酸取代以改变抗体的效应功能。例如,选自根据eu编号系统编号的氨基酸残基234、235、236、237、297、318、320和322的一个或多个氨基酸,可以被不同氨基酸残基置换,使得抗体对效应配体的亲和力改变,但保持亲本抗体的抗原结合能力。对其的亲和力改变的效应配体可以是,例如fc受体或补体c1组分。这种方法在美国专利第5,624,821和5,648,260号中进行了更详细地描述,其各自通过引用整体并入本文。在一些实施方案中,恒定区结构域的缺失或失活(通过点突变或其它方式)可以减少循环抗体与fc受体结合,从而增加肿瘤定位。对使恒定结构域缺失或失活并从而增加肿瘤定位的突变的描述,参见,例如美国专利第5,585,097和8,591,886号,其各自通过引用整体并入本文。在某些实施方案中,可向本文所述抗体的fc区引入一个或多个氨基酸取代以去除fc区上的潜在糖基化位点,这样可以减少fc受体结合(参见,例如shieldsrl等人(2001)jbiolchem276:6591-604,其通过引用整体并入本文)。在各个实施方案中,可以在本文所述抗体恒定区中产生根据eu编号系统编号的以下突变中的一种或多种:n297a取代;n297q取代;l235a取代和l237a取代;l234a取代和l235a取代;e233p取代;l234v取代;l235a取代;c236缺失;p238a取代;d265a取代;a327q取代;或p329a取代。在某些实施方案中,可以在本文所述抗体的恒定区中产生选自根据eu编号系统编号的d265a、p329a及其组合的突变。
在一个具体实施方案中,本文所述的抗体包含根据eu编号系统编号,具有n297q或n297a氨基酸取代的igg1恒定结构域。在一个实施方案中,本文所述的抗体包含根据eu编号系统编号,具有选自d265a、p329a及其组合的突变的igg1恒定结构域。在另一个实施方案中,本文所述的抗体包含根据eu编号系统编号,具有选自l234a、l235a及其组合的突变的igg1恒定结构域。在某些实施方案中,在本文所述抗体的恒定区中与人igg1重链中根据eu编号系统编号的位置l234、l235和d265相对应的位置处的氨基酸残基,分别不是l、l和d。这种方法在国际公布第wo14/108483号中进行了详细描述,其通过引用整体并入本文。在一个特定实施方案中,根据eu编号系统编号,与人igg1重链中的位置l234、l235和d265相对应的氨基酸分别为f、e和a;或a、a和a。
在某些实施方案中,根据eu编号系统编号,选自本文所述抗体恒定区中的氨基酸残基329、331和322的一个或多个氨基酸,可以被不同氨基酸残基置换,使得该抗体的c1q结合改变和/或补体依赖性细胞毒性(cdc)降低或消除。这种方法在美国专利第6,194,551号(idusogie等人)中有进一步详细描述,其通过引用整体并入本文。在一些实施方案中,根据eu编号系统编号,改变本文所述抗体ch2结构域n端区域中氨基酸位置231至238内的一个或多个氨基酸残基,从而改变抗体固定补体的能力。这种方法在国际公布第wo94/29351号中有进一步描述,其通过引用整体并入本文。在某些实施方案中,通过使根据eu编号系统编号的以下位置的一个或多个氨基酸突变(例如,引入氨基酸取代)来修饰本文所述抗体的fc区以增加抗体介导抗体依赖性细胞毒性(adcc)的能力和/或增加抗体对fcγ受体的亲和力:238、239、248、249、252、254、255、256、258、265、267、268、269、270、272、276、278、280、283、285、286、289、290、292、293、294、295、296、298、301、303、305、307、309、312、315、320、322、324、326、327、328、329、330、331、333、334、335、337、338、340、360、373、376、378、382、388、389、398、414、416、419、430、434、435、437、438或439。这种方法在国际公布第wo00/42072号中有进一步描述,其通过引用整体并入本文。
在某些实施方案中,本文所述的抗体包含igg4抗体的恒定区并且根据eu编号系统编号的重链氨基酸残基228处的丝氨酸被脯氨酸取代。在某些实施方案中,本公开提供了与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:74的氨基酸序列的重链恒定区。在某些实施方案中,本公开提供了与tim-3(例如,人tim-3)特异性结合的分离的抗体,所述抗体包含含有seqidno:75的氨基酸序列的重链恒定区。
在某些实施方案中,可向本文所述具有两个重链恒定区的抗体的一个或两个重链恒定区中引入本文所述的任何恒定区突变或修饰。
在某些实施方案中,本公开提供了与tim-3(例如,人tim-3)特异性结合并且起拮抗剂作用的分离的抗体。
在某些实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且通过本文所述的和/或本领域技术人员已知的方法评估,相对于无任何抗体或有无关抗体(例如,不与tim-3(例如,人tim-3)特异性结合的抗体)时的tim-3(例如,人tim-3)活性,使tim-3(例如,人tim-3)活性降低至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%。在某些实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且通过本文所述的和/或本领域技术人员已知的方法评估,相对于无任何抗体或有无关抗体(例如,不与tim-3(例如,人tim-3)特异性结合的抗体)时的tim-3(例如,人tim-3)活性,使tim-3(例如,人tim-3)活性降低至少约1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。tim-3(例如,人tim-3)活性的非限制性实例包括tim-3(例如,人tim-3)信号传导,tim-3(例如,人tim-3)与tim-3(例如,人tim-3)配体(例如,磷脂酰丝氨酸)结合,及抑制细胞因子生成(例如,ifn-γ和/或tnf-α)。在某些实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且灭活、降低或抑制tim-3(例如,人tim-3)活性。在具体实施方案中,如下文实施例中所述,评估tim-3(例如,人tim-3)活性的降低。
在具体实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,相对于无任何抗体或有无关抗体(例如,不与tim-3(例如,人tim-3)特异性结合的抗体)时tim-3(例如,人tim-3)与其配体(例如,磷脂酰丝氨酸)的结合,使tim-3(例如,人tim-3)与其配体(例如,磷脂酰丝氨酸)的结合减少至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%。在具体实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,相对于无任何抗体或有无关抗体(例如,不与tim-3(例如,人tim-3)特异性结合的抗体)时tim-3(例如,人tim-3)与其配体(例如,磷脂酰丝氨酸)的结合,使tim-3(例如,人tim-3)与其配体(例如,磷脂酰丝氨酸)的结合减少至少约1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。
在具体实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,相对于无任何抗体或有无关抗体(例如,不与tim-3(例如,人tim-3)特异性结合的抗体)时的细胞因子生成,使细胞因子(例如,ifn-γ和/或tnf-α)生成增加至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%。在具体实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,相对于无任何抗体或有无关抗体(例如,不与tim-3(例如,人tim-3)特异性结合的抗体)时的细胞因子生成,使细胞因子(例如,ifn-γ和/或tnf-α)生成增加至少约1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。
在具体实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且单独地或与抗pd-1抗体(例如,派姆单抗或纳武单抗)组合,通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,相对于无任何抗体或有无关抗体(例如,不与tim-3(例如,人tim-3)特异性结合的抗体)时的ifn-γ生成,使人外周血单核细胞(pbmc)中响应于葡萄球菌肠毒素a(sea)刺激的ifn-γ生成增加至少约1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。
在某些实施方案中,在本文所述的与tim-3(例如,人tim-3)特异性结合的抗体存在下,经葡萄球菌肠毒素a(sea)刺激的人外周血单核细胞(pbmc),通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,相对于无任何抗体或有无关抗体(例如,不与tim-3(例如,人tim-3)特异性结合的抗体)时仅受sea刺激的pbmc,ifn-γ生成增加至少约1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。
在具体实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且单独地或与抗pd-l抗体(例如,派姆单抗或纳武单抗)组合,通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,相对于没有与tim-3(例如,人tim-3)特异性结合的抗体时的ifn-γ和/或tnfα生成,使肿瘤浸润淋巴细胞(til)中响应于抗cd3抗体和抗cd28抗体刺激的ifn-γ和/或tnfα生成增加至少约1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。在一个实施方案中,til来自于非小细胞肺癌(nsclc)肿瘤。在另一个实施方案中,til来自于胆囊腺癌肿瘤。在另一个实施方案中,til来自于乳腺癌肿瘤。
在某些实施方案中,在本文所述的与tim-3(例如,人tim-3)特异性结合的抗体存在下,经抗cd3抗体和抗cd28抗体刺激的肿瘤浸润淋巴细胞(til),通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,相对于没有与tim-3(例如,人tim-3)特异性结合的抗体时仅受抗cd3抗体和抗cd28抗体刺激的til,ifn-γ和/或tnfα生成增加至少约1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。在一个实施方案中,til来自于非小细胞肺癌(nsclc)肿瘤。在另一个实施方案中,til来自于胆囊腺癌肿瘤。在另一个实施方案中,til来自于乳腺癌肿瘤。
在某些实施方案中,本公开提供了一种分离的抗体,其与tim-3(例如,人tim-3)特异性结合并且在与表达tim-3(例如,人tim-3)的细胞结合后内化。在具体实施方案中,通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的本文所述抗体在与表达tim-3(例如,人tim-3)的细胞结合后内化。在某些实施方案中,在包括以下步骤的测定中,在本文所述抗体的存在下与在参考抗tim-3(例如,人tim-3)抗体的存在下相比,存活的表达tim-3(例如,人tim-3)的细胞百分比低:
(a)按每孔2x104个细胞将表达tim-3(例如,人tim-3)的细胞铺板在组织培养板中;
(b)按100μl/孔的最终体积,添加相同浓度的αhfc-nc-dm1和本文所述的抗体或参考抗tim-3(例如,人tim-3)抗体(例如,1.5ng/ml、4.6ng/ml、13.7ng/ml、41.2ng/ml、123.5ng/ml、370ng/ml、1111ng/ml或3333ng/ml);
(c)在37℃和5%co2下孵育72小时;
(d)测量表达tim-3(例如,人tim-3)的细胞的存活;并且
(e)计算相对于未经处理的表达tim-3(例如,人tim-3)的细胞的细胞存活百分比。
在某些实施方案中,在本文所述抗体存在下的细胞存活百分比比在参考抗tim-3(例如,人tim-3)抗体存在下的细胞存活百分比低至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%。在某些实施方案中,在本文所述抗体存在下的细胞存活百分比比在参考抗tim-3(例如,人tim-3)抗体存在下的细胞存活百分比低至少约1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍。在某些实施方案中,参考抗tim-3(例如,人tim-3)抗体为pab1944w(igg1n297a)。在某些实施方案中,参考抗tim-3(例如,人tim-3)抗体为hum11(igg4s228p)。在某些实施方案中,表达tim-3(例如,人tim-3)的细胞为kasumi-3细胞。在某些实施方案中,表达tim-3(例如,人tim-3)的细胞为kasumi-3细胞(
在某些实施方案中,在包括以下步骤的测定中,相对于未经处理的表达tim-3(例如,人tim-3)的细胞,在本文所述抗体的存在下,至多50%表达tim-3(例如,人tim-3)的细胞存活:
(a)按每孔2x104个细胞将表达tim-3(例如,人tim-3)的细胞铺板在组织培养板中;
(b)按100μl/孔的最终体积,添加相同浓度的αhfc-nc-dm1和本文所述的抗体(例如,1.5ng/ml、4.6ng/ml、13.7ng/ml、41.2ng/ml、123.5ng/ml、370ng/ml、1111ng/ml或3333ng/ml);
(c)在37℃和5%co2下孵育72小时;
(d)测量表达tim-3(例如,人tim-3)的细胞的存活;并且
(e)计算相对于未经处理的表达tim-3(例如,人tim-3)的细胞的细胞存活百分比。
在某些实施方案中,相对于未经处理的表达tim-3(例如,人tim-3)的细胞,在本文所述抗体的存在下,至多10%、15%、20%、25%、30%、35%、40%、45%或50%表达tim-3(例如,人tim-3)的细胞存活。在某些实施方案中,添加浓度为1111ng/ml的αhfc-nc-dm1和本文所述的抗体并且相对于未经处理的表达tim-3(例如,人tim-3)的细胞,在本文所述抗体的存在下,至多10%、15%、20%、25%、30%、35%、40%、45%或50%表达tim-3(例如,人tim-3)的细胞存活。在某些实施方案中,添加浓度为1111ng/ml的αhfc-nc-dm1和本文所述的抗体并且相对于未经处理的表达tim-3(例如,人tim-3)的细胞,在本文所述抗体的存在下,至多50%表达tim-3(例如,人tim-3)的细胞存活。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有x1x2x3x4x5s(seqidno:48)的氨基酸序列的cdrh1,其中:
x1为r、s、a、g、k、m或t,
x2为q、s、a、g、r或t,
x3为n、y、g或q,
x4为a或q,并且
x5为w、m、a、s或t。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有x1x2naws(seqidno:49)的氨基酸序列的cdrh1,其中
x1为r或a;并且
x2为q或r。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有x1x2gqx3s(seqidno:50)的氨基酸序列的cdrh1,其中
x1为k、m或g;
x2为a或s;并且
x3为s或t。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有x1x2qqas(seqidno:51)的氨基酸序列的cdrh1,其中
x1为s、r、t或g;并且
x2为a、s、t或g。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有wvsaisgsggsty(seqidno:2)的氨基酸序列的cdrh2。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有akggdyggnyfd(seqidno:3)的氨基酸序列的cdrh3。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有x1asqsvx2ssyla(seqidno:52)的氨基酸序列的cdrl1,其中
x1为r或g;并且
x2不存在或为s。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有x1asx2rat(seqidno:53)的氨基酸序列的cdrl2,其中
x1为d或g,并且
x2为n、s或t。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含含有qqygsspx1t(seqidno:54)的氨基酸序列的cdrl3,其中
x1为l或i。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体与包含分别如以下所列的重链和轻链可变区氨基酸序列的抗体交叉竞争结合tim-3(例如,人tim-3):seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中该抗体与本文所述的抗体,例如包含分别如以下所列的重链和轻链可变区氨基酸序列的抗体,结合tim-3(例如,人tim-3)的相同或重叠表位:seqidno:24和36;24和38;26和42;24和42;24和46;24和43;26和43;26和46;26和41;24和41;25和39;24和47;25和40;26和47;25和37;25和45;25和44;25和46;25和42;25和41;25和43;25和47;27和46;28和46;29和46;30和46;31和46;32和46;33和46;34和46;或35和46。
在某些实施方案中,本公开提供了一种与tim-3(例如,人tim-3)特异性结合的分离的抗体,其中通过本文所述的(参见下文的实施例)或本领域技术人员已知的方法评估,至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的抗体在与表达tim-3(例如,人tim-3)的细胞结合之后内化,并且其中所述抗体包含为野生型人igg重链恒定区变体的人igg重链恒定区,其中所述变体人igg重链恒定区以比野生型人igg重链恒定区与人fcγ受体结合的亲和力低的亲和力与人fcγ受体结合。在某些实施方案中,人fcγ受体选自fcγri、fcγrii和fcγriii。在某些实施方案中,变体人igg重链恒定区是包含根据eu编号系统编号的n297a突变的igg1恒定区。
6.3药物组合物
本文提供了包含在生理上可接受的载体、赋形剂或稳定剂中具有所需纯度的本文所述的抗tim-3(例如,人tim-3)抗体的组合物(remington’spharmaceuticalsciences(1990)mackpublishingco.,easton,pa)。可接受的载体、赋形剂或稳定剂在所用剂量和浓度下对受者无毒,并且包括缓冲剂,诸如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)的多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂诸如edta;糖类,诸如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐抗衡离子诸如钠;金属复合物(例如,锌-蛋白质复合物);和/或非离子表面活性剂,诸如tweentm、pluronicstm或聚乙二醇(peg)。
在一个具体实施方案中,药物组合物包含于药学上可接受的载体中的本文所述的抗tim-3(例如,人tim-3)抗体和任选一种或多种附加预防剂或治疗剂。在一个具体实施方案中,药物组合物包含有效量的于药学上可接受的载体中的本文所述的抗tim-3(例如,人tim-3)抗体和任选一种或多种附加预防剂或治疗剂。在一些实施方案中,所述抗体是药物组合物中包括的唯一活性成分。本文所述的药物组合物可用于抑制tim-3(例如,人tim-3)活性和治疗病状,诸如癌症或感染性疾病。在一个实施方案中,本发明涉及本发明的药物组合物,其包含用作药物的本发明的抗tim-3抗体。在另一个实施方案中,本发明涉及用于治疗癌症或感染性疾病的方法中的本发明的药物组合物。在另一个实施方案中,本发明涉及本发明的药物组合物用于制备治疗癌症或感染性疾病的药物的用途。
肠胃外制剂中使用的药学上可接受的载体包括水性媒介物、非水性媒介物、抗微生物剂、等渗剂、缓冲剂、抗氧化剂、局部麻醉剂、悬浮剂和分散剂、乳化剂、多价螯合剂或螯合剂和其它药学上可接受的物质。水性媒介物的实例包括氯化钠注射液、林格氏注射液(ringersinjection)、等渗葡萄糖注射液、无菌水注射液、葡萄糖和乳酸林格氏注射液。非水性肠胃外媒介物包括植物来源的不挥发性油、棉籽油、玉米油、芝麻油和花生油。可以将抑菌或抑真菌浓度的抗微生物剂添加到包装在多剂量容器中的肠胃外制剂中,包括苯酚或甲酚、汞、苄醇、氯丁醇、对羟基苯甲酸甲酯和对羟基苯甲酸甲酯、硫柳汞、苯扎氯铵和苄索氯铵。等渗剂包括氯化钠和右旋糖。缓冲剂包括磷酸盐和柠檬酸盐。抗氧化剂包括硫酸氢钠。局部麻醉剂包括盐酸普鲁卡因。悬浮剂和分散剂包括羧甲基纤维素钠、羟丙基甲基纤维素和聚乙烯吡咯烷酮。乳化剂包括聚山梨醇酯80(
可以配制药物组合物用于对受试者的任何施用途径。施用途径的具体实例包括鼻内、口服、肺部、透皮、皮内和肠胃外。本文还考虑了肠胃外施用,其特征在于皮下、肌肉内或静脉内注射。注射剂可以以常规形式制备,可以制备成液体溶液或悬浮液,适合在注射前溶解或悬浮在液体中的固体形式,或者乳液。注射剂、溶液和乳剂还含有一种或多种赋形剂。合适的赋形剂为,例如水、盐水、右旋糖、甘油或乙醇。另外,如果需要,待施用的药物组合物还可含有少量无毒辅助物质,诸如润湿剂或乳化剂、ph缓冲剂、稳定剂、溶解度增强剂和其它此类剂,例如乙酸钠、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯和环糊精。
用于肠胃外施用抗体的制剂包括注射即用型无菌溶液;准备好在使用前与溶剂组合的无菌干燥可溶性产品,诸如冻干粉,包括皮下注射片剂;注射即用型无菌悬浮液;准备好在使用前与媒介物组合的无菌干燥不溶性产品;和无菌乳液。所述溶液可以是水溶液或非水溶液。
如果经静脉内施用,则合适的载体包括生理盐水或磷酸盐缓冲盐水(pbs),以及含有增稠剂和助溶剂,诸如葡萄糖、聚乙二醇和聚聚丙二醇及其混合物的溶液。
如所述制备包含抗体的外用混合物用于局部和全身施用。所得混合物可以是溶液、悬浮液、乳液等,并且可以配制成乳膏、凝胶、软膏、乳液、溶液、酏剂、洗剂、悬浮液、酊剂、糊剂、泡沫、气溶胶、冲洗剂、喷雾剂、栓剂、绷带、皮肤贴剂或适于局部施用的任何其它调配物。
本文所述的抗tim-3(例如,人tim-3)抗体可以配制成气溶胶供局部应用,例如通过吸入(参见,例如美国专利第4,044,126、4,414,209和4,364,923号,其描述了用于递送对治疗炎症性疾病,特别是哮喘有用的类固醇的气溶胶并且通过引用整体并入本文)。这些用于向呼吸道施用的调配物可以呈用于雾化器的气溶胶或溶液的形式,或作为单独地或与惰性载体诸如乳糖组合用于吹入的微细粉末。在此类情况下,所述调配物的颗粒,在一个实施方案中将具有小于50微米的直径,在一个实施方案中将具有小于10微米的直径。
本文所述的抗tim-3(例如,人tim-3)抗体可以配制成凝胶、乳膏和洗剂形式用于局部(local)或局部(topical)应用,例如向皮肤和粘膜诸如眼部局部应用,并且可以配制用于向眼部应用或用于脑池内或脊柱内应用。考虑到局部施用,用于透皮递送并且还用于向眼部或粘膜施用,或用于吸入疗法。也可以施用单独的抗体或与其它药学上可接受的赋形剂组合的鼻用溶液。
透皮贴剂,包括离子电渗和电泳装置,是本领域技术人员公知的,并且可以用于施用抗体。例如,在美国专利第6,267,983、6,261,595、6,256,533、6,167,301、6,024,975、6,010715、5,985,317、5,983,134、5,948,433和5,860,957号中公开了此类贴剂,所述专利全部通过引用整体并入本文。
在某些实施方案中,包含本文所述抗体的药物组合物为冻干粉,其可以重构为溶液、乳液和其它混合物用于施用。也可以重构并配制成固体或凝胶。通过将本文所述的抗体或其药学上可接受的衍生物溶解在合适的溶剂中来制备冻干粉。在一些实施方案中,冻干粉是无菌的。溶剂可含有赋形剂,其改善粉末或由粉末制备的重构溶液的稳定性或其它药理学组分。可以使用的赋形剂包括但不限于右旋糖、山梨糖醇、果糖、玉米糖浆、木糖醇、甘油、葡萄糖、蔗糖或其它合适的剂。在一个实施方案中,溶剂还可含有约为中性ph的缓冲剂,例如柠檬酸盐、磷酸钠或磷酸钾或本领域技术人员已知的其它此类缓冲剂。随后对溶液进行无菌过滤,接着在本领域技术人员已知的标准条件下冻干,得到所需调配物。在一个实施方案中,将所得溶液分配到小瓶中进行冻干。每个小瓶将含有单剂量或多剂量的化合物。冻干粉可以储存在适当条件下,例如在约4℃至室温下。用注射用水重构该冻干粉提供了用于肠胃外施用的调配物。为了重建,将冻干粉添加到无菌水或其它合适的载体中。精确的量取决于所选化合物。此量可以凭经验确定。
本文所述的抗tim-3(例如,人tim-3)抗体和本文提供的其它组合物还可以配制成靶向待治受试者身体的特定组织、受体或其它区域。许多此类靶向方法是本领域技术人员所公知的。本文考虑所有此类靶向方法用于本发明组合物。对于靶向方法的非限制性实例,参见例如,美国专利第6,316,652、6,274,552、6,271,359、6,253,872、6,139,865、6,131,570、6,120,751、6,071,495、6,060,082、6,048,736、6,039,975、6,004,534、5,985,307、5,972,366、5,900,252、5,840,674、5,759,542和5,709,874号,其全部通过引用整体并入本文。在一个具体实施方案中,本文所述的抗体靶向肿瘤。
待用于体内施用的组合物可以是无菌的。这易于通过例如无菌过滤膜过滤实现。
6.4使用方法和用途
另一方面,本公开提供了一种使用本文公开的抗tim-3(例如,人tim-3)抗体治疗受试者的方法。受试者中任何将会受益于对tim-3(例如,人tim-3)功能的抑制的疾病或病症均可使用本文公开的抗tim-3(例如,人tim-3)抗体治疗。本文公开的抗tim-3(例如,人tim-3)抗体对抑制免疫系统对肿瘤的耐受性特别有用,并且因此可用作癌症受试者的免疫疗法。例如,在某些实施方案中,本公开提供了一种增加响应于受试者抗原的t细胞活化的方法,所述方法包括向受试者施用有效量的如本文所公开的抗tim-3(例如,人tim-3)抗体或其药物组合物。在某些实施方案中,本公开提供了一种治疗受试者癌症的方法,所述方法包括向受试者施用有效量的如本文所公开的抗体或其药物组合物。在某些实施方案中,本公开提供了用于治疗癌症或感染性疾病的方法中的如本文所公开的抗体或药物组合物。在某些实施方案中,本公开提供了用作药物的如本文所公开的抗体或药物组合物。在另一个实施方案中,本公开提供了如本文所公开的抗体或药物组合物用于制备治疗癌症或感染性疾病的药物的用途。
可用本文公开的抗tim-3(例如,人tim-3)抗体或药物组合物治疗的癌症包括但不限于实体瘤、血液学癌症(例如,白血病、淋巴瘤、骨髓瘤(例如多发性骨髓瘤))和转移性病变。在一个实施方案中,癌症为实体瘤。实体瘤的实例包括恶性肿瘤,例如肉瘤和癌,例如各种器官系统的腺癌,诸如影响肺、乳腺、卵巢、淋巴、胃肠(例如结肠)、肛门、生殖器和泌尿生殖道(例如,肾、尿路上皮、膀胱细胞、前列腺)、咽、cns(例如脑、神经或神经胶质细胞)、头颈部、皮肤(如黑色素瘤)和胰腺的那些腺癌,以及包括诸如结肠癌、直肠癌、肾细胞癌、肝癌、肺癌(例如,非小细胞肺癌或小细胞肺癌)、小肠癌和食道癌等恶性肿瘤在内的腺癌。所述癌症可能处于早期、中期、晚期或为转移性癌症。在某些实施方案中,所述癌症与升高的pd-1活性(例如,升高的pd-1表达)相关。
在一个实施方案中,所述癌症选自肺癌(例如,肺腺癌或非小细胞肺癌(nsclc)(例如,具有鳞状和/或非鳞状组织学特征的nsclc,或nsclc腺癌))、黑素瘤(例如,晚期黑色素瘤)、肾癌(例如肾细胞癌)、肝癌(例如,肝细胞癌)、骨髓瘤(例如多发性骨髓瘤)、前列腺癌、乳腺癌(例如,不表达雌激素受体、孕激素受体或her2/neu中的一种、两种或全部的乳腺癌症,例如三阴性乳腺癌)、卵巢癌、结直肠癌、胰腺癌、头颈癌(例如,头颈部鳞状细胞癌(hnscc)、肛门癌、胃食管癌(例如食道鳞状细胞癌)、间皮瘤、鼻咽癌、甲状腺癌、宫颈癌、上皮癌、腹膜癌或淋巴组织增生性疾病(例如,移植后淋巴组织增生性疾病)。在一个实施方案中,所述癌症为nsclc。在一个实施方案中,所述癌症为肾细胞癌。在一个实施方案中,所述癌症为卵巢癌。在一个具体实施方案中,卵巢癌是铂难治性卵巢癌。
在一个实施方案中,所述癌症为血液学癌症,例如白血病、淋巴瘤或骨髓瘤。在一个实施方案中,所述癌症为白血病,例如急性成淋巴细胞性白血病(all)、急性髓性白血病(aml)、急性成髓细胞性白血病(aml)、慢性淋巴细胞性白血病(cll)、慢性髓性白血病(cml)、慢性骨髓性白血病(cml)、慢性骨髓单核细胞性白血病(cmml)、慢性淋巴细胞性白血病(cll)或毛细胞白血病。在一个实施方案中,所述癌症为淋巴瘤,例如b细胞淋巴瘤、弥漫性大b细胞淋巴瘤(dlbcl)、活化b细胞样(abc)弥漫性大b细胞淋巴瘤、生发中心b细胞(gcb)弥漫性大b细胞淋巴瘤、套细胞淋巴瘤、霍奇金淋巴瘤(hodgkinlymphoma)、非霍奇金淋巴瘤(non-hodgkinlymphoma)、复发性非霍奇金淋巴瘤、难治性非霍奇金淋巴瘤、复发性滤泡性非霍奇金淋巴瘤、伯基特淋巴瘤(burkittlymphoma)、小淋巴细胞淋巴瘤、滤泡性淋巴瘤、淋巴浆细胞淋巴瘤或结外边缘区淋巴瘤。在一个实施方案中,所述癌症为骨髓瘤,例如多发性骨髓瘤。
在另一个实施方案中,所述癌症选自癌(例如,晚期或转移癌)、黑素瘤或肺癌,例如非小细胞肺癌。
在一个实施方案中,所述癌症为肺癌,例如肺腺癌、非小细胞肺癌或小细胞肺癌。
在一个实施方案中,所述癌症为黑素瘤,例如晚期黑素瘤。在一个实施方案中,所述癌症是对其它疗法无应答的晚期或不可切除的黑素瘤。在其它实施方案中,所述癌症是具有braf突变(例如,brafv600突变)的黑素瘤。还有其它实施方案中,本文公开的抗tim-3(例如,人tim-3)抗体或药物组合物在用含或不含braf抑制剂(例如,威罗菲尼(vemurafenib)或达拉菲尼(dabrafenib))的抗-ctla-4抗体(例如,伊匹单抗(ipilimumab))治疗后施用。
在另一个实施方案中,所述癌症为肝癌,例如有或无病毒感染的晚期肝癌,例如慢性病毒性肝炎。
在另一个实施方案中,所述癌症为前列腺癌,例如晚期前列腺癌。
再另一个实施方案中,所述癌症为骨髓瘤,例如多发性骨髓瘤。
再另一个实施方案中,所述癌症为肾癌,例如肾细胞癌(rcc)(例如,转移性rcc、透明细胞肾细胞癌(ccrcc)或肾乳头状细胞癌)。
再另一个实施方案中,所述癌症选自肺癌、黑素瘤、肾癌、乳腺癌、结直肠癌、白血病或癌症的转移性病变。
在某些实施方案中,本公开提供了预防或治疗受试者的感染性疾病的方法,该方法包括向受试者施用有效量的如本文所公开的抗tim-3(例如,人tim-3)抗体或其药物组合物。在一个实施方案中,本文提供了用于预防和/或治疗感染(例如,病毒感染、细菌感染、真菌感染、原生动物感染或寄生虫感染)的方法。根据该方法预防和/或治疗的感染可由本文鉴定的感染因子引起。在一个具体实施方案中,本文所述的抗tim-3(例如,人tim-3)抗体或其组合物是施用于受试者的唯一活性剂。在一些实施方案中,本文所述的抗tim-3(例如,人tim-3)抗体或其组合物与用于治疗感染性疾病的抗感染干预(例如,抗病毒药、抗细菌药、抗真菌药或抗蠕虫药)组合使用。因此,在一个实施方案中,本发明涉及用于预防和/或治疗感染性疾病的方法中的本发明的抗体和/或药物组合物,任选地其中所述抗体或药物组合物是施用给受试者的唯一活性剂,或其中所述抗体或药物组合物与抗感染干预组合使用。
可通过本文公开的抗tim-3(例如,人tim-3)抗体或药物组合物治疗和/或预防的感染性疾病由感染因子引起,包括但不限于细菌、寄生虫、真菌、原生动物和病毒。在一个具体实施方案中,通过本文公开的抗tim-3(例如人tim-3)抗体或药物组合物治疗和/或预防的感染性疾病是由病毒引起的。可根据本文所述的方法预防和/或治疗的病毒性疾病或病毒性感染包括但不限于由甲型肝炎、乙型肝炎、丙型肝炎、流感(例如,甲型流感或乙型流感)、水痘、腺病毒、单纯疱疹病毒i型(hsv-i)、单纯疱疹病毒ii型(hsv-ii)、牛瘟、鼻病毒、埃可病毒、轮状病毒、呼吸道合胞病毒、乳头瘤病毒、乳多泡病毒、巨细胞病毒、棘状病毒(echinovirus)、虫媒病毒、汉坦病毒(huntavirus)、柯萨奇病毒、腮腺炎病毒、麻疹病毒、风疹病毒、脊髓灰质炎病毒、天花病毒、eb病毒、i型人类免疫缺陷病毒(hiv-i)和ii型人类免疫缺陷病毒(hiv-ii),及病毒性疾病如病毒性脑膜炎、脑炎、登革热(dengue)或天花的因子引起的那些。
可以预防和/或治疗的细菌感染包括由大肠杆菌(escherichiacoli)、肺炎克雷伯菌(klebsiellapneumoniae)、金黄色葡萄球菌(staphylococcusaureus)、粪肠球菌(enterococcusfaecalis)、普通变形杆菌(proteusvulgaris)、草绿色葡萄球菌(staphylococcusviridan)和铜绿假单胞菌(pseudomonasaeruginosa)引起的感染。可以根据本文描述的方法预防和/或治疗的由细菌(例如,大肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌、粪肠球菌、普通变形杆菌、草绿色葡萄球菌和铜绿假单胞菌)引起的细菌性疾病包括但不是限于,分枝杆菌立克次氏体(mycobacteriarickettsia)、支原体(mycoplasma)、奈瑟球菌(neisseria)、肺炎链球菌(s.pneumonia)、伯氏疏螺旋体(borreliaburgdorferi)(莱姆病(lymedisease))、炭疽芽孢杆菌(bacillusantracis)(炭疽)、破伤风、链球菌(streptococcus)、葡萄球菌(staphylococcus)、分枝杆菌(mycobacterium)、百日咳(pertissus)、霍乱(cholera)、鼠疫(plague)、白喉(diptheria)、衣原体(chlamydia)、金黄色葡萄球菌和军团杆菌(legionella)。
可以根据本文所述的方法预防和/或治疗的由原生动物引起的原生动物疾病或原生动物感染包括但不限于利什曼原虫、球虫病、锥虫血吸虫或疟疾引起的疾病。可以根据本文所述的方法预防和/或治疗的由寄生虫引起的寄生虫疾病或寄生虫感染包括但不限于衣原体和立克次氏体引起的疾病。
可根据本文所述的方法预防和/或治疗的真菌疾病或真菌感染包括但不限于由以下引起的那些:念珠菌(candida)感染、接合菌病(zygomycosis)、念珠菌乳腺炎、具有潜伏性毛孢子虫血症的进行性播散性毛孢子菌病、播散性念珠菌病、肺副球孢子菌病、肺曲霉病、卡氏肺孢子虫(pneumocystiscarinii)肺炎、隐球菌性脑膜炎、球孢子菌(coccidioidal)脑膜脑炎和脑脊髓脉管炎,黑曲霉(aspergillusniger)感染、镰刀菌角膜炎(fusariumkeratitis)、副鼻窦霉菌病、烟曲霉(aspergillusfumigatus)心内膜炎、胫骨软骨发育不良、光滑念珠菌(candidaglabrata)阴道炎、口咽念珠菌病、x连锁慢性肉芽肿病、足癣、皮肤念珠菌病、霉菌性胎盘炎、播散性毛孢子菌病、变应性支气管肺曲菌病、真菌性角膜炎、新型隐球菌(cryptococcusneoformans)感染、真菌性腹膜炎、膝曲弯孢菌(curvulariageniculata)感染、葡萄球菌眼内炎、孢子丝菌病和皮肤真菌病。
在某些实施方案中,这些方法还包括向受试者施用附加治疗剂。在某些实施方案中,附加治疗剂为化疗剂、放疗剂或检查点靶向剂。在某些实施方案中,化疗剂为减甲基化剂(例如阿扎胞苷(azacitidine))。在某些实施方案中,检查点靶向剂选自拮抗剂抗ctla-4抗体、拮抗剂抗pd-l1抗体、拮抗剂抗pd-l2抗体、拮抗剂抗pd-1抗体、拮抗剂抗tim-3抗体、拮抗剂抗lag-3抗体、拮抗剂抗ceacam1抗体、激动剂抗cd137抗体、拮抗剂抗tigit抗体、拮抗剂抗vista抗体、激动剂抗gitr抗体和激动剂抗ox40抗体。
在一个实施方案中,本发明涉及用于本发明方法中的本发明的抗体和/或药物组合物,其中所述方法还包括向受试者施用附加治疗剂。在一个实施方案中,本发明涉及(a)本发明的抗体和/或药物组合物和(b)用作药物的附加治疗剂。在一个实施方案中,本发明涉及(a)本发明的抗体和/或药物组合物,和(b)用于治疗癌症的方法中的附加治疗剂。在另一实施方案中,本发明涉及一种药物组合物、药盒或分药盒,其包含(a)本发明的抗体和/或药物组合物和(b)另附加治疗剂。在一个实施方案中,附加治疗剂为化疗剂、放疗剂或检查点靶向剂。
在某些实施方案中,在本文公开的方法中使用抗pd-1抗体。在某些实施方案中,抗pd-1抗体是bristol-myerssquibb开发的纳武单抗,也称为bms-936558或mdx1106。在某些实施方案中,抗pd-1抗体是merck&co开发的派姆单抗,也称为拉姆布罗力珠单抗(lambrolizumab)或mk-3475。在某些实施方案中,抗pd-1抗体是curetech开发的皮地利珠单抗(pidilizumab),也称为ct-011。在某些实施方案中,抗pd-1抗体是medimmune开发的medi0680,也称为amp-514。在某些实施方案中,抗pd-1抗体是novartispharmaceuticals开发的pdr001。在某些实施方案中,抗pd-1抗体是regeneronpharmaceuticals开发的regn2810。在某些实施方案中,抗pd-1抗体是pfizer开发的pf-06801591。在某些实施方案中,抗pd-1抗体是beigene开发的bgb-a317。在某些实施方案中,抗pd-1抗体是anaptysbio和tesaro开发的tsr-042。在某些实施方案中,抗pd-1抗体是hengrui开发的shr-1210。
在以下专利和专利申请中公开了可用于本文公开的治疗方法中的抗pd-1抗体的更多非限制性实例,所述专利和专利申请全部通过引用整体并入本文用于所有目的:美国专利第6,808,710号;美国专利第7,332,582号;美国专利第7,488,802号;美国专利第8,008,449号;美国专利第8,114,845号;美国专利第8,168,757号;美国专利第8,354,509号;美国专利第8,686,119号;美国专利第8,735,553号;美国专利第8,747,847号;美国专利第8,779,105号;美国专利第8,927,697号;美国专利第8,993,731号;美国专利第9,102,727号;美国专利第9,205,148号;美国公布第us2013/0202623a1号;美国公布第us2013/0291136a1号;美国公布第us2014/0044738a1号;美国公布第us2014/0356363a1号;美国公布第us2016/0075783a1号;和pct公布第wo2013/033091a1号;pct公布第wo2015/036394a1号;pct公布第wo2014/179664a2号;pct公布第wo2014/209804a1号;pct公布第wo2014/206107a1号;pct公布第wo2015/058573a1号;pct公布第wo2015/085847a1号;pct公布第wo2015/200119a1号;pct公布第wo2016/015685a1号;和pct公布第wo2016/020856a1号。
在某些实施方案中,在本文公开的方法中使用抗pd-l1抗体。在某些实施方案中,抗pd-l1抗体是genentech开发的阿特珠单抗(atezolizumab)。在某些实施方案中,抗pd-l1抗体是astrazeneca、celgene和medimmune开发的度伐鲁单抗(durvalumab)。在某些实施方案中,抗pd-l1抗体是merckserono和pfizer开发的阿维鲁单抗(avelumab),也称为msb0010718c。在某些实施方案中,抗pd-l1抗体是bristol-myerssquibb开发的mdx-1105。在某些实施方案中,抗pd-l1抗体是amplimmuneandgsk开发的amp-224。
在以下专利和专利申请中公开了可用于本文公开的治疗方法中的抗pd-l1抗体的非限制性实例,所述专利和专利申请全部通过引用整体并入本文用于所有目的:美国公布第7,943,743号;美国公布第8,168,179号;美国公布第8,217,149号;美国专利第8,552,154号;美国专利第8,779,108号;美国专利第8,981,063号;美国专利第9,175,082号;美国公布第us2010/0203056a1号;美国公布第us2003/0232323a1号;美国公布第us2013/0323249a1号;美国公布第us2014/0341917a1号;美国公布第us2014/0044738a1号;美国公布第us2015/0203580a1号;美国公布第us2015/0225483a1号;美国公布第us2015/0346208a1号;美国公布第us2015/0355184a1号;和pct公布第wo2014/100079a1号;pct公布第wo2014/022758a1号;pct公布第wo2014/055897a2号;pct公布第wo2015/061668a1号;pct公布第wo2015/109124a1号;pct公布第wo2015/195163a1号;pct公布第wo2016/000619a1号;和pct公布第wo2016/030350a1号。
在某些实施方案中,本文公开的抗tim-3(例如,人tim-3)抗体与靶向免疫调节酶诸如ido(吲哚胺-(2,3)-双加氧酶)和/或tdo(色氨酸2,3-双加氧酶)的化合物组合施用于受试者。因此,在一个实施方案中,附加治疗剂是靶向免疫调节酶的化合物,诸如吲哚胺-(2,3)-双加氧酶(ido)的抑制剂。在某些实施方案中,此类化合物选自epacadostat(incytecorp;参见,例如通过引用整体并入本文的wo2010/005958)、f001287(flexusbiosciences/bristol-myerssquibb)、indoximod(newlinkgenetics)和nlg919(newlinkgenetics)。在一个实施方案中,所述化合物为epacadostat。在另一个实施方案中,所述化合物为f001287。在另一个实施方案中,所述化合物为indoximod。在另一个实施方案中,所述化合物为nlg919。在一个具体实施方案中,本文公开的抗tim-3(例如,人tim-3)抗体与用于治疗癌症的ido抑制剂组合施用于受试者。如本文所述用于治疗癌症的ido抑制剂存在于药物组合物的固体剂型中,诸如片剂、丸剂或胶囊,其中所述药物组合物包括ido抑制剂和药学上可接受的赋形剂。同样,如本文所述的抗体和如本文所述的ido抑制剂可以作为独立剂型单独、依次或同时施用。在一个实施方案中,所述抗体经肠胃外施用,而ido抑制剂经口服施用。在特定实施方案中,所述抑制剂选自epacadostat(incytecorporation)、f001287(flexusbiosciences/bristol-myerssquibb)、indoximod(newlinkgenetics)和nlg919(newlinkgenetics)。在pct公布第wo2010/005958号中描述了epacadostat,其通过引用整体并入本文用于所有目的。在一个实施方案中,所述抑制剂为epacadostat。在另一个实施方案中,所述抑制剂为f001287。在另一个实施方案中,所述抑制剂为indoximod。在另一个实施方案中,所述抑制剂为nlg919。
在某些实施方案中,本文公开的抗tim-3(例如,人tim-3)抗体与疫苗组合施用于受试者。所述疫苗可以是,例如肽疫苗、dna疫苗或rna疫苗。在某些实施方案中,所述疫苗是基于热休克蛋白的肿瘤疫苗或基于热休克蛋白的病原体疫苗。在某些实施方案中,本文公开的抗tim-3(例如,人tim-3)抗体与通过引用整体并入本文的wo2016/183486中所述的疫苗(例如,包含至少一种包含来自于受试者的癌症中存在的癌特异性突变的合成肽的疫苗)组合施用于受试者。在一个具体实施方案中,本文公开的抗tim-3(例如,人tim-3)抗体与基于热休克蛋白的肿瘤疫苗组合施用于受试者。热休克蛋白(hsp)是在所有物种中普遍存在的高度保守蛋白家族。其表达可以因热休克或其它形式的应激(包括暴露于毒素、氧化应激或葡萄糖饥饿)而有效诱导到高得多的水平。已根据分子量归类为五个家族:hsp-110、hsp-90、hsp-70、hsp-60和hsp-28。hsp通过抗原呈递细胞(apc)如巨噬细胞和树突状细胞(dc)中的交叉呈递途径递送免疫原性肽,从而导致t细胞活化。hsp起到肿瘤相关抗原肽的伴侣蛋白载体的作用,形成能够诱导肿瘤特异性免疫的复合物。在从垂死肿瘤细胞释放时,hsp-抗原复合物由抗原呈递细胞(apc)摄取,在其中抗原被加工成结合mhci类和ii类分子的肽,从而导致抗肿瘤cd8+和cd4+t细胞活化。由源自肿瘤制剂的hsp复合物引发的免疫特异性地针对各受试者的癌症所表达的独特抗原肽库。因此,在一个实施方案中,本发明涉及(a)本发明的抗体和/或药物组合物和(b)疫苗,其用作药物,例如用于治疗癌症的方法中。在一个实施方案中,本发明涉及药物组合物、药盒或分药盒,其包含(a)本发明的抗体和/或药物组合物和(b)疫苗。在一个实施方案中,所述疫苗是基于热休克蛋白的肿瘤疫苗。在一个实施方案中,所述疫苗是基于热休克蛋白的病原体疫苗。
热休克蛋白肽复合物(hsppc)是由与抗原肽非共价复合的热休克蛋白组成的蛋白肽复合物。hsppc引发先天性和适应性免疫应答。在一个具体实施方案中,抗原肽对所治癌症显示出抗原性。hsppc通过膜受体(主要是cd91)或通过结合toll-样受体被apc有效捕捉。hsppc内化导致apc功能成熟及趋化因子和细胞因子产生,从而导致天然杀伤细胞(nk)、单核细胞活化及th1和th-2介导的免疫应答。在某些实施方案中,本文公开的方法中使用的hsppc包含与抗原肽复合的来自应激蛋白hsp60、hsp70或hsp90家族的一种或多种热休克蛋白。在某些实施方案中,hsppc包含hsc70、hsp70、hsp90、hsp110、grp170、gp96、钙网蛋白(calreticulin)或其两种或更多种的组合。
在一个具体实施方案中,热休克蛋白肽复合物(hsppc)包含与重组抗原肽复合的重组热休克蛋白(例如,hsp70或hsc70)或其肽结合结构域。重组热休克蛋白可以通过重组dna技术产生,例如,使用如dworniczak和mirault,nucleicacidres.15:5181-5197(1987)及genbank登录号p11142和/或y00371中所述的人hsc70序列,其各自通过引用整体并入本文。在某些实施方案中,hsp70序列如hunt和morimotoproc.natl.acad.sci.u.s.a.82(19),6455-6459(1985)及genbank登录号p0dmv8和/或m11717中所述,其各自通过引用整体并入本文。抗原肽也可以通过本领域中已知的重组dna方法制备。
在某些实施方案中,抗原肽包含经修饰的氨基酸。在某些实施方案中,经修饰的氨基酸包含翻译后修饰。在某些实施方案中,经修饰的氨基酸包含翻译后修饰的模拟物。在某些实施方案中,经修饰的氨基酸是已经在侧链羟基或胺上磷酸化的tyr、ser、thr、arg、lys或his。在某些实施方案中,经修饰的氨基酸是已经在侧链羟基或胺上磷酸化的tyr、ser、thr、arg、lys或his氨基酸的模拟物。
在一个具体实施方案中,本文公开的抗tim-3(例如,人tim-3)抗体与热休克蛋白肽复合物(hsppc),例如,热休克蛋白肽复合物-96(hsppc-96)组合施用于受试者以治疗癌症。hsppc-96包含与抗原肽复合的96kda热休克蛋白(hsp),即gp96。hsppc-96是从受试者的肿瘤制得的癌症免疫治疗剂且含有癌症的抗原“指纹”。在某些实施方案中,这种指纹含有仅存在于该特定受试者的特定癌细胞中的独特抗原,并且注射疫苗意在刺激受试者的免疫系统以识别和攻击具有特定癌症指纹的任何细胞。因此,在一个实施方案中,本发明涉及与热休克蛋白肽复合物(hsppc)组合的本发明的抗体和/或药物组合物,其用作药物和/或用于治疗癌症的方法中。
在某些实施方案中,hsppc,例如hsppc-96,由受试者的肿瘤组织产生。在一个具体实施方案中,hsppc(例如,hsppc-96)由所治疗的癌症或其转移类型的肿瘤产生。在另一具体实施方案中,hsppc(例如,hsppc-96)是所治疗的受试者自体的。在某些实施方案中,肿瘤组织是非坏死肿瘤组织。在某些实施方案中,至少1克(例如,至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9或至少10克)的非坏死肿瘤组织用于产生疫苗方案。在某些实施方案中,在手术切除后,非坏死肿瘤组织在用于疫苗制备之前冷冻。在一些实施方案中,hsppc,例如hsppc-96,通过纯化技术从肿瘤组织分离,过滤并制备用于可注射疫苗。在某些实施方案中,为受试者施用6-12个剂量的hsppc,例如hspcc-96。在此类实施方案中,hsppc(例如hsppc-96)剂量的前4个剂量可以每周施用一次,然后2-8个另外的剂量每两周施用一次。
可以根据本文所述的方法使用的hsppc的更多实例公开于以下专利和专利申请中,其全部通过引用整体并入本文:美国专利第6,391,306、6,383,492、6,403,095、6,410,026、6,436,404、6,447,780、6,447,781和6,610,659。
在某些实施方案中,本文中公开的抗tim-3抗体与佐剂组合施用于受试者。可以根据治疗情况使用各种佐剂。合适佐剂的非限制性实例包括但不限于完全弗氏佐剂(cfa)、不完全弗氏佐剂(ifa)、montanideisa(不完全seppic佐剂)、ribi佐剂体系(ras)、titermax、胞壁肽、syntex佐剂制剂(saf)、明矾(氢氧化铝和/或磷酸铝)、铝盐佐剂、
在某些实施方案中,本文中公开的抗tim-3抗体与包含tcr的附加治疗剂组合施用于受试者。在某些实施方案中,附加治疗剂为可溶性tcr。在某些实施方案中,附加治疗剂是表达tcr的细胞。因此,在一个实施方案中,本发明涉及与包含tcr的附加治疗剂组合的本发明的抗体和/或药物组合物,其用作药物和/或用于治疗癌症的方法中。
在某些实施方案中,本文公开的抗tim-3抗体与表达嵌合抗原受体(car)的细胞组合施用于受试者。在某些实施方案中,所述细胞为t细胞。
在某些实施方案中,本文公开的抗tim-3抗体与tcr模拟抗体组合施用于受试者。在某些实施方案中,tcr模拟抗体是特异性结合肽-mhc复合物的抗体。对于tcr模拟抗体的非限制性实例,参见,例如美国专利第9,074,000号及美国公布第us2009/0304679a1和us2014/0134191a1号,其全部通过引用整体并入本文。
抗tim-3(例如,人tim-3)抗体和附加治疗剂(例如,化疗剂、放疗剂、检查点靶向剂、ido抑制剂、疫苗、佐剂、可溶性tcr、表达tcr的细胞、表达嵌合抗原受体的细胞和/或tcr模拟抗体)可以作为独立剂型单独、依次或同时施用。在一个实施方案中,抗tim-3(例如,人tim-3)抗体经肠胃外施用,而ido抑制剂经口服施用。
本文所述的抗体或药物组合物可以通过多种途径递送到受试者。这些包括但不限于肠胃外、鼻内、气管内、口服、皮内、外用、肌肉内、腹膜内、透皮、静脉内、鞘内、肿瘤内、结膜、动脉内和皮下途径。在某些实施方案中,所述抗体或药物组合物经静脉内递送。也可以采用肺部施用,例如,通过使用吸入器或雾化器,以及用雾化剂配制用作喷雾。在某些实施方案中,本文所述的抗体或药物组合物经皮下或静脉内递送。在某些实施方案中,本文所述的抗体或药物组合物经动脉内递送。在某些实施方案中,本文所述的抗体或药物组合物经肿瘤内递送。在某些实施方案中,本文所述的抗体或药物组合物递送至肿瘤引流淋巴结。
治疗和/或预防病状有效的抗体或组合物的量将取决于疾病的性质,并且可以通过标准临床技术测定。
待用于组合物中的精确剂量也将取决于施用途径及感染或由其引起的疾病的严重性,并且应当根据从业者的判断和各受试者的情况决定。例如,有效剂量也可以根据施用方式、目标部位、患者的生理状态(包括年龄、体重和健康)(无论患者是人还是动物)、施用的其它药物治疗或治疗是预防性的还是治疗性的而变化。通常,患者是人,但是也可以治疗非人哺乳动物包括转基因动物。治疗剂量经最佳地滴定以优化安全性和效力。
本文所述的抗tim-3(例如,人tim-3)抗体也可以用于利用本领域技术人员已知的经典免疫组织学方法(包括免疫测定,诸如酶联免疫吸附测定(elisa)、免疫沉淀或western印迹)测定生物样品中的tim-3(例如,人tim-3)蛋白水平。合适的抗体测定标记是本领域中已知的并且包括酶标记诸如葡萄糖氧化酶;放射性同位素诸如碘(125i、121i)、碳(14c)、硫(35s)、氚(3h)、铟(121in)和锝(99tc);发光标记,诸如鲁米诺(luminol);和荧光标记,诸如荧光素和罗丹明,及生物素。此类标记可以用于标记本文所述的抗体。或者,识别本文所述的抗tim-3(例如,人tim-3)抗体的第二抗体可以被标记并与抗tim-3(例如,人tim-3)抗体组合用于检测tim-3(例如,人tim-3)蛋白水平。因此,在一个实施方案中,本发明涉及本发明的抗体用于体外检测生物样品中的tim-3(例如,人tim-3)蛋白的用途。在另一实施方案中,本发明涉及本发明的抗tim-3(例如,人tim-3)抗体用于体外测定和/或检测生物样品中的tim-3(例如,人tim-3)蛋白水平的用途,任选地其中抗tim-3(例如,人tim-3)抗体与放射性核素或可检测标记缀合和/或携带本文所述的标记,和/或其中使用免疫组织学方法。
对tim-3(例如,人tim-3)蛋白表达水平的测定意在包括直接地(例如,通过测定或估计绝对蛋白水平)或相对地(例如,通过与第二生物样品中的疾病相关蛋白水平比较)定性或定量地测量或估计第一生物样品中的tim-3(例如,人tim-3)蛋白水平。可以测量或估计第一生物样品中的tim-3(例如,人tim-3)多肽表达水平并与标准tim-3(例如,人tim-3)蛋白水平相比较,该标准获自从没有病症的个体获得的第二生物样品或通过平均来自没有病症的个体群体的水平来确定。如本领域中所认识到的,一旦已知“标准”tim-3(例如,人tim-3)多肽水平,就可以重复地用作比较标准。因此,在另一实施方案中,本发明涉及用于测定和/或检测生物样品中的tim-3蛋白水平,例如人tim-3蛋白水平的体外方法,其包括通过免疫组织学方法定性或定量地测量或估计生物样品中的tim-3蛋白,例如人tim-3蛋白的水平。
如本文中所用,术语“生物样品”是指从受试者获得的任何生物样品,可能表达tim-3(例如,人tim-3)的细胞系、组织或其它细胞来源。用于从动物(例如,人)获得组织活检样品和体液的方法是本领域中公知的。生物样品包括外周血单核细胞。
本文所述的抗tim-3(例如,人tim-3)抗体可以用于预后、诊断、监测和筛选应用,包括技术人员公知和标准的和基于本说明书的体外和体内应用。用于体外评估和评价免疫系统状态和/或免疫应答的预后、诊断、监测和筛选测定和药盒可以用于预测、诊断和监测以评价患者样品,包括已知具有或怀疑具有免疫系统功能障碍的那些,或关于预期或所需免疫系统应答、抗原应答或疫苗应答来预测、诊断和监测。对免疫系统状态和/或免疫应答的评估和评价也可用于测定患者对于药物临床试验或对于施用特定化疗剂、放疗剂或抗体(包括其组合),相对于不同剂或抗体的适合性。这一类型的预后和诊断性监测和评估实际上早已利用针对乳腺癌中的her2蛋白的抗体(herceptesttm,dako),其中所述测定也用于针对使用
在一个实施方案中,抗tim-3(例如,人tim-3)抗体可以用于活检样品的免疫组织化学中。在一个实施方案中,该方法是体外方法。在另一个实施方案中,抗tim-3(例如,人tim-3)抗体可以用于检测tim-3(例如,人tim-3)的水平或在其膜表面上含有tim-3(例如,人tim-3)的细胞的水平,然后可以将该水平与某些疾病症状相关联。本文所述的抗tim-3(例如,人tim-3)抗体可以携带可检测或功能性标记和/或可以与放射性核素或可检测标记缀合。当使用荧光标记时,当前可用的显微镜术和荧光激活细胞分选分析(facs)或本领域中已知的两种方法过程的组合可以用于鉴定和量化特定结合成员。本文所述的抗tim-3(例如,人tim-3)抗体可以携带荧光标记或与荧光标记缀合。示例性荧光标记包括,例如反应性和缀合探针,例如氨基香豆素(aminocoumarin)、荧光素(fluorescein)和德克萨斯红(texasred)、alexafluor染料、cy染料和dylight染料。抗tim-3(例如,人tim-3)抗体可以携带放射性标记或放射性核素或与之偶联,如同位素3h、14c、32p、35s、36cl、51cr、57co、58co、59fe、67cu、90y、99tc、111in、117lu、121i、124i、125i、131i、198au、211at、213bi、225ac和186re。当使用放射性标记时,当前可用的本领域已知的计数程序可以用于鉴定和量化抗tim-3(例如,人tim-3)抗体与tim-3(例如,人tim-3)的特异性结合。在其中标记是酶的情况中,检测可以通过如本领域中已知的任何当前采用的比色、分光光度、荧光分光光度、电流分析或气体定量技术完成。这可以通过在允许形成抗体和tim-3(例如,人tim-3)之间的复合物的条件下使样品或对照样品与抗tim-3(例如,人tim-3)抗体接触来实现。检测抗体和tim-3(例如,人tim-3)之间形成的任何复合物并在样品或对照样品中进行比较。鉴于本文所述的抗体对tim-3(例如,人tim-3)的特异性结合,抗体可以用于特异性检测细胞表面的tim-3(例如,人tim-3)表达。本文所述的抗体也可以用于通过免疫亲和纯化来纯化tim-3(例如,人tim-3)。本文还包括用于定量分析例如tim-3(例如,人tim-3)或tim-3(例如,人tim-3)/tim-3(例如,人tim-3)配体复合物的存在水平,可制备成测试药盒、药盒或分药盒的形式的测定系统。该系统、测试药盒、药盒或分药盒可以包含标记的组分,例如标记的抗体,和一种或多种附加免疫化学试剂。
6.5用于产生抗tim-3抗体的多核苷酸、载体和方法
另一方面,本文提供了包含编码特异性结合tim-3(例如,人tim-3)抗原的本文所述的抗体或其片段(例如,轻链可变区和/或重链可变区)的核苷酸序列的多核苷酸,及载体,例如包含此类多核苷酸用于在宿主细胞(例如,大肠杆菌和哺乳动物细胞)中重组表达的载体。本文提供了包含编码本文提供的任何抗体的重链和/或轻链的核苷酸序列的多核苷酸,以及包含此类多核苷酸序列的载体,例如用于在宿主细胞,例如哺乳动物细胞中高效表达的表达载体。
如本文中所用,“分离的”多核苷酸或核酸分子是与在该核酸分子的天然来源(例如,小鼠或人)中存在的其它核酸分子分开的多核苷酸或核酸分子。而且,“分离的”核酸分子诸如cdna分子可以基本上不含其它细胞物质,或在通过重组技术产生时,基本上不含培养基,或在化学合成时,基本上不含化学前体或其它化学品。例如,语言“基本上不含”包括具有少于约15%、10%、5%、2%、1%、0.5%或0.1%(尤其是少于约10%)的其它物质(例如,细胞物质、培养基、其它核酸分子、化学前体和/或其它化学品)的多核苷酸或核酸分子制剂。在一个具体实施方案中,编码本文所述的抗体的核酸分子是分离或纯化的。
在特定方面中,本文提供了包含编码特异性结合tim-3(例如,人tim-3)多肽且包含如本文所述的氨基酸序列的抗体,以及与此类抗体竞争结合tim-3(例如,人tim-3)多肽(例如,以剂量依赖性方式)或与此类抗体结合相同表位的抗体的核苷酸序列的多核苷酸。
在某些方面中,本文提供了包含编码本文所述抗体的轻链或重链的核苷酸序列的多核苷酸。多核苷酸可以包含编码含有本文所述的抗体的vlfr和cdr(参见,例如表1)的轻链的核苷酸序列或编码含有本文所述的抗体的vhfr和cdr(参见,例如表1)的重链的核苷酸序列。
本文还提供了编码抗tim-3(例如,人tim-3)抗体的多核苷酸,例如通过密码子/rna优化、异源信号序列置换和mrna不稳定性元件的消除来对其进行优化。通过引入密码子变化和/或消除mrna中的抑制性区域产生用于重组表达的编码抗tim-3(例如,人tim-3)抗体或其片段(例如,轻链、重链、vh结构域或vl结构域)的优化核酸的方法可以通过相应地采用例如,美国专利第5,965,726、6,174,666、6,291,664、6,414,132和6,794,498中描述的优化方法进行,所述专利全部通过引用整体并入本文。例如,rna内的潜在剪接位点和不稳定性元件(例如,富a/t或a/u元件)可以突变而不改变该核酸序列编码的氨基酸以提高用于重组表达的rna的稳定性。所述改变利用了遗传密码的简并性,例如,使用相同氨基酸的替代密码子。在一些实施方案中,可能希望改变一个或多个密码子以编码保守性突变,例如具有与原始氨基酸相似的化学结构和性质和/或功能的相似氨基酸。相对于由尚未优化的多核苷酸编码的抗tim-3(例如,人tim-3)抗体的表达,此类方法可以使抗tim-3(例如,人tim-3)抗体或其片段的表达增加至少1倍、2倍、3倍、4倍、5倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍或更多。
在某些实施方案中,编码本文所述的抗tim-3(例如,人tim-3)抗体或其片段(例如,vl结构域和/或vh结构域)的优化多核苷酸序列可以与编码本文所述的抗tim-3(例如,人tim-3)抗体或其片段(例如,vl结构域和/或vh结构域)的未优化多核苷酸序列的反义(例如,互补)多核苷酸杂交。在具体实施方案中,编码本文所述的抗tim-3(例如,人tim-3)抗体或其片段的优化核苷酸序列在高严格性条件下与编码本文所述的抗tim-3(例如,人tim-3)抗体或其片段的未优化多核苷酸序列的反义多核苷酸杂交。在一个具体实施方案中,编码本文所述的抗tim-3(例如,人tim-3)抗体或其片段的优化核苷酸序列在高严格性、中等或低严格性杂交条件下与编码本文所述的抗tim-3(例如,人tim-3)抗体或其片段的未优化多核苷酸序列的反义多核苷酸杂交。关于杂交条件的信息已有描述,参见,例如,美国专利申请公开第us2005/0048549号(例如,72-73段),其通过引用整体并入本文。
多核苷酸可以通过本领域中已知的任何方法获得,并测定多核苷酸的核苷酸序列。编码本文所述的抗体(例如,表1中所描述的抗体)及这些抗体的修饰形式的核苷酸序列可以使用本领域中公知的方法测定,即,已知编码特定氨基酸的核苷酸密码子以产生编码该抗体的核酸的方式组装。此类编码抗体的多核苷酸可以由化学合成的寡核苷酸组装(例如,如kutmeier等人(1994),biotechniques17:242-6中所述,其通过引用整体并入本文),简言之,这涉及合成含有部分抗体编码序列的重叠寡核苷酸,使那些寡核苷酸退火和连接,然后通过pcr扩增连接的寡核苷酸。
或者,编码本文所述的抗体的多核苷酸可以使用本领域中公知的方法(例如,pcr和其它分子克隆方法)由来自合适来源(例如,杂交瘤)的核酸产生。例如,使用可与已知序列的3’和5’末端杂交的合成引物进行的pcr扩增可以使用从产生目标抗体的杂交瘤细胞获得的基因组dna进行。此类pcr扩增方法可以用于获得包含编码抗体轻链和/或重链的序列的核酸。此类pcr扩增方法可以用于获得包含编码抗体可变轻链区和/或可变重链区的序列的核酸。扩增的核酸可以克隆到用于在宿主细胞中表达和用于进一步克隆的载体中,例如,以产生嵌合和人源化抗体。
如果含有编码特定抗体的核酸的克隆物不可得,但抗体分子的序列已知,则编码免疫球蛋白的核酸可以化学合成或通过使用可与该序列的3’和5’末端杂交的合成引物进行pcr扩增或通过使用对于特定基因序列有特异性的寡核苷酸探针进行克隆以鉴定例如来自编码抗体的cdna文库的cdna克隆物而从合适的来源(例如,抗体cdna文库或从由表达抗体的任何组织或细胞(诸如选择用于表达本文所述的抗体的杂交瘤细胞)分离的核酸(优选聚a+rna)产生的cdna文库)获得。通过pcr产生的扩增核酸然后可以使用本领域中公知的任何方法克隆到可复制克隆载体中。
编码本文所述的抗tim-3(例如,人tim-3)抗体的dna可以使用常规程序(例如,通过使用能够特异性结合编码抗tim-3(例如,人tim-3)抗体的重链和轻链的基因的寡核苷酸探针)容易地分离和测序。杂交瘤细胞可以用作此类dna的来源。一旦分离,就可以将dna置于表达载体中,然后将表达载体转染到宿主细胞诸如大肠杆菌细胞、猿cos细胞、中国仓鼠卵巢(cho)细胞(例如,来自chogssystemtm(lonza)的cho细胞)或骨髓瘤细胞(其不另外产生免疫球蛋白)中以在重组宿主细胞中获得抗tim-3(例如,人tim-3)抗体的合成。
为产生全抗体,可以使用包括vh或vl核苷酸序列、限制性位点和保护限制性位点的侧翼序列的pcr引物扩增scfv克隆物中的vh或vl序列。利用本领域技术人员已知的克隆技术,可以将pcr扩增的vh结构域克隆到表达重链恒定区(例如,人γ4恒定区)的载体中,并且可以将pcr扩增的vl结构域克隆到表达轻链恒定区(例如,人κ或λ恒定区)的载体中。在某些实施方案中,用于表达vh或vl结构域的载体包含ef-1α启动子、分泌信号、可变区克隆位点、恒定结构域和选择标记如新霉素(neomycin)。vh和vl结构域也可以克隆到表达必要恒定区的一个载体中。然后使用本领域技术人员已知的技术将重链转换载体和轻链转换载体共转染到细胞系中以产生表达全长抗体(例如,igg)的稳定或瞬时细胞系。
也可以例如通过用人重链和轻链恒定结构域的编码序列替代鼠序列,或者通过将非免疫球蛋白多肽的全部或部分编码序列与免疫球蛋白编码序列共价接合来修饰dna。
还提供了在高严格性、中等或低严格性杂交条件下与编码本文所述的抗体的多核苷酸杂交的多核苷酸。在具体实施方案中,本文所述的多核苷酸在高严格性、中等或低严格性杂交条件下与编码本文提供的vh结构域和/或vl结构域的多核苷酸杂交。
杂交条件已经在本领域中进行了描述并且是本领域技术人员已知的。例如,在严格条件下的杂交可以涉及在约45℃下在6x氯化钠/柠檬酸钠(ssc)中与滤器结合的dna杂交,接着在约50-65℃下在0.2xssc/0.1%sds中洗涤一次或多次;在高度严格条件下的杂交可以涉及在约45℃下在6xssc中与滤器结合的核酸杂交,接着在约68℃下在0.1xssc/0.2%sds中洗涤一次或多次。在其它严格杂交条件下的杂交是本领域技术人员已知的并且已进行了描述,参见,例如,ausubelfm等人编辑(1989)currentprotocolsinmolecularbiology,第i卷,greenpublishingassociates,inc.和johnwiley&sons,inc.,newyork,第6.3.1-6.3.6和2.10.3页,其通过引用整体并入本文。
在某些方面中,本文提供了表达(例如,重组表达)特异性结合tim-3(例如,人tim-3)的本文所述的抗体的细胞(例如,宿主细胞),及相关多核苷酸和表达载体。本文提供了用于在宿主细胞中,优选在哺乳动物细胞中重组表达的包含含有编码抗tim-3(例如,人tim-3)抗体或片段的核苷酸序列的多核苷酸的载体(例如,表达载体)。本文还提供了包含用于重组表达本文所述的抗tim-3(例如,人tim-3)抗体(例如,人或人源化抗体)的此类载体的宿主细胞。在一个特定方面中,本文提供了用于产生本文所述的抗体的方法,其包括从宿主细胞表达此类抗体。
特异性结合tim-3(例如,人tim-3)的本文所述的抗体(例如,本文所述的全长抗体、抗体的重链和/或轻链或单链抗体)的重组表达涉及构建含有编码该抗体的多核苷酸的表达载体。一旦获得编码本文所述的抗体分子、抗体的重链和/或轻链或其片段(例如,重链和/或轻链可变区)的多核苷酸,则用于产生抗体分子的载体可以使用本领域中公知的技术通过重组dna技术产生。因此,本文描述了用于通过表达含有编码抗体或抗体片段(例如,轻链或重链)的核苷酸序列的多核苷酸制备蛋白质的方法。本领域技术人员公知的方法可以用于构建含有抗体或抗体片段(例如,轻链或重链)编码序列及适当转录和翻译控制信号序列的表达载体。这些方法包括,例如,体外重组dna技术、合成技术和体内遗传重组。还提供了包含任选地与启动子连接的编码本文所述的抗体分子、抗体的重链或轻链、抗体或其片段的重链或轻链可变区或者重链或轻链cdr的核苷酸序列的可复制载体。此类载体可以,例如,包括编码抗体分子恒定区的核苷酸序列(参见,例如,国际公布第wo86/05807和wo89/01036号;和美国专利第5,122,464号,其通过引用整体并入本文),并且抗体可变区可以克隆到此类载体中用于表达整条重链、整条轻链或整条重链和轻链两者。
表达载体可以通过常规技术转移到细胞(例如,宿主细胞),然后所得细胞可以通过常规技术培养以产生本文所述的抗体或其片段。因此,本文提供了含有编码本文所述的抗体或其片段,或其重链或轻链或其片段,或本文所述的单链抗体的多核苷酸的宿主细胞,所述多核苷酸与用于在宿主细胞中表达此类序列的启动子可操作地连接。在某些实施方案中,为了表达双链抗体,如以下详述的那样,单独地编码重链和轻链两者的载体可以在宿主细胞中共表达以表达整个免疫球蛋白分子。在某些实施方案中,宿主细胞含有包含编码本文所述的抗体或片段的重链和轻链两者的多核苷酸。在具体实施方案中,宿主细胞含有两个不同的载体,第一载体包含编码本文所述的抗体或其片段的重链或重链可变区的多核苷酸,而第二载体包含编码本文所述的抗体或其片段的轻链或轻链可变区的多核苷酸。在其它实施方案中,第一宿主细胞包含含有编码本文所述的抗体或其片段的重链或重链可变区的多核苷酸的第一载体,而第二宿主细胞包含含有编码本文所述的抗体或其片段的轻链或轻链可变区的多核苷酸的第二载体。在具体实施方案中,由第一细胞表达的重链/重链可变区与第二细胞的轻链/轻链可变区缔合形成本文所述的抗tim-3(例如,人tim-3)抗体。在某些实施方案中,本文提供了包含此类第一宿主细胞和此类第二宿主细胞的宿主细胞群体。
在一个特定实施方案中,本文提供了载体群体,其包含含有编码本文所述的抗tim-3(例如,人tim-3)抗体的轻链/轻链可变区的多核苷酸的第一载体和含有编码本文所述的抗tim-3(例如,人tim-3)抗体的重链/重链可变区的多核苷酸的第二载体。
多种宿主-表达载体系统可以用于表达本文所述的抗体分子(参见,例如,美国专利第5,807,715号,其通过引用整体并入本文)。此类宿主-表达系统代表可以通过其产生并随后纯化目标编码序列的媒介物,但也代表在用适当核苷酸编码序列转化或转染时可以原位表达本文所述的抗体分子的细胞。这些包括但不限于微生物,诸如用含有抗体编码序列的重组噬菌体dna、质粒dna或粘粒dna表达载体转化的细菌(例如,大肠杆菌和枯草芽孢杆菌(b.subtilis));用含有抗体编码序列的重组酵母表达载体转化的酵母(例如,毕赤酵母(saccharomycespichia));用含有抗体编码序列的重组病毒表达载体(例如,杆状病毒)感染的昆虫细胞系统;用重组病毒表达载体(例如,花椰菜花叶病毒,camv;烟草花叶病毒,tmv)感染的或用含有抗体编码序列的重组质粒表达载体(例如,ti质粒)转化的植物细胞系统(例如,绿藻诸如莱茵衣藻(chlamydomonasreinhardtii));或携带含有源自哺乳动物细胞基因组的启动子(例如,金属硫蛋白启动子)或源自哺乳动物病毒的启动子(例如,腺病毒晚期启动子;牛痘病毒7.5k启动子)的重组表达构建体的哺乳动物细胞系统(例如,cos(例如,cos1或cos)、cho、bhk、mdck、hek293、ns0、per.c6、vero、crl7o3o、hss78bst、hela和nih3t3、hek-293t、hepg2、sp210、r1.1、b-w、l-m、bsc1、bsc40、yb/20和bmt10细胞)。在一个具体实施方案中,用于表达本文所述的抗体的细胞是cho细胞,例如来自chogssystemtm(lonza)的cho细胞。在一个特定实施方案中,用于表达本文所述的抗体的细胞是人细胞,例如,人细胞系。在一个具体实施方案中,哺乳动物表达载体为poptivectm或pcdna3.3。在一个特定实施方案中,特别是用于表达完整重组抗体分子的细菌细胞诸如大肠杆菌或真核细胞(例如,哺乳动物细胞)用于表达重组抗体分子。例如,与载体诸如来自人巨细胞病毒的主要中早期基因启动子元件结合的哺乳动物细胞诸如中国仓鼠卵巢(cho)细胞是抗体的有效表达系统(foeckingmk&hofstetterh(1986)gene45:101-5;和cockettmi等人(1990)biotechnology8(7):662-7,其各自通过引用整体并入本文)。在某些实施方案中,本文所述的抗体通过cho细胞或ns0细胞产生。在一个具体实施方案中,编码特异性结合tim-3(例如,人tim-3)的本文所述的抗体的核苷酸序列的表达受组成型启动子、诱导型启动子或组织特异性启动子调节。
在细菌系统中,多种表达载体可以有利地根据所表达抗体分子的预期用途来选择。例如,当要产生大量此类抗体用于生成抗体分子的药物组合物时,指导容易纯化的融合蛋白产物的高水平表达的载体可能是合需要的。此类载体包括但不限于大肠杆菌表达载体pur278(ruetheru&mueller-hillb(1983)emboj2:1791-1794),其中抗体编码序列可以单独地与lacz编码区同框连接到载体中,以便产生融合蛋白;pin载体(inouyes&inouyem(1985)nucacidsres13:3101-3109;vanheekeg&schustersm(1989)jbiolchem24:5503-5509);等等,其全部通过引用整体并入本文。例如,pgex载体也可以用于将外源多肽表达为与谷胱甘肽5-转移酶(gst)的融合蛋白。一般而言,此类融合蛋白是可溶性的且可以容易地通过吸附和与基质谷胱甘肽琼脂糖珠结合,接着在游离谷胱甘肽的存在下洗脱从裂解细胞纯化。pgex载体设计为包括凝血酶或因子xa蛋白酶裂解位点以使得克隆的靶基因产物可以从gst部分释放。
在昆虫系统中,例如,苜蓿银纹夜蛾(autographacalifornica)核多角体病毒(acnpv)可以用作表达外源基因的载体。病毒在草地贪夜蛾(spodopterafrugiperda)细胞中生长。抗体编码序列可以单独克隆到病毒的非必需区(例如多角体蛋白基因)中并置于acnpv启动子(例如多角体蛋白启动子)的控制下。
在哺乳动物宿主细胞中,可以利用多种基于病毒的表达系统。在其中腺病毒用作表达载体的情况下,目标抗体编码序列可以连接到腺病毒转录/翻译控制复合体,例如晚期启动子和三联体前导序列。然后可以通过体外或体内重组将这一嵌合基因插入到腺病毒基因组中。病毒基因组的非必需区(例如,el或e3区)中的插入将产生有活力并且能够在受感染宿主中表达抗体分子的重组病毒(例如,参见loganj&shenkt(1984)pnas81(12):3655-9,其通过引用整体并入本文)。特定起始信号序列也可以是插入的抗体编码序列高效翻译所需的。这些信号序列包括atg起始密码子和相邻序列。此外,起始密码子必须与所需编码序列的阅读框同相以确保整个插入片段翻译。这些外源翻译控制信号序列和起始密码子可以具有多种来源,天然的和合成的。表达效率可以通过包括适当的转录增强子元件、转录终止子等而增强(参见,例如,bitterg等人(1987)methodsenzymol.153:516-544,其通过引用整体并入本文)。
另外,可以选择调节插入序列的表达或者以所需的特定方式修饰和加工基因产物的宿主细胞株。蛋白质产物的此类修饰(例如,糖基化)和加工(例如,裂解)对于蛋白质的功能可能很重要。不同的宿主细胞具有用于蛋白质和基因产物的翻译后加工和修饰的特有和特定机制。可以选择适当的细胞系或宿主系统以确保对所表达的外源蛋白的正确修饰和加工。为此,可以使用具有用于初级转录物的适当加工、基因产物的糖基化和磷酸化的细胞机制的真核宿主细胞。此类哺乳动物宿主细胞包括但不限于cho、vero、bhk、hela、mdck、hek293、nih3t3、w138、bt483、hs578t、htb2、bt2o和t47d、ns0(不内源产生任何免疫球蛋白链的鼠骨髓瘤细胞系)、crl7o3o、cos(例如,cos1或cos)、per.c6、vero、hss78bst、hek-293t、hepg2、sp210、r1.1、b-w、l-m、bsc1、bsc40、yb/20、bmt10和hss78bst细胞。在某些实施方案中,本文所述的抗tim-3(例如,人tim-3)抗体在哺乳动物细胞,诸如cho细胞中产生。
在一个具体实施方案中,本文所述的抗体具有降低的岩藻糖含量或没有岩藻糖含量。此类抗体可以使用本领域技术人员已知的技术产生。例如,抗体可以在岩藻糖化能力缺陷或缺乏的细胞中表达。在一个具体实例中,α1,6-岩藻糖基转移酶的两个等位基因敲除的细胞系可以用于产生岩藻糖含量降低的抗体。
为了长期、高产率产生重组蛋白,可以生成稳定的表达细胞。例如,可以生成稳定地表达本文所述的抗tim-3(例如,人tim-3)抗体的细胞系。在具体实施方案中,本文提供的细胞稳定地表达轻链/轻链可变区和重链/重链可变区,其缔合形成本文所述的抗体。
在某些方面中,不使用含病毒复制起点的表达载体,宿主细胞可以用受到适当表达控制元件(例如,启动子、增强子、序列、转录终止子、多腺苷酸化位点等)和选择标记控制的dna转化。在引入外源dna/多核苷酸后,可以允许工程化细胞在富集培养基中生长1-2天,然后转换为选择培养基。重组质粒中的选择标记赋予对选择的抗性并且允许细胞稳定地将质粒整合到其染色体中并生长以形成可以转而克隆和扩增到细胞系中的基因座。这种方法可以有利地用于工程化表达本文所述的抗tim-3(例如,人tim-3)抗体或其片段的细胞系。此类工程化细胞系可以对筛选和评价直接或间接地与抗体分子相互作用的组合物特别有用。
可以使用多种选择系统,包括但不限于分别在tk-、hgprt-或aprt-细胞中的单纯疱疹病毒胸苷激酶(wiglerm等人(1977)cell11(1):223-32)、次黄嘌呤鸟嘌呤磷酸核糖基转移酶(szybalskaeh&szybalskiw(1962)pnas48(12):2026-2034)和腺嘌呤磷酸核糖基转移酶(lowyi等人(1980)cell22(3):817-23)基因,其全部通过引用整体并入本文。同样,抗代谢物抗性可以用作对于以下基因进行选择的基础:dhfr,其赋予对甲氨喋呤的抗性(wiglerm等人(1980)pnas77(6):3567-70;o’harek等人(1981)pnas78:1527-31);gpt,其赋予对霉酚酸的抗性(mulliganrc&bergp(1981)pnas78(4):2072-6);neo,其赋予对氨基糖苷g-418的抗性(wugy&wuch(1991)biotherapy3:87-95;tolstoshevp(1993)annrevpharmacoltoxicol32:573-596;mulliganrc(1993)science260:926-932;和morganra&andersonwf(1993)annrevbiochem62:191-217;nabelgj&felgnerpl(1993)trendsbiotechnol11(5):211-5);和hygro,其赋予对潮霉素的抗性(santerrerf等人(1984)gene30(1-3):147-56),其全部通过引用整体并入本文。重组dna技术领域中通常已知的方法可以常规地应用于选择所需的重组克隆物并且此类方法例如在ausubelfm等人(编辑),currentprotocolsinmolecularbiology,johnwiley&sons,ny(1993);krieglerm,genetransferandexpression,alaboratorymanual,stocktonpress,ny(1990);和在dracopolinc等人(编辑),currentprotocolsinhumangenetics第12和13章,johnwiley&sons,ny(1994);colbère-garapinf等人(1981)jmolbiol150:1-144中有描述,其通过引用整体并入本文。
抗体分子的表达水平可以通过载体扩增提高(综述参见bebbingtoncr&hentschelccg,theuseofvectorsbasedongeneamplificationfortheexpressionofclonedgenesinmammaliancellsindnacloning,第3卷(academicpress,newyork,1987),其通过引用整体并入本文)。当表达抗体的载体系统中的标记可扩增时,宿主细胞培养物中存在的抑制剂水平的提高将增加标记基因的拷贝数。由于扩增区域与抗体基因相关,抗体的产生也会增加(crousegf等人(1983)molcellbiol3:257-66,其通过引用整体并入本文)。
宿主细胞可以用本文所述的两种或更多种表达载体共转染,第一载体编码重链来源的多肽而第二载体编码轻链来源的多肽。两个载体可以含有相同的选择标记,其使得重链和轻链多肽能够等同表达。宿主细胞可以用不同量的两种或更多种表达载体共转染。例如,宿主细胞可以用以下比率中任一种的第一表达载体和第二表达载体转染:1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:12、1:15、1:20、1:25、1:30、1:35、1:40、1:45或1:50。
或者,可以使用编码且能够表达重链和轻链多肽两者的单一载体。在此类情形下,轻链应当置于重链之前以避免过量的毒性游离重链(proudfootnj(1986)nature322:562-565;和
一旦本文所述的抗体分子已经通过重组表达产生,就可以通过本领域已知用于免疫球蛋白分子纯化的任何方法进行纯化,例如,通过色谱法(例如,离子交换色谱法、亲和色谱法,对于蛋白a后的特定抗原特别是通过亲和力色谱和施胶(sizingcolumn)色谱法)、离心、差异溶解性或通过任何其它用于蛋白质纯化的标准技术。此外,本文所述的抗体可以与本文所述的或本领域中另外已知的异源多肽序列融合以促进纯化。
在具体实施方案中,本文所述的抗体是分离或纯化的。通常,分离的抗体是基本上不含具有与分离的抗体不同的抗原特异性的其它抗体的抗体。例如,在一个特定实施方案中,本文所述的抗体的制剂基本上不含细胞物质和/或化学前体。语言“基本上不含细胞物质”包括其中抗体与它从其中分离或重组产生的细胞的细胞组分分离的抗体制剂。因此,基本上不含细胞物质的抗体包括具有少于约30%、20%、10%、5%、2%、1%、0.5%或0.1%(以干重计)的异源蛋白(本文也称为“污染蛋白质”)的抗体和/或抗体的变体,例如,抗体的不同翻译后修饰形式或抗体的其它不同形式(例如,抗体片段)的制剂。当抗体重组产生时,通常也基本上不含培养基,即,培养基占蛋白质制剂体积的少于约20%、10%、2%、1%、0.5%或0.1%。当抗体通过化学合成产生时,通常基本上不含化学前体或其它化学品,即,它与参与蛋白质合成的化学前体或其它化学品分开。因此,此类抗体制剂具有少于约30%、20%、10%或5%(以干重计)的化学前体或除目标抗体以外的化合物。在一个具体实施方案中,本文所述的抗体是分离或纯化的。
特异性结合tim-3(例如,人tim-3)的抗体或其片段可以通过本领域中已知用于抗体合成的任何方法产生,例如,通过化学合成或通过重组表达技术产生。除非另有说明,否则本文所述的方法采用分子生物学、微生物学、遗传分析、重组dna、有机化学、生物化学、pcr、寡核苷酸合成和修饰、核酸杂交及现有技术的相关领域中的常规技术。例如,本文中引用的参考文献中描述了这些技术且在文献中进行了完全说明。参见,例如,maniatist等人(1982)molecularcloning:alaboratorymanual,coldspringharborlaboratorypress;sambrookj等人(1989),molecularcloning:alaboratorymanual,第2版,coldspringharborlaboratorypress;sambrookj等人(2001)molecularcloning:alaboratorymanual,coldspringharborlaboratorypress,coldspringharbor,ny;ausubelfm等人,currentprotocolsinmolecularbiology,johnwiley&sons(1987和年度更新);currentprotocolsinimmunology,johnwiley&sons(1987和年度更新)gait(编辑)(1984)oligonucleotidesynthesis:apracticalapproach,irlpress;eckstein(编辑)(1991)oligonucleotidesandanalogues:apracticalapproach,irlpress;birrenb等人(编辑)(1999)genomeanalysis:alaboratorymanual,coldspringharborlaboratorypress,其全部通过引用整体并入本文。
在一个具体实施方案中,本文所述的抗体是通过涉及dna序列的生成(例如,经由合成)、遗传工程的任何方式制备、表达、生成或分离的抗体(例如,重组抗体)。在某些实施方案中,此类抗体包含不天然存在于动物或哺乳动物(例如,人)体内的抗体种系库内的序列(例如,dna序列或氨基酸序列)。
一方面,本文提供了制备特异性结合tim-3(例如,人tim-3)的抗体的方法,其包括培养本文所述的细胞或宿主细胞。在一个实施方案中,该方法在体外进行。在某些方面中,本文提供了产生特异性结合tim-3(例如,人tim-3)的抗体的方法,其包括使用本文所述的细胞或宿主细胞(例如,包含编码本文所述的抗体的多核苷酸的细胞或宿主细胞)表达(例如,重组表达)抗体。在一个特定实施方案中,细胞是分离的细胞。在一个特定实施方案中,外源多核苷酸已经引入细胞中。在一个特定实施方案中,该方法还包括纯化从细胞或宿主细胞获得的抗体的步骤。
用于产生多克隆抗体的方法中是本领域中已知的(参见,例如,shortprotocolsinmolecularbiology,(2002)第5版中的第11章,ausubelfm等人编辑,johnwileyandsons,newyork,其通过引用整体并入本文)。
单克隆抗体可以使用本领域中已知的多种多样的技术制备,包括使用杂交瘤、重组技术和噬菌体展示技术,或其组合。例如,单克隆抗体可以使用杂交瘤技术产生,包括本领域中已知的和例如,在harlowe&laned,antibodies:alaboratorymanual,(coldspringharborlaboratorypress,1988年第2版);hammerlinggj等人,在:monoclonalantibodiesandt-cellhybridomas563681(elsevier,n.y.,1981)(其各自通过引用整体并入本文)中教导的那些。如本文中所用的术语“单克隆抗体”不限于通过杂交瘤技术产生的抗体。例如,单克隆抗体可以从外源表达本文所述的抗体或其片段,例如,此类抗体的轻链和/或重链的宿主细胞重组产生。
在具体实施方案中,如本文中所用的“单克隆抗体”是通过单一细胞(例如,产生重组抗体的杂交瘤或宿主细胞)产生的抗体,其中如例如通过elisa或本领域中已知的或本文提供的实施例中的其它抗原结合或竞争结合测定法测定的那样,所述抗体特异性结合tim-3(例如,人tim-3)。在特定实施方案中,单克隆抗体可以是嵌合抗体或人源化抗体。在某些实施方案中,单克隆抗体是单价抗体或多价(例如,二价)抗体。在特定实施方案中,单克隆抗体是单特异性或多特异性抗体(例如,双特异性抗体)。例如,本文所述的单克隆抗体可以,例如通过如kohlerg&milsteinc(1975)nature256:495(其通过引用整体并入本文)中所述的杂交瘤方法产生,或者可以例如,使用本文所述的技术从噬菌体文库分离。用于制备克隆细胞系和由此表达的单克隆抗体的其它方法是本领域中公知的(参见,例如,shortprotocolsinmolecularbiology,(2002)第5版中的第11章,ausubelfm等人,同上)。
使用杂交瘤技术产生和筛选特异性抗体的方法是常规的并且是本领域中公知的。例如,在杂交瘤方法中,小鼠或其它适当的宿主动物如绵羊、山羊、兔、大鼠、仓鼠或猕猴经免疫以引发产生或能够产生将会特异性结合用于免疫的蛋白质(例如,tim-3(例如,人tim-3))的抗体的淋巴细胞。或者,淋巴细胞可以在体外进行免疫。然后使用合适的融合剂诸如聚乙二醇使淋巴细胞与骨髓瘤细胞融合以形成杂交瘤细胞(godingjw(编辑),monoclonalantibodies:principlesandpractice,第59-103页(academicpress,1986),其通过引用整体并入本文)。另外,rimms(多位点重复免疫)技术可以用于使动物免疫(kilpatrickke等人(1997)hybridoma16:381-9,其通过引用整体并入本文)。
在一些实施方案中,小鼠(或其它动物,诸如大鼠、猴、驴、猪、绵羊、仓鼠或狗)可以用抗原(例如,tim-3(例如,人tim-3))免疫且一旦检测到免疫应答,例如,在小鼠血清中检测到对该抗原具特异性的抗体,就收获小鼠脾脏并分离脾细胞。然后通过公知技术使脾细胞与任何合适的骨髓瘤细胞,例如来自于可从美国模式培养物保藏所
这样制备的杂交瘤细胞在优选含有一种或多种抑制未融合的亲本骨髓瘤细胞生长或存活的物质的合适培养基中接种和生长。例如,如果亲本骨髓瘤细胞缺乏次黄嘌呤鸟嘌呤磷酸核糖基转移酶(hgprt或hprt),则杂交瘤的培养基通常将包括次黄嘌呤、氨基喋呤和胸苷(hat培养基),这些物质防止hgprt缺陷细胞的生长。
具体实施方案采用高效地融合,支持所选抗体产生细胞的稳定高水平抗体产生和对培养基诸如hat培养基敏感的骨髓瘤细胞。在这些骨髓瘤细胞系中有鼠骨髓瘤系,诸如ns0细胞系或可从salkinstitutecelldistributioncenter,sandiego,ca,usa获得的源自mopc-21和mpc-11小鼠肿瘤的那些,及可从美国模式培养物保藏所(rockville,md,usa)获得的sp-2或x63-ag8.653细胞。人骨髓瘤和小鼠-人杂交骨髓瘤细胞系也已经描述用于产生人单克隆抗体(kozbord(1984)jimmunol133:3001-5;brodeur等人,monoclonalantibodyproductiontechniquesandapplications,第51-63页(marceldekker,inc.,newyork,1987),其各自通过引用整体并入本文)。
测定杂交瘤细胞生长的培养基中针对tim-3(例如,人tim-3)的单克隆抗体的产生。杂交瘤细胞产生的单克隆抗体的结合特异性通过本领域中已知的方法(例如,免疫沉淀)或通过体外结合测定诸如放射免疫测定法(ria)或酶联免疫吸附测定法(elisa)测定。
在鉴定产生具有所需特异性、亲和力和/或活性的抗体的杂交瘤细胞后,克隆物可以通过有限稀释过程亚克隆并通过标准方法培养(godingjw(编辑),monoclonalantibodies:principlesandpractice,同上)。用于这一目的的合适的培养基包括,例如d-mem或rpmi1640培养基。另外,杂交瘤细胞可以在动物中作为腹水瘤在体内生长。
亚克隆物分泌的单克隆抗体通过常规免疫球蛋白纯化过程,例如蛋白a琼脂糖、羟磷灰石色谱法、凝胶电泳、透析或亲和色谱法从培养基、腹水或血清中适当地分离。
本文所述的抗体包括识别特异性tim-3(例如,人tim-3)的抗体片段并且可以通过本领域技术人员已知的任何技术产生。例如,本文所述的fab和f(ab’)2片段可以使用酶诸如木瓜蛋白酶(用于产生fab片段)或胰蛋白酶(用于产生f(ab’)2片段),通过免疫球蛋白分子的蛋白水解裂解而产生。fab片段对应于抗体分子两个相同臂之一且含有与重链的vh和ch1结构域配对的完整轻链。f(ab’)2片段含有抗体分子通过铰链区中的二硫键连接的两个抗原结合臂。
此外,本文所述的抗体还可以使用本领域中已知的各种噬菌体展示方法产生。在噬菌体展示方法中,功能性抗体结构域展示在携带编码它们的多核苷酸序列的噬菌体颗粒的表面上。具体而言,编码vh和vl结构域的dna序列由动物cdna文库(例如,受影响的组织的人或鼠cdna文库)扩增。编码vh和vl结构域的dna通过pcr与scfv接头重组在一起并克隆到噬菌粒载体中。载体电穿孔到大肠杆菌中且大肠杆菌用辅助噬菌体感染。用于这些方法中的噬菌体通常是丝状噬菌体,包括fd和m13,且vh和vl结构域通常与噬菌体基因iii或基因viii重组融合。可以用抗原,例如,使用标记的抗原或者结合或捕获到固体表面或珠粒的抗原,选择或鉴定表达与特定抗原结合的抗原结合结构域的噬菌体。可以用于制备本文所述的抗体的噬菌体展示方法的实例包括brinkmanu等人(1995)jimmunolmethods182:41-50;amesrs等人(1995)jimmunolmethods184:177-186;kettleboroughca等人(1994)eurjimmunol24:952-958;persicl等人(1997)gene187:9-18;burtondr&barbascf(1994)advanimmunol57:191-280;pct申请号pct/gb91/001134;国际公布第wo90/02809、wo91/10737、wo92/01047、wo92/18619、wo93/11236、wo95/15982、wo95/20401和wo97/13844号;和美国专利第5,698,426、5,223,409、5,403,484、5,580,717、5,427,908、5,750,753、5,821,047、5,571,698、5,427,908、5,516,637、5,780,225、5,658,727、5,733,743和5,969,108号中公开的那些,其全部通过引用整体并入本文。
如以上文献中所述,在噬菌体选择后,来自噬菌体的抗体编码区可以分离并用于产生全抗体,包括人抗体,或任何其它所需的抗原结合片段,并且在任何所需宿主中表达,包括哺乳动物细胞、昆虫细胞、植物细胞、酵母和细菌,例如,如以下所述的。重组产生抗体片段如fab、fab’和f(ab’)2片段的技术也可以使用本领域中已知的方法来利用,诸如pct公布第wo92/22324号;mullinaxrl等人(1992)biotechniques12(6):864-9;sawaih等人(1995)amjreprodimmunol34:26-34;和betterm等人(1988)science240:1041-1043中公开的那些方法,其全部通过引用整体并入本文。
在某些实施方案中,为生成全抗体,包括vh或vl核苷酸序列、限制性位点和保护限制性位点的侧翼序列的pcr引物可以用于由模板(例如,scfv克隆物)扩增vh或vl序列。利用本领域技术人员已知的克隆技术,可以将pcr扩增的vh结构域克隆到表达vh恒定区的载体中,并且可以将pcr扩增的vl结构域克隆到表达vl恒定区(例如,人κ或λ恒定区)的载体中。vh和vl结构域也可以克隆到表达必要恒定区的一个载体中。然后使用本领域技术人员已知的技术将重链转化载体和轻链转化载体共转染到细胞系中以产生表达全长抗体(例如,igg)的稳定或瞬时细胞系。
嵌合抗体是其中抗体的不同部分源自不同免疫球蛋白分子的分子。例如,嵌合抗体可以含有与人抗体的恒定区融合的小鼠或大鼠单克隆抗体可变区。用于产生嵌合抗体的方法是本领域中已知的。参见,例如,morrisonsl(1985)science229:1202-7;oivt&morrisonsl(1986)biotechniques4:214-221;gilliessd等人(1989)jimmunolmethods125:191-202;和美国专利第5,807,715、4,816,567、4,816,397和6,331,415号,其全部通过引用整体并入本文。
人源化抗体能够结合预定抗原且其包含具有基本上人免疫球蛋白的氨基酸序列的框架区和具有基本上非-人免疫球蛋白(例如,鼠免疫球蛋白)的氨基酸序列的cdr。在特定实施方案中,人源化抗体还包含免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白的至少一部分。抗体还可以包括重链的ch1、铰链、ch2、ch3和ch4区。人源化抗体可以选自任何类别的免疫球蛋白,包括igm、igg、igd、iga和ige,和任何同种型,包括igg1、igg2、igg3和igg4。人源化抗体可以使用本领域中已知的多种技术产生,包括但不限于,cdr移植(欧洲专利第ep239400号;国际公布第wo91/09967号;和美国专利第5,225,539、5,530,101和5,585,089号)、镶嵌(veneering)或表面重塑(resurfacing)(欧洲专利第ep592106和ep519596号;padlanea(1991)molimmunol28(4/5):489-498;studnickagm等人(1994)protengineering7(6):805-814;和roguskama等人(1994)pnas91:969-973)、链改组(美国专利第5,565,332号),以及例如美国专利第6,407,213号、美国专利第5,766,886号、国际公布第wo93/17105号;tanp等人(2002)jimmunol169:1119-25;caldasc等人(2000)proteineng.13(5):353-60;moreav等人(2000)methods20(3):267-79;bacam等人(1997)jbiolchem272(16):10678-84;roguskama等人(1996)proteineng9(10):895904;coutojr等人(1995)cancerres.55(23增刊):5973s-5977s;coutojr等人(1995)cancerres55(8):1717-22;sandhujs(1994)gene150(2):409-10和pedersenjt等人(1994)jmolbiol235(3):959-73(其全部通过引用整体并入本文)中公开的技术。还请参见美国申请公布第us2005/0042664a1号(2005年2月24日),其通过引用整体并入本文。
用于制备多特异性(例如,双特异性)抗体的方法已有描述,参见,例如,美国专利第7,951,917、7,183,076、8,227,577、5,837,242、5,989,830、5,869,620、6,132,992和8,586,713号,其全部通过引用整体并入本文。
单域抗体,例如,缺乏轻链的抗体,可以通过本领域中公知的方法产生。参见riechmannl&muyldermanss(1999)jimmunol231:25-38;nuttallsd等人(2000)currpharmbiotechnol1(3):253-263;muyldermanss,(2001)jbiotechnol74(4):277-302;美国专利第6,005,079号;和国际公布第wo94/04678、wo94/25591和wo01/44301号,其全部通过引用整体并入本文。
此外,特异性结合tim-3(例如,人tim-3)抗原的抗体转而可以用于使用本领域技术人员公知的技术生成“模拟”抗原的抗独特型抗体。参见,例如,greenspanns&bonaca(1989)fasebj7(5):437-444;和nissinoffa(1991)jimmunol147(8):2429-2438,其各自通过引用整体并入本文。
在特定实施方案中,与本文所述的抗tim-3(例如,人tim-3)抗体结合相同的tim-3(例如,人tim-3)的表位的本文所述的抗体为人抗体。在特定实施方案中,竞争性阻断(例如,以剂量依赖性方式)本文所述任何一种抗体与tim-3(例如,人tim-3)结合的本文所述的抗体为人抗体。人抗体可以使用本领域中已知的任何方法产生。例如,可以使用不能够表达功能性内源免疫球蛋白但可以表达人免疫球蛋白基因的转基因小鼠。具体而言,人重链和轻链免疫球蛋白基因复合体可以随机地或通过同源重组引入到小鼠胚胎干细胞中。或者,除人重链和轻链基因外,人可变区、恒定区和多变区可以引入小鼠胚胎干细胞中。与通过同源重组引入人免疫球蛋白基因座独立地或同时地,可以致使小鼠重链和轻链免疫球蛋白基因为非功能性。具体而言,jh区的纯合缺失防止内源抗体产生。经修饰的胚胎干细胞经扩增并显微注射到囊胚中以产生嵌合小鼠。然后嵌合小鼠可以繁殖产生表达人抗体的纯合后代。转基因小鼠用所选抗原,例如,整个或一部分抗原(例如,tim-3(例如,人tim-3))以正常形式进行免疫。可以使用常规杂交瘤技术从免疫的转基因小鼠获得针对抗原的单克隆抗体。转基因小鼠携带的人免疫球蛋白转基因在b细胞分化过程中重排,随后发生类别转换和体细胞突变。因此,使用此类技术,有可能产生治疗上有用的igg、iga、igm和ige抗体。对于这种用于产生人抗体的技术的综述,参见lonbergn&huszard(1995)intrevimmunol13:65-93,其通过引用整体并入本文。对于这种用于产生人抗体和人单克隆抗体的技术和用于产生此类抗体的方案的详细讨论,参见,例如国际公布wo98/24893、wo96/34096和wo96/33735号;和美国专利第5,413,923、5,625,126、5,633,425、5,569,825、5,661,016、5,545,806、5,814,318和5,939,598号,其全部通过引用整体并入本文。能够产生人抗体的小鼠的实例包括xenomousetm(abgenix,inc.;美国专利第6,075,181和6,150,184号)、huab-mousetm(mederex,inc./genpharm;美国专利第5,545,806和5,569,825号)、transchromomousetm(kirin)和kmmousetm(medarex/kirin),其全部通过引用整体并入本文。
特异性结合tim-3(例如,人tim-3)的人抗体可以通过本领域中已知的多种方法,包括使用源自人免疫球蛋白序列的抗体文库的上述噬菌体展示方法制备。还请参见美国专利第4,444,887、4,716,111和5,885,793号;及国际公布第wo98/46645、wo98/50433、wo98/24893、wo98/16654、wo96/34096、wo96/33735和wo91/10741号,其全部通过引用整体并入本文。
在一些实施方案中,人抗体可以使用小鼠-人杂交瘤产生。例如,用埃-巴二氏病毒(ebv)转化的人外周血淋巴细胞可以与小鼠骨髓瘤细胞融合以产生分泌人单克隆抗体的小鼠-人杂交瘤,并且可以筛选这些小鼠-人杂交瘤以确定分泌特异性结合靶抗原(例如,tim-3(例如,人tim-3))的人单克隆抗体的小鼠-人杂交瘤。此类方法是本领域已知的并且进行了描述,参见,例如,shinmotoh等人(2004)cytotechnology46:19-23;naganaway等人(2005)humanantibodies14:27-31,其各自通过引用整体并入本文。
6.6药盒
还提供了包含一种或多种本文所述的抗体或其药物组合物或缀合物的药盒。在一个具体实施方案中,本文提供了包含填充有本文所述的药物组合物的一种或多种成分,诸如本文提供的一种或多种抗体的一个或多个容器的药物包装或药盒。在一些实施方案中,药盒含有本文所述的药物组合物和任何预防或治疗剂,诸如本文所述的那些。在某些实施方案中,药盒可以含有t细胞丝裂原,例如植物血凝素(pha)和/或乙酸肉豆蔻酸佛波醇酯(pma),或tcr复合物刺激性抗体,诸如抗cd3抗体和抗cd28抗体。任选地与此类容器相联的可以是监管药物或生物学产品的生产、使用和销售的政府机构规定形式的通告,该通告反映该机构批准生产、使用和销售供人类施用。
还提供了可以用于上述方法的药盒。在一个实施方案中,药盒在一个或多个容器中包含本文所述的抗体,优选纯化抗体。在一个具体实施方案中,本文所述的药盒含有作为对照的基本上分离的tim-3(例如,人tim-3)抗原。在另一具体实施方案中,本文所述的药盒还包含不与tim-3(例如,人tim-3)抗原应答的对照抗体。在另一具体实施方案中,本文所述的药盒含有用于检测抗体与tim-3(例如,人tim-3)抗原的结合的一种或多种元素(例如,抗体可以与可检测的基质诸如荧光化合物、酶底物、放射性化合物或发光化合物缀合,或者识别第一抗体的第二抗体可以与可检测的基质缀合)。在具体实施方案中,本文提供的药盒可以包括重组产生的或化学合成的tim-3(例如,人tim-3)抗原。药盒中提供的tim-3(例如,人tim-3)抗原也可以附接于固体支撑物。在更具体的实施方案中,上述药盒的检测手段包括tim-3(例如,人tim-3)抗原附接于其上的固体支撑物。此类药盒还可包括非附接的报告因子标记的抗人抗体或抗小鼠/大鼠抗体。在这个实施方案中,抗体与tim-3(例如,人tim-3)抗原的结合可以通过所述报告因子标记的抗体的结合来检测。在一个实施方案中,本发明涉及本发明的试剂盒用于体外测定和/或检测生物样品中的tim-3抗原(例如,人tim-3)的用途。
7.实施例
本章节(即,第7节)中的实施例通过举例说明的方式,而不是通过限制的方式来提供。
7.1实施例1:针对人tim-3的新型抗体的生成和表征
本实施例描述了结合人t细胞免疫球蛋白和粘蛋白结构域-3(tim-3)的抗体的生成和表征。具体而言,本实施例描述了与人tim-3特异性结合并抑制人tim-3功能的人抗体的生成。
在下面描述的一些研究中,将本发明的抗tim-3抗体的活性与参考抗tim-3抗体pab1944w或hum11的活性做比较。基于美国专利第8,552,156号(其通过引用整体并入本文)中提供的抗体8213hv0lv0的可变区生成抗体pab1944w。表7中示出了pab1944w的序列。抗体pab1944w表达为包含根据eu编号系统编号的fc区中n297a突变的igg1抗体。基于美国专利公布第us2015/0218274号(其通过引用整体并入本文)中提供的抗体abtim3-hum11的可变区生成抗体hum11。表7中示出了hum11的序列。抗体hum11表达为包含根据eu编号系统编号的fc区中s228p突变的igg4抗体。
表7.参考抗tim-3抗体的序列。
7.1.1使用retrocytedisplaytm技术生成抗tim-3抗体
本文描述了retrocytedisplaytm文库的生成。为了生成文库插入物,通过苯酚/氯仿从经过facs分选的cd19阳性人b淋巴细胞中提取总rna。总rna用于使用来自fermentas的revertaid第一链cdna合成试剂盒(目录编号(cat#)k1621和k1622)进行第一链cdna合成。通过pcr由cdna扩增抗体可变区并克隆到逆转录病毒表达载体(pcma)中。随后使用retrocytedisplaytm技术将这些构建体用于转导鼠前b(preb)细胞以在表面表达所述抗体。
针对重组人tim-3和重组食蟹猴tim-3,对如上所述生成的retrocytedisplaytm文库进行筛选,导致鉴定出两种抗体,命名为pab2085和pab2088。表4中汇总了pab2085和pab2088可变区的序列信息。抗体pab2085和pab2088表达为igg1抗体并且在下述测定中进行分析。
7.1.2抗tim-3抗体与tim-3表达细胞的结合
使用流式细胞术测试抗体pab2085和pab2088与tim-3表达细胞的结合。简言之,野生型鼠1624-5细胞或经工程化以表达人tim-3的1624-5细胞与小鼠fc受体阻断剂(bdpharmingen,cat#553142)一起孵育以减少非特异性结合。洗涤后,细胞经抗tim-3抗体或同种型对照抗体染色并使用facscalibur(bdbiosciences)进行分析。pab2085和pab2088两者均表现出与表达人tim-3的1624-5细胞结合,但不与野生型1624-5细胞结合(图1)。
7.1.3抗tim-3抗体的稳定性测定
使用悬浮阵列技术评估相对于家族成员tim-1和tim-4,pab2085和pab2088对tim-3的选择性。
pab2085(图2a)和pab2088(图2b)两者均显示出与人和食蟹猴tim-3特异性结合,而在测试浓度下未观察到与tim-1或tim-4的显著结合。
7.1.4使用retrocytedisplaytm技术对抗tim-3抗体的优化
抗体pab2085和pab2088共有相同的重链。为获得另外的抗tim-3抗体,基于pab2085和pab2088的重链生成重链retrocytedisplaytm子文库并与更多样化的轻链文库组合。进一步针对重组人tim-3和重组食蟹猴tim-3,对这一新的retrocytedisplaytm文库进行筛选,导致鉴定出轻链优化变体:pab2173、pab2174、pab2175、pab2176、pab2177、pab2178、pab2179、pab2180、pab2181、pab2182、pab2183、pab2184、pab2185、pab2186、pab2187、pab2188、pab2189、pab2190、pab2191和pab2192。表4中列出的这些轻链优化变体可变区的序列信息。轻链优化变体表达为含有野生型igg1fc区或igg1变体fc区的抗体。这种igg1变体fc区不会影响fc区的效应功能。
轻链优化抗体pab2188是在轻链恒定结构域中含有根据kabat编号的t109s取代(即,相对于野生型序列在位置109处苏氨酸经丝氨酸取代)的抗体,所述取代有利于可变区同框克隆到恒定区内。这种突变是不影响抗体结合或功能的保守性修饰。还生成了野生型对应物,命名为pab2188w,其根据kabat编号,在轻链的位置109处含苏氨酸。抗体pab2188w表达为含有igg1n297afc区的抗体。
7.1.5抗tim-3抗体与tim-3表达细胞的结合
在与上述类似的流式细胞术测定中评估轻链优化变体与表达人或食蟹猴tim-3的细胞的结合。所有变体均表现出与经工程化以表达人tim-3(图3a和3b)或食蟹猴tim-3(图3c和3d)的鼠1624-5细胞结合,但不结合野生型鼠1624-5细胞(数据未示出)。
将轻链优化变体与原代人t细胞的结合与亲本抗体pab2085的结合做比较。简言之,使用基于磁性的分离(miltenyibiotec),使得通过ficoll梯度从健康供体血沉棕黄层(researchbloodcomponents,llc)分离的外周血单核细胞(pbmc)富集未触及的全t细胞。然后在37℃和5%co2下,在补充有10%热灭活fbs的rpmi培养基中用板结合的抗cd3抗体(sp34,3μg/ml)和可溶性抗cd28抗体(cd28.1,2μg/ml)活化富集的t淋巴细胞群体3天。活化后,在室温下用人fc受体阻断剂孵育细胞15分钟以减少非特异性结合(fcrblock,biolegend)。向单独样品中添加抗tim-3或igg同种型对照抗体(12点剂量滴定,10,000ng/ml至0.06ng/ml)并在4℃下孵育30分钟。洗涤样品两次并向将含有fitc缀合的抗κ抗体以及抗cd3(bv711、okt3)、抗cd4(bv605、okt4)和抗cd8a(pe、rpa-t8,均为2.5μg/ml的抗体混合物稀释于缓冲液(pbs、2mmedta、0.5%bsa,ph7.2)中,添加到每份样品中并在4℃下孵育30分钟。洗涤样品两次并使用lsrfortessa流式细胞仪(bdbiosciences)分析。使用facsdiva和wehiweasel软件组合分析流式细胞图。
如图4所示,该研究中测试的所有轻链优化变体均显示出与活化人cd8+t细胞的结合比亲本抗体pab2085强。
接下来,检测抗tim-3抗体pab2188与原代食蟹猴细胞的结合。冷冻保存的分离自食蟹猴(worldwideprimates,inc.)的pbmc经解冻、洗涤,然后进行流式细胞术分析。在孵育抗体之前,在室温下用10%食蟹猴血清(abcam)处理细胞15分钟以减少非特异性结合。向独立样品中添加抗tim-3或igg同种型对照抗体(10点剂量滴定,20,000ng/ml至0.6ng/ml)并在4℃下孵育30分钟。洗涤样品两次并将2.5μg/ml稀释于缓冲液(pbs、2mmedta、0.5%bsa,ph7.2)中的含有fitc缀合的抗κ抗体以及抗cd11b(bv785、m1/70)的抗体混合物添加到每份样品中并在4℃下孵育30分钟。洗涤样品两次并使用lsrfortessa流式细胞仪(bdbiosciences)分析。使用facsdiva和wehiweasel软件组合分析流式细胞图。
如图5所示,抗tim-3抗体pab2188以剂量依赖性方式结合原代食蟹猴骨髓细胞。
7.1.6抗tim-3抗体的配体阻断活性
测试抗tim-3抗体阻断重组人或食蟹猴tim-3与由受辐照的wr19l鼠淋巴瘤细胞表达的磷脂酰丝氨酸结合的能力。抗tim-3或igg同种型对照抗体(对于人而言,9点剂量滴定,20,000ng/ml至70ng/ml;对于食蟹猴而言,6点剂量滴定,20,000ng/ml至625ng/ml)与在1xannexin-v结合缓冲液(调节至ph7.4的10mmhepes,140mmnacl和2.5mmcacl2)中制备的重组人tim-3fc(r&dsystems,#2365-tm)或重组食蟹猴tim-3fc(r&dsystems,#7914-tm)(10,000ng/ml)在室温下一起孵育30分钟。经20gy辐照并重新悬浮在1xannexin-v结合缓冲液中的wr19l细胞添加到抗tim-3:tim-3-fc混合物中,最终密度为1x106个细胞/ml并在室温下孵育45分钟。样品洗涤一次并将含有pe缀合的抗fc抗体(1:100稀释)以及活力染剂(biolegend,nir通道;1:1000稀释),稀释于1xannexin-v结合缓冲液中的抗体混合物添加到每份样品中并在室温下孵育20分钟。然后将样品于1xannexin-v结合缓冲液中洗涤一次,重新悬浮在150μl缓冲液(pbs、2mmedta、0.5%bsa,ph7.2)中并使用lsrfortessa流式细胞仪(bdbiosciences)分析。使用facsdiva分析流式细胞图。
抗tim-3抗体pab2085和pab2188阻断重组人tim-3(图6a)和重组食蟹猴tim-3(图6b)与磷脂酰丝氨酸结合。
7.1.7在葡萄球菌肠毒素a(sea)刺激后抗tim-3抗体对人pbmc的影响
评估葡萄球菌肠毒素a(sea)刺激后,轻链优化变体对原代人pbmc的功能活性。简言之,按1x105个细胞/孔将冷冻保存的人pbmc(researchbloodcomponents)铺板在96孔nunclondelta表面板(nunctm)中补充有normocintm(invivogen#ant-nr)和10%热灭活fbs(gibco,invitrogencorporation)的rpmi1640中。在5μg/ml抗pd-1抗体派姆单抗(批次7002688300,myoderm)、抗tim-3抗体(10μg/ml)和sea超抗原(100ng/ml,toxintechnologies)的存在下,在37℃和5%co2下培养细胞6天。收集无细胞上清液并储存在-80℃直至分析。使用alphalisa(perkinelmer)测定ifnγ水平。
与抗pd-1抗体派姆单抗组合时,在这项原代人pbmc测定中轻链优化的变体增强ifnγ产生(图7)。
在sea刺激测定中使用修改方案分析pab2188w的功能活性。按1x105个细胞/孔将冷冻保存的人pbmc(researchbloodcomponents)铺板在96孔nunclondelta表面板(nunctm)中补充有normocintm(invivogen#ant-nr)和10%热灭活fbs(gibco,invitrogencorporation)的rpmi1640中。在5μg/ml抗pd-1抗体派姆单抗(批次7002688300,myoderm)、抗tim-3抗体(10μg/ml)和sea超抗原(100ng/ml,toxintechnologies)的存在下,在37℃和5%co2下培养细胞9天。然后将细胞洗涤一次并用新鲜sea和抗体再刺激2天。收集无细胞上清液并储存在-80℃直至分析。使用alphalisa(perkinelmer)测定ifnγ水平。
如图8a-8f所示,在这项sea刺激测定中抗tim-3抗体pab2188w(igg1n297a),单独地或与抗pd-1抗体派姆单抗组合,增强了来自多个供体的人pbmc中的ifnγ产生。
7.2实施例2:使用cdr诱变对抗tim-3抗体的优化
为提高结合亲和力,使用对重链和轻链可变区cdr残基的定向诱变来修饰抗tim-3抗体pab2188w。简言之,基于亲本抗体pab2188w生成六个fab噬菌体展示库,其各自含有使用nnk简并密码子随机化修饰的cdrh或cdrl区。fab噬菌体文库进行针对重组人和食蟹猴tim-3抗原的亲和力驱动选择。基于结合和解离速率测量对命名为am-1、am-2、am-3、am-4、am-5、am-6、am-7、am-8和am-9的9种克隆物进行选择。表4中汇总了这9种克隆物的可变区的序列信息。这些变体全部共有pab2188w的轻链,但在重链cdr1中含有突变。am-1至am-9表达为含有igg1n297afc区的全长抗体并在下述实验中对其进行分析。
7.2.1抗tim-3抗体与tim-3表达细胞的结合
在流式细胞术分析中将抗体am-1至am-9与异位表达人tim-3的jurkat细胞的结合与亲本抗体pab2188w的结合做比较。如图9a所示,与表达tim-3的jurkat细胞的所有变体及am-2和am-6显示出比亲本抗体pab2188w强的结合。使用kasumi-3(
接下来,在类似测定中,使用藻红蛋白(pe)缀合的pab2188w、am-2或同种型对照抗体,通过流式细胞术分析与原代人和食蟹猴cd14+骨髓细胞的结合。简言之,将冷冻保存的分离自人或食蟹猴(worldwideprimates,inc.)的pbmc解冻、洗涤,然后进行流式细胞术分析。在孵育抗体之前,在室温下用10%食蟹猴血清(abcam,cat#ab155109)处理细胞15分钟以减少非特异性结合。将pe缀合的抗tim-3或igg同种型对照抗体(12点剂量滴定,对于人pbmc而言为10,000ng/ml至0.05ng/ml并且对于食蟹猴pbmc而言为100,000ng/ml至0.5ng/ml)添加到单独样品中含抗cd14抗体(apc、m5e2)和zombiegreentm可固定活力标记的抗体混合物中,然后在4℃下孵育30分钟。留出另外的样品用于单染色补偿对照(cd45-fitc、cd45-pe和cd45-apc;克隆mb4-6d6,miltenyi)。将样品于缓冲液中洗涤两次并使用lsrfortessa流式细胞仪(bdbiosciences)分析。使用facsdiva和wehiweasel软件组合分析流式细胞图。am-2显示出与人(图9e)和食蟹猴(图9f)cd14+骨髓细胞的结合比亲本抗体pab2188w强。
7.2.2抗tim-3抗体的选择性测定
使用悬浮阵列技术评估am-2和am-6对tim-3的选择性。
抗tim-3抗体pab2188w(图10b)、am-2(图10c)和am-6(图10d)显示出与人和食蟹猴tim-3特异性结合,并且在试验浓度下未检测到与小鼠tim-3、人tim-1、人tim-4、人ox40、人gitr、人dr3或人cd137的显著结合。
7.2.3抗tim-3抗体的配体阻断活性
进一步分析抗tim-3抗体am-2和am-6阻断磷脂酰丝氨酸与人或食蟹猴tim-3结合的能力。简言之,抗tim-3或igg同种型对照抗体(10点剂量滴定,40,000ng/ml至1000ng/ml)与在1xannexin-v结合缓冲液(调节至ph7.4的10mmhepes,140mmnacl和2.5mmcacl2)中制备的重组人tim-3fc(r&dsystems,#2365-tm)或重组食蟹猴tim-3fc(r&dsystems,#7914-tm)(10,000ng/ml)在室温下孵育30分钟。将经20gy辐照并重新悬浮在1xannexin-v结合缓冲液中的wr19l细胞添加到抗tim-3:tim-3-fc混合物中,最终密度为1x106个细胞/ml并在室温下孵育45分钟。样品洗涤一次并将含有pe缀合的抗fc抗体(1:100稀释)以及活力染剂(biolegend,nir通道;1:1000稀释)稀释于1xannexin-v结合缓冲液中的抗体混合物添加到每份样品中并在室温下孵育20分钟。然后将样品于1xannexin-v结合缓冲液中洗涤一次并使用lsrfortessa流式细胞仪(bdbiosciences)分析。使用facsdiva分析流式细胞图。
如图11a和11b中所示,抗tim-3抗体pab2188w、am-2和am-6有效地阻断人或食蟹猴tim-3与磷脂酰丝氨酸表达细胞的结合。
7.2.4在葡萄球菌肠毒素a(sea)刺激后抗tim-3抗体对人pbmc的影响
使用经葡萄球菌肠毒素a(sea)刺激的原代人pbmc分析pab2188w变体的功能活性。简言之,按1x105个细胞/孔将冷冻保存的人pbmc(researchbloodcomponents)铺板在96孔nunclondelta表面板(nunctm)中补充有normocintm(invivogen#ant-nr)和10%热灭活fbs(gibco,invitrogencorporation)的rpmi1640中。在5μg/ml抗pd-1抗体派姆单抗(批次7002688300,myoderm)、抗tim-3抗体(10μg/ml)和sea超抗原(100ng/ml,toxintechnologies)的存在下,在37℃和5%co2下培养细胞9天。然后洗涤细胞一次并用新鲜sea和抗体再刺激2天。收集无细胞上清液并储存在-80℃直至分析。使用alphalisa(perkinelmer)测定ifnγ水平。
如图12a和12b中所示,单独的或与抗pd-1抗体派姆单抗组合的许多pab2188w变体增强来自于两个不同供体的人pbmc中的ifnγ产生。
7.2.5抗tim-3抗体对肿瘤浸润淋巴细胞的细胞因子产生的影响
进一步评估单独的或与抗pd-1抗体组合的抗tim-3抗体刺激活化原代肿瘤浸润淋巴细胞(til)的细胞因子产生的能力。通过机械显微解剖分离来自新鲜的非小细胞肺癌(nsclc)(ii期)、胆囊腺癌(iv期)或乳腺癌(ii期)肿瘤(umassmedicalschool,worcester,ma)的单细胞悬浮液。在一些情况下,根据纤维化水平,酶消化是必需的(liberaseanddnasei,roche)。使细胞按5x104个细胞/孔静止于96孔nunclondelta表面板(nunctm)中补充有normocintm(invivogen#ant-nr)、重组人il-2(20u/ml,r&dsystems)和10%热灭活fbs(gibco,invitrogencorporation)的rpmi1640中1天。第二天,将样品离心并添加含有目标抗体(20μg/ml的抗tim-3抗体和5μg/ml的抗pd-1抗体派姆单抗)和抗cd3/cd28微珠(1:1珠粒:细胞比)的新鲜培养基,最终体积为100μl,并允许将其在37℃和5%co2下孵育3天。收集无细胞上清液并储存在-80℃直至分析。使用alphalisa(perkinelmer)测定ifnγ和tnfα水平。
如图13a-13f所示,抗tim-3抗体增强了来自nsclc、胆囊腺癌或乳腺癌肿瘤的活化原代til的ifnγ和tnfα产生。
7.2.6结合后抗tim-3抗体的内化
在本实施例中,分析了抗tim-3抗体向细胞的内化。在第一组实验中,使用αhfc-nc-dm1(经不可裂解接头与美登醇(maytansinoid)dm1缀合的抗人iggfc抗体,moradecllc)评估抗tim-3抗体的内化。这种二抗药物缀合物αhfc-nc-dm1与试验抗体(例如,抗tim-3抗体)结合并在内化后引起细胞毒性有效负载dm1释放到细胞的细胞质内。在第二组实验中,使用与单甲基澳瑞他汀e(mmae)直接缀合的抗tim-3抗体pab2188w(igg1n297a)和hum11(igg4s228p)评价内化。每种抗体均表现出相似的药物-抗体比率(dar;同种型对照=3.5,pab2188w=4.0,hum11=3.0),支持在内化后递送相等水平的抗体-药物缀合物(adc)。在第三组实验中,通过经细胞不可透的荧光染料标记的tim-3蛋白的亚细胞定位来评估内化。
简言之,按每孔2x104个的密度,将kasumi-3(
通过在大范围的抗体浓度下细胞存活降低更多所证明,αhfc-nc-dm1实验中抗tim-3抗体pab2188w(igg1n297a)、am-2(igg1n297a)和am-6(igg1n297a)比参考抗tim-3抗体hum11(igg4s228p)和pab1944w(igg1n297a)更有效内化在jurkat细胞(图14a)和kasumi-3细胞(图14b)上表达的tim-3。
对于第二组实验,抗体pab2188w(igg1n297a)和hum11(参考,igg4s228p)与相似浓度的mmae直接缀合,是二级药物缀合物(αhfc-nc-dm1)结合抗体不同fc区的潜在倾向差异的原因。向细胞中添加9点剂量滴定(6,666ng/ml至1ng/ml)的mmae缀合的抗tim-3抗体或mmae缀合的igg同种型对照抗体,最终体积为100μl/孔。在37℃和5%co2下用缀合抗体孵育细胞72小时。孵育后,向每个孔添加90μl重构的celltiterglo(promega)并在室温下孵育细胞5分钟。使用envision仪器(perkinelmer)记录所产生的荧光。
如图14c所示,抗体pab2188w(igg1n297a)比抗体hum11(参考,igg4s228p)诱导细胞存活降低更多,表明用二抗药物缀合物(例如,如图14a所示)观察到的效果可归因于每种tim-3抗体的内化潜力。
在第三组实验中,通过对活细胞的共聚焦荧光显微镜检查来分析抗tim-3抗体的内化。首先在37℃和5%co2下用1μm紫色增殖染料450(bd)孵育表达halotag-tim-3融合蛋白的jurkat细胞30分钟。孵育后,于pbs中洗涤细胞并重新悬浮在培养基中。为检测tim-3的胞外结构域,在37℃和5%co2下用不可透过膜的halotagalexafluor488配体(promega,1μm)对jurkathalotag-tim-3细胞染色15分钟。然后使细胞重新悬浮在新鲜培养基中并铺板在含抗tim-3抗体am-2(igg1n297a)或同种型对照(每种抗体10μg/ml)的384孔显微镜板(15,000个细胞/孔)中。使用imagexpressmicroconfocalhigh-content显微镜(moleculardevices)在环境控制(37℃和5%co2)下收集活动图像并每30分钟获取一次图像,持续过程3.5小时。使用metaxpress分析软件(moleculardevices)进行图像分析。由dapi通道(紫色增殖染料450)鉴定jurkat细胞并且由fitc通道(halotagalexafluor488)量化每个细胞的内化tim-3信号量。
如图15所示,相对于用同种型对照抗体孵育的细胞,对于用抗tim-3抗体am-2孵育的细胞而言,观察到随时间推移tim-3内化增加。具体而言,在3.5小时后,与用同种型对照抗体处理的tim-3阳性细胞相比,am-2抗体处理导致显示出tim-3内化的tim-3阳性细胞的百分比为两倍(即,分别为15.1%内化对比7.2%内化)。此外,在3.5小时对于am-2抗体处理的细胞所观察到的内化信号比用同种型对照抗体处理的细胞的内化信号明显更强(p=0.00027,单尾t检验)。在0小时时间点不存在统计学显著差异(p=0.91,单尾t-检验)。
7.3实施例3:抗tim-3抗体的表位作图
在本实施例中,表征抗tim-3抗体pab2188(igg1变体)、pab2187(igg1变体)和am-2(igg1n297a)的表位。
7.3.1使用丙氨酸扫描进行抗tim-3抗体的表位作图
通过丙氨酸扫描来评估抗tim-3抗体pab2188(igg1变体)和pab2187(igg1变体)的结合特征。简言之,使用来自于agilenttechnologies(cat#g5901a)的quikchangeht蛋白质工程系统(cat#g5901a)产生在胞外结构域中具有丙氨酸取代的人tim-3突变体。使用逆转录病毒转导使人tim-3突变体在鼠1624-5前b细胞的表面表达。表达人tim-3的细胞的转导效率或百分比保持低于5%以确保大多数细胞不表达两种或更多种不同的tim-3突变体。
正如流式细胞术中通过与多克隆抗tim-3抗体(r&dsystems,cat#af2365)的结合所证明的那样,进一步选择表达正确折叠的人tim-3突变体的细胞中表达不结合单克隆抗tim-3抗体pab2188(igg1变体)或pab2187(igg1变体)的人tim-3突变体的亚群体。通过制备、高速facs(facsariaii,bdbiosciences)将表现出特异性抗体结合的细胞与非结合细胞群体分离。将抗体反应性或非反应性细胞库在组织培养物中再次扩增并重复抗体导向的细胞分选和组织培养扩增循环,直至获得可明确检测到的抗tim-3抗体(pab2188(igg1变体)或pab2187(igg1变体))非反应性细胞群体。这种抗tim-3抗体(pab2188(igg1变体)或pab2187(igg1变体))非反应性细胞群体进行最终、单细胞或批量分选步骤。细胞扩增几天后,使用流式细胞术针对与多克隆抗tim-3抗体的结合以及与单克隆抗体pab2188(igg1变体)或pab2187(igg1变体)的不结合,对单细胞或批量分选的细胞再次进行测试。
为了将表型与基因型联系起来,对批量分选的表达人tim-3突变体的细胞进行ngs测序。序列分析显示,对多克隆抗tim-3抗体有反应性,但对单克隆抗tim-3抗体pab2188(igg1变体)或pab2187(igg1变体)无反应性的细胞表达其中位置40由phe突变为ala(根据seqidno:79编号)的人tim-3突变体。
7.3.2使用氢-氘交换(hdx)质谱法进行抗tim-3抗体的表位作图
在第一项研究中,使用氢-氘交换(hdx)质谱法研究pab2188(igg1变体)与人tim-3的相互作用。
对于去糖基化处理,在37℃下用4μl的pngasef孵育250μg的重组人tim-3/fc嵌合体(r&dsystems,cat#2365-tm)3小时。人tim-3/fc嵌合体包含与人igg1融合的seqidno:102的氨基酸序列。
对于胃蛋白酶消化,通过添加115μl的4m盐酸胍、0.85mtcep缓冲液(最终ph2.5)并在10℃下孵育混合物3分钟,使6.9μg于115μl对照缓冲液(50mm磷酸盐、100mm氯化钠,ph7.4)中的天然或去糖基化人tim-3/fc嵌合体变性3分钟。然后,使用内部填充肽柱使混合物经受柱上胃蛋白酶消化,并且使用由watersacquityuplc与qexactivetmhybridquadrupole-orbitrap质谱仪(thermo)耦合组成的uplc-ms系统分析所得的肽。在50mmx1mmc8柱上,以20.5-分钟梯度从2-32%溶剂b(0.1%于乙腈中的甲酸)分离肽。通过用mascot软件针对人tim-3序列搜索ms/ms数据来进行肽鉴定。前体和产物离子的质量公差分别为20ppm和0.05da。
用105μl氧化氘标记缓冲液(50mm磷酸盐、100mm氯化钠,pd7.4)孵育10μl天然或去糖基化人tim-3/fc嵌合体(6.9μg)、10μl天然人tim-3/fc嵌合体和抗体混合物(6.9μg:12.9μg),或10μl去糖基化人tim-3/fc嵌合体和抗体混合物(6.9μg:12.9μg)0秒、60秒、300秒、1800秒、7200秒、14400秒和28800秒。对于天然人tim-3/fc嵌合体及其与抗体的复合物在10℃下进行氘交换或对于去糖基化人tim-3/fc嵌合体及其与抗体的复合物在4℃下进行。通过添加115μl的4m盐酸胍、0.85mtcep缓冲液(最终ph2.5)来淬灭氘交换。随后,淬灭样品如上所述经受柱上胃蛋白酶消化和lc-ms分析。以仅ms模式记录质谱。为了计算氘并入量,合并给定肽在提取的离子色谱峰上的质谱并计算加权平均m/z。从天然肽(0分钟)的质量到加权平均质量的质量增量对应于氘并入水平。
天然和去糖基化人tim-3所达到的序列覆盖率分别为71.6%和98.4%。虽然有和无抗tim-3抗体时,大多数人tim-3肽展示出相同或相似的氘水平,发现几个肽片段在抗体结合后具有显著降低的氘并入量。天然和去糖基化人tim-3在由seqidno:94(vcwgkgacpvfecgnvvl)的氨基酸序列组成的区域和由seqidno:95(riqipgimnd)的氨基酸序列组成的区域结合抗人tim-3抗体pab2188(igg1变体)后显示出氘摄取显著减少。在由seqidno:93(pvfecgn)的氨基酸序列组成的区域观察到氘摄取的最强减少。
接下来,在与上述相似的hdx质谱研究中研究am-2(igg1n297a)与人tim-3的相互作用。简言之,在单独的或与抗人tim-3抗体am-2(igg1n297a)复合的氧化氘中孵育去糖基化人tim-3/fc嵌合体。在10℃下进行氘交换0秒、60秒、300秒、1800秒、7200秒和14400秒。用低ph淬灭交换反应并且使淬灭的样品经受如上所述的柱上胃蛋白酶/蛋白酶xiii或蛋白酶xviii消化和lc-ms分析。使用用于分析h/d交换ms数据的软件hdxworkbench处理原始ms数据(j.am.soc.massspectrom.2012,23(9),1512-1521,其通过引用整体并入本文)。使用氘化肽及其天然形式(t0)之间的平均质量差计算氘水平。
对于去糖基化人tim-3而言达到百分百序列覆盖率。抗tim-3抗体am-2(igg1n297a)显示出与pab2188(igg1变体)所表现出的结合模式相似的结合模式。当去糖基化人tim-3与抗tim-3抗体am-2(igg1n297a)结合时,两个区域,一个由seqidno:94(vcwgkgacpvfecgnvvl)的氨基酸序列组成而另一个由seqidno:96(riqipgimndekfnlkl)的氨基酸序列组成,经历强烈的氘保护。在由seqidno:93(pvfecgn)的氨基酸序列组成的区域观察到最强降低。
7.3.3使用pepscan分析进行抗tim-3抗体的表位作图
针对制备成芯片结合的肽阵列的合成tim-3相关肽片段测量抗tim-3抗体pab2188(igg1变体)的结合。通过pepscanprestobv、lelystad、netherlands进行分析。简言之,为了重新构建人tim-3的表位,合成了肽文库。通过用专有亲水性聚合物制剂接枝,接着使用二环己基碳二亚胺(dcc)和n-羟基苯并三唑(hobt),进行与叔丁氧羰基-六亚甲基二胺(bochmda)的反应并随后使用三氟乙酸(tfa)裂解boc基团,获得氨基官能化聚丙烯支撑物。使用标准fmoc-肽合成法在氨基官能化固体支撑物上通过自定义修改的janus液体处理站(perkinelmer)合成肽。使用pepscan的专有支架上化学连接肽(clips)技术进行结构模拟物的合成。clips技术容许将肽结构构造成单环、双环、三环、片状折叠、螺旋样折叠及其组合。在基于pepscan的elisa中测试抗体与每种合成肽的结合。肽阵列在4℃下与一抗溶液孵育过夜。洗涤后,将肽阵列在25℃下与山羊抗人hrp缀合物(southernbiotech,cat#2010-05)孵育一小时。洗涤后,添加过氧化物酶底物2,2’-联氮-二-3-乙基苯并噻唑啉磺酸酯(abts)和2μl/ml的3%h2o2。一小时后,测量显色并用电荷耦合装置(ccd)–相机和图像处理系统进行量化。
pepscan研究证明抗tim-3抗体pab2188(igg1变体)识别人tim-3链段,包括由seqidno:99(gkgacpvfe)的氨基酸序列组成的区域和由seqidno:100(dftaafpr)的氨基酸序列组成的区域。
***
本发明在范围上不受本文所述的具体实施方案限制。事实上,除所描述的那些改变之外本发明的各种修改将从前述说明和附图将对于本领域技术人员变得显而易见。此类修改意在落入所附权利要求的范围内。
本文引用的所有参考文献(例如,出版物或专利或专利申请)通过引用整体并入本文并用于所有目的,其程度如同明确地单独指出每个单独的参考文献(例如,出版物或专利或专利申请)通过引用整体并入本文并用于所有目的一样。
其它实施方案在以下权利要求中。
- 还没有人留言评论。精彩留言会获得点赞!