使用奥法木单抗治疗多发性硬化的方案和方法与流程
本披露涉及抗cd20单克隆抗体奥法木单抗的给药方案以治疗多发性硬化(ms)。相比先前使用的其他抗cd20单克隆抗体的剂量,该给药方案使用更低的剂量,该给药方案允许皮下给予奥法木单抗。该给药方案还使用负荷剂量方案、然后是维持剂量方案。
背景技术:
多发性硬化(ms)是一种免疫介导的慢性中枢神经系统疾病,其特征是炎症、脱髓鞘和轴突/神经元破坏,最终导致严重残疾。
一线护理疗法标准包括具有适度功效、良好安全性特征和熟知的耐受性问题的可注射化合物(干扰素-β和乙酸格拉替雷)。用于治疗ms的更有效的药物是那他珠单抗和芬戈莫德。那他珠单抗是针对淋巴细胞上的α-4整合素的单克隆抗体(mab),并且已经在rms患者中显示出功效(polman等人(2006);rudick等人(2006))。然而,由于存在致命的机会性感染(即进行性多病灶脑白质病或pml)的风险,那他珠单抗主要限于用作二线疗法。芬戈莫德是口服s1p受体调节剂,其在复发ms中也已显示出功效,并且被批准为一线(例如us)疗法或二线(例如eu)疗法。与安慰剂和目前的一线疗法之一干扰素β-1aim二者相比,芬戈莫德显示出功效(kappos等人(2010);cohen等人(2010))。芬戈莫德与熟知的s1p相关的安全性风险(例如,需要首次剂量监测的在治疗开始时的缓慢性心律失常)、黄斑水肿、高血压和肝脏转氨酶升高相关。
鉴于用于治疗ms的高效药物具有相关风险,而一线疗法仅具有适度的功效,因此需要鉴定药物和伴随给药方案,该药物和伴随给药方案提供高功效以及与一线疗法相当或比其更好的安全性特征。
技术实现要素:
本发明提供了一种在患有多发性硬化(ms)的患者中用抗cd20抗体奥法木单抗或其抗原结合片段治疗、阻止或预防多发性硬化(ms)的方法,该方法包括向患者给予至少一种皮下剂量的奥法木单抗或其抗体片段。
本文披露了治疗ms的方法,其包括:a)在负荷剂量方案期间向有需要的患者给予奥法木单抗或其抗原结合片段,其中该负荷剂量方案包括在给予第一维持剂量之前向患者至少一次给予负荷剂量的奥法木单抗;以及b)其后在维持方案期间向患者给予奥法木单抗或其抗原结合片段,其中该维持方案包括在第4周且其后每四周向患者给予约3mg至约60mg的奥法木单抗或其抗原结合片段。
本文披露了治疗ms的方法,其包括:a)在负荷剂量方案期间向有需要的患者给予奥法木单抗或其抗原结合片段,其中该负荷剂量方案包括在给予第一维持剂量之前向患者至少一次给予负荷剂量的奥法木单抗;以及b)其后在维持方案期间向患者给予奥法木单抗或其抗原结合片段,其中该维持方案包括在第4周且其后每四周向患者给予约3mg、10mg、20mg、30mg或60mg的奥法木单抗或其抗原结合片段。
本文披露了治疗ms的方法,其包括:a)在负荷剂量方案期间向有需要的患者给予奥法木单抗或其抗原结合片段,其中该负荷剂量方案包括在给予第一维持剂量之前向患者至少三次给予负荷剂量的奥法木单抗;以及b)其后在维持方案期间向患者给予奥法木单抗或其抗原结合片段,其中该维持方案包括在第4周且其后每四周向患者给予约3mg、10mg、20mg、30mg或60mg的奥法木单抗或其抗原结合片段。
本文披露了治疗ms的方法,其包括:
a)在负荷剂量方案期间向有需要的患者给予奥法木单抗或其抗原结合片段,其中该负荷剂量方案包括在给予第一维持剂量之前在第0天、第7天和第14天向患者给予3-60mg、或约3mg、或约10mg、或约20mg、或约30mg、或约60mg的奥法木单抗。优选地,该负荷剂量为20mg的奥法木单抗;以及
b)其后在维持方案期间向患者给予奥法木单抗或其抗原结合片段,其中该维持方案包括在第4周且其后每四周向患者给予约3mg、或约10mg、或约20mg、或约30mg、或约60mg的奥法木单抗或其抗原结合片段。优选地,该维持剂量为20mg的奥法木单抗。
本文披露了治疗ms的方法,其包括a)在负荷剂量方案期间向有需要的患者给予奥法木单抗或其抗原结合片段,其中该负荷剂量方案包括在给予第一维持剂量之前在第0天、第7天和第14天向患者给予20mg的奥法木单抗;以及b)其后在维持方案期间向患者给予奥法木单抗或其抗原结合片段,其中该维持方案包括在第4周且其后每四周向患者给予约20mg的奥法木单抗或其抗原结合片段。
附图说明
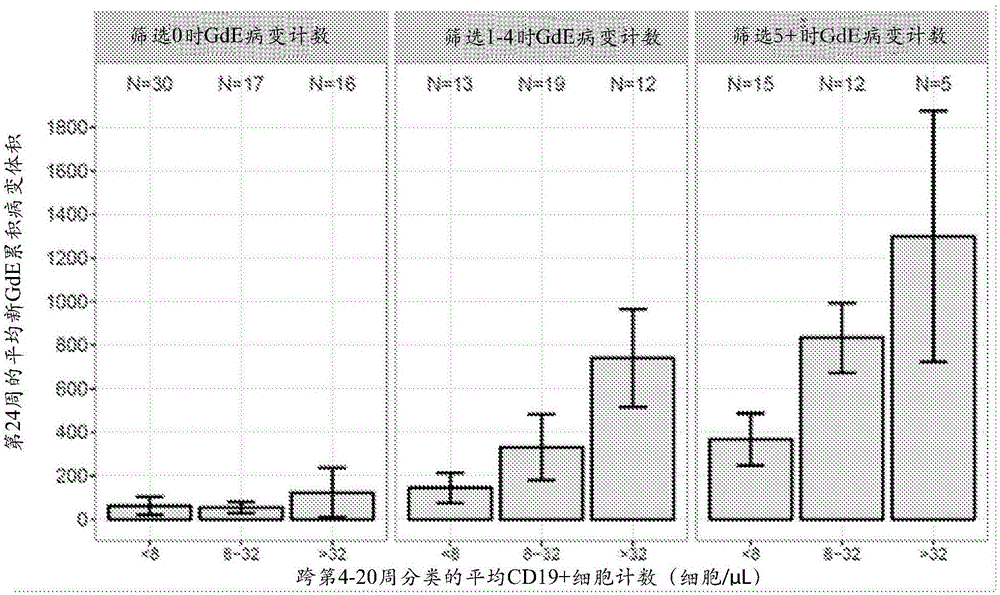
图1显示了第24周的平均累积新gde病变体积、基线时gde病变数量和跨4-20周的平均cd19b细胞计数类别。
图2显示了平均cd19b细胞计数,其表示为基线百分比(半对数标度)(itt群体)。
图3显示了预测cd19细胞耗减与负荷剂量方案的建模研究结果。
图4显示了预测cd19细胞耗减与维持剂量的建模研究结果。
图5显示了治疗组新gde病变数量的时间历程。
具体实施方式
多发性硬化(ms)是一种免疫介导的慢性中枢神经系统(cns)疾病,其特征是炎症、脱髓鞘和轴突/神经元破坏,最终导致严重残疾。
有越来越多的证据表明ms中免疫介导的损伤不仅仅涉及t细胞。具体而言,在ms中b细胞对免疫介导的组织病理学的贡献的早期作用(archelos等人2000;frohman等人2006;mcfarland2008)已经变得更加清楚。b细胞在调节免疫应答中具有重要功能,可通过自身抗原呈递、作为cd4+t细胞活化的细胞佐剂(bouaziz等人,2007)、并通过调节t细胞功能和经细胞因子产生的炎症(lund2008)(除产生自身抗体外)促成疾病发病机制。b细胞存在于ms患者的慢性斑块、脱髓鞘区域和脑脊髓液中(klaus等人,2013)。
来自利妥昔单抗(hauser等人,2008)和奥瑞珠单抗(kappos等人,2011)的2期研究的临床证据显示了这些药剂所致的b细胞耗减导致复发型ms患者中mri测量的炎症活性显著降低。最近,在rms患者的2期3次试验中证实了奥瑞珠单抗的功效(hauser等人,2015;hauser等人,2017)。这些研究显示了奥瑞珠单抗显著降低了复发率、降低了mri疾病活性、并延迟了到残疾恶化的时间(与用干扰素β1a,经2年导致残疾恶化相比)。
使用抗cd20单克隆抗体例如利妥昔单抗和奥瑞珠单抗治疗ms可能存在问题。首先,利妥昔单抗是嵌合抗体,并且嵌合抗体比其人源化(奥瑞珠单抗)和完全人类(奥法木单抗)对应物更具免疫原性。此外,高剂量方案(如与利妥昔单抗和奥瑞珠单抗一起使用的方案)导致许多区室中b细胞的严重耗减。与使用能够产生更精确且可逆的b细胞耗减的抗cd20单克隆抗体剂量的方案相比,这进而可导致更高的感染发生率以及b细胞效应有效管理的同时损失。此外,将高剂量的利妥昔单抗和奥瑞珠单抗作为静脉输注剂给予,这必须由医疗保健专业人员在诊所进行给予,并且可导致输注反应的高发生率(hauser等人2008;hauser等人,2015年)。鉴于使用“像癌症的”高剂量b细胞耗减方案以治疗ms的缺点,找到一种更便利和更安全的方案以用具有相同或更好功效的抗cd20单克隆抗体治疗ms将是有益的。
因此,对于以类似作用机制靶向b细胞病理的高级治疗仍然存在未满足的需求,该治疗具有高功效、可接受的安全性特征和自我给药便利性。
奥法木单抗是一种人类抗cd20单克隆抗体(mab),被批准用于治疗慢性淋巴细胞白血病
奥法木单抗靶向cd20分子上的新表位(不同于利妥昔单抗(rtx)-即嵌合抗cd20mab)。rtx研究已利用高静脉内(iv)剂量(相隔14天两次1000mg剂量)导致非常快速的b细胞裂解,导致输注反应,尽管使用了iv皮质类固醇(cs)术前用药。第一项涉及奥法木单抗的研究是i/ii期研究以研究在类风湿性关节炎(ra)中使用低剂量皮下(sc)奥法木单抗制剂(在没有cs的情况下给予)可能提供比rtx研究中所观察到的更多的受控b细胞耗减。主要目的是研究类风湿性关节炎(ra)患者中在背景甲氨蝶呤(mtx)上用单次sc剂量的奥法木单抗的安全性和耐受性。次要目标包括研究实现靶标外周b细胞耗减的最小剂量、药效学剂量-反应曲线和b细胞恢复曲线。在稳定mtx剂量的ra患者的这项研究中,30mg、60mg或100mg的sc奥法木单抗剂量导致严重和持续的外周b细胞耗减。可以耐受高达60mg的单剂量,并且可以提供实现b细胞耗减而无需额外的cs术前用药的方法。该研究确定了外周b细胞耗减的持续时间随着抗cd20抗体奥法木单抗(ofatumumab)的剂量而增加。
也已在ms患者中研究了奥法木单抗。已在rrms患者的2期2次研究中评价了奥法木单抗(oms115102和oms112831/mirror研究)。oms115102研究是一项48周(24周交叉)、双盲、安慰剂受控的研究,该研究评价了38例rrms患者中静脉内给予奥法木单抗的效果(soerensen等人,2014)。该研究由3个剂量群组(100mg、300mg、700mg)组成,其中12名患者在每个群组中以2:1的比例随机分配至奥法木单抗或安慰剂。24周后,将奥法木单抗患者转换为安慰剂,并将安慰剂患者转换为他们群组的奥法木单抗剂量,并随后进行24周(第24-48周)。该研究显示了在两个治疗期内评估的每个剂量水平下,静脉内给予奥法木单抗导致循环b细胞计数的严重降低和mri病变活性的抑制(与安慰剂相比,病变活性降低高达96%)(teeling等人(2004),blood[血液]104(6):1793-800)。
oms112831/mirror是一项2b期、48周研究(24周双盲治疗期,然后是24周随访期),该研究检查了复发缓解型多发性硬化(rrms)中广泛重复剂量皮下奥法木单抗的功效和安全性(bar-or,2016)。在这项称为mirror的研究(在rrms中的mri研究:评价奥法木单抗方案)中,患者每12周(q12w)接受3mg、30mg或60mg的奥法木单抗,或每4周(q4w)接受60mg的奥法木单抗。为了评价是否可以通过给予初始的、较低的、调节性剂量的奥法木单抗来改善对较高的奥法木单抗剂量(30mg和60mg)的耐受性(理论上导致b细胞逐渐裂解并可能减少细胞因子释放反应),将30mgq12w、60mgq12w和60mgq4w剂量组中的患者随机化(1:1)以在第0周接受安慰剂或调节性剂量的奥法木单抗3mg。
主要终点是在第0-12周期间脑磁共振成像(mri)上的新钆增强病变的累积数量。包括的其他终点
(i)其他时间点新gd增强病变的累积数量;
(ii)(ii)a)新gd增强病变,b)新/新扩大的t2病变,和c)t1低信号病变的第12周和第24周的总体积;
(iii)没有复发的患者比例;
(iv)扩展残疾状况量表(edss)得分;
(v)多发性硬化功能综合(msfc)及其组成得分;
(vi)改良式疲劳影响量表(mfis);以及
(vii)评价初始调节性奥法木单抗剂量的使用。
在累积的奥法木单抗剂量≥30mg(p<0.001)的事后分析中,在第0-12周期间,与安慰剂相比,奥法木单抗使新钆增强病变的平均累积数量减少65%(p<0.001),并且第4-12周期间,与安慰剂相比,奥法木单抗使新钆增强病变的平均累积数量减少≥90%。在第0-12周期间,与安慰剂相比,奥法木单抗减少了累积的新/新扩大的t2病变(60%-72%;p≤0.002),并剂量依赖性地耗减cd19b细胞。在第0-12周期间,与接受安慰剂的9/67名患者(13%)相比,接受奥法木单抗的17/164名患者(10%)经历复发。值得注意的是,给予3mg调节性剂量没有益处。总体而言,这些结果显示了奥法木单抗sc可以以远低于之前在ms患者中所研究的剂量抑制新的脑mri病变。结果还证明了b细胞计数的快速的剂量和剂量频率依赖性降低,3mgq12方案的效果不太明显。每月给药显示了在给药间隔期间没有b细胞恢复的迹象。30mg和60mgq12周均显示了在重新给药之前血液区室中约95%的b细胞抑制。一旦停止给药,与高剂量静脉内抗cd20抗体相比,所有治疗在60周的随访中均显示了相对快速的b细胞再增殖。治疗组对cd19+b细胞的抑制如图1所示。每月给药显示了在给药之间的间隔期间没有b细胞恢复的迹象,而30和60mgq12周二者均显示了在重新给药之前约75%的b细胞抑制。在半对数标度上,一旦已停止给予,所有治疗均显示类似的b细胞再增殖率,如平行生长曲线所证明的(图1)。在导致最大外周b细胞耗减的剂量下,用奥法木单抗持续抑制新gd增强病变和t2病变与其他抗cd20mab所证明的效果一致(vonbudingen等人2012;bleeker等人2008)。
总体而言,奥法木单抗对于rrms患者安全且耐受性良好。奥法木单抗的安全性特征与之前的数据一致;没有报告新的信号。
在皮下奥法木单抗的oms112831/mirror研究中,奥法木单抗剂量组中最常报告的ae是注射相关反应(奥法木单抗为52%,安慰剂为15%)。注射相关反应主要发生在首次剂量后,随后给药时减少,并且严重程度为轻度/中度(97%的事件)。治疗组在感染相关ae(包括尿道和呼吸道感染)的整体发生率方面没有显著差异。报告的严重不良事件(sae)很少。这些主要是全身注射相关反应(3名患者),全部发生在第1天和60mg奥法木单抗剂量组。在研究期间没有报告机会性感染的案例。
术语“包括(comprising)”涵盖“包含(including)”以及“组成(consisting)”,例如“包括”x的组合物可以仅由x组成,或者可以包括另外的某物,例如x+y。
术语“约”相对于数值x,意指+/-10%,除非上下文另外规定。
本文所用的术语“免疫球蛋白”是指一类由两对多肽链、一对轻(l)低分子量链和一对重(h)链组成的结构相关糖蛋白,所有四个链均通过二硫键相互连接。免疫球蛋白的结构已得到很好的表征。参见,例如,fundamentalimmunologych.7(paul,w.编,第2版ravenpress,n.y.(1989))。简而言之,每条重链通常由重链可变区(在本文缩写为vh)和重链恒定区构成。重链恒定区ch通常由三个结构域,即ch1、ch2以及ch3构成。每条轻链通常由轻链可变区(在本文缩写为vl)和轻链恒定区构成。轻链恒定区通常由一个结构域cl构成。vh和vl区可以进一步被细分为高变性区域(或高变区,其可以在结构上定义的环的序列和/或形式中是高变的),也称为互补决定区(cdr),其散布有更保守的区域,称为框架区(fr)。每个vh和vl通常由从氨基末端到羧基末端按以下顺序排列的三个cdr和四个fr构成:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4(还参见chothia和leskj.mol.biol.[分子生物学杂志]196,901-917(1987))。通常,该区域中氨基酸残基的编号是通过如下中描述的方法进行:kabat等人,sequencesofproteinsofimmunologicalinterest[有免疫学意义的蛋白质序列],第5版publichealthservice[公共卫生服务],nationalinstitutesofhealth[国立卫生研究院],bethesda[贝塞斯达],马里兰州(1991)(短语,如kabat中或本文中根据kabat的可变结构域残基编号指的是重链可变结构域或轻链可变结构域的编号系统)。使用该编号系统,肽的实际线性氨基酸序列可含有较少或额外的氨基酸,该较少或额外的氨基酸对应于可变结构域的fr或cdr的缩短或插入。例如,重链可变结构域可在vhcdr2的残基52之后包括单个氨基酸插入物(例如根据kabat的残基52a)和在重链fr残基82之后包括插入残基(例如根据kabat的残基82a、82b和82c等)。通过将抗体序列与“标准”kabat编号序列的同源性区域比对,可以确定给定抗体的残基的kabat编号。
如本文所用的术语“抗体”是指免疫球蛋白分子、免疫球蛋白分子的片段或其任一的衍生物,该抗体具有在典型的生理条件下与抗原特异性结合相当长时间的能力,该时间如至少约30分钟、至少约45分钟、至少约一小时、至少约两小时、至少约四小时、至少约8小时、至少约12小时、约24小时或更长、约48小时或更长、约3天、4天、5天、6天、7天或更多天等,或任何其他相关功能定义的时期(例如足以诱导、促进、增强和/或调节与抗体结合抗原相关的生理反应的时间和/或足以使抗体募集fc介导的效应子活性的时间)。如本文所用的术语抗体的“抗原结合部分”是指保留特异性地结合抗原(例如cd20)的能力的抗体的片段。已经显示抗体的抗原结合功能可以由全长抗体的片段执行。涵盖在术语抗体的“抗原结合部分”内的结合片段的实例包括fab片段,一种由vl、vh、cl和ch1结构域组成的单价片段;f(ab)2片段,一种包含在铰链区通过二硫桥连接的两个fab片段的二价片段;由vh和ch1结构域组成的fd片段;由抗体的单一臂的vl和vh结构域组成的fv片段;由vh结构域组成的dab片段(ward等人,1989,nature[自然]341:544-546);和分离的cdr。
免疫球蛋白分子的重链和轻链的可变区包含与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子(包括免疫系统的各种细胞(如效应子细胞)和补体系统的组分如c1q,即经典补体活化途径的第一组分)的结合。
如上所述,除非另有说明或与上下文明显矛盾,否则本文所用的术语“抗体”包括通过任何已知技术(如酶促裂解、肽合成和保留特异性地结合抗原的能力的重组技术)提供的抗体片段。已经显示抗体的抗原结合功能可以由全长(完整)抗体的片段执行。涵盖在术语“抗体”内的抗原结合片段的实例包括但不限于(i)fab片段,一种由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab)2和f(ab')2片段,为包含在绞链区由二硫桥连接的两个fab片段的二价片段;(iii)基本上由vh和ch1结构域组成的fd片段;(iv)基本上由抗体单个臂的vl和vh结构域组成的fv片段,(v)dab片段(ward等人,nature[自然]341,544-546(1989)),其基本上由vh结构域组成,也称为结构域抗体(holt等人(2003年11月)trendsbiotechnol.[生物技术趋势]21(11):484-90);(vi)骆驼抗体或纳米抗体(revets等人(2005年1月)expertopinbiolther.[生物疗法专家意见]5(1):111-24)),(vii)分离的互补决定区(cdr),如vhcdr3,(viii)unibodytm,如wo2007/059782中披露的单价抗体,(ix)单链抗体或单链fv(scfv),参见例如bird等人,science[科学]242,423-426(1988)和huston等人,pnasusa[美国国家科学院院刊]85,5879-5883(1988)),(x)双体抗体(scfv二聚体)、三体抗体或四体抗体,该双体抗体可以是单特异性的或双特异性的(参见例如pnasusa[美国国家科学院院刊]90(14),6444-6448(1993)、ep404097或wo93/11161描述的双体抗体)。尽管这些片段通常包括在抗体的定义内,但它们共同地且各自独立地是本发明的独特特征,表现出不同的生物学特性和实用性。本文进一步讨论了本发明上下文中的这些和其他有用的抗体片段。
应当理解的是,术语抗体通常包括单克隆抗体以及多克隆抗体。抗体可以是人类抗体、人源化抗体、嵌合抗体、鼠抗体等。产生的抗体可以具有任何同种型。
如本文所用,术语“人类抗体”旨在包括具有源自人类种系免疫球蛋白序列的可变区和恒定区的抗体。本发明的人类抗体可以包括不是由人类种系免疫球蛋白序列编码的氨基酸残基(例如,通过在体外随机诱变或位点特异性诱变或通过在体内体细胞突变来引入的突变)。然而,如本文所用的,术语“人类抗体”不旨在包括其中源自另一种哺乳动物物种(例如小鼠)种系的cdr序列已被移植到人类框架序列中的抗体。
如本文所用的,如果抗体是使用人类免疫球蛋白序列从系统获得的,例如通过使携带人类免疫球蛋白基因的转基因小鼠免疫或通过筛选人类免疫球蛋白基因文库,则人类抗体“源自”特定种系序列,并且其中,所选择的人类抗体的氨基酸序列与种系免疫球蛋白基因编码的氨基酸序列是至少90%、如至少95%、如至少96%、如至少97%、例如至少98%、或如至少99%一致的。通常,源自特定人类种系序列的人类抗体将显示不超过10个氨基酸差异,如与种系免疫球蛋白基因编码的氨基酸序列有不超过5个(例如不超过4、3、2或1个)氨基酸差异。对于vh抗体序列,vhcdr3结构域不包括在这种比较中。
术语“嵌合抗体”是指含有来自一种抗体的一个或多个区域和来自一种或多种其他抗体的一个或多个区域的抗体。术语“嵌合抗体”包括单价、二价或多价抗体。单价嵌合抗体是由通过二硫桥与嵌合l链连接的嵌合h链形成的二聚体(hl)。二价嵌合抗体是由通过至少一个二硫桥连接的两个hl二聚体形成的四聚体(h2l2)。例如,也可以通过使用组装成具有2+结合位点的分子的ch区(例如来自igmh链或μ链)来产生多价嵌合抗体。通常,嵌合抗体是指这样的抗体:其中一部分重链和/或轻链与源自特定物种或属于特定抗体类或亚类的抗体中的相应序列相同或同源,而该一个或多个链的其余部分与源自另一物种或属于另一抗体类或亚类的抗体以及此类抗体的片段中的相应序列相同或同源,只要它们表现出所需的生物活性(参见例如美国专利号4,816,567;也参见morrison等人,pnasusa[美国国家科学院院刊]81,6851-6855(1984))。嵌合抗体通过本领域公知的重组方法产生(参见例如cabilly等人,pnasusa[美国国家科学院院刊]81,3273-3277(1984),morrison等人,pnasusa[美国国家科学院院刊]81,6851-6855(1984),boulianne等人,nature[自然]312,643-646(1984),ep125023,neuberger等人,nature[自然]314,268-270(1985),ep171496,ep173494,wo86/01533,ep184187,sahagan等人,j.immunol.[免疫学杂志]137,1066-1074(1986),wo87/02671,liu等人,pnasusa[美国国家科学院院刊]84,3439-3443(1987),sun等人,pnasusa[美国国家科学院院刊]84,214-218(1987),better等人,science[科学]240,1041-1043(1988)和harlow等人,antibodies:alaboratorymanual[抗体:实验室手册],coldspringharborlaboratorypress[冷泉港实验室出版社],coldspringharbor[冷泉港],纽约,(1988))。
术语“人源化抗体”是指含有源自非人类抗体的最小序列的人类抗体。通常,人源化抗体是人类免疫球蛋白(受体抗体),其中来自受体高变区的残基被来自非人类物种(例如小鼠、大鼠、兔或非人类灵长类动物)的具有所需特异性、亲和力和容量的高变区(供体抗体)的残基替换。
此外,人源化抗体可包含在受体抗体或供体抗体中未发现的残基。进行这些修饰以进一步改善抗体性能。通常,人源化抗体将包含基本上所有如下项:至少一个(通常两个)可变结构域,其中所有或基本上所有高变环对应于非人类免疫球蛋白的那些高变环,且所有或基本上所有fr区是人类免疫球蛋白序列的那些fr区。人源化抗体任选地也将包含人类免疫球蛋白恒定区的至少一部分。进一步的细节参见jones等人,nature[自然]321,522-525(1986),riechmann等人,nature[自然]332,323-329(1988)和presta,curr.op.struct.biol.[当前结构生物学观点]2,593-596(1992)。
术语“cd19”是指b淋巴细胞抗原cd19(cd19=分化簇19),是人类中由cd19基因编码且在b细胞(一类型的白细胞)表面发现的蛋白质。术语“b细胞”是指一类型的白细胞。b细胞也称为b淋巴细胞,它们通过分泌抗体在适应性免疫系统的体液免疫组分中起作用。另外,b细胞呈递抗原(它们也被分类为专业抗原呈递细胞(apc))并分泌细胞因子。如本文所用的,“cd19细胞”和“b细胞”是指相同类型的细胞。
术语“患者”是指人类患者。
如本文所用的术语“单克隆抗体”或“单克隆抗体组合物”是指单一分子组合物的抗体分子的制品。单克隆抗体组合物表现出对特定表位的单一结合特异性和亲和力。因此,术语“人类单克隆抗体”是指表现出单一结合特异性的抗体,该抗体具有源自人类种系免疫球蛋白序列的可变区和恒定区。人类单克隆抗体可以由杂交瘤产生,该杂交瘤包括从转基因或转染色体非人类动物(例如转基因小鼠)获得的、与永生化细胞融合的b细胞,该b细胞具有包含人类重链转基因和轻链转基因的基因组。
如本文所用的,术语“重组人类抗体”包括通过重组方法制备、表达、产生或分离的所有人类抗体,例如(a)从针对人类免疫球蛋白基因转基因或转染色体的动物(例如小鼠)或由其制备的杂交瘤分离的抗体(本文其他地方进一步描述),(b)从转化以表达抗体的宿主细胞(如从转染瘤)分离的抗体,(c)从重组、组合人类抗体文库分离的抗体,和(d)通过涉及将人类免疫球蛋白基因序列剪接到其他dna序列的任何其他手段制备、表达、产生或分离的抗体。此类重组人类抗体具有源自人类种系免疫球蛋白序列的可变区和恒定区。然而,在某些实施例中,可以对此类重组人类抗体进行体外诱变(或者,当使用针对人类ig序列转基因的动物时,进行体内体细胞诱变),从而尽管源自人类种系vh和vl序列且与其相关,但是重组抗体的vh和vl区的氨基酸序列为可能不是天然存在于体内人类抗体种系库内的序列。
cd20分子(也称为人类b淋巴细胞限制性分化抗原或bp35)是位于前b淋巴细胞和成熟b淋巴细胞上的分子量约35kd的疏水性跨膜蛋白(valentine等人(1989)j.biol.chem.[生物化学杂志]264(19):11282-11287;和einfield等人(1988)emboj.[embo杂志]7(3):711-717)。cd20被发现处于来自外周血或淋巴器官的多于90%的b细胞的表面上,并且在早期前b细胞发育期间被表达并且一直持续到浆细胞分化。cd20存在于正常b细胞以及恶性b细胞二者上。特别地,在大于90%的b细胞非霍奇金淋巴瘤(nhl)上表达cd20(anderson等人(1984)blood[血液]63(6):1424-1433),但在造血干细胞、祖b细胞、正常浆细胞或其他正常组织上未发现cd20(tedder等人(1985)j.immunol.[免疫学杂志]135(2):973-979)。
cd20蛋白质的85个氨基酸的羧基末端区域位于细胞质内。该区域的长度与其他b细胞特异性表面结构的长度(例如igm、igd和igg重链或组织相容性抗原ii类α链或β链的长度,它们分别具有3、3、28、15和16个氨基酸的相对短的胞质内区域)形成对比(komaromy等人(1983)nar11:6775-6785)。在最后61个羧基末端氨基酸中,21个是酸性残基,而只有2个是碱性残基,表明该区域具有强净负电荷。genbank登录号为np_690605。
可以经任何合适的途径给予本发明的抗cd20抗体奥法木单抗,如口服、鼻腔、可吸入、支气管内、肺泡内、局部(包括口腔、透皮和舌下)、直肠、阴道和/或肠胃外途径。在一个实施例中,通常通过注射经皮下(s.c.)给予本发明的药物组合物。在一个实施例中,使用自动注射器实现包含奥法木单抗的药物组合物的皮下(sc)给予。适合根据本发明使用的自动注射器的非限制性实例是
如本文所用的短语“肠胃外给予”和“肠胃外地给予”意指除了肠道和局部给予以外的给予方式,通常通过注射,并且包括表皮、静脉内、肌肉内、动脉内、鞘内、囊内、眼眶内、心内、皮内、腹膜内、腱内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、颅内、胸内、硬脑膜外以及胸骨内注射和输注。
在本发明的一个实施例中,奥法木单抗组合物按照常规程序配制成适用于人类静脉内给予的药物组合物。通常,用于静脉内给予的组合物是无菌等渗水性缓冲液溶液。在合适的情况下,该组合物还可以包括增溶剂和局部麻醉剂(如利多卡因)以缓解注射部位的疼痛。通常,成分分开供应或以指示活性剂的量的单位剂型混合在一起供应,例如作为气密密封容器(例如安瓿或小药囊)中的干燥冻干粉末或无水浓缩物。
如果通过输注给予组合物,可以用含有无菌药用级水或盐水的输注瓶进行配药。
如果通过注射给予组合物,可以提供一安瓿瓶无菌注射用水或盐水,以便在给予之前将各成分混合。
在一个实施例中,可以根据wo/2009/009407中披露的制剂配制用于奥法木单抗的制剂。
在一个实施例中,以抗体制剂配制奥法木单抗,其中奥法木单抗的存在量为约20-300mg/ml、50-300mg/ml、100-300mg/ml、150-300mg/ml、200-300mg/ml、或250-300mg/ml,优选为50mg/ml。
在一个实施例中,以抗体制剂配制奥法木单抗,其中制剂包含10至100mm乙酸钠、25至100mm氯化钠、0.5%至5%精氨酸游离碱、0.02至0.2mmedta、0.01%至0.2%聚山梨醇酯80,并调节ph至5.0至7.0。优选地,奥法木单抗制剂包含50mm乙酸钠、51mm氯化钠、1%精氨酸游离碱、0.05mmedta、0.02%聚山梨醇酯80,并调节ph至5.5。
在一个实施例中,以预先填充的注射器提供奥法木单抗制剂。
在一个实施例中,提供了一种治疗多发性硬化(ms)的方法,其包括a)在负荷剂量方案期间向有需要的患者给予奥法木单抗;以及b)其后在维持方案期间向患者给予奥法木单抗。
在一个实施例中,提供了一种用于缓解或延迟多发性硬化症状进展的方法,其包括a)在负荷剂量方案期间向有需要的患者给予奥法木单抗;以及b)其后在维持方案期间向患者给予奥法木单抗。
在一个实施例中,提供了一种用于减慢多发性硬化进展的方法,其包括a)在负荷剂量方案期间向有需要的患者给予奥法木单抗;以及b)其后在维持方案期间向患者给予奥法木单抗。
在一个实施例中,负荷剂量为约15mg与约25mg之间的奥法木单抗,优选约18mg与约22mg之间的奥法木单抗,最优选约20mg的奥法木单抗。在一个实施例中,维持剂量为约15mg与约25mg之间的奥法木单抗,优选约18mg与约22mg之间的奥法木单抗,并且优选约20mg的奥法木单抗。在一个实施例中,负荷剂量和维持剂量二者均为约15mg与约25mg之间的奥法木单抗,优选约18mg与约22mg之间的奥法木单抗,最优选约20mg的奥法木单抗。
在一个实施例中,提供了一种治疗多发性硬化(ms)的方法,其包括以下方案:a)在负荷剂量方案期间向有需要的患者给予奥法木单抗,
该负荷剂量方案包括在剂量方案的第0天、第7天和第14天皮下注射20mg奥法木单抗;以及b)在维持剂量方案期间将奥法木单抗给予至有需要的患者,该维持剂量方案包括在给药方案的第四周开始皮下注射20mg奥法木单抗,以及其后在治疗方案的持续时间内每四周继续皮下注射20mg奥法木单抗。
在一个实施例中,提供了一种缓解或延迟多发性硬化(ms)症状进展的方法,其包括以下方案:a)在负荷剂量方案期间将奥法木单抗给予至有需要的患者,该负荷剂量方案包括在给药方案的第0天、第7天和第14天皮下注射20mg奥法木单抗;以及b)在维持剂量方案期间将奥法木单抗给予至有需要的患者,该维持剂量方案包括在给药方案的第四周开始皮下注射20mg奥法木单抗,以及其后在治疗方案的持续时间内每四周继续皮下注射20mg奥法木单抗。
在一个实施例中,提供了一种减慢多发性硬化(ms)进展的方法,其包括以下方案:a)在负荷剂量方案期间将奥法木单抗给予至有需要的患者,该负荷剂量方案包括在给药方案的第0天、第7天和第14天皮下注射20mg奥法木单抗;以及b)在维持剂量方案期间将奥法木单抗给予至有需要的患者,该维持剂量方案包括在给药方案的第四周开始皮下注射20mg奥法木单抗,以及其后在治疗方案的持续时间内每四周继续皮下注射20mg奥法木单抗。
在一个实施例中,提供了用于在治疗多发性硬化(ms)的方法中使用的奥法木单抗,该方法包括a)在负荷剂量方案期间向有需要的患者给予奥法木单抗;并且b)其后在维持方案期间向患者给予奥法木单抗。
在一个实施例中,提供了用于在治疗多发性硬化(ms)的方法中使用的奥法木单抗,该方法包括a)在负荷剂量方案期间将奥法木单抗给予至有需要的患者,该负荷剂量方案包括在给药方案的第0天、第7天和第14天皮下注射20mg奥法木单抗;并且b)在维持剂量方案期间将奥法木单抗给予至有需要的患者,该维持剂量方案包括在给药方案的第四周开始皮下注射20mg奥法木单抗,以及其后在治疗方案的持续时间内每四周继续皮下注射20mg奥法木单抗。
在一个实施例中,提供了在用于在治疗多发性硬化(ms)的方法中使用的药物的制造中的奥法木单抗,其中该方法包括a)在负荷剂量方案期间向有需要的患者给予奥法木单抗;并且b)其后在维持方案期间向患者给予奥法木单抗。
本披露的一个或多个实施例的细节陈述于上文所附的说明书中。虽然与本文所述的那些方法和材料类似或等同的任意方法和材料可以用于本披露的实践或测试,但是现在描述优选的方法和材料。根据说明书并且根据权利要求书,本披露的其他特征、目标和优点将是清楚的。除非另外定义,否则本文所用的全部技术和科学术语具有与本披露所属领域的普通技术人员通常所理解的相同的意义。在本说明书中引证的所有专利以及公开文件通过引用并入。提出以下实例以便更充分地说明本披露的优选实施例。该实例决不应被解释为限制如由所附权利要求书限定的所披露的患者问题的范围。
实例
比较奥法木单抗与特立氟胺对患有复发性多发性硬化的患者的功效和安全性的随机、双盲、双模拟、平行组研究
与平行进行的相同设计的第二研究相结合设计该研究以提供在复发性多发性硬化(ms)患者中与口服特立氟胺
本研究的主要目的是证明在降低确认复发的频率方面,每4(q4)周一次皮下(s.c.)奥法木单抗20mg优于每日一次口服特立氟胺14mg,该确诊复发的频率通过复发性ms患者的年度复发率(arr)评价。
次要目的包括(i)通过扩展残疾状况量表(edss)的3个月确认恶化(3mcdw)来测量到残疾恶化的时间;(ii)通过edss的6个月确认恶化(6mcdw)来测量到残疾恶化的时间;(iii)通过edss的6个月确认改善(6mcdi)来测量到残疾改善的时间;(iv)每次mri扫描的t1gd增强病变的数量;(v)每年mri上新增或扩大的t2病变数量(年度t2病变率);(vi)基于对相对于基线的脑体积变化百分比的评估,脑体积损失(bvl)率。
还评价了与每日一次口服特立氟胺14mg相比的q4周皮下奥法木单抗20mg的安全性和耐受性。
研究设计
这是一项复发性ms患者中的具有可变治疗持续时间的随机、双盲、双模拟、活性比较对照、平行组、多中心研究。符合条件的患者将被随机分配接受q4周皮下注射奥法木单抗20mg(在最初14天内每周三次20mg剂量的初始负荷方案后)或每日一次口服特立氟胺14mg。为了使不同制剂呈盲选,将使用双模拟设计:活性奥法木单抗治疗组患者将额外每日一次口服安慰剂胶囊;活性特立氟胺治疗组患者将额外q4周使用含安慰剂的皮下注射剂(在最初14天内每周三次注射的初始方案后)。
将登记edss得分为0至5.5的复发性多发性硬化(ms)的患者(具有疾病活性的rrms或spms,如lublin等人2014所定义)。基于最近在登记前一年或两年内复发或在随机化前一年的mri上的一个或多个gd增强病变,特定疾病活性标准定义了具有活性炎症性疾病的群体。定义的试验群体是典型的复发性ms。
负荷剂量方案和维持剂量方案
本研究中奥法木单抗的剂量方案是在第1天、第7天和第14天进行20mg的负荷剂量方案,然后从第4周开始每4周给予20mg的每月维持剂量方案。剂量选择依赖于临床假设,即淋巴组织中b细胞的耗减是功效的关键(通过mri和复发测量),并且脑实质和脑膜b细胞的耗减可能是作用方式的另一个因素;血液b细胞计数是组织状态的不完美的、假象的量度。该假设表明,为了达到所需的功效,应满足2个条件:
●用于淋巴耗减的具有足够高初始pk的负荷剂量方案,和
●可使b细胞耗减水平保持在所需的阈值之下的持续的维持剂量。
在复发性ms患者中皮下奥法木单抗的2期研究(oms112831/mirror研究)提供了关于通过mrigd增强的脑病变测定的外周b细胞耗减和功效之间的关系的重要信息。在该研究中,使用准泊松回归模型(quasi-poissonregressionmodel)检测到明确的剂量-反应关系,该模型使新gd增强病变体积、基线病变数量和治疗组相关。剂量反应完全由cd19+细胞计数下降的程度来解释。该模型表明较低的cd19+细胞水平导致更好地控制病变体积,并且随后在整个治疗历程中应保持高水平的cd19+细胞耗减(例如≤8个细胞/μl)以便确保所需的功效。
建模研究
期望在没有任何延迟的情况下实现最大mri功效和低于8个细胞/μl的b细胞耗减(图1)。基于oms112831/mirror研究的2期数据的探索性建模表明单个剂量皮下奥法木单抗20mg不足以将b细胞水平降低至≤8个细胞/μl(参见图2)。从图3和图4中还可以看出,建模研究预测了提供以多个负荷剂量给予奥法木单抗20mg可以获得高度的靶标耗减,并且随后的维持剂量(也是20mg)将维持或增加初始耗减。更具体地说,我们确定了需要3个独立的20mg剂量(第0、1和2周)的负荷剂量方案以在>95%的患者中基于建模获得靶标耗减(≤8个细胞/μl),并且推断为比单次60mg负荷更有效。因此,选择该负荷剂量方案。
在oms112831/mirror研究中,研究了每12周3mg、每12周30mg、每12周60mg和每4周60mg的奥法木单抗给予。尽管3mg具有明显的mri效果,并且每12周30mg似乎非常接近最大mri功效,但是还研究了每12周60mg以确保最大mri功效将真正转化为对复发和残疾的最大临床效果。与每12周60mg相比,最高剂量水平(每4周60mg)没有增加任何功效(图5)。然而,当观察b细胞恢复时,我们注意到在给予下一个12周剂量之前存在向b细胞恢复的趋势。因为在给药间隔期间,q4周给药60mg的患者没有显示b细胞恢复的迹象,我们决定维持剂量给药间隔为4周(每4(q4)周一次)。建模研究估计了相对于剂量和给药频率的b细胞恢复率。从mirror研究数据估计了ms患者b细胞恢复率。建模研究表明了对于ms的平均情况,认为3mg维持剂量足以维持b细胞耗减4周时间(参见图4,上图)。然而,相同的建模估计:对于具有非常高的恢复率(对应于从mirror研究评估的百分之95)的患者,即在“最坏情况”中,3mg和10mg维持都不足以维持经4周间隔的b细胞耗减,而20mg或更高剂量将维持足够的耗减(参见图4,下图)。因此,基于探索性建模,即使在具有高恢复率的患者中,20mg的奥法木单抗显现足以维持或进一步耗减先前已经过耗减的>95%的患者中的b细胞。因此,为了确保持续的维持功效,发明人决定将测试的mirror剂量方案(每12周60mg)分开以便每4周服用20mg。
在oms112831/mirror研究中,关于安全性和耐受性,与q12周3mg或30mg的较低剂量方案相比,q12周和q4周60mg的剂量方案与更多的不良事件(ae)相关。特别地,在第1天报告为sae的注射后全身性反应仅在60mg剂量方案中观察到。在第一次给药时存在b细胞的情况下,并且当b细胞已开始恢复时,全身性反应是预期的ae,并且它们的严重性可能是剂量和b细胞计数相关的。
由于复发性ms是一种具有预期长期治疗的慢性疾病,因此剂量选择应旨在平衡功效和安全性方面。选择在第1天、第7天和第14天皮下奥法木单抗20mg的负荷剂量方案,然后每4周给予20mg的每月维持剂量方案(从第4周开始),因为对于几乎所有患者,它将耗减并随后维持b细胞的水平低于8个细胞/μl,并且与较高剂量相比,预测其具有最大临床益处和更好的耐受性。总之,结合维持b细胞低于阈值,在mri病变和复发(sormani等人2009;sormani等人2013)与在测试的累积剂量下观察到的病变抑制之间的强关系支持建议剂量方案的选择。
本文引证的参考文献
1.hauseretal.,b-celldepletionwithrituximabinrelapsing-remittingmultiplesclerosis,nengljmed2008;358:676-88.
2.polmanetal.,arandomized,placebo-controlledtrialofnatalizumabforrelapsingmultiplesclerosis,nengljmed2006;354:899-910.
3.rudicketal.,natalizumabplusinterferonbeta-1aforrelapsingmultiplesclerosis,nengljmed2006;354:911-923.
4.kapposetal.,aplacebo-controlledtrialoforalfingolimodinrelapsingmultiplesclerosis,nengljmed2010;362:387-401.
5.cohenetal.,oralfingolimodorintramuscularinterferonforrelapsingmultiplesclerosis,nengljmed2010;362:402-415.
6.archelosetal.,theroleofb-cellsandautoantibodiesinmultiplesclerosis,annneurol2000;47:694-706.
7.frohmanetal.,multiplesclerosis–theplaqueanditspathogenesis,newengljmed2006;354:942-955.
8.mcfarland,theb-cell–oldplayer,newpositionontheteam,nengljmed2008;358:664-5.
9.bouazizetal.,therapeuticb-celldepletionimpairsadaptiveandautoreactivecd4+t-cellactivationinmice,pro.natl.acad.sci.usa2007;104:20882-20887.
10.lund,cytokine-producingblymphocytes–keyregulatorsofimmunity,curropinimmunol.2008;20(3):332–38.
11.klauslehmann-hornetal.,targetingb-cellsinthetreatmentofmultiplesclerosis,theradvneuroldisorders2013;6(3):161-173.
12.kapposetal.,ocrelizumabinrelapsing-remittingmultiplesclerosis:aphase2,randomized,placebo-controlled,mutlicentretrial,lancet2011;378:1779-87.
13.hauseretal.,efficacyandsafetyofocrelizumabinrelapsingmultiplesclerosis-resultsoftheinterferon-beta-1a-controlled,double-blind,phaseiiioperaiandiistudies,ectrimsonlinelibrary;hauser,2015;116634.
14.hauseretal.,ocrelizumabversusinterferonbeta-1ainrelapsingmultiplesclerosis,nengljmed2017;376(3):221-234.
15.
16.soerensenetal.,safetyandefficacyofofatumumabinrelapsingremittingmultiplesclerosis,neurology2014;82:573-581.
17.bar-oretal.,subcutaneousofatumumabinpatientswithrelapsing–remittingmultiple
sclerosis,2016(manuscriptinpreparation).
18.vonbudingenetal.,bcellexchangeacrosstheblood-brainbarrierinmultiplesclerosis,thejournalofclinicalinvestigation2012;122(12):4533-43.
19.bleekeretal.,estimationofdoserequirementsforsustainedinvivoactivityofatherapeutichumananti-cd20antibody,britishjournalofhaematology2008(epubnovember27,2007);140(3):303-12.
20.lublinetal.,definingtheclinicalcourseofmultiplesclerosis,neurology2014;83:278-286.
21.sormanietal.,magneticresonanceimagingasapotentialsurrogateforrelapsesinmultiplesclerosis:ametaanalyticapproach,annneurol.2009;65(3):268-75.
22.sormanietal.,mrilesionsasasurrogateforrelapsesinmultiplesclerosis:ameta-analysisofrandomisedtrials,lancetneurol2013;12:669-676.
- 还没有人留言评论。精彩留言会获得点赞!