嗅觉受体共同受体的制作方法
本发明涉及一种嗅觉受体共同受体。另外,本发明涉及编码嗅觉受体共同受体的多核苷酸、导入有该多核苷酸的表达质粒、以及导入有该表达质粒的细胞。
背景技术:
近年来,已知有测定挥发性化学物质(有气味物质)的各种技术。这种技术有望应用于癌症诊断等诊断、保健领域、人体搜索、麻醉品等的检测等防灾、安全领域、有害物质的检测等环境领域等。
在有气味物质的检测中有时利用狗、线虫等生物。然而,利用生物的方法虽然可以高灵敏度地检测有气味物质,然而由于随着身体状态、个体不同而有波动,因此缺乏稳定性,另外,由于在集中力的持续时间方面有极限,因此还有难以长时间利用的一面。
由此,关注的并非生物本身,而是生物所具备的嗅觉功能。特别是昆虫的嗅觉功能被认为对有气味物质的识别特异性高,正在摸索在嗅觉传感器等中的利用。在昆虫的嗅觉器官中,存在有识别有气味物质的嗅觉受体(odorantreceptor、以下有时也称作“or”。)与嗅觉受体共同受体(odorantreceptorco-receptor、以下有时也称作“orco”或“共同受体”。)所形成的嗅觉受体复合体,当被有气味物质活化时,上述复合体即显示出离子通道活性,由此检测出有气味物质(u.benjaminkaupp,naturereviewsneuroscience,vol11(2010),p188-200)。
技术实现要素:
发明所要解决的问题
然而,在意图现场检测出有气味物质的情况下,有时其浓度非常低。因此,要求用于检测有气味物质的嗅觉传感器的灵敏度高。
本发明是鉴于上述情况而完成的,其目的在于,提供一种嗅觉受体共同受体,其在与嗅觉受体结合而形成嗅觉受体复合体时,对有气味物质发挥优异的检测灵敏度。
用于解决问题的方法
本发明人等研究了将不同种的两种昆虫的嗅觉受体共同受体重组而得的嵌合嗅觉受体共同受体,结果发现,在上述两种嗅觉受体共同受体的重组位置为嗅觉受体共同受体的第四跨膜结构域的羧基末端侧最远的氨基酸残基附近的情况下,具有所得的嵌合嗅觉受体共同受体的嗅觉受体复合体与具有原来的(最初的)嗅觉受体共同受体的嗅觉受体复合体相比,对有气味物质的检测灵敏度优异。本发明是基于这些见解的发明。
即,本发明例如涉及以下的[1]~[17]。
[1]一种嗅觉受体共同受体,其具有以下的第一氨基酸序列、和接在第一氨基酸序列的羧基末端侧最远的氨基酸残基之后的以下的第二氨基酸序列:
(1)第一氨基酸序列,是第一昆虫的嗅觉受体共同受体或其变体的部分氨基酸序列,并且所述第一氨基酸序列为从第一昆虫的嗅觉受体共同受体或其变体的氨基末端开始直至位于第四跨膜结构域的羧基末端侧最远的氨基酸残基的前后20个氨基酸残基的范围中的任意一个氨基酸残基为止的连续氨基酸序列;以及
(2)第二氨基酸序列,是与第一昆虫不同种的第二昆虫的嗅觉受体共同受体或其变体的部分氨基酸序列,在对第一昆虫的嗅觉受体共同受体或其变体的氨基酸序列和第二昆虫的嗅觉受体共同受体或其变体的氨基酸序列进行比对分析的情况下,所述第二氨基酸序列是在第二昆虫的嗅觉受体共同受体或其变体中从相当于第一氨基酸序列的羧基末端侧最远的氨基酸残基的位置的一个羧基末端侧的氨基酸残基开始直至第二昆虫的嗅觉受体共同受体或其变体的羧基末端为止的连续氨基酸序列。
[2]根据[1]中记载的嗅觉受体共同受体,其中,第一昆虫及第二昆虫为选自内翅总目昆虫中的不同种的昆虫。
[3]根据[1]或[2]中记载的嗅觉受体共同受体,其中,第一昆虫及第二昆虫为选自双翅目昆虫、鳞翅目昆虫及膜翅目昆虫中的不同种的昆虫。
[4]根据[1]~[3]中任一项记载的嗅觉受体共同受体,其中,第一昆虫及第二昆虫为选自蚊科昆虫、果蝇科昆虫、蚕蛾科昆虫及蜜蜂科昆虫中的不同种的昆虫。
[5]根据[1]~[4]中任一项记载的嗅觉受体共同受体,其中,第一昆虫为埃及伊蚊(aedesaegypti)、冈比亚按蚊(anophelesgambiae)、或黑尾果蝇(drosophilamelanogaster)的任意一种昆虫。
[6]根据[1]~[5]中任一项记载的嗅觉受体共同受体,其中,第一氨基酸序列为与序列号1、135或136中任一项记载的氨基酸序列具有90%以上的同源性的氨基酸序列。
[7]根据[1]~[6]中任一项记载的嗅觉受体共同受体,其中,第二昆虫为埃及伊蚊或西洋蜜蜂(apismellifera)的任意一种昆虫。
[8]根据[1]~[7]中任一项记载的嗅觉受体共同受体,其中,第二氨基酸序列为与序列号2或137中记载的氨基酸序列具有90%以上的同源性的氨基酸序列。
[9]根据[1]~[4]中任一项记载的嗅觉受体共同受体,其中,第一昆虫为黑尾果蝇,第二昆虫为西洋蜜蜂。
[10]根据[9]中记载的嗅觉受体共同受体,其具有与序列号100中记载的氨基酸序列具有90%以上的同源性的氨基酸序列。
[11]根据[1]~[4]中任一项记载的嗅觉受体共同受体,其中,第一昆虫为黑尾果蝇,第二昆虫为埃及伊蚊。
[12]根据[11]中记载的嗅觉受体共同受体,其具有与序列号71中记载的氨基酸序列具有90%以上的同源性的氨基酸序列。
[13]根据[1]~[4]中任一项记载的嗅觉受体共同受体,其中,第一昆虫为埃及伊蚊,第二昆虫为西洋蜜蜂。
[14]根据[13]中记载的嗅觉受体共同受体,其具有与序列号108中记载的氨基酸序列具有90%以上的同源性的氨基酸序列。
[15]一种多核苷酸,其编码[1]~[14]中任一项记载的嗅觉受体共同受体。
[16]一种表达质粒,其导入有[15]中记载的多核苷酸。
[17]一种细胞,其导入有[15]中记载的多核苷酸或[16]中记载的表达质粒。
发明效果
根据本发明,可以提供一种嵌合嗅觉受体共同受体,其在与嗅觉受体结合而形成嗅觉受体复合体时,对有气味物质发挥优异的检测灵敏度。具有本发明的嵌合嗅觉受体共同受体的嗅觉受体复合体与分别具有该嵌合嗅觉受体共同受体的原来的两种嗅觉受体共同受体的嗅觉受体复合体相比,对有气味物质的检测灵敏度更优异。另外,本发明提供编码本发明的嵌合嗅觉受体共同受体的多核苷酸、导入有该多核苷酸的表达质粒、以及导入有该多核苷酸或该表达质粒的细胞。
附图说明
图1表示向作为嗅觉受体表达aaor8、作为共同受体表达aaorco、dmorco、或重组位置不同的各种嵌合共同受体(dm-aaorco)的任意一种的细胞添加1-辛烯-3-醇时的发光量的相对值。
图2表示向作为嗅觉受体表达aaor8、作为共同受体表达amorco、dmorco、或重组位置不同的各种嵌合共同受体(dm-amorco)的任意一种的细胞添加1-辛烯-3-醇时的发光量的相对值。
图3表示向作为嗅觉受体表达aaor8、作为共同受体表达aaorco、dmorco、或各种嵌合共同受体(dm-aaorco)的任意一种的细胞添加1-辛烯-3-醇时的发光量的相对值。
图4表示向作为嗅觉受体表达aaor8、作为共同受体表达aaorco、dmorco、或各种嵌合共同受体(dm-aaorco)的任意一种的细胞添加1-辛烯-3-醇时的发光量的相对值。
图5表示向作为嗅觉受体表达aaor8、作为共同受体表达aaorco、dmorco、dm(nt-tm4)aaorco、或重组跨膜结构域或细胞内区域及细胞外区域而得的各种嵌合共同受体(dm-aaorco)的任意一种的细胞添加1-辛烯-3-醇时的发光量的相对值。
图6表示向作为嗅觉受体表达dmor47a、作为共同受体表达dmorco、amorco、或dm(nt-tm4)amorco的任意一种的细胞添加乙酸戊酯时的发光量的相对值。
图7表示向作为嗅觉受体表达aaor8、作为共同受体表达aaorco、amorco、或aa(nt-tm4)amorco的任意一种的细胞添加1-辛烯-3-醇时的发光量的相对值。
图8表示向作为嗅觉受体表达aaor8、作为共同受体表达agorco、amorco、或ag(nt-tm4)amorco的任意一种的细胞添加1-辛烯-3-醇时的发光量的相对值。
图9表示向作为嗅觉受体表达bmor56、作为共同受体表达bmorco、或dm(nt-tm4)amorco的任意一种的细胞添加顺式茉莉酮时的发光量的相对值。
具体实施方式
以下,对用于实施本发明的方式(以下称作“本实施方式”。)进行详细说明。需要说明的是,本发明并不限定于以下的实施方式。
昆虫的嗅觉受体是具有七次跨膜结构的g蛋白偶联受体的一种,其对有气味物质的识别特异性高。已知有几种有气味物质特异性的嗅觉受体。
昆虫的嗅觉受体共同受体虽然是与嗅觉受体相同地具有七次跨膜结构的膜蛋白,然而其自身不识别有气味物质,与嗅觉受体形成杂合物(ヘテロ複合体)而发挥作用。上述嗅觉受体共同受体在所有昆虫中保守,作为orco家族为人所知。orco家族的嗅觉受体共同受体的大多数从其氨基末端(以下有时也称作“n末端”。)朝向羧基末端(以下有时也称作“c末端”。)依次连结n末端区域(nt)、第一跨膜结构域(tm1)、第一细胞外环(ec1)、第二跨膜结构域(tm2)、第一细胞内环(ic1)、第三跨膜结构域(tm3)、第二细胞外环(ec2)、第四跨膜结构域(tm4)、第二细胞内环(ic2)、第五跨膜结构域(tm5)、第三细胞外环(ec3)、第六跨膜结构域(tm6)、第三细胞内环(ic3)、第七跨膜结构域(tm7)、以及c末端区域(ct)而构成。
作为由上述嗅觉受体和上述嗅觉受体共同受体构成的杂合物的嗅觉受体复合体具备由有气味物质活化的离子通道活性,一旦被活化,则使钠离子(na+)、钙离子(ca2+)等阳离子流入细胞内。
本实施方式的嗅觉受体共同受体从其n末端起依次具有作为第一昆虫的嗅觉受体共同受体或其变体的部分氨基酸序列的第一氨基酸序列、和作为与第一昆虫不同种的第二昆虫的嗅觉受体共同受体或其变体的部分氨基酸序列的第二氨基酸序列。即,本实施方式的嗅觉受体共同受体具有第一氨基酸序列、和接在第一氨基酸序列的c末端侧最远的氨基酸残基之后的第二氨基酸序列。
本说明书中所谓“变体”,是指与成为对象的蛋白质相比虽然维持了作为共同受体的功能、然而在其氨基酸序列中有数个氨基酸残基不同的蛋白质,具体而言,可以有1~10个氨基酸残基不同,也可以有1~5个不同,还可以有1个或2个不同。该氨基酸残基的差异具体而言为缺失、取代、添加等氨基酸差异。在这些差异中包括因共同受体所来源的生物的种类差别、个体差别等而天然产生的基因突变、因人为导入的基因突变等而产生的氨基酸的缺失、取代、添加等。作为氨基酸的取代,例如可以举出取代为疏水性、电荷、pk、立体结构上的特征等类似的氨基酸的保守性取代。
第一昆虫及第二昆虫是彼此不同种的昆虫。第一昆虫及第二昆虫可以是内翅总目昆虫。作为内翅总目昆虫,例如可以举出蚊科、果蝇科等双翅目、蚕蛾科等鳞翅目、或蜜蜂科等膜翅目。第一昆虫及第二昆虫也可以是选自双翅目昆虫、鳞翅目昆虫及膜翅目昆虫中的不同种的昆虫。作为蚊科的昆虫,例如可以举出冈比亚按蚊(anophelesgambiae)、埃及伊蚊(aedesaegypti)、致倦库蚊(culexquinquefasciatus)等。作为果蝇科的昆虫,例如可以举出黑尾果蝇(drosophilamelanogaster)、拟暗果蝇(drosophilapseudoobscura)、黑果蝇(drosophilavirillis)等。作为蚕蛾科的昆虫,例如可以举出蚕蛾(bombyxmori)、野桑蚕(bombyxmandarina)、三角斑褐蚕蛾(trilochavarians)等。作为蜜蜂科的昆虫,例如可以举出西洋蜜蜂(apismellifera)、小蜜蜂(apisflorea)、大蜜蜂(apisdorsata)、西洋熊蜂(bombusterrestris)等。
作为第一昆虫,优选埃及伊蚊、冈比亚按蚊或黑尾果蝇。作为第二昆虫,优选埃及伊蚊或西洋蜜蜂。第一昆虫及第二昆虫只要是彼此不同种的昆虫,则可以任意组合。作为第一昆虫及第二昆虫的具体的组合,例如可以是第一昆虫为黑尾果蝇、第二昆虫为西洋蜜蜂的组合,也可以是第一昆虫为黑尾果蝇、第二昆虫为埃及伊蚊的组合,还可以是第一昆虫为埃及伊蚊、第二昆虫为西洋蜜蜂的组合。
在本实施方式的嗅觉受体共同受体中,第一氨基酸序列是从第一昆虫的嗅觉受体共同受体或其变体的n末端开始直至位于第四跨膜结构域的c末端侧最远的氨基酸残基的前后20个氨基酸残基的范围中的任意一个氨基酸残基为止的连续氨基酸序列。即,第一氨基酸序列是从第一昆虫的嗅觉受体共同受体或其变体的n末端区域(nt)经过第一跨膜结构域(tm1)、第一细胞外环(ec1)、第二跨膜结构域(tm2)、第一细胞内环(ic1)、第三跨膜结构域(tm3)及第二细胞外环(ec2)直至位于第四跨膜结构域(tm4)的c末端侧最远的氨基酸残基的前后20个氨基酸残基的范围的任意一个氨基酸残基的氨基酸序列。第一氨基酸序列的c末端侧最远的氨基酸残基可以是第一昆虫的嗅觉受体共同受体或其变体的位于第四跨膜结构域的c末端侧最远的氨基酸残基的前后20个氨基酸残基的范围的任意一个氨基酸残基,也可以是位于第四跨膜结构域的c末端侧最远的氨基酸残基的前后15个氨基酸残基的范围的任意一个氨基酸残基,也可以是位于第四跨膜结构域的c末端侧最远的氨基酸残基的前后10个氨基酸残基的范围的任意一个氨基酸残基,也可以是位于第四跨膜结构域的c末端侧最远的氨基酸残基的前后5个氨基酸残基的范围的任意一个氨基酸残基,也可以是第四跨膜结构域的c末端侧最远的氨基酸残基。
第一氨基酸序列例如可以是与黑尾果蝇的嗅觉受体共同受体的从n末端区域的n末端氨基酸残基连续至第四跨膜结构域的c末端侧最远的氨基酸残基的氨基酸序列(序列号1)具有90%以上的同源性的氨基酸序列,也可以是具有95%以上的同源性的氨基酸序列,也可以是具有98%以上的同源性的氨基酸序列,也可以是具有99%以上的同源性的氨基酸序列,也可以是100%同源。
第一氨基酸序列例如可以是与埃及伊蚊的嗅觉受体共同受体的从n末端区域的n末端氨基酸残基连续至第四跨膜结构域的c末端侧最远的氨基酸残基的氨基酸序列(序列号135)具有90%以上的同源性的氨基酸序列,也可以是具有95%以上的同源性的氨基酸序列,也可以是具有98%以上的同源性的氨基酸序列,也可以是具有99%以上的同源性的氨基酸序列,也可以是100%同源。
第一氨基酸序列例如可以是与冈比亚按蚊的嗅觉受体共同受体的从n末端区域的n末端氨基酸残基连续至第四跨膜结构域的c末端侧最远的氨基酸残基的氨基酸序列(序列号136)具有90%以上的同源性的氨基酸序列,也可以是具有95%以上的同源性的氨基酸序列,也可以是具有98%以上的同源性的氨基酸序列,也可以是具有99%以上的同源性的氨基酸序列,也可以是100%同源。
本实施方式的嗅觉受体共同受体中,第二氨基酸序列在对第一昆虫的嗅觉受体共同受体或其变体的氨基酸序列与第二昆虫的嗅觉受体共同受体或其变体的氨基酸序列进行比对分析的情况下,可以是在第二昆虫的嗅觉受体共同受体或其变体中从相当于第一氨基酸序列的c末端侧最远的氨基酸残基的位置的一个c末端侧的氨基酸残基连续至第二昆虫的嗅觉受体共同受体或其变体的c末端的氨基酸序列。第二氨基酸序列例如是从第二昆虫的嗅觉受体共同受体或其变体的位于第二细胞内环(ic2)的n末端侧最远的氨基酸残基的前后约20个氨基酸残基的范围的任意一个氨基酸残基开始、经过第五跨膜结构域(tm5)、第三细胞外环(ec3)、第六跨膜结构域(tm6)、第三细胞内环(ic3)、第七跨膜结构域(tm7)直至c末端区域(ct)的氨基酸序列。
即,具有第一氨基酸序列和第二氨基酸序列的本实施方式的嗅觉受体共同受体是将第一昆虫的嗅觉受体共同受体中对应于第二氨基酸序列的位置的氨基酸序列替换为第二昆虫的嗅觉受体共同受体的氨基酸序列的嗅觉受体共同受体。在第一氨基酸序列与第二氨基酸序列之间,在原来的两种嗅觉受体共同受体的氨基酸序列的比对中相应的位置的氨基酸残基中不存在重复或缺失。
第二氨基酸序列例如可以是与西洋蜜蜂的嗅觉受体共同受体的从第二细胞内环的n末端侧最远的氨基酸残基连续至c末端区域的c末端氨基酸残基的氨基酸序列(序列号2)具有90%以上的同源性的氨基酸序列,也可以是具有95%以上的同源性的氨基酸序列,也可以是具有98%以上的同源性的氨基酸序列,也可以是具有99%以上的同源性的氨基酸序列,也可以是100%同源。
第二氨基酸序列例如可以是与埃及伊蚊的嗅觉受体共同受体的从第二细胞内环的n末端侧最远的氨基酸残基连续至c末端区域的c末端氨基酸残基的氨基酸序列(序列号137)具有90%以上的同源性的氨基酸序列,也可以是具有95%以上的同源性的氨基酸序列,也可以是具有98%以上的同源性的氨基酸序列,也可以是具有99%以上的同源性的氨基酸序列,也可以是100%同源。
本实施方式的嵌合嗅觉受体共同受体具有第一氨基酸序列和第二氨基酸序列,包含约460个到约500个氨基酸残基。本实施方式的嵌合嗅觉受体共同受体从其n末端朝向c末端依次连结n末端区域(nt)、第一跨膜结构域(tm1)、第一细胞外环(ec1)、第二跨膜结构域(tm2)、第一细胞内环(ic1)、第三跨膜结构域(tm3)、第二细胞外环(ec2)、第四跨膜结构域(tm4)、第二细胞内环(ic2)、第五跨膜结构域(tm5)、第三细胞外环(ec3)、第六跨膜结构域(tm6)、第三细胞内环(ic3)、第七跨膜结构域(tm7)、以及c末端区域(ct)而构成。
本实施方式的嵌合嗅觉受体共同受体具有与昆虫嗅觉受体相伴地使阳离子流入细胞内的能力。嗅觉受体共同受体与嗅觉受体相伴地使阳离子流入细胞内的能力例如可以使用共表达测定对象的嗅觉受体共同受体和昆虫嗅觉受体的培养细胞来测定。具体而言,使上述嗅觉受体的配体(リガンド)接触上述培养细胞,测定细胞内钙浓度的一过性的变化。若测定对象的嗅觉受体共同受体具有上述能力,则可以检测出由嗅觉受体的活化引起的细胞内钙浓度的升高。
作为本实施方式的嵌合嗅觉受体共同受体的更具体的例子,可以举出:
第一氨基酸序列为黑尾果蝇共同受体的部分氨基酸序列、第二氨基酸序列为西洋蜜蜂共同受体的部分氨基酸序列的嗅觉受体共同受体;
具有与序列号100中记载的氨基酸序列具有90%以上的同源性的氨基酸序列的嗅觉受体共同受体;
第一氨基酸序列为黑尾果蝇共同受体的部分氨基酸序列、第二氨基酸序列为埃及伊蚊共同受体的部分氨基酸序列的上述嗅觉受体共同受体;
具有与序列号71中记载的氨基酸序列具有90%以上的同源性的氨基酸序列的嗅觉受体共同受体;
第一氨基酸序列为埃及伊蚊共同受体的部分氨基酸序列、第二氨基酸序列为西洋蜜蜂共同受体的部分氨基酸序列的上述嗅觉受体共同受体;以及
具有与序列号108中记载的氨基酸序列具有90%以上的同源性的氨基酸序列的嗅觉受体共同受体。
此处,作为“90%以上的同源性”,可以举出90%、95%、98%、或99%以上的同源性、或100%的同源性。
本实施方式的嗅觉受体共同受体可以利用如下的方法等来制备,即,将编码具有第一氨基酸序列的多肽的多核苷酸、和编码具有第二氨基酸序列的多肽的多核苷酸以阅读框配合地连接它们的方式导入一个表达用质粒,将该表达用质粒导入细胞并表达作为目标的蛋白质后,对所表达的蛋白质进行纯化。在细胞中表达嗅觉受体共同受体的方法没有特别限定,可以使用公知的方法。将编码具有第一氨基酸序列的多肽的多核苷酸、和编码具有第二氨基酸序列的多肽的多核苷酸导入一个表达用质粒时的dna片段的比率(摩尔比率)优选为1:1。对于表达质粒是否被导入细胞,可以利用pcr等方法来确认。在细胞中表达出的嗅觉受体共同受体可以通过在使细胞膜可溶化后、对其使用各种纯化用色谱柱来纯化。
根据本实施方式的嵌合嗅觉受体共同受体,与原来的两种嗅觉受体共同受体相比,在与嗅觉受体结合而形成嗅觉受体复合体时,对有气味物质的检测灵敏度优异。具有这种特性的嗅觉受体共同受体作为可以检测更低浓度的有气味物质的嗅觉传感器而言有用。
在将本实施方式的嗅觉受体共同受体与嗅觉受体一起使用来制备嗅觉受体复合体的情况下,嗅觉受体的种类可以根据作为目标的配体来适当地选择。嗅觉受体具体而言可以是埃及伊蚊(aedesaegypti)的or8、或or10、冈比亚按蚊(anophelesgambiae)的or10、或or28、蚕蛾(bombyxmori)的or56、或黑尾果蝇(drosophilamelanogaster)的or47a。
本实施方式的多核苷酸编码上述嵌合嗅觉受体共同受体。本实施方式的多核苷酸具有编码第一氨基酸序列的第一碱基序列、和编码第二氨基酸序列的第二碱基序列。本实施方式的多核苷酸可以利用使具有第一碱基序列的多核苷酸与具有第二碱基序列的多核苷酸结合的方法等来制备。使多核苷酸之间结合的方法没有特别限定,可以使用公知的方法,例如,可以与表达用质粒一起使用in-fusionhd克隆试剂盒(takara公司制)等。该情况下,本实施方式的多核苷酸可以在被导入质粒的状态下获得。表达用质粒没有特别限定,例如可以使用pcdna3.1等。
本实施方式的细胞被导入有上述本实施方式的多核苷酸或导入有该多核苷酸的表达质粒,可以表达上述嗅觉受体共同受体。本实施方式的细胞可以通过将上述本实施方式的多核苷酸或表达质粒导入细胞来制备。作为细胞,可以根据所要导入的表达质粒的种类来适当地选择。作为细胞,例如可以举出埃希氏大肠杆菌k12等大肠杆菌、枯草芽孢杆菌mi114等芽孢杆菌属细菌、酿酒酵母ah22等酵母、草地夜蛾来源的sf细胞系或粉纹夜蛾来源的highfive细胞系等昆虫细胞、cos7细胞等动物细胞等。作为动物细胞,优选举出哺乳动物来源的培养细胞,具体而言,可以举出cos7细胞、cho细胞、hek293细胞、hek293ft细胞、hela细胞、pc12细胞、n1e-115细胞、sh-sy5y细胞等。
[实施例]
以下,基于实施例对本发明进行具体的说明。但是,本发明并不限定于以下的实施例。
本实施例中记载的昆虫如下所示。
冈比亚按蚊(anophelesgambiae:以下有时也称作“按蚊”或“ag”。);
埃及伊蚊(aedesaegypti:以下有时也称作“伊蚊”或“aa”。);
黑尾果蝇(drosophilamelanogaster:以下有时也称作“果蝇”或“dm”。);
西洋蜜蜂(apismellifera:以下有时也称作“蜜蜂”或“am”。);
蚕蛾(bombyxmori:以下有时也称作“蚕”或“bm”。)。
<共同受体的表达质粒的制作>
果蝇共同受体(以下有时也称作“dmorco”。)的表达质粒
使用果蝇(drosophilamelanogaster)成虫rna(takara公司制)作为模板,添加superscriptiii逆转录酶(invitrogen公司制),在55℃保温50分钟,然后在75℃保温15分钟,由此进行逆转录反应,得到cdna。使用所得的cdna1μl作为模板,使用10μm的正向引物dmorco-5’(5’-caccatgacaacctcgatgcagccgagcaagt;序列号3)1μl、10μm的反向引物dmorco-3’(5’-ttacttgagctgcaccagcaccataaagt;序列号4)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在68℃进行1.5分钟,反复进行35个循环的(2)~(3)的工序。对所得的pcr产物进行琼脂糖凝胶电泳后,回收在该凝胶上检测出的约1.5kb的dna。将所回收到的dna导入pentr/d-topo载体(invitrogen公司制),得到命名为pentr-dmorco的质粒。将4μl的pentr-dmorco、1μl的pcdna6.2v5-dest及2μl的lr克隆酶ii(invitrogen公司制)混合并在室温保持1小时。将所得的混合物导入大肠杆菌中进行培养,由此得到命名为pcdna6.2-dmorco的表达质粒。对表达质粒pcdna6.2-dmorco的碱基序列利用dna测序仪进行分析,结果判明,该质粒含有以序列号5表示的碱基序列。以序列号5表示的碱基序列编码以序列号6表示的氨基酸序列。
伊蚊共同受体(以下有时也称作“aaorco”。)的表达质粒
利用液氮使埃及伊蚊(aedesaegypti)的头部冻结后,加入trizol(invitrogen公司制)在液氮存在下使用乳钵和乳槌进行破碎。从所得的破碎物中,依照trizol试剂中附带的说明书提取rna。对所提取的rna使用rna纯化试剂盒(rneasyminikit;qiagen公司制)依照该试剂盒中附带的说明书进行纯化。以所得的总rna作为模板,添加superscriptiii逆转录酶(invitrogen公司制),在55℃保温50分钟,然后在75℃保温15分钟,由此进行逆转录反应,得到cdna。使用所得的cdna1μl作为模板,使用10μm的正向引物aaorco-5’(5’-tggaattctgcagatcaccatgaacgtccaaccgacaaagtacc;序列号7)1μl、10μm的反向引物aaorco-3’(5’-gccactgtgctggatttatttcaactgcaccaacacc;序列号8)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将所得的pcr产物使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结后,导入大肠杆菌中进行培养,由此得到命名为pcdna3.1-aaorco的表达质粒。对表达质粒pcdna3.1-aaorco的碱基序列利用dna测序仪进行分析,结果判明,该质粒含有以序列号9表示的碱基序列。以序列号9表示的碱基序列编码以序列号10表示的氨基酸序列。
蜜蜂共同受体(以下有时也称作“amorco”。)的表达质粒
合成出在任意一方的dna链中具有以序列号11表示的碱基序列的双链dna。使用所得的dna100ng作为模板,使用10μm的正向引物amorco-5’(5’-tggaattctgcagatcaccatgaagttcaagcaacaagggctaa;序列号12)1μl、10μm的反向引物amorco-3’(5’-gccactgtgctggattcacttcagttgcaccaacaccatgaa;序列号13)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将所得的pcr产物使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结后,导入大肠杆菌中进行培养,由此得到命名为pcdna3.1-amorco的表达质粒。对表达质粒pcdna3.1-amorco的碱基序列利用dna测序仪进行分析,结果判明,该质粒含有以序列号11表示的碱基序列。以序列号11表示的碱基序列编码以序列号14表示的氨基酸序列。
按蚊共同受体(以下有时也称作“agorco”。)的表达质粒
用液氮使冈比亚按蚊(anophelesgambiae)kisum系统或g3系统的头部冻结后,加入trizol(invitrogen公司制)在液氮存在下使用乳钵和乳槌进行破碎。从所得的破碎物中,依照trizol试剂中附带的说明书提取rna。对所提取出的rna使用rna纯化试剂盒(rneasyminikit;qiagen公司制)依照该试剂盒中附带的说明书进行纯化。以所得的总rna为模板,添加superscriptiii逆转录酶(invitrogen公司制),在55℃保温50分钟,然后在75℃保温15分钟,由此进行逆转录反应,得到cdna。使用所得的cdna1μl作为模板,使用10μm的正向引物agorco-5’(5’-caccatgcaagtccagccgaccaagtacgtcggcct;序列号15)1μl、10μm的反向引物agorco-3’(5’-ttacttcagctgcaccagcaccatgaagt;序列号16)1μl及kodplusdna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行5分钟,(2)在98℃进行10秒,(3)在60℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。对所得的pcr产物进行琼脂糖凝胶电泳后,回收在该凝胶上检测出的约1.4kb的dna。将所回收到的dna导入pentr/d-topo载体(invitrogen公司制),得到命名为pentr-agorco的质粒。将4μl的pentr-agorco、1μl的pcdna6.2v5-dest及2μl的lr克隆酶ii(invitrogen公司制)混合并在室温保持1小时。将所得的混合物导入大肠杆菌中进行培养,由此得到命名为pcdna6.2-agorco的表达质粒。对表达质粒pcdna6.2-agorco的碱基序列利用dna测序仪进行分析,结果判明,该质粒含有以序列号17表示的碱基序列。以序列号17表示的碱基序列编码以序列号18表示的氨基酸序列。
果蝇共同受体与伊蚊共同受体的嵌合共同受体的表达质粒
使用上述的dmorco的表达质粒100ng作为模板,使用10μm的正向引物1μl、10μm的反向引物1μl、和kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将正向引物与反向引物的组合及所得的pcr产物表示于表1中。
另外,使用上述的aaorco的表达质粒1μl(100ng)作为模板,使用10μm的正向引物1μl、10μm的反向引物1μl、和kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将正向引物与反向引物的组合及所得的pcr产物表示于表2中。
将表1中记载的pcr产物的一种与表2中记载的pcr产物的一种以表3所示的组合使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到来源于果蝇共同受体及伊蚊共同受体的各种嵌合共同受体的表达质粒。对所得的嵌合受体表达质粒的碱基序列利用dna测序仪进行分析,结果判明,各质粒分别含有以序列号59~68表示的碱基序列的任意一个。以序列号59~68表示的碱基序列分别编码以序列号69~78表示的氨基酸序列。将上述嵌合受体表达质粒的制作中所用的pcr产物的组合、和嵌合共同受体编码区域的碱基序列的序列号及嵌合共同受体的氨基酸序列的序列号表示于表3中。
将由所得的表达质粒编码的嵌合共同受体的氨基酸序列的构成表示如下。
dm(nt-ec1)aaorco中,从n末端区域(nt)直至第一细胞外环(ec1)的氨基酸序列为果蝇共同受体来源,从第二跨膜结构域直至c末端区域的氨基酸序列为伊蚊共同受体来源。
dm(nt-tm3)aaorco中,从n末端区域(nt)直至第三跨膜结构域(tm3)的氨基酸序列为果蝇共同受体来源,从第二细胞外环直至c末端区域的氨基酸序列为伊蚊共同受体来源。
dm(nt-tm4)aaorco中,从n末端区域(nt)直至第四跨膜结构域(tm4)的氨基酸序列(从其n末端氨基酸残基直至第234个氨基酸残基的氨基酸序列)为果蝇共同受体来源(dm(nt-tm4)、序列号1),从第二细胞内环直至c末端区域的氨基酸序列为伊蚊共同受体来源(aa(ic2-ct)、序列号137)。
dm(nt-tm5)aaorco中,从n末端区域(nt)直至第五跨膜结构域(tm5)的氨基酸序列为果蝇共同受体来源,从第三细胞外环直至c末端区域的氨基酸序列为伊蚊共同受体来源。
dm(nt-tm6)aaorco中,从n末端区域(nt)直至第六跨膜结构域(tm6)的氨基酸序列为果蝇共同受体来源,从第三细胞内环直至c末端区域的氨基酸序列为伊蚊共同受体来源。
dm(nt-792)aaorco中,从其n末端氨基酸残基直至第264个氨基酸残基的氨基酸序列为果蝇共同受体来源,从第265个氨基酸残基直至c末端氨基酸残基的氨基酸序列为伊蚊共同受体来源。
dm(nt-879)aaorco中,从其n末端氨基酸残基直至第293个氨基酸残基的氨基酸序列为果蝇共同受体来源,从第294个氨基酸残基直至c末端氨基酸残基的氨基酸序列为伊蚊共同受体来源。
dm(nt-969)aaorco中,从其n末端氨基酸残基直至第323个氨基酸残基的氨基酸序列为果蝇共同受体来源,从第324个氨基酸残基直至c末端氨基酸残基的氨基酸序列为伊蚊共同受体来源。
dm(nt-1080)aaorco中,从其n末端氨基酸残基直至第360个氨基酸残基的氨基酸序列为果蝇共同受体来源,从第361个氨基酸残基直至c末端氨基酸残基的氨基酸序列为伊蚊共同受体来源。
dm(nt-636)aaorco中,从其n末端氨基酸残基直至第212个氨基酸残基的氨基酸序列为果蝇共同受体来源,从第213个氨基酸残基直至c末端氨基酸残基的氨基酸序列为伊蚊共同受体来源。
[表1]
(nt:n-末端区域、ec:细胞外环、tm:跨膜结构域)
[表2]
(ec:细胞外环、ic:细胞内环、tm:跨膜结构域、ct:c-末端区域)
[表3]
(nt:n-末端区域、ec:细胞外环、tm:跨膜结构域)
跨膜结构域为果蝇共同受体来源、其以外的区域为伊蚊共同受体来源的嵌合共同受体(以下有时也称作“aa(tm1-4dm)aaorco”。)的表达质粒
合成出在任意一方的dna链中具有以序列号79表示的碱基序列的双链dna。使用所得的dna100ng作为模板,使用10μm的正向引物aaorco-5’(5’-tggaattctgcagatcaccatgaacgtccaaccgacaaagtacc;序列号80)1μl、10μm的反向引物dmaaorco(ic2-ct)-3’(5’-gccactgtgctggatttatttcaactgcaccaaca;序列号81)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将所得的pcr产物使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到命名为pcdna3.1-aa(tm1-4dm)aaorco的表达质粒。对所得的表达质粒pcdna3.1-aa(tm1-4dm)aaorco的碱基序列利用dna测序仪进行分析,结果判明,含有以序列号79表示的碱基序列。以序列号79表示的碱基序列编码以序列号82表示的氨基酸序列。由表达质粒pcdna3.1-aa(tm1-4dm)aaorco编码的嵌合共同受体中,第一跨膜结构域、第二跨膜结构域、第三跨膜结构域、以及第四跨膜结构域的氨基酸序列为果蝇共同受体来源,其以外的区域的氨基酸序列为伊蚊共同受体来源。
氨基末端区域、第一细胞外环、第一细胞内环、以及第二细胞外环为果蝇共同受体来源、其以外的区域为伊蚊共同受体来源的嵌合共同受体(以下有时也称作“dm(tm1-4aa)aaorco”。)的表达质粒
合成出在任意一方的dna链中具有以序列号83表示的碱基序列的双链dna。使用所得的dna100ng作为模板,使用10μm的正向引物dmorco(nt-tm4)-5’(5’-tggaattctgcagatcaccatgacaacctcgatgcagccgagcaa;序列号84)1μl、10μm的反向引物dmaaorco(ic2-ct)-3’(5’-gccactgtgctggatttatttcaactgcaccaaca;序列号85)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将所得的pcr产物使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到命名为pcdna3.1-dm(tm1-4aa)aaorco的表达质粒。对所得的表达质粒pcdna3.1-aa(tm1-4dm)aaorco的碱基序列利用dna测序仪进行分析,结果判明,含有以序列号83表示的碱基序列。以序列号83表示的碱基序列编码以序列号86表示的氨基酸序列。由表达质粒pcdna3.1-aa(tm1-4dm)aaorco编码的嵌合共同受体中,氨基末端区域、第一细胞外环、第一细胞内环、以及第二细胞外环的氨基酸序列为果蝇共同受体来源,第一跨膜结构域、第二跨膜结构域、第三跨膜结构域、以及第四跨膜结构域的氨基酸序列为伊蚊共同受体来源,从第二细胞内环直至c末端区域的氨基酸序列为伊蚊共同受体来源。
果蝇共同受体与蜜蜂共同受体的嵌合共同受体的表达质粒
制备出表1所示的pcr产物的dm(nt-tm3)、dm(nt-tm4)、dm(nt-tm5)及dm(nt-tm6)。
使用上述的amorco的表达质粒1μl(100ng)作为模板,使用10μm的正向引物1μl、10μm的反向引物1μl、和kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将正向引物与反向引物的组合及所得的pcr产物表示于表4中。
将上述pcr产物dm(nt-tm3)、dm(nt-tm4)、dm(nt-tm5)或dm(nt-tm6)的一种与表4中记载的pcr产物的一种以表5所示的组合,使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到来源于果蝇共同受体及蜜蜂共同受体的各种嵌合共同受体的表达质粒。对所得的嵌合受体表达质粒的碱基序列利用dna测序仪进行分析,结果判明,各质粒分别含有以序列号95~98表示的碱基序列的任意一个。以序列号95~98表示的碱基序列分别编码以序列号99~102表示的氨基酸序列。将上述嵌合受体表达质粒的制作中所用的pcr产物的组合、和嵌合共同受体编码区域的碱基序列的序列号及嵌合共同受体的氨基酸序列的序列号表示于表5中。
将由所得的表达质粒编码的嵌合共同受体的氨基酸序列的构成表示如下。
dm(nt-tm3)amorco中,从n末端区域(nt)直至第三跨膜结构域(tm3)的氨基酸序列为果蝇共同受体来源,从第二细胞外环直至c末端区域的氨基酸序列为蜜蜂共同受体来源(am(ic2-ct)、序列号2)。
dm(nt-tm4)amorco中,从n末端区域(nt)直至第四跨膜结构域(tm4)的氨基酸序列为果蝇共同受体来源(dm(nt-tm4)、序列号1),从第二细胞内环直至c末端区域的氨基酸序列为蜜蜂共同受体来源。
dm(nt-tm5)amorco中,从n末端区域(nt)直至第五跨膜结构域(tm5)的氨基酸序列为果蝇共同受体来源,从第三细胞外环直至c末端区域的氨基酸序列为蜜蜂共同受体来源。
dm(nt-tm6)amorco中,从n末端区域(nt)直至第六跨膜结构域(tm6)的氨基酸序列为果蝇共同受体来源,从第三细胞内环直至c末端区域的氨基酸序列为蜜蜂共同受体来源。
[表4]
(ec:细胞外环、ic:细胞内环、ct:c-末端)
[表5]
(nt:n-末端区域、tm:跨膜结构域)
伊蚊共同受体与蜜蜂共同受体的嵌合共同受体(以下有时也称作“aa(nt-tm4)amorco”。)的表达质粒
使用上述的aaorco的表达质粒100ng作为模板,使用10μm的正向引物aaorco(nt-tm4)-5’(5’-tggaattctgcagatcaccatgaacgtccaaccgacaaagtacc;序列号103)1μl、10μm的反向引物aaorco(nt-tm4)-3’(5’-caaatgttgcagctgttcgcaagtga;序列号104)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。使用上述的amorco的表达质粒100ng作为模板,使用10μm的正向引物aaamorco(ic2-ct)-5’(5’-cagctgcaacatttgaagaatatcatgaagcctttgatggaa;序列号105)1μl、10μm的反向引物aaamorco(ic2-ct)-3’(5’-gccactgtgctggattcacttcagttgcaccaacaccatgaa;序列号106)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将所得的两种pcr产物使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到命名为pcdna3.1-aaamorco的伊蚊共同受体与蜜蜂共同受体的嵌合共同受体的表达质粒。对所得的表达质粒pcdna3.1-aaamorco的碱基序列利用dna测序仪进行分析,结果判明,含有以序列号107表示的碱基序列。以序列号107表示的碱基序列编码以序列号108表示的氨基酸序列。由表达质粒pcdna3.1-aaamorco编码的嵌合本共同受体中,其从n末端区域(nt)直至第四跨膜结构域(tm4)的氨基酸序列为伊蚊共同受体来源(aa(nt-tm4)、序列号135),从第二细胞内环直至c末端区域的氨基酸序列为蜜蜂共同受体来源(am(ic2-ct)、序列号2)。
按蚊共同受体与蜜蜂共同受体的嵌合共同受体(以下有时也称作“ag(nt-tm4)amorco”。)的表达质粒
使用上述的按蚊共同受体的表达质粒100ng作为模板,使用10μm的正向引物agorco(nt-tm4)-5’(5’-tggaattctgcagatcaccatgcaagtccagccgaccaagtacgt;序列号109)1μl、10μm的反向引物agorco(nt-tm4)-3’(5’-caagtgttgcagctgctcgcaggcta;序列号110)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。使用上述的蜜蜂共同受体的表达质粒100ng作为模板,使用10μm的正向引物agamorco(ic2-ct)-5’(5’-cagctgcaacacttgaagaatatcatgaagcctttgatgg;序列号111)1μl、10μm的反向引物amorco-3’(5’-gccactgtgctggattcacttcagttgcaccaacaccatgaa;序列号112)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将所得的两种pcr产物使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结。将经过连结的dna导入大肠杆菌中进行克隆,由此得到命名为pcdna3.1-agamorco的按蚊共同受体与蜜蜂共同受体的嵌合共同受体的表达质粒。对所得的表达质粒pcdna3.1-agamorco的碱基序列利用dna测序仪进行分析,结果判明,含有以序列号113表示的碱基序列。以序列号113表示的碱基序列编码以序列号114表示的氨基酸序列。由表达质粒pcdna3.1-agamorco编码的嵌合共同受体中,从氨基末端区域(nt)直至第四跨膜结构域(tm4)的氨基酸序列为按蚊共同受体来源(ag(nt-tm4)、序列号136),从第二细胞内环直至c末端区域的碱基序列为蜜蜂共同受体来源(am(ic2-ct)、序列号2)。
<嗅觉受体表达质粒的制作>
伊蚊嗅觉受体or8(以下有时也称作“aaor8”。)的表达质粒
使用利用上述方法制备出的伊蚊头部来源的cdna1μl作为模板,使用10μm的正向引物aaor8-5’(5’-tggaattctgcagatcaccatgggaggtaagttctc;序列号115)1μl、10μm的反向引物aaor8-3’(5’-gccactgtgctggattcacttctgacttggttc;序列号116)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在68℃进行1分钟,反复进行30个循环的(2)~(4)的工序。将所得的pcr产物使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到命名为pcdna3.1-aaor8的表达质粒。对表达质粒pcdna3.1-aaor8的碱基序列利用dna测序仪进行分析,结果判明,含有以序列号117表示的碱基序列。以序列号117表示的碱基序列编码以序列号118表示的氨基酸序列。
果蝇嗅觉受体or47a(以下有时也称作“dmor47a”。)的表达质粒
使用利用上述方法制备出的果蝇成虫来源的cdna1μl作为模板,使用10μl的正向引物dmor47a-5’(5’-caccatggacagttttctgcaagtacagaa;序列号119)1μl、10μm的反向引物dmor47a-3’(5’-ttaggagaatgatctcagcattgtgatgta;序列号120)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在68℃进行1.5分钟,反复进行35个循环的(2)~(3)的工序。对所得的pcr产物进行琼脂糖凝胶电泳后,回收在该凝胶上检测出的约1.2kb的dna。将所回收到的dna导入pentr/d-topo载体(invitrogen公司制),得到命名为pentr-dmor47a的质粒。将4μl的pentr-dmor47a、1μl的pcdna6.2v5-dest及2μl的lr克隆酶ii(invitrogen公司制)混合并在室温保持1小时。将所得的混合物导入大肠杆菌中进行培养,由此得到命名为pcdna6.2-dmor47a的表达质粒。对表达质粒pcdna6.2-dmor47a的碱基序列利用dna测序仪进行分析,结果判明,含有以序列号121表示的碱基序列。以序列号121表示的碱基序列编码以序列号122表示的氨基酸序列。
蚕蛾嗅觉受体or56(以下有时也称作“bmor56”。)的表达质粒
合成出在任意一方的dna链中具有以序列号123表示的碱基序列的双链dna。使用具有以序列号123表示的碱基序列的双链dna100ng作为模板,使用10μm的正向引物bmor56-5’(5’-tggaattctgcagatcaccatgaagctcctggagaagctag;序列号124)1μl、10μm的反向引物bmor56-3’(5’-gccactgtgctggattcatgttttattcatttgcgactgac;序列号125)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在94℃进行2分钟,(2)在98℃进行10秒,(3)在63℃进行30秒,(4)在68℃进行1.5分钟,反复进行35个循环的(2)~(4)的工序。将所得的pcr产物使用in-fusionhd克隆试剂盒(takara公司制)与用ecorv消化了的pcdna3.1(invitrogen公司制)连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到命名为pcdna3.1-bmor56的表达质粒。对表达质粒pcdna3.1-bmor56的碱基序列利用dna测序仪进行分析,结果判明,含有以序列号123表示的碱基序列。以序列号123表示的碱基序列编码以序列号126表示的氨基酸序列。
<水母蛋白(aequorin)表达质粒的制作>
使用将编码aequorin的以序列号127表示的碱基序列克隆到pmd19载体中的质粒(pmd19-aeq)50ng作为模板,使用10μm的正向引物aeq-5’(5’-caccatgacaagcaaacaatactc;序列号128)1μl、10μm的反向引物aeq-3’(5’-ttaggggacagctccaccgtag;序列号129)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在95℃进行3分钟,(2)在95℃进行30秒,(3)在60℃进行30秒,(4)在68℃进行1分钟,反复进行35个循环的(2)~(4)的工序。对所得的pcr产物进行琼脂糖凝胶电泳后,回收在该凝胶上检测出的约600bp的dna。将所回收到的dna导入pentr/d-topo载体(invitrogen公司制),得到命名为pentr-aeq的质粒。以序列号127表示的碱基序列编码以序列号130表示的氨基酸序列。将4μl的pentr-aeq、1μl的pcdna6.2v5-dest及2μl的lr克隆酶ii(invitrogen公司制)混合并在室温保持1小时。将所得的混合物导入大肠杆菌中进行扩增,由此得到命名为pcdna6.2-aeq的质粒。使用质粒pcdna6.2-aeq100ng作为模板,使用10μm的正向引物in-fusionaeq-5’(5’-gtggcggccgctcgaggccaccatgacaagcaaacaatactc;序列号131)1μl、10μm的反向引物in-fusionaeq-3’(5’-gccctctagactcgagttaggggacagctccaccgtag;序列号132)1μl及kodneoplusdna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在95℃进行3分钟,(2)在95℃进行30秒,(3)在60℃进行30秒,(4)在68℃进行1分钟,反复进行35个循环的(2)~(4)的工序。对所得的dna进行琼脂糖凝胶电泳后,回收在该凝胶上检测出的约600bp的dna并将其设为插入dna1。使用以xhoi消化了的pcdna3.1(invitrogen公司制)作为载体,将上述插入dna1使用in-fusionhd克隆试剂盒(takara公司制)与该载体连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到命名为pcdna3.1-aeq的质粒。使用pcdna3.1-aeq100ng作为模板,使用10μm的正向引物in-fusionaeq-5’(5’-gtggcggccgctcgaggccaccatgacaagcaaacaatactc;序列号133)1μl、10μm的反向引物in-fusionaeq-3’(5’-gccctctagactcgagttaggggacagctccaccgtag;序列号134)1μl及kodplusneodna聚合酶(东洋纺制)1μl进行pcr。pcr反应在如下的条件下进行,即,(1)在95℃进行3分钟,(2)在95℃进行30秒,(3)在60℃进行30秒,(4)在68℃进行1分钟,反复进行35个循环的(2)~(4)的工序。对所得的dna进行琼脂糖凝胶电泳后,回收在该凝胶上检测出的约600bp的dna并将其设为插入dna2。使用以xhoi消化了的pcdna3.1(hygro)(invitrogen公司制)作为载体,将上述插入dna2使用in-fusionhd克隆试剂盒(takara公司制)与该载体连结。将经过连结的dna导入大肠杆菌中进行培养,由此得到命名为pcdna3.1(hygro)-aeq的表达质粒。
<表达质粒向细胞中的导入>
在10cm培养皿中以3×106细胞/培养皿接种hek293ft细胞(从invitrogen公司购入),在包含10%fbs的dmem培养基(nacalaitesque公司制)中,在37℃、5%co2条件下培养约24小时。将所制作的任意一种共同受体表达质粒3μg、所制作的任意一种嗅觉受体表达质粒1.5μg、和aequorin表达质粒8μg与12.5μl的plus试剂及31.25μl的脂转染胺ltx(invitrogen公司制)混合,保持30分钟。其后,将该混合液转染到上述细胞中。开始转染4小时后以9×104细胞/孔接种在96孔板中,在包含10%fbs的dmem培养基(nacalaitesque公司制)中,在37℃、5%co2条件下培养约24小时。由此,得到瞬时导入有共同受体表达质粒、嗅觉受体表达质粒及aequorin表达质粒的转化细胞。
<活性测定>
当水母蛋白与钙离子结合时即被活化而将水母水通道蛋白辅因子(coelenterazine)等底物氧化发光。因而,表达水母蛋白的细胞的细胞内钙离子浓度的升高直接作为发光量的增大表现出来,从而可以根据发光量的变化来测定嗅觉受体复合体是否因受检物的添加而作为离子通道发挥作用。
除去上述转化细胞的培养液而置换为包含分析缓冲液(0.5μm水母水通道蛋白辅因子h(promega公司制)及0.3%的bsa的hanks-hepes(20mmph7.4)),再在室温静置4小时。然后,使用flexstation3(moleculardevices公司制),将对应于嗅觉受体的受检物添加到细胞的培养液中,并且测定出细胞的发光量。将作为对照物质添加了二甲亚砜的细胞中的发光量设为1,作为相对值算出添加了受检物的细胞的发光量。
(试验例1)
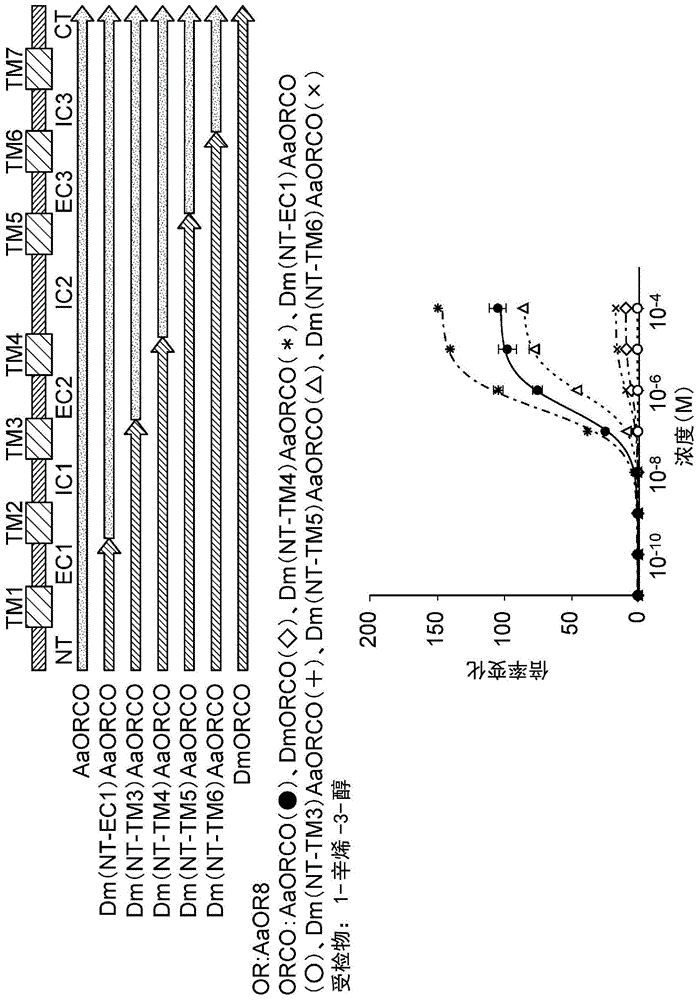
使用导入有嗅觉受体aaor8的表达质粒;共同受体aaorco或dmorco、或重组位置不同的各种嵌合共同受体dm-aaorco[dm(nt-ec1)aaorco、dm(nt-tm3)aaoroc、dm(nt-tm4)aaorco、dm(nt-tm5)aaorco、或dm(nt-tm6)aaorco]的任意一种表达质粒;以及aequorin表达质粒的细胞,如上所述地测定出发光量。使用1-辛烯-3-醇作为受检物,以10-4m、10-5m、10-6m、10-7m、10-8m、10-9m、或10-10m的浓度添加到培养液中。将其结果表示于图1中。对于表达dmorco与aaorco的嵌合共同受体当中的从n末端区域直至第四跨膜结构域的氨基酸序列为果蝇共同受体来源、从第二细胞内环直至c末端区域的氨基酸序列为伊蚊共同受体来源的嵌合共同受体[dm(nt-tm4)aaorco]和嗅觉受体的细胞而言,与表达原来的aaorco或dmorco和嗅觉受体的细胞相比,由1-辛烯-3-醇的添加造成的发光量的增加更大。结果显示,对于表达从n末端区域直至第四跨膜结构域的氨基酸序列为果蝇共同受体来源、从第二细胞内环直至c末端区域的氨基酸序列为伊蚊共同受体来源的嵌合共同受体[dm(nt-tm4)aaorco]和嗅觉受体的细胞而言,与表达原来的aaorco或dmorco的任意一种和嗅觉受体的细胞相比,对1-辛烯-3-醇更强地响应。
(试验例2)
使用导入有嗅觉受体aaor8的表达质粒;共同受体amorco或dmorco、或重组位置不同的各种嵌合共同受体dm-amorco[dm(nt-tm3)amoroc、dm(nt-tm4)amorco、dm(nt-tm5)amorco、或dm(nt-tm6)amorco]的任意一种表达质粒;以及aequorin表达质粒的细胞,如上所述地测定出发光量。使用1-辛烯-3-醇作为受检物,以10-4m、10-5m、10-6m、10-7m、10-8m、10-9m、或10-10m的浓度添加到培养液中。将其结果表示于图2中。在dmorco与amorco的嵌合共同受体中,也与dmorco与aaorco的嵌合共同受体同样,是从n末端区域直至第四跨膜结构域的氨基酸序列为果蝇共同受体来源、从第二细胞内环直至c末端区域的氨基酸序列为蜜蜂共同受体来源的嵌合共同受体[dm(nt-tm4)amorco],对于表达所述嵌合共同受体[dm(nt-tm4)amorco]和嗅觉受体的细胞而言,与表达原来的amorco或dmorco的任意一种和嗅觉受体的细胞相比,由1-辛烯-3-醇的添加造成的发光量的增加更大。试验例1及2的结果显示,要制作在与嗅觉受体结合而形成嗅觉受体复合体时对配体的响应强度大的嵌合共同受体,重要的是在第四跨膜结构域的c末端附近将原来的两种共同受体的氨基酸序列重组。
(试验例3)
使用导入有嗅觉受体aaor8的表达质粒;共同受体aaorco或dmorco、或重组位置不同的各种嵌合共同受体dm-aaorco[dm(nt-tm4)aaorco、dm(nt-792)aaorco、dm(nt-879)aaorco、dm(nt-969)aaorco、dm(nt-1080)aaorco、dm(nt-tm5)aaorco、或dm(nt-636)aaorco]的任意一种表达质粒;以及aequorin表达质粒的细胞,如上所述地测定出发光量。使用1-辛烯-3-醇作为受检物,以10-4m、10-5m、10-6m、10-7m、10-8m、10-9m、或10-10m的浓度添加到培养液中。将其结果表示于图3及4中。表达dm(nt-tm4)aaorco和嗅觉受体的细胞与表达原来的aaorco或dmorco的任意一种和嗅觉受体的细胞相比,对1-辛烯-3-醇的响应强度更高。与之相对,表达dmorco来源的氨基酸序列比dm(nt-tm4)aaorco在c末端侧长30个氨基酸残基的dm(792)aaorco和嗅觉受体的细胞与表达原来的aaorco和嗅觉受体的细胞相比,对1-辛烯-3-醇的响应强度减小。对于表达dmorco来源的氨基酸序列比dm(nt-tm4)aaorco在n末端侧短22个氨基酸残基的dm(nt-636)aaorco和嗅觉受体的细胞也是,与表达原来的aaorco或dmorco的任意一种和嗅觉受体的细胞相比,对1-辛烯-3-醇的响应强度减小。这些结果暗示,在嵌合共同受体中,第一昆虫的orco来源的氨基酸序列优选包含从n末端直至第四跨膜结构域的c末端侧最远的氨基酸残基的前后20个氨基酸残基左右以内的范围的任意一个氨基酸残基。
(试验例4)
使用导入有嗅觉受体aaor8的表达质粒;共同受体aaorco或dmorco、或嵌合共同受体dm(nt-tm4)aaorco、仅将第一至第四跨膜结构域从aaorco重组为dmorco的aa(tm1-4dm)aaorco、或、将n末端区域、第一及第二细胞外区域、第一细胞内区域从aaorco重组为dmorco的dm(tm1-4aa)aaorco的任意一种表达质粒;以及aequorin表达质粒的细胞,如上所述地测定出发光量。使用1-辛烯-3-醇作为受检物,以10-4m、10-5m、10-6m、10-7m、10-8m、10-9m、或10-10m的浓度添加到培养液中。将其结果表示于图5中。其结果是,对于表达仅重组了跨膜结构域、细胞内区域及细胞外区域的嵌合共同受体[aa(tm1-4dm)aaorco或dm(tm1-4aa)aaorco]和嗅觉受体的细胞而言,与表达原来的aaorco或dmorco的任意一种和嗅觉受体的细胞相比,对1-辛烯-3-醇的响应强度减小。结果显示,要制作在与嗅觉受体结合而形成嗅觉受体复合体时对配体的响应强度大的嵌合共同受体,需要从n末端连续至第四跨膜结构域地为同种的orco来源的区域。
(试验例5)
使用导入有嗅觉受体dmor47a的表达质粒;共同受体dmorco或amorco、或嵌合共同受体dm(nt-tm4)amorco的任意一种表达质粒;以及aequorin表达质粒的细胞,如上所述地测定出发光量。使用乙酸戊酯作为受检物,以10-4m、10-4.5m、10-5m、10-5.5、m10-6m、10-6.5m、或10-7m的浓度添加到培养液中。将其结果表示于图6中。结果显示,表达dm(nt-tm4)amorco和嗅觉受体的细胞与表达原来的dmorco或amorco的任意一种和嗅觉受体的细胞相比,对乙酸戊酯更强地响应。
(试验例6)
使用导入有嗅觉受体aaor8的表达质粒;共同受体aaorco或amorco、或嵌合共同受体aa(nt-tm4)amorco的任意一种表达质粒;以及aequorin表达质粒的细胞,如上所述地测定出发光量。使用1-辛烷-3-醇作为受检物,以10-4m、10-5m、10-6m、10-7m、10-8m、10-9m、或10-10m的浓度添加到培养液中。将其结果表示于图7中。结果显示,表达aa(nt-tm4)amorco和嗅觉受体的细胞与表达原来的aaorco或amorco的任意一种和嗅觉受体的细胞相比,对1-辛烷-3-醇更强地响应。
(试验例7)
使用导入有嗅觉受体aaor8的表达质粒;共同受体agorco或amorco、或嵌合共同受体ag(nt-tm4)amorco的任意一种表达质粒;以及aequorin表达质粒的细胞,如上所述地测定出发光量。使用1-辛烷-3-醇作为受检物,以10-4m、10-5m、10-6m、10-7m、10-8m、10-9m、或10-10m的浓度添加到培养液中。将其结果表示于图8中。结果显示,在与嗅觉受体结合而形成嗅觉受体复合体时,表达ag(nt-tm4)amorco和嗅觉受体的细胞与表达原来的aaorco或amorco的任意一种和嗅觉受体的细胞相比,对更低浓度的1-辛烷-3-醇产生响应。
(试验例8)
使用导入有嗅觉受体bmor56的表达质粒;共同受体bmorco、或嵌合共同受体dm(nt-tm4)amorco的任意一种表达质粒;以及aequorin表达质粒的细胞,如上所述地测定出发光量。使用顺式茉莉酮作为受检物,以10-5m、10-6m、10-7m、10-8m、10-9m、10-10m、或10-11m的浓度添加到培养液中。将其结果表示于图9中。结果显示,表达dm(nt-tm4)amorco和bmor56的细胞与表达bmorco和bmor56的细胞相比,对顺式茉莉酮更强地响应。另外,实施例7及8的结果显示,对于表达与成为构成嵌合共同受体的原来的orco的来源的各个昆虫不同种的昆虫来源的嗅觉受体和本实施方式的嵌合共同受体的细胞而言,与表达原来的嗅觉受体共同受体和上述嗅觉受体的细胞相比,对配体更强地或灵敏度更高地响应。
- 还没有人留言评论。精彩留言会获得点赞!