一种各向异性微趋结构材料及其制备方法与应用与流程
本发明属于生物材料技术领域,具体涉及一种各向异性微趋结构材料及其制备方法与应用。
背景技术
众多的研究表明当细胞与具有微纳结构的材料表面相接触时,会产生很多奇特的生物行为,这主要是由于微纳结构与细胞相接触后会使得细胞膜表面的蛋白做出响应,产生极化现象,而细胞迁移的重要因素就是细胞骨架的极化。在材料表面构筑可控诱导细胞迁移界面对于研究细胞行为以及进行生物材料移植都有着重要的意义。
各向异性微结构,近几年在微纳结构领域被广泛的研究起来,由于其特殊的不对称性,在光学领域,磁学领域都有着不错的应用,而这种特殊的结构在生物领域的研究依然很少,可以设想微纳结构的不对称性在与细胞接触时也必然会引起细胞黏附的不对称性,这种不对称性所引发的细胞行为值得去研究。以往的细胞迁移表面的设计通常是构筑梯度变化的微结构阵列,或者是梯度变化的软硬基底,这种微结构所引发的细胞迁移行为的动力主要来源于表面的梯度变化,变化越大,作用力越明显,而这种梯度变化的范围是有限的,因此微结构可构筑的范围也同样有限,使其在实际应用方面受到了很大限制。
技术实现要素:
针对现有技术的问题,本发明提供一种各向异性微趋结构的思路和设计,即微趋结构的各向异性是基于每一个微柱而不是某一区域的各向异性,而且能够在材料表面无限微趋的延展下去。
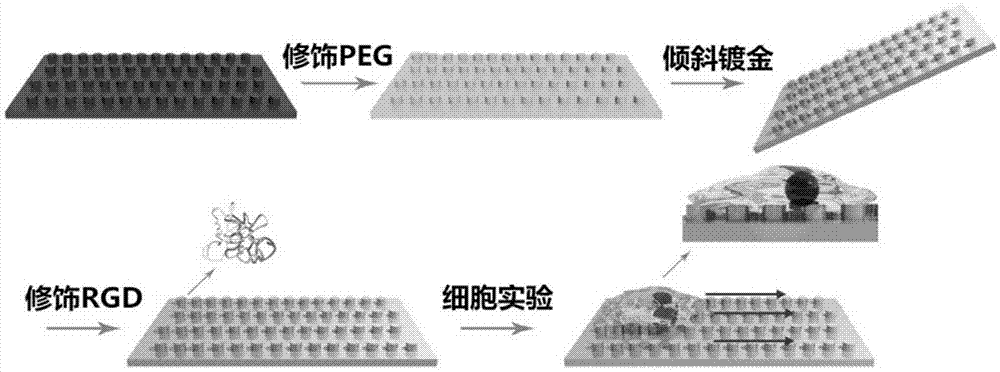
本发明通过翻录的方式在pdms表面构筑出一种各向异性微趋结构材料:将抗细胞黏附的peg分子链修饰在pdms表面获得抗细胞黏附界面,通过倾斜蒸镀的方式在微柱的一侧沉积金纳米层,将促细胞黏附的的rgd多肽修饰到镀金表面,最终得到各向异性细胞黏附微趋结构。通过sem,afm观察证明:本发明在大范围内制备了直径为1-5微米的微柱作为结构单元的有序各向异性微趋阵列,这种新颖的结构在细胞力学行为、细胞黏附上都展现出了的有趣且显著的各向异性特点。本发明所构筑的各向异性微趋结构具有诱导并改变细胞迁移的功能,这对于无药物刺激影响细胞行为、研究各种细胞的迁移行为机理以及调控肿瘤细胞在生物体内扩散都具有很好的研究意义和应用价值。
本发明所设计的微结构的各向异性是基于每一个微柱的各向异性而不是某一区域,而且在材料表面可以无限微趋的延展下去,这使得细胞迁移表面可以构筑的很长,足以达到实际应用所需的长度,具有很好的实际应用潜质。
为实现上述目的,本发明采用以下技术方案:
一种各向异性微趋结构材料,包括至少一个表面上设有凸起微结构的基底,在所述基底表面上还设有抗细胞黏附界面层,在所有所述凸起微结构的所述抗细胞黏附界面层上的相同一侧还依次设有铬层和金纳米层。
也就是说,仅在每个所述凸起微结构的所述抗细胞黏附界面层上的相同一侧还依次设有铬层、金纳米层,所述凸起微结构另一侧的表面上仅设有所述抗细胞黏附界面层;从而形成软硬不同的各向异性。
进一步地,在所述金纳米层上和/或在所述抗细胞黏附界面层上还设有促细胞黏附层。和/或,
进一步地,每个所述凸起微结构的表面上依次设有铬层、金纳米层的区域占每个所述凸起微结构的表面积的20-60%,更优选为50%;和/或,
进一步地,每个所述凸起微结构的表面上设有所述促细胞黏附层的区域占每个所述凸起微结构的表面积的20-100%,更优选为50%。
进一步地,所述基底的至少一个表面具有所述表面凸起微结构,例如可以一面或两面均具有表面凸起微结构。
进一步地,所述基底材料可选自pdms(聚二甲基硅氧烷),聚甲基丙烯酸甲酯(pmma)、聚碳酸酯(pc)、玻璃、硅片等中的一种或几种,优选为pdms。
进一步地,所述基底的厚度为500nm-5mm。和/或,
进一步地,所述抗细胞黏附界面层的厚度为0.5-1nm。和/或,
进一步地,所述铬层的厚度为2-10nm,优选为5nm。和/或,
进一步地,所述金纳米层的厚度为10-30nm,优选为20nm。和/或,
进一步地,所述促细胞黏附层的厚度为0.1-1nm。
本发明中,所述表面凸起微结构也称为微柱。
进一步地,所述表面凸起微结构的高度为1.5-2微米;和/或,所述表面凸起微结构的高度与最大宽度的比例为1:1;和/或,所述表面凸起微结构的最大宽度为1.5-2微米。
进一步地,所述表面凸起微结构为圆柱形或不规则形等。
进一步地,所述表面凸起微结构为圆柱形,高度为1.5-2微米,高度与直径的比例为1:1左右。
进一步地,所述表面凸起微结构在基底上的间距为2-5微米;或者每平方厘米的基底上,所述表面凸起微结构的个数为(4×106)-(4×107)个。
进一步地,构成所述抗细胞黏附界面层的材料为peg(聚乙二醇)。
具体地,所述抗细胞黏附界面层是由聚乙二醇甲基丙烯酸酯与异丙醇反应制得的;聚乙二醇甲基丙烯酸酯与异丙醇的质量比例优选为(6:4)-(9:1),更优选为8:2;反应过程中还可加入适量铂金作为催化剂。
在本发明一个具体实施方式中,将所述基底放入由聚乙二醇甲基丙烯酸酯8g和异丙醇2g制成混合溶液中,加入30μl的卡斯特铂金催化剂,室温搅拌15小时;然后使用丙酮、蒸馏水反复洗涤数次,真空干燥,即可在基底上制备出抗细胞黏附界面层。
进一步地,可使用磁控溅射蒸镀法(磁控溅射蒸镀仪)先在抗细胞黏附界面层上(表面)蒸镀铬层,再在铬层上(表面)蒸镀金层。
具体地,蒸镀时将抗细胞黏附界面层的基底倾斜一定角度,使每个所述凸起微结构的所述抗细胞黏附界面层上的相同一侧依次蒸镀铬层、金纳米层,而另一侧无法蒸镀,表面仅为抗细胞黏附界面层,从而形成软硬不同的各向异性。一般倾斜角度为20-80度角,常用的倾斜角度是45度角。
进一步地,所述促细胞黏附层由rgd多肽(arg-gly-asp,即精氨酸、甘氨酸、天门冬氨酸多肽)构成,即由rgd多肽修饰到所述金层表面,构成促细胞黏附层。
在本发明一个较佳的实施方式中,所述基底材料为pdms;所述表面凸起微结构为圆柱形,其高度为5微米、宽度为5微米、在基底上的间距为2-5微米;所述抗细胞黏附界面层、铬层、金纳米层、促细胞黏附层的厚度分别为1nm、5nm、20nm、1nm;所述抗细胞黏附界面层是由聚乙二醇甲基丙烯酸酯与异丙醇反应制得的;所述促细胞黏附层由rgd多肽修饰在所述金纳米层表面构成。
本发明还提供一种如上所述的各向异性微趋结构材料的制备方法,包括如下步骤:
1)将所述基底放入含硅油(即固化的液态pdms)和无水甲醇的混合溶液中,加入适量浓硫酸溶液(例如硅油体积2%左右的浓硫酸溶液),室温条件下磁力搅拌,处理一定时间(30分钟左右),然后用正己烷和甲醇反复冲洗,洗净后真空干燥(一般24小时);密封保存,备用;
其中,硅油与无水甲醇的体积比为(1:2)-(3:4),优选为3:5;
2)将步骤1)处理的基底放入含聚乙二醇甲基丙烯酸酯和异丙醇的混合溶液中,加入铂金催化剂,室温搅拌(一般15小时),在基底上制备出抗细胞黏附界面层;然后使用丙酮、蒸馏水反复洗涤数次,真空干燥;密封保存,备用;
其中,聚乙二醇甲基丙烯酸酯与异丙醇的质量比例优选为(6:4)-(9:1),更优选为8:2。
3)将步骤2)处理所得基底(修饰有聚乙二醇分子链)使用磁控溅射蒸镀法(磁控溅射蒸镀仪)先在抗细胞黏附界面层上(表面)蒸镀铬层,再在铬层上(表面)蒸镀金层;
具体地,蒸镀时将含抗细胞黏附界面层的基底倾斜一定角度,使所有所述凸起微结构的所述抗细胞黏附界面层上的相同一侧依次蒸镀铬层、金纳米层,而另一侧无法蒸镀,表面仅为抗细胞黏附界面层,从而形成软硬不同的各向异性。一般倾斜角度为20-80度角,常用的倾斜角度是45度角。
4)在步骤3)处理所得基底的金层表面上和/或所述抗细胞黏附界面层上修饰rgd多肽;
该步骤可采用本领域常规方法,例如将步骤3)处理所得基底浸泡在接有巯基的rgd多肽水溶液(2%质量体积浓度)中,经过30分钟的修饰,将样品取出使用去离子水反复冲洗,去除未接到金表面的rgd多肽,氮气吹干即可。
本发明所述基底可用本领域常规方法制备。
具体地,本发明提供一种所述基底的制备方法,包括如下步骤:
1)将含有微孔结构的硅基底模板用二甲基二氯硅烷进行表面氟化;
具体可将干净的含有微孔结构的硅基底模板放入密闭容器中,滴入适量二甲基二氯硅烷,对所述硅基底模板进行表面氟化以降低其表面活化能,氟化时间一般为30分钟左右;
2)将pdms预聚体混合液灌注到已表面氟化的含有微孔结构的硅基底模板上,置于在4℃条件下(冰箱冷藏层)静置过夜;然后烘烤,使pdms预聚体固化;将固化的pdms从所述含有微孔结构的硅基底模板上分离,即可将模板图案翻录到pdms表面,获得有序排列的微柱阵列的基底。
例如含有微孔结构的硅基底模板上孔的尺寸为,孔深5微米,孔的直径5微米,孔的间距5微米,构筑范围为2cm×2cm,可使用无水乙醇、丙酮在低功率条件下各超声清洗两次,一次5分钟,清洗后使用氮气吹干表面。
所述pdms预聚体混合液可按本领域常规方法制备,例如将pdms预聚体与固化剂按照10:1的质量比进行混合,搅匀后将混合液移入真空干燥器中,抽气1小时,排尽预聚体混合液中的气泡。
烘烤温度与时间会影响pdms的硬度,可根据需要进行选择调整。一般地,所述烘烤温度为40-90℃,时间为40分钟-12小时;优选地,所述烘烤温度为70℃,时间为3小时。
pdms预聚体固化反应如下所示:
nsi(ch3)2cl2+nh2o→[si(ch3)2o]n+2nhcl
本发明还包括上述方法制备的各向异性微趋结构材料。
本发明所述各向异性微趋结构材料可以无限延展(在平面方向上)。
本发明还包括上述各向异性微趋结构材料在研究细胞迁移等方面的应用。
本发明所用原料均可市售购得,或按本领域常规方法制备。
在符合本领域常识的基础上,上述各优选条件,可以相互组合,即得本发明各较佳实例。
此外,应理解,本文中,“包括”、“包含”、“含有”等术语的含义中也包括了“由……组成”、“由……构成”、“由……制成”等。
本发明具有以下有益效果:
1)本发明制备了均匀、大范围内的各向异性微趋结构材料,这种新颖的各向异性结构,具有两种不同的各向异性性质,一:利用分子修饰所产生的细胞黏附各向异性;二:利用倾斜蒸镀所产生的软硬(杨氏模量)各向异性性质。
2)本发明提供一种各向异性微趋结构的思路和设计,即微趋结构的各向异性是基于每一个微柱而不是某一区域的各向异性,而且能够在材料表面无限微趋的延展下去。
3)本发明各向异性微趋结构材料能够比较明显的促进细胞的迁移。
附图说明
图1:实施例1各向异性微趋结构材料的制备和应用于细胞实验的流程示意图;
图2:实施例1中制备的各向异性微趋材料扫描电镜sem下的结构图片;
图3:实验例1中细胞在各向异性微趋材料上迁移的扫描电镜图片。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
实施例1
一种各向异性微趋结构材料,其制备方法如图1所示,具体包括:
1.将含有微孔结构的硅基底模板(硅基底上孔的尺寸为,孔深5微米,孔的直径5微米,孔的间距5微米,构筑范围为2cm×2cm),使用无水乙醇、丙酮在低功率条件下各超声清洗两次,一次5分钟,清洗后使用氮气吹干表面;
2.将吹干后的表面放入一个密闭容器中,在容器中滴入几滴二甲基二氯硅烷,进行表面氟化从而降低表面活化能,氟化时间为30分钟;
3.在基底氟化过程中将pdms预聚体与固化剂按照10:1的质量比进行混合,搅匀后将混合液移入真空干燥器中,抽气1小时,排尽预聚体混合液中的气泡;
4.抽气完毕后将预聚体混合液灌注在表面氟化完毕的微孔结构基底上,将基底连同覆盖在其表面的预聚体混合液在4℃条件下(冰箱冷藏层)静置过夜;
5.将过夜后的样品放入70℃烘箱3小时,使pdms预聚体固化;
6.经过高温固化后的pdms由流动态转变为较坚硬的固态,使用手术刀片在模板的一角小心地将pdms揭起,即可将模板图案翻录到pdms表面,获得有序排列的微柱阵列(柱高5微米,柱的直径5微米,柱的间距5微米,构筑范围为2cm×2cm)。
7.将上述获得的pdms表面放入硅油(3ml)和无水甲醇(5ml)的混合溶液中,加入60μl的浓硫酸溶液,室温条件下磁力搅拌30分钟,用正己烷和甲醇反复冲洗,真空干燥24小时,密封保存;
8.干燥后的样品放入聚乙二醇甲基丙烯酸酯(8g)和异丙醇(2g)的混合溶液中,加入30μl的卡斯特铂金催化剂,室温搅拌15小时;
9.反应完成后将pdms使用丙酮、蒸馏水反复洗涤数次,真空干燥24小时,密封保存;
10.将修饰有聚乙二醇分子链的pdms使用磁控溅射蒸镀仪在倾斜45度角的条件下,使其表面蒸镀上一层5nm后的铬层,然后再蒸镀上一层20nm后的金层。
11.将所得镀有金层的pdms浸泡在接有巯基的rgd多肽水溶液(2%质量体积浓度)中,经过30分钟的修饰,将样品取出使用去离子水反复冲洗,去除未接到金表面的rgd多肽,氮气吹干即可。
本实施例制得的各向异性微趋结构材料sem图见图2。
实验例1
利用实施例1制得的各向异性微趋结构材料研究细胞在其表面的迁移:
1.将修饰后的各向异性材料转移至紫外灯下照射灭菌2小时,作为基底进行细胞迁移实验:
2.将长满培养皿的黑色素瘤细胞,使用胰蛋白酶消化下来,配制成10000细胞每毫升的细胞悬液;
3.将修饰好的pdms样品放入一个小培养皿(直径35mm,高度10mm)中,向培养皿中加入3ml上述细胞悬液并转移至活细胞工作站中;
4.将活细胞工作站连通倒置荧光显微镜,设定为37℃,通入5%co2气体,进行持续24h的活细胞培养;
5.在培养过程中利用显微镜所带的拍摄系统对观测区域拍照,通过培养期间连续拍摄的照片评测细胞在结构表面的迁移情况。
黑色素瘤细胞在各向异性微趋材料上迁移的扫描电镜图见图3。结果表明,黑色素瘤细胞形态改变,明显拉伸,较明显看出向一侧发生梭形状迁移。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!