一种水凝胶的制备方法与流程
本发明涉及凝胶材料合成领域,特别是涉及一种水凝胶的制备方法。
背景技术:
智能水凝胶凭借其独特的刺激-响应机制、可逆体系的多样性等优异特性,逐渐成为当前化学与药学领域的研究热点之一。水凝胶在控制药物的释放速率与释放位置、提高药物在体内的生物利用度以及降低毒副作用等方面正在发挥越来越重要的作用。
纤维素纳米纤丝(cnf)是一种具有特殊网状结构且直径为纳米级的微细纤维。基于cnf天然高分子材料制备得到的水凝胶具有较好的生物相容性、生物可降解性以及与活体组织的相似性,更适合作为药物输送的载体。但在关于纤维素基水凝胶药物控释方面,因疏水性药物与水凝胶亲水性聚合物网络之间固有的不亲和性,导致该类材料多用于水溶性药物的输送,此外,疏水性药物从此类水凝胶中的释放不能长时间控制。
β-环糊精(β-cd)作为一种具有疏水性空腔结构的环状低聚糖,可用于提高疏水性药物的溶解度、稳定性及生物利用度。许多研究表明环糊精可凭借其自组装、分子识别和动态可逆能力与其他生物相容性材料构筑不同性能的智能药物载体。在现有报道中,多通过交联聚合方法制备得到β-cd与纤维素基材料相结合的水凝胶,但在制备过程中需使用有毒的交联剂及多种化学助剂,很大程度上影响了水凝胶的生物相容性。刘泽华等研究者(cmc/阳离子β-环糊精自组装材料的制备研究,造纸化学品,2009,21(5),7-12)报道了一种利用羧甲基纤维素(cmc)与阳离子β-cd之间的静电相互作用制备获得的纤维,可将其抄片成纸用于苯酚废水的处理。但该报道公开的技术方案中纤维形成的静电驱动力在整体上较弱,所引入的β-cd较少,制备获得的材料也不具备良好的体内药物输送特性,不适用于水凝胶等生物材料的制备。
技术实现要素:
针对上述问题,本发明的目的在于提供一种可作为药物载体且性能更优异的水凝胶的制备方法。
具体技术方案包括如下步骤:
1、纤维素纳米纤丝膜的制备:
取适量tempo氧化纤维素纳米纤丝(即通过tempo氧化法制备获得的纤维素纳米纤丝)溶于水中,再加入甘油,之后将溶液进行脱泡处理,脱泡后的溶液经干燥处理后即获得纤维素纳米纤丝膜;
优选地,反应体系中各原料添加量的质量份数分别为:tempo氧化纤维素纳米纤丝1~2份,甘油5~7份,余量为水。
2、水凝胶的制备:
将水溶性阳离子β-cd聚合物的水溶液与氨基化纳米银粒子的水溶液混合得到浸泡液;将步骤1制备获得的纤维素纳米纤丝膜在浸泡液中浸泡反应10~20min后取出,即获得水凝胶产品;
优选地,所述水溶性阳离子β-cd聚合物在其水溶液中的浓度为10~30%,氨基化纳米银粒子(ag-nh2nps)在其水溶液中的浓度为0.03~0.04mg/ml;用以混合制备所述浸泡液的水溶性阳离子β-cd聚合物水溶液与氨基化纳米银粒子水溶液的体积比为35~40:1;用以浸泡的纤维素纳米纤丝膜与浸泡液的质量比为0.01~0.03:1。
进一步地,上述步骤2中,所述水溶性阳离子β-cd聚合物通过如下步骤制备获得:
(1)将β-cd溶于naoh溶液中,之后加入2,3-环氧丙基三甲基氯化铵溶液、环氧氯丙烷以及聚乙二醇600,加热搅拌反应至少3h;
优选地,上述反应体系中各原料添加量的质量份数分别为:β-cd12~15份、naoh4~6份、2,3-环氧丙基三甲基氯化铵18~20份、环氧氯丙烷9~12份、聚乙二醇6005~9份,余量为水。
(2)向反应后的体系中加入无水乙醇并快速搅拌至产生白色沉淀,静置一段时间后对沉淀进行倾析分离。
(3)倾析获得的固体用水重溶并调节ph至7,之后于50℃加热至少12h,最后将溶液转入截留分子量为6000~8000的透析袋,在蒸馏水中透析至少48h,将透析后的溶液进行冷冻干燥处理即得到水溶性阳离子β-cd聚合物。
上述步骤2中,所述氨基化纳米银粒子的制备方法为:在室温下,将适量agno3完全溶解在聚乙烯吡咯烷酮/乙二醇溶液中,随后以1℃/min的升温速率将混合溶液加热至120℃,之后保持120℃反应1h;自然冷却后加入丙酮以产生沉淀。超速离心获得银纳米粒子,之后在100ml0.5mol/l的naoh溶液中70℃下反应12h,所得产物超速离心、洗涤后在甲醇/水溶液中再分散,之后于70℃下用3-氨丙基三乙氧基硅烷氨化12h,收集固体,用蒸馏水洗涤后在30℃下真空干燥,得到氨基化纳米银粒子。具体制备方法还可参考以下现有技术:
文献1:wang,j.,gao,x.,etal.(2016).monodispersedgraphenequantumdotsencapsulatedagnanoparticlesforsurface-enhancedramanscattering.materialsletters,162(suppl.c),142–145.
文献2:zhang,f.,braun,g.b.,etal.(2010).fabricationofag@sio2@y2o3:ernanostructuresforbioimaging:tuningoftheupconversionfluorescencewithsilvernanoparticles.journaloftheamericanchemicalsociety,132(9),2850–2851.
本发明提供的水凝胶制备方法,以tempo氧化纤维素纳米纤丝与水溶性阳离子β-cd聚合物间的静电相互作用为基础,通过加入的氨基化纳米银粒子与水溶性阳离子β-cd聚合物的协同作用,进一步加强了阴阳离子间的静电相互作用,使水溶性阳离子β-cd聚合物的含量成倍提高,从而大幅提高其吸附、载药性能,同时纳米银粒子和纤维素纳米纤丝还可在体系中作为增强相提高水凝胶的力学强度和粘弹性。另外,在制备原料及方法上,水凝胶在组装过程中避免了有毒交联剂的使用,制备条件温和且交联速度快,制备得到的cnf/阳离子β-cd聚合物/纳米银粒子水凝胶具有良好的生物相容性、生物可降解性及一定的抗菌性,同时也保留了环糊精对疏水性分子的识别、包结性能,使水凝胶对疏水性药物具有极佳的承载能力以及不同ph条件下的缓释能力。
附图说明:
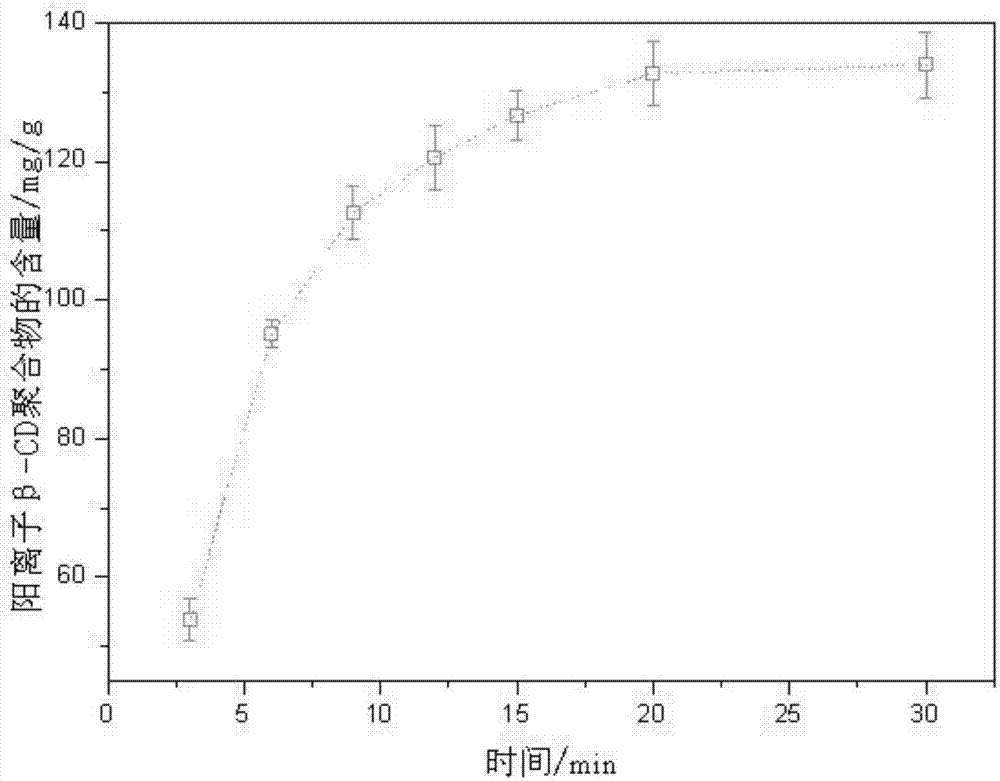
图1阳离子β-cd聚合物在水凝胶中的含量随凝胶组装时间的变化图。
具体实施方式:
以下通过实施例对本发明技术方案做进一步详细说明。
实施例1
1、纤维素纳米纤丝膜的制备:
取适量tempo氧化纤维素纳米纤丝加入水中,40℃快速搅拌至完全溶解,再加入甘油并继续于40℃下快速搅拌至溶液均一透明,之后将溶液进行离心脱泡及超声脱泡处理,脱泡后的溶液于55℃烘箱中干燥6~12h后即获得纤维素纳米纤丝膜。
反应体系中各原料添加量的质量份数分别为:tempo氧化纤维素纳米纤丝1.5份,甘油6份,余量为水。
2、水凝胶的制备:
将水溶性阳离子β-cd聚合物溶于水,配制成浓度为20%的溶液,再取适量ag-nh2nps(参照前述文献1和文献2中记载的方法制备获得)溶于水,配制成浓度为0.03mg/ml的溶液,将水溶性阳离子β-cd聚合物水溶液与ag-nh2nps水溶液按照体积比38:1进行混合得到浸泡液;将步骤1制备获得的纤维素纳米纤丝膜在浸泡液中浸泡反应12min后取出,即获得水凝胶产品。用以浸泡的纤维素纳米纤丝膜与混合溶液的质量比为0.03:1。
实施例2
1、纤维素纳米纤丝膜的制备:
取适量tempo氧化纤维素纳米纤丝加入水中,40℃快速搅拌至完全溶解,再加入甘油并继续于40℃下快速搅拌至溶液均一透明,之后将溶液进行离心脱泡及超声脱泡处理,脱泡后的溶液于55℃烘箱中干燥10h即获得纤维素纳米纤丝膜。
反应体系中各原料添加量的质量份数分别为:tempo氧化纤维素纳米纤丝2份,甘油7份,余量为水。
2、水溶性阳离子β-cd聚合物的制备:
(1)将适量β-cd加入浓度为220g/l的naoh溶液中,60℃搅拌至完全溶解,之后加入浓度为900g/l的2,3-环氧丙基三甲基氯化铵溶液、环氧氯丙烷以及聚乙二醇600,55~60℃搅拌反应至少3h;
上述反应体系中各原料添加量的质量份数分别为:β-cd14份、naoh5份、2,3-环氧丙基三甲基氯化铵18份、环氧氯丙烷10份、聚乙二醇6008份,余量为水。
(2)向反应后的体系中加入至少2倍体积的无水乙醇并快速搅拌至产生白色沉淀,静置12h后进行倾析分离。
(3)倾析获得的固体用水重溶并用6mol/l盐酸调节ph至7,之后于50℃加热至少12h,最后将溶液转入截留分子量为6000~8000的透析袋,在蒸馏水中透析至少48h,将透析后的溶液进行冷冻干燥处理即得到水溶性阳离子β-cd聚合物。
通过上述方法制备获得的水溶性阳离子β-cd聚合物的电荷密度为1.73mmol/g,可进一步加强水凝胶自组装的静电相互作用。
3、水凝胶的制备:
将步骤2制备获得的水溶性阳离子β-cd聚合物溶于水,配制成浓度为25%的溶液,再取适量ag-nh2nps(参照前述文献1和文献2中记载的方法制备获得)溶于水,配制成浓度为0.035mg/ml的溶液,将水溶性阳离子β-cd聚合物水溶液与ag-nh2nps水溶液按照体积比39:1进行混合得到浸泡液;将步骤1制备获得的纤维素纳米纤丝膜在浸泡液中浸泡反应15min后取出,即获得水凝胶产品。用以浸泡的纤维素纳米纤丝膜与混合溶液的质量比为0.03:1。
图1显示了实施例2步骤3中,水溶性阳离子β-cd聚合物在水凝胶中的含量随凝胶自组装时间的变化趋势。从图中可以看出,阳离子β-cd聚合物的含量在前15min内迅速上升,接近130mg/g;在20min时阳离子β-cd聚合物的含量达到132.60mg/g;在20min后阳离子β-cd聚合物的含量随时间延长基本保持不变,达到平衡。该结果说明了cnf、阳离子β-cd聚合物及ag-nh2nps多组分间的静电自组装是一个快速交联过程,与常规化学交联过程相比时间大大缩短,后者通常需要数小时。
实施例3
1、纤维素纳米纤丝膜的制备:
取适量tempo氧化纤维素纳米纤丝加入水中,40℃快速搅拌至完全溶解,再加入甘油并继续于40℃下快速搅拌至溶液均一透明,之后将溶液进行离心脱泡及超声脱泡处理,脱泡后的溶液于55℃烘箱中干燥10h即获得纤维素纳米纤丝膜。
反应体系中各原料添加量的质量份数分别为:tempo氧化纤维素纳米纤丝1份,甘油5份,余量为水。
2、水溶性阳离子β-cd聚合物的制备:方法与实施例2相同。
3、水凝胶的制备:
将步骤2制备获得的水溶性阳离子β-cd聚合物溶于水,配制成浓度为30%的溶液,再取适量ag-nh2nps(参照前述文献1和文献2中记载的方法制备获得)溶于水,配制成浓度为0.04mg/ml的溶液,将水溶性阳离子β-cd聚合物水溶液与ag-nh2nps水溶液按照体积比36:1进行混合得到浸泡液;将步骤1制备获得的纤维素纳米纤丝膜在浸泡液中浸泡反应20min后取出,即获得水凝胶产品。用以浸泡的纤维素纳米纤丝膜与混合溶液的质量比为0.02:1。
实施例4
制备不含纳米银粒子的水凝胶,将其作为对照组,与实施例2的水凝胶产品进行阳离子β-cd聚合物含量的比较。对照组水凝胶的制备方法与实施例2基本相同,不同之处仅在于浸泡液为25%的水溶性阳离子β-cd聚合物溶液,其中不含有ag-nh2nps,浸泡时间至少30min。
结果表明:对照组水凝胶中阳离子β-cd聚合物的含量在初始10min内迅速上升,10min后随时间的延长基本保持不变,维持在58mg/g左右。具体比较结果如表1所示:对照组水凝胶中阳离子β-cd聚合物的含量在30min后的含量为58.12mg/g,远低于实施例2的水凝胶产品(自组装15min时的阳离子β-cd聚合物含量为132.60mg/g)。
实施例5
载药试验:将前述对照组水凝胶及实施例2、3制备的水凝胶分别于40ml浓度为1mg/ml的氯霉素水溶液中浸泡24h后取出,通过对比浸泡前后氯霉素水溶液的吸光度变化计算凝胶载药量。结果如表1所示:实施例2和实施例3的水凝胶产品对疏水性药物氯霉素的载药量远高于对照组,是对照组的5倍左右。
表1水凝胶的阳离子β-cd聚合物的含量及载药量对比
a组装时间:即纤维素纳米纤丝膜在浸泡液中的浸泡反应时间
b聚合物含量:即阳离子β-cd聚合物的含量
实施例6
不同ph环境下的释药试验:将实施例2、3制备的水凝胶进行冷冻干燥处理,之后于40ml浓度为1mg/ml的氯霉素水溶液中浸泡24h,最后分别置于50ml不同ph的缓冲液中(ph分别为4、6、7、8、10),于摇床中以37.5±0.5℃、150rpm持续振荡处理。根据缓冲液振荡处理12h后的吸光度变化计算药物释放浓度,再根据释放浓度进一步计算释放率。试验结果表明,实施例2、3制备的水凝胶对疏水性药物具有良好的缓释能力,且在不同ph刺激响应下的控释能力差异明显(具体结果见表2)。
表2载药水凝胶在不同ph环境下持续缓释12h后的平均累积释放率
实施例7
压缩应力测试:将实施例2制备的水凝胶制成直径20mm、高5mm的圆柱形样品,使用流变仪进行压缩应力-应变测试,压缩样品时压力达到最大装载量50n时结束。测试结果表明:实施例2制备的水凝胶可承受的最大应力达到6~9kpa。
- 还没有人留言评论。精彩留言会获得点赞!