一种催化苄醇类化合物胺化的方法与流程
本发明是一种有机化合物合成方法,具体涉及的是利用非金属路易斯酸催化剂催化醇类化合物胺化反应,并将其利用到一系列不同类型胺类化合物的合成。
背景技术
醇类化合物作为一类重要的有机化合物,其不仅具有广泛的来源并且具有低毒稳定等特点,在工业,医药及精细化工中均有着重要的地位。通过醇类化合物合成含氮原子化合物是一类重要的化学转化,但由于醇羟基本身具有难以离去的化学性质,因此在通常的化学转化中大多需要对于醇羟基进行预活化或保护从而加强其离去性能,而在这一过程中则会产生不必要的原子浪费及化学污染。目前,绿色化学及原子经济性是化学生产中两大重要的指标。综上所述,发展一种绿色高效的醇类化合物胺化反应是必要且具有重要意义的。
利用化学催化方法实现醇类化合物的直接胺化反应是一种快速获得胺类化合物的重要方法。在2006年prim课题组报道了使用金属路易斯酸金催化剂对于苄醇的直接胺化反应,该反应所使用的催化剂为三氯化金氯化钠,使用二氯甲烷作为溶剂可以对一系列不同取代的苄醇进行磺酰胺化反应。而在这一反应中则必须使用磺酰胺等具有弱酸性的胺源(式1)。
随后在2012年中国科学家夏春谷教授发展了一种使用磺酸离子液体催化苄醇直接胺化反应,该反应在1,4-二氧六环为溶剂80摄氏度下可以获得二苯甲醇磺酰胺化产物(式2)。
在目前已经报道的醇类化合物直接胺化反应中,一般都需要使用金属路易斯酸,并且胺源必须为磺酰胺,酰胺等一系列具有弱酸性的有机胺,而这些限制条件并不能满足在化工生产中的实际应用,因此发展一类非金属催化并且胺源为芳胺类化合物的醇胺化反应是非常有必要的。
技术实现要素:
本发明的目的在于提供一种使用三五氟苯基硼烷催化苄醇类化合物直接胺化的方法。
本发明的目的通过以下技术方案实现:
一种催化苄醇类化合物胺化的方法,将苄醇类化合物与苯胺类化合物混合,加入溶剂与催化剂三五氟苯基硼烷,85℃~120℃下反应12-24小时即得到苄醇胺化产物。
该方法具体如下:
所述苄醇类化合物为
优选地,所述苄醇类化合物为二苯甲醇及其类似物,苯乙醇及其类似物(1-苯基乙醇)或扁桃腈。
所述苯胺类化合物为
优选地,所述苯胺类化合物为对甲氧基苯胺或对甲基苯胺。
优选地,所述苄醇类化合物与芳胺类化合物的摩尔比为1:2。
优选地,所述催化剂的添加量为1%-20%。
优选地,所述催化剂的添加量摩尔百分比为1%-20%。
优选地,所述苄醇类化合物与催化剂的摩尔比为1:0.1。
优选地,所述溶剂为硝基甲烷,甲苯,1,2-二氯乙烷,四氢呋喃或氯仿。
与现有技术相比,本发明具有如下优点:
(1)本发明利用三五氟苯基硼烷催化对于苄醇类型底物胺化反应。该反应利用商业可得的三五氟苯基硼烷作为催化剂对于一系列苄醇类化合物实现脱水胺化,反应无需对醇进行预活化或保护,该方法可以高效的构建一系列不同取代基的有机胺化合物。
(2)本发明操作简单,反应高效并且不会产生多余的化学污染,原子利用率高。
附图说明
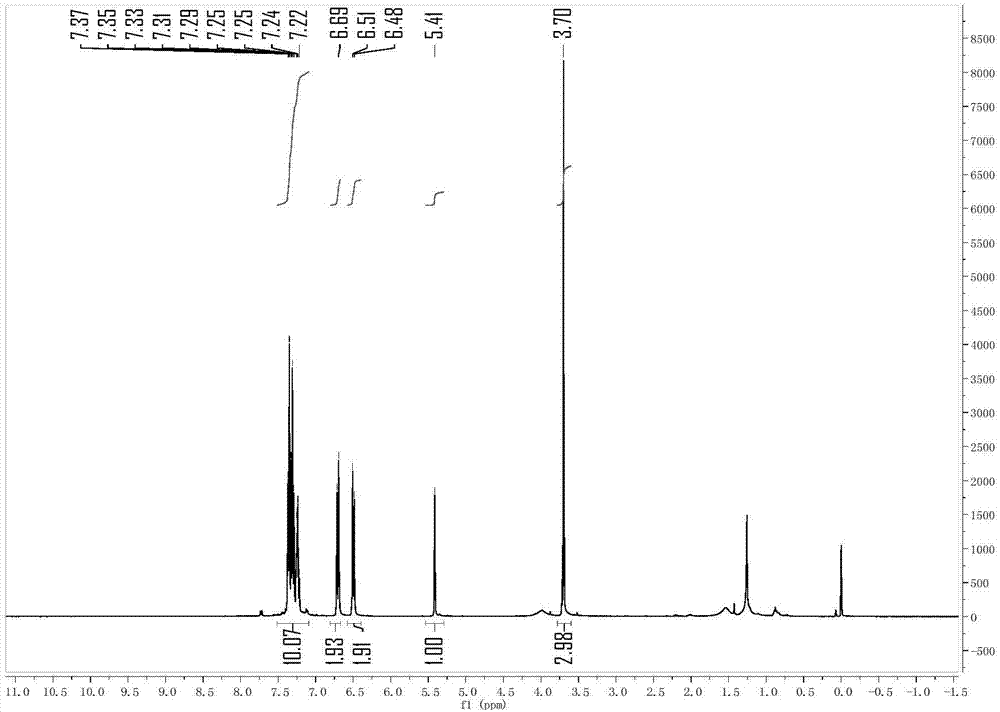
图1为实施例1制得产物的核磁共振图,(a)为氢谱图,(b)为碳谱图。
图2为实施例2制得产物的核磁共振图,(a)为氢谱图,(b)为碳谱图。
图3为实施例3制得产物的核磁共振图,(a)为氢谱图,(b)为碳谱图。
图4为实施例4制得产物的核磁共振图,(a)为氢谱图,(b)为碳谱图。
具体实施方式
下面结合具体实施例对本发明作进一步说明。
实施例1
将二苯甲醇(36.8mg)置于10毫升反应管中,加入1毫升硝基甲烷作为溶剂,随后加入11mg三五氟苯基硼烷及对甲氧基苯胺(49.2mg),反应温度升高至120摄氏度,反应12小时后将反应冷却至室温随后将溶剂去除后通过柱层析对于产物进行分离:n-二苯甲基-4-甲氧基苯胺(49mg,产率86%)棕色液体,86%产率。分析数据:1hnmr(400mhz,cdcl3)δ7.34(m,8h),7.27–7.22(m,2h),6.71(d,j=8.9hz,2h),6.50(d,j=8.9hz,2h),5.41(s,1h),3.70(s,3h).13cnmr(100mhz,cdcl3)δ152.14,143.22,141.70,128.74,127.42,127.31,114.74,114.63,63.84,55.75.hrms(esi)m/z[m+h]+:calcdforc20h20no:290.1545.found:290.1524.
实施例2
将1-苯基乙醇(24.4mg)置于10毫升反应管中,加入1毫升硝基甲烷作为溶剂,随后加入11mg三五氟苯基硼烷及对甲氧基苯胺(49.2mg),反应温度升高至120摄氏度,反应12小时后将反应冷却至室温随后将溶剂去除后通过柱层析对于产物进行分离:4-甲氧基-n-(1-苯乙基)苯胺(30mg,产率67%)无色液体,67%产率。分析数据:1hnmr(400mhz,cdcl3)δ7.33(dt,j=13.1,7.4hz,4h),7.21(t,j=7.8hz,1h),6.68(d,j=8.9hz,2h),6.46(d,j=8.9hz,2h),4.40(q,j=6.7hz,1h),3.68(s,3h),1.49(d,j=6.7hz,3h).13cnmr(100mhz,cdcl3)δ151.89,145.51,141.58,128.64,126.84,125.91,114.77,114.55,55.75,54.27,25.17.hrms(esi)m/z[m+h]+:calcdforc15h18no:228.1388.found:228.1370.
实施例3
将扁桃腈(26.6mg)置于10毫升反应管中,加入1毫升硝基甲烷作为溶剂,随后加入11mg三五氟苯基硼烷及对甲氧基苯胺(49.2mg),反应温度升高至120摄氏度,反应12小时后将反应冷却至室温随后将溶剂去除后通过柱层析对于产物进行分离:2-(4-甲氧基苯基)胺-2-苯基乙腈(33mg,产率68%)无色液体,68%产率。分析数据:1hnmr(400mhz,cdcl3)δ7.66–7.56(m,2h),7.45(dt,j=11.9,4.1hz,3h),6.85(d,j=8.9hz,2h),6.76(d,j=6.7hz,2h),5.34(d,j=8.4hz,1h),3.77(s,3h).13cnmr(100mhz,cdcl3)δ154.16,138.59,134.16,129.47,129.29,127.28,118.48,116.34,115.02,55.68,51.61.hrms(esi)m/z[m+h]+:calcdforc15h15n2o:239.1184.found:239.1165.
实施例4
将2-羟基-2-苯基乙酮(42.4mg)置于10毫升反应管中,加入1毫升硝基甲烷作为溶剂,随后加入11mg三五氟苯基硼烷及对甲氧基苯胺(49.2mg),反应温度升高至120摄氏度,反应12小时后将反应冷却至室温随后将溶剂去除后通过柱层析对于产物进行分离:2-(4-甲氧基苯基)亚胺-1,2-二苯乙炔-1-酮(51.2mg,产率81%)。无色液体,81%产率。分析数据:1hnmr(400mhz,cdcl3)δ7.86(d,j=7.9hz,2h),7.77(d,j=7.9hz,2h),7.44(dt,j=21.7,7.5hz,4h),7.33(t,j=7.6hz,2h),6.90(d,j=8.6hz,2h),6.67(d,j=8.6hz,2h),3.66(s,3h).13cnmr(100mhz,cdcl3)δ198.66,165.41,157.04,142.33,135.39,134.54,134.29,131.41,129.27,128.87,128.76,127.98,122.26,113.95,55.27.hrms(esi)m/z[m+h]+:calcdforc21h18no:316.1338.found:316.1335.
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!