一种基于阿魏酸聚合物的载药纳米粒及其制备方法和应用与流程
本发明属于药物载体与控释材料技术领域。更具体地,涉及一种基于阿魏酸聚合物的载药纳米粒及其制备方法和应用。
背景技术:
肿瘤治疗仍是目前医学领域的一大难题,亟需开发出化疗毒副作用小、抑瘤效果显著的新型抗肿瘤药物和方法。由于大多数抗肿瘤药物具有很强的疏水性,以及在胃肠道中存在大量的外排泵,致使抗肿瘤药物的口服吸收效果很差,普遍存在生物利用度低且毒副作用大等缺陷,因此,提高抗肿瘤药物的生物利用度以及病人的顺应性成为亟需解决的问题。抗肿瘤药物的给药(特别是注射给药)的最大障碍是溶解度低,难于制备适宜的制剂。往往需要采取各种增加溶解度的办法,如将药物制备成盐、加入潜溶媒、加入助溶剂、以及加入表面活性剂增溶。由于成盐往往需要强酸或强碱条件,对许多药物往往不适用;生理安全的潜溶媒很少,且用量有限;通过与药物形成络合物而增加药物溶解度的助溶剂的安全性不易保证。对于水溶性较差的药物往往需要同时采用几种措施,这往往导致许多不足,从而影响药物的作用。
近年来,采用纳米药物载体负载抗肿瘤化疗药物,给肿瘤化疗提供了一种新的思路。纳米载药体系应该满足以下几点要求:1、聚合物载体的物理化学性质稳定;2、载药体系安全无毒,且具备良好的生物相容性和生物可降解性;3、纳米粒粒径合适、性质稳定;4、有合适的载药量,实现化疗药的有效递送;5、制备方法简单便捷、有重现性,实现制药的精确可控。
纳米剂型可实现功能性药物的靶向定位,并且改变药物的生物分布和释放动力学,从而增强药物的药效。而来自植物的天然有效成分阿魏酸有较好的生物相容性和可降解性,以阿魏酸为先导物进行结构改造是进行创新医药研究的重要途径之一。但是,目前没有直接利用阿魏酸高分子聚合物来制备成药物纳米载体的相关报导。
技术实现要素:
本发明要解决的技术问题是克服上述现有技术的缺陷和不足,提供一种基于阿魏酸聚合物的载药纳米粒。本发明的载药纳米材料性质稳定,有良好的生物相容性和可降解性,并且安全无毒,可作为肿瘤的靶向治疗药物,提高药物对肿瘤部位的选择性,以促进药物吸收、增强药物的治疗作用,提高药物的生物利用度,为疾病的有效治疗开拓了一种新的途径。
本发明的第一个目的是提供一种聚合物pfa。
本发明的第二个目的是提供上述聚合物pfa的制备方法。
本发明的第三个目的是提供上述聚合物pfa在作为或制备药物传递载体方面的应用。
本发明的第四个目的是提供一种基于阿魏酸聚合物的纳米材料的制备方法。
本发明的第五个目的是提供一种基于阿魏酸聚合物的载药纳米粒。
本发明的第六个目的是提供上述载药纳米粒的制备方法。
本发明的第七个目的是提供上述载药纳米粒在作为或制备治疗癌症的药物中的应用。
本发明上述目的通过以下技术方案实现:
一种新型结构的聚合物pfa,由多个重复的阿魏酸结构单元组成,其结构式如下式(i)所示:
其中,n=3~9。
优选地,所述聚合物pfa的分子量为546~1602。
本发明还提供了聚合物pfa的制备方法,以阿魏酸和socl2为原料,在吡啶碱性环境中发生缩聚反应,制备得到聚合物pfa。
阿魏酸(ferulicacid,fa)属于羟基酸,分子结构中含有酚羟基和羧基官能团。本发明以阿魏酸为单体,利用阿魏酸中的α,β不饱和羧酸和苯酚官能团在特定催化条件下发生聚合反应,合成高分子聚合物pfa,具有操作简单、反应步骤少且产物无污染等优点,其制备方法简单、高效、经济。
优选地,所述吡啶碱性环境是指含有吡啶或4-二甲氨基吡啶(dmap)、同时ph值为8~9的环境。
优选地,所述阿魏酸和socl2的摩尔比为0.5~3:1。例如0.5:1、1:1、1.5:1、2:1、2.5:1或3:1。
更优选地,所述阿魏酸和socl2的摩尔比为1~2:1。
优选地,缩聚反应的反应时间为0.5~10h。例如0.5h、1h、2h、3h、4h、5h、6h、7h、8h、9h或10h。
更优选地,缩聚反应的反应时间为1~4h。
优选地,所述缩聚反应在冰浴条件下进行。
更优选地,所述冰浴条件为0~4℃的冰浴。
优选地,在冰浴条件下,以0.5~3.5ml/min的速度缓慢滴加socl2。
更优选地,在冰浴条件下,以2ml/min的速度缓慢滴加socl2。
优选地,所述缩聚反应结束时,以稀盐酸洗涤产物,除去残留的吡啶成分。
更优选地,所述缩聚反应结束时,以0.5%~2%稀盐酸洗涤产物。
具体优选地,所述聚合物pfa的制备方法,包括以下步骤:
s31.在冰浴环境下,加入吡啶,搅拌;加入socl2,搅拌;加入阿魏酸,常温搅拌;
s32.将反应后的红棕色溶液转移至容器,加水沉淀出黄色不溶物,并用hcl洗涤2~4次,再用超纯水洗涤2~4次,抽滤得固体,冻干,得到棕褐色粉末状产物,即为聚合物pfa。
优选地,所述常温为22~28℃。
实验发现,用聚合物pfa包载药物的载药纳米粒有良好的稳定性,载药纳米粒的粒径在200nm以下,拥有较高的比表面积,载药量最高可达9%,是优良的载药体系,可增强药物的疗效;而且该载药纳米粒能够利用epr效应增强药物在肿瘤部位的靶向性。
因此,所述聚合物pfa在作为或制备药物传递载体方面的应用,也在本发明的保护范围之内。
本发明所述药物为疏水性或亲水性的药物。
所述药物为抗肿瘤药物、解热镇痛药或抗生素。
优选地,所述抗肿瘤药物为化疗药。
优选地,所述传递载体为靶向载体。
更进一步优选地,所述抗肿瘤药物选自紫杉醇、阿霉素、喜树碱或所述抗肿瘤药物药学上可接受的盐中的任意一种或多种。
本发明还提供了一种基于阿魏酸聚合物的纳米材料的制备方法,采用纳米沉淀法制备pfa纳米粒,包括以下步骤:
s1.将聚合物pfa、表面稳定剂分别溶解于溶剂中,将两溶液混合后,得到油相;
s2.将油相滴加到水相中,搅拌,超滤得到pfa纳米粒,即为所述纳米材料。
优选地,所述表面稳定剂为二硬脂酰基磷酸酯酰乙醇胺(dspe-peg)、十二烷基硫酸钠(sds)、泊洛沙姆(pluronicf68)或聚山梨酯中的一种或多种。
更优选地,所述稳定剂为dspe-peg,聚乙二醇链段的重均分子量为2000~3000。
更进一步优选地,所述dspe-peg中聚乙二醇链段的重均分子量为3000。
优选地,表面稳定剂的用量为pfa用量的30%~100%。例如30%、40%、50%、60%、70%、80%、90%或100%。
更优选地,表面稳定剂的用量为pfa用量的40%~70%。
优选地,所述溶剂为dmso或dmf。
优选地,所述水相为水溶液。
优选地,水相与油相的体积比为7~10:1。
优选地,将油相滴加到水相中时,滴加速度为2ml/min。
优选地,搅拌速度为800~1600rpm,搅拌时间为30s~1h。
优选地,超滤2~4次,控制溶剂的含量在千分之一以下。
更优选地,每次超滤的条件为:在3000rpm转速下超滤5~15min。
优选地,聚合物pfa溶液的浓度为5~25mg/ml。例如5mg/ml、10mg/ml、15mg/ml、20mg/ml或25mg/ml。
优选地,所制备得到的pfa纳米粒的平均粒径为70~200nm。
本发明还提供了一种基于阿魏酸聚合物的载药纳米粒,所述载药纳米粒呈壳核结构,包括内核和亲水性外壳;所述内核为所载的药物,所述亲水性外壳为所述聚合物pfa。
优选地,所述载药纳米粒还包括表面稳定剂;所述表面稳定剂为二硬脂酰基磷酸酯酰乙醇胺(dspe-peg)、十二烷基硫酸钠(sds)、泊洛沙姆(pluronicf68)或聚山梨酯中的一种或多种。
优选地,所载的药物为抗肿瘤药物、解热镇痛药或抗生素。
更优选地,所述抗肿瘤药物为化疗药,所述化疗药为疏水性或亲水性的化疗药。
更进一步优选地,所述抗肿瘤药物选自紫杉烷类、阿霉素、喜树碱或所述抗肿瘤药物药学上可接受的盐中的任意一种或多种。
优选地,所述载药纳米粒以dspe-peg作自组装纳米粒的表面稳定剂、聚合物pfa为外壳,以化疗药为疏水性内核形成壳核结构。
优选地,所述载药纳米粒的平均粒径约为90~200nm。
优选地,所述载药纳米粒的载药量为2%~9%。
本发明还提供了一种基于阿魏酸聚合物的载药纳米粒的制备方法,包括以下步骤:
s11.将聚合物pfa、所载的药物、表面稳定剂分别溶解于溶剂中后,混合后,得到油相;
s12.将油相滴加到水相中,搅拌,即可得到所述载药纳米粒。
本发明以聚合物pfa高分子材料作为纳米载体原料,采用简单易行的纳米沉淀法制备纳米载药颗粒,该方法具有操作方便、简单易行、成本低廉以及可重复性好等优势,这些优势可被广泛应用于多种药物的纳米载药颗粒制备。
优选地,聚合物pfa与所载的药物的质量比为5~20:1。例如20:1、19:1、18:1、17:1、16:1、15:1、14:1、13:1、12:1、11:1、10:1、9:1、8:1、7:1、6:1或5:1。
更优选地,聚合物pfa与所载的药物的质量比为5~9:1。
优选地,表面稳定剂的用量为pfa用量的30%~100%。例如30%、40%、50%、60%、70%、80%、90%或100%。
更优选地,表面稳定剂的用量为pfa用量的40%~70%。
优选地,所述表面稳定剂为dspe-peg、sds、pluronicf68、聚山梨酯中的一种或多种。
更优选地,所述稳定剂为dspe-peg,聚乙二醇链段的重均分子量为2000~3000。
更进一步优选地,所述dspe-peg中聚乙二醇链段的重均分子量为3000。
优选地,所述溶剂为dmso或dmf。
优选地,所述水相为水溶液。
优选地,水相与油相的体积比为7~10:1。
优选地,将油相滴加到水相中时,滴加速度为2ml/min。
优选地,搅拌速度为800~1600rpm,搅拌时间为30s~1h。
优选地,超滤2~4次,控制溶剂的含量在千分之一以下。
更优选地,每次超滤的条件为:在3000rpm转速下超滤5~15min。
优选地,聚合物pfa溶液的浓度为5~25mg/ml。例如5mg/ml、10mg/ml、15mg/ml、20mg/ml或25mg/ml。
相应地,上述载药纳米粒在作为或制备治疗癌症药物中的应用,也在本发明的保护范围之内。
在本发明中,载药纳米粒的亲水性外壳为高分子聚合物,其单体来源于天然的植物成分阿魏酸,由此得到的聚阿魏酸是以酯键连接的聚合物,由于对羟基肉桂酸酯很容易被酯酶降解,所以具有良好的生物相容性和可降解性,不产生炎症反应。
本发明的高分子聚合物pfa可自身形成纳米粒,可通过纳米沉淀法制备得到,制备方法简单有重现性。
本发明以聚合物pfa为药物载体装载化疗药物,通过纳米沉淀法制备得到由dspe-peg作稳定剂、以亲水性聚合物外壳和疏水性药物内核自组装成的、性质稳定、呈核壳结构的载药纳米粒。该载药纳米粒实现在体内长循环递送抗癌药物的同时,减少化疗药对人体产生毒副作用。
本发明所述的pfa纳米粒材料和载药纳米粒的粒径均小于200nm,该粒径范围内的纳米粒更易于渗透并聚集在肿瘤部位,更有效地发挥对肿瘤部位的治疗作用。
与现有技术相比,本发明具有以下有益效果:
(1)本发明以阿魏酸为原料合成高分子聚合物pfa,并将其自组装成纳米粒的方法,具备纳米粒壳核结构形态,能够利用epr效应增强药物在肿瘤部位的靶向性。
(2)由于体内的聚合物分解产物最终影响聚合物的总体毒性和相容性,因此,聚合物中单体的化学性质对聚合物的总体设计至关重要。本发明的原料阿魏酸是来自于植物的天然成分,几乎无毒副作用,将其引入阿魏酸基聚合物的骨架中表现出了良好的生物相容性。
(3)阿魏酸属于羟基酸,本发明利用阿魏酸自身结构的酚羟基和羧基在特定条件下分子间缩聚得到有优异热性能的新型均聚酯,制得的聚合物pfa结构稳定,同时酯键可被酶水解也表现了聚合物pfa材料的生物可降解性。
(4)高分子聚合物pfa无毒、生物相容性好,可作为载药体系的优势载体。用pfa包载化疗药的载药纳米粒具有良好的稳定性,粒径在200nm以下,拥有较高的比表面积,载药量最高可达9%,是优良的载药体系,可增强抗肿瘤药物的肿瘤抑制作用。
附图说明
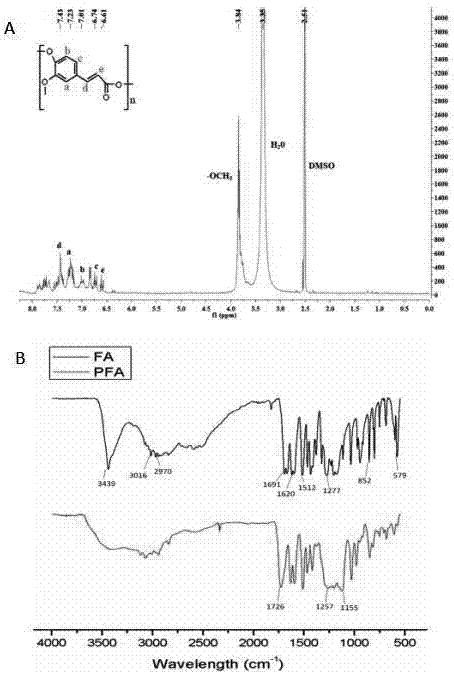
图1为实施例1制备的聚合物pfa的表征;其中,a为聚合物pfa结构氢谱解析图,b为聚合物pfa结构红外光谱解析图。
图2为实施例2制备的pfa纳米粒的表征;其中,a为载体粒径分布图,b为扫描电镜图。
图3为实施例3制备的载药纳米粒pfa@ptx的表征;其中,a为载药纳米粒扫描电镜图,b载药纳米粒稳定性测试结果图。
图4为实施例3制备得到的载药纳米粒pfa@ptx作用于ct26细胞的细胞凋亡结果图。
图5为实施例3制备得到的载药纳米粒pfa@ptx对ct26肿瘤小鼠的抑瘤效果。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1聚合物pfa的制备
1、通过以下方法制备作为药物载体的高分子聚合物pfa,包括以下步骤:
(1)冰浴环境下,加入5ml吡啶,调节ph为8~9;搅拌5min;加入定量socl2,搅拌15min;加入阿魏酸,常温搅拌1h;其中,socl2与阿魏酸的摩尔比为1:1;
(2)将反应后的红棕色溶液转移至烧杯,加水沉淀出黄色不溶物,并用1%hcl洗涤2次,再用超纯水洗涤2次,抽滤得固体,冻干,最终得到棕褐色粉末状产物,即为聚合物pfa。
2、结果
(1)利用500m超导核磁共振波谱仪(ascendtm500)和布鲁克红外光谱仪(vertex70)表征实施例1制备的聚合物pfa的结构。
如图1所示,图1中a图中7.22、7.01、6.74ppm的宽峰来自于聚合物单元中苯环上的三个氢质子,扩展的峰形表明了pfa的成功聚合。从图1中b图中可看出,聚合物pfa无游离羟基,在3700~3300cm-1处几乎无苯环上-oh的吸收峰;羧基转变为酯基后,c=o移向高频,显示为1726cm-1,且1300~1150cm-1之间的峰大而宽。
(2)经鉴定,聚合物pfa结构通式如式(i)所示:
其中,n=3~9。
实施例2一种基于阿魏酸聚合物的纳米材料pfa纳米粒的制备
1、pfa纳米粒的制备,包括以下步骤:
(1)将pfa用dmso配制成10mg/ml溶液,取200μl备用;以dspe-peg3000为表面稳定剂,dspe-peg3000用量为pfa用量的50%,用dmso溶解后,取100μl备用;
(2)将上述两种溶液混合得0.3ml油相,在1200rpm转速下缓慢滴加到3ml水相(水)中,即水相与油相的体积比为10:1,搅拌30s形成纳米粒溶液;
(3)将纳米粒溶液超滤2次(每次3000rpm超滤15min),使dmso含量达到千分之一以下,即可得到pfa纳米粒。
2、结果
利用纳米电位仪和透射电镜进行表征,结果显示如图2,制备得到的纳米材料pfa纳米粒的粒径约100nm,呈圆形或类圆形,大小均匀,所得纳米材料在作为药物传递载体方面具有良好应用前景。
实施例3一种基于阿魏酸聚合物的载药纳米粒(pfa@ptx)的制备
1、通过以下方法制备载药纳米体系,包括以下步骤:
(1)将pfa和紫杉醇(ptx)用dmso均配制成10mg/ml溶液,以pfa与ptx的投料质量比5:1为例,将200μlpfa与40μlptx混合,得到pfa与ptx的混合溶液;以dspe-peg3000为表面稳定剂,dspe-peg3000用量为pfa用量的60%,用dmso溶解后,取120μl的dspe-peg3000溶液与上述pfa、ptx的混合溶液混合,得到油相;
(2)将上述混合的油相在1200rpm转速下缓慢滴加到水相(水)中,控制水相与油相的体积比为10:1,搅拌30s形成纳米粒溶液;
(3)将纳米粒溶液超滤2次(每次3000rpm超滤15min),使dmso含量达到千分之一以下,即可得到载药纳米粒(pfa@ptx)。
2、结果
(1)利用纳米电位仪和透射电镜表征,结果显示如图3,从图3中a图中可看出载药纳米粒pfa@ptx的粒径约120nm,呈圆形或类圆形,大小较为均一。图3中b图显示了,载药纳米粒在pbs、和含10%fbs的pbs中粒径较为稳定。
(2)载药纳米粒pfa@ptx的载药量为9%。
实施例4载药纳米粒(pfa@ptx)的抗肿瘤效果评价
1、对实施例3制备得到的纳米载药体系对小鼠结肠癌ct26细胞进行细胞作用评价。
图4为载药纳米粒pfa@ptx诱导ct26细胞凋亡结果图。由与游离ptx的对比可知,本发明的载药纳米粒pfa@ptx诱导细胞凋亡的作用更强,且载体对癌细胞无明显作用,载体安全无毒。
2、对实施例3制备得到的载药纳米粒pfa@ptx进行体内抗肿瘤作用评价。
体内抑瘤效果如图5所示。载药纳米粒pfa@ptx具有更显著的体内抑瘤效果。由此可知,本发明制备的纳米载药体系有显著的抑瘤效果,在癌症治疗领域有一定的应用潜力。
实施例5聚合物pfa的制备
其他条件与实施例1相同,唯一不同之处在于,socl2与阿魏酸的摩尔比为0.5:1,制备得到棕褐色粉末状聚合物pfa。
实施例6聚合物pfa的制备
其他条件与实施例1相同,唯一不同之处在于,socl2与阿魏酸的摩尔比为3:1,制备得到棕褐色粉末状聚合物pfa。
实施例7聚合物pfa的制备
其他条件与实施例1相同,唯一不同之处在于,加入阿魏酸后,常温搅拌4h,制备得到棕褐色粉末状聚合物pfa。
实施例8聚合物pfa的制备
其他条件与实施例1相同,唯一不同之处在于,加入阿魏酸后,常温搅拌10h,制备得到棕褐色粉末状聚合物pfa。
实施例9聚合物pfa的制备
其他条件与实施例1相同,唯一不同之处在于,加入阿魏酸后,常温搅拌0.5h,制备得到棕褐色粉末状聚合物pfa。
实施例10一种基于阿魏酸聚合物的载药纳米粒的制备
1、通过以下方法制备载药纳米体系,包括以下步骤:
(1)将pfa和解热镇痛药阿司匹林用dmso均配制成10mg/ml溶液,pfa与阿司匹林投料质量比5:1,将pfa与阿司匹林混合,得到pfa与阿司匹林的混合溶液;以dspe-peg3000为表面稳定剂,dspe-peg3000用量为pfa用量的60%,用dmso溶解后,将dspe-peg3000溶液与上述pfa、ptx的混合溶液混合,得到油相;
(2)将上述混合的油相在1200rpm转速下缓慢滴加到水相(水)中,控制水相与油相的体积比为10:1,搅拌30min形成纳米粒溶液;
(3)将纳米粒溶液超滤2次(每次3000rpm超滤15min),使dmso含量达到千分之一以下,即可得到载药纳米粒。
2、结果
本实施例所得的载药纳米粒的粒径约150nm,呈圆形或类圆形,大小较为均一。该载药纳米粒在pbs、和含10%fbs的pbs中粒径较为稳定。
实施例11一种基于阿魏酸聚合物的载药纳米粒的制备
1、通过以下方法制备载药纳米体系,包括以下步骤:
(1)将pfa和青霉素钾用dmso均配制成10mg/ml溶液,pfa与青霉素钾的投料质量比20:1,将两者混合,得到pfa与青霉素钾的混合溶液;以dspe-peg3000为表面稳定剂,dspe-peg3000用量为pfa用量的70%,用dmso溶解后,将dspe-peg3000溶液与上述pfa、ptx的混合溶液混合,得到油相;
(2)将上述混合的油相在1200rpm转速下缓慢滴加到水相(水)中,控制水相与油相的体积比为10:1,搅拌1h形成纳米粒溶液;
(3)将纳米粒溶液超滤2次(每次3000rpm超滤15min),使dmso含量达到千分之一以下,即可得到载药纳米粒。
2、结果
本实施例所得的载药纳米粒的粒径小于200nm,呈圆形或类圆形,大小较为均一。该载药纳米粒在pbs、和含10%fbs的pbs中粒径较为稳定。
实施例12一种基于阿魏酸聚合物的载药纳米粒的制备
1、通过以下方法制备载药纳米体系,包括以下步骤:
(1)将pfa和阿霉素用dmso均配制成10mg/ml溶液,pfa与阿霉素的投料比15:1,将pfa与阿霉素混合,得到pfa与阿霉素的混合溶液;以dspe-peg3000为表面稳定剂,dspe-peg3000用量为pfa用量的100%,用dmso溶解后,将dspe-peg3000溶液与上述pfa、阿霉素的混合溶液混合,得到油相;
(2)将上述混合的油相在1200rpm转速下缓慢滴加到水相(水)中,控制水相与油相的体积比为9:1,搅拌30s形成纳米粒溶液;
(3)将纳米粒溶液超滤2次(每次3000rpm超滤15min),使dmso含量达到千分之一以下,即可得到载药纳米粒。
2、结果
本实施例所得的载药纳米粒的粒径小于200nm,呈圆形或类圆形,大小较为均一。该载药纳米粒在pbs、及含10%fbs的pbs中粒径较为稳定。
申请人声明,以上具体实施方式为便于理解本发明而说明的较佳实施例,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!