一种促进海科贝特氏菌生长及絮凝剂积累的方法与流程
本发明属于生物工程技术领域,涉及对海科贝特氏菌细胞生长及絮凝剂生产的调控,具体涉及一种促进海科贝特氏菌生长及絮凝剂积累的方法。
背景技术:
海科贝特氏菌(cobetiamarina)属γ变形菌纲,盐单胞菌科,科贝特氏菌属,为革兰氏阴性菌,好氧,其形态呈杆状,无芽孢。海科贝特氏菌具有极强的生存适应能力,如可生长于0.5~20%盐分、10~42℃和ph5~10的环境当中(marechal,etal.2004)。海科贝特氏菌以产出的胞外多糖有着良好絮凝作用而被人们熟知,可作为生物淤积的模型被人们所研究(lei,etal.2015;balabanova,etal.2016),同时它作为亚硝酸细菌(nitritebacteria)的一种,能将氨氧化为亚硝酸,在水污染的治理及水产养殖中有着重要作用,因此具有极大的应用前景。
21世纪以来,随着科技的进步,人们的生活质量不断提高,对不可持续资源尤其是化石燃料的利用和依赖与日俱增,生物柴油就此登上舞台。生物柴油可通过微藻合成,目前如何高效进行微藻的富集成了其工业化生产亟待解决的重要问题。至今,微藻收集方法包括离心、过滤和絮凝等,其中絮凝法,尤其生物絮凝法因其成本低廉、环境友好而被广泛应用(万春,等.2015;马志欣,等.2016)。2015年,lei等人从海洋中筛选出一株海科贝特氏菌,其能生产一种稳定絮凝剂,可使微藻絮凝后悬浮于培养液表面,且复选效率高达92.7%(lei,etal.2015)。由于浮选的优点,这种方法能够高效收集微藻,大大增加了微藻制油在未来能源市场的竞争力。但是海科贝特氏菌本身的生长速度要慢于其它工业菌种,而且胞外目标产物的产率不高,阻碍了其进一步的应用。因此,有必要提供一种促进海科贝特氏菌生长并提高其胞外产物产率的方法。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,提供了一种促进海科贝特氏菌生长及絮凝剂积累的方法。
本发明解决其技术问题所采用的技术方案是:
一种促进海科贝特氏菌生长及絮凝剂积累的方法,海科贝特式菌(cobetiamarinamccc1113,购买于国家海洋局第三海洋研究所,中国海洋微生物菌种资源保藏管理中心)经活化后,培养获得种子液;种子液以9~11%的接种量接入发酵培养基,所述发酵培养基中含有葡萄糖25~50g/l,复合氮源7~11g/l,所述复合氮源包括质量比为4~6:1的酵母粉和谷氨酸;然后在26~30℃、140~160rpm发酵培养22~32h,获得海科贝特氏菌及其胞外多糖。
一实施例中:所述发酵培养的时间为30~32h。
一实施例中:所述发酵培养基中,葡萄糖的浓度为28~32g/l。
一实施例中:所述发酵培养基中,复合氮源的浓度为9~10.5g/l。
一实施例中:所述发酵培养基中,复合氮源包括质量比为4.5~5.5:1的酵母粉和谷氨酸。
一实施例中:所述发酵培养基还包括:三羟甲基氨基甲烷(tris-base)1.4~1.6g/l,人工海水75~85%,水15~25%,ph值6.8~7.2;所述人工海水包括:nacl23.5~24.5g/l,mgcl2·6h2o10.5~11.5g/l,na2so43.5~4.5g/l,cacl2·6h2o1.8~2.2g/l,kcl0.6~0.8g/l,kbr0.05~0.15g/l,h3bo30.02~0.04g/l,na2sio3·9h2o0.004~0.006g/l,srcl2·6h2o0.003~0.005g/l,naf0.002~0.004g/l,nh4no30.001~0.003g/l。
一实施例中:所述活化的过程包括:将冻存的海科贝特氏菌菌种转接于平板培养基中,26~30℃培养45~50h;所述培养获得种子液的过程包括:将活化后的海科贝特氏菌接入种子培养基,26~30℃、140~160rpm培养22~26h,获得种子液。
一实施例中:所述平板培养基包括:胰蛋白胨10~11g/l,酵母粉4.5~5.5g/l,氯化钠28.0~32.0g/l,琼脂19.0~21.0g/l,水100%,ph值6.8~7.2。
一实施例中:所述种子培养基包括:胰蛋白胨10~11g/l,酵母粉4.5~5.5g/l,氯化钠28.0~32.0g/l,水100%,ph值6.8~7.2。
本技术方案与背景技术相比,它具有如下优点:
除菌株本身对微生物代谢产物的影响外,培养基的组成和培养条件对微生物的生产及产物积累都有很大影响。例如,胞外多糖的积累与碳源种类和浓度密切相关;单糖对絮凝剂的合成有明显促进作用,葡萄糖几乎对所有微生物都具有普适性;作为构成生物体的蛋白质、核酸及其他氮素化合物的原料,氮源会通过影响细胞生长代谢从而影响产物合成,有机氮源对胞外多糖合成促进作用显著高于无机氮源。而微生物的生长和产物的积累也不是必然线性相关的。因此,碳源、氮源、碳氮比、培养温度、ph等多方面因素是息息相关,相互影响的。本发明综合调控了碳源、氮源、碳氮比、培养温度、ph等多方面因素,得到了促进海科贝特氏菌生长并提高其胞外多糖产率的最佳条件,在该条件下海科贝特氏菌的最大生物量和絮凝剂产量分别为3.5g/l和2.0g/l,较原始发酵培养基条件下分别提高了84.2%和42.8%,为进一步优化培养条件以提高絮凝剂产量,以及进一步大规模工业化应用奠定了基础。
附图说明
下面结合附图和实施例对本发明作进一步说明。
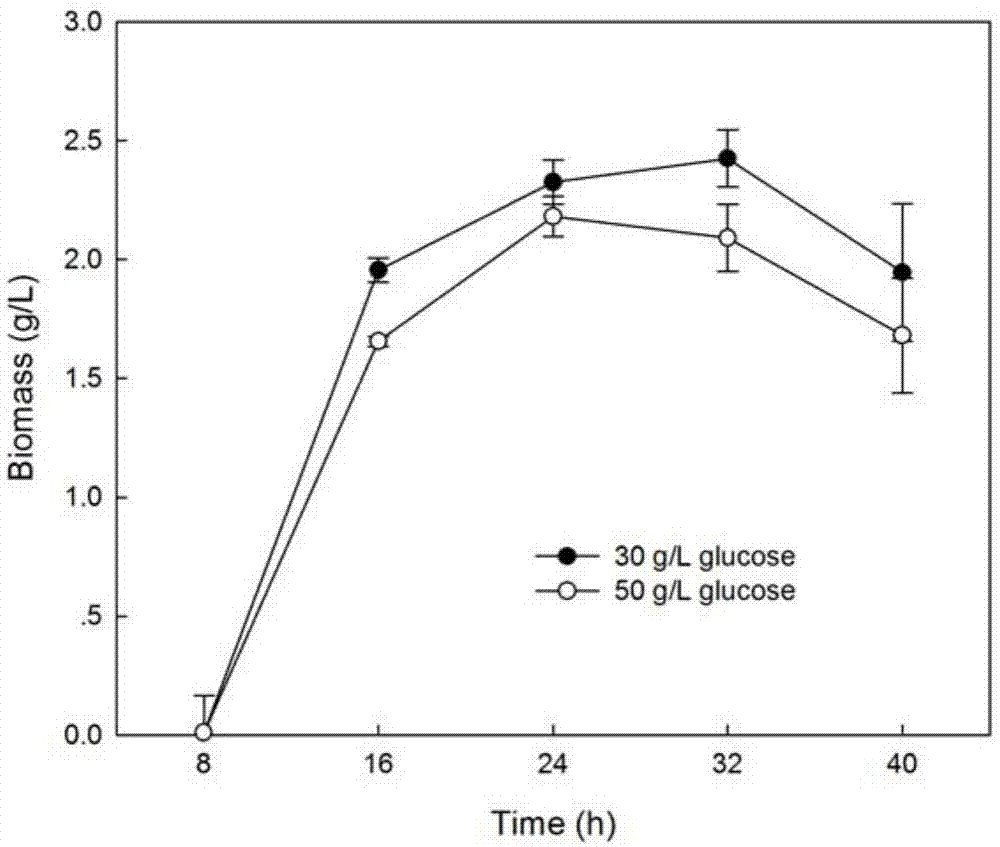
图1为不同葡萄糖浓度对海科贝特氏菌生物量的影响,图中横坐标代表时间,纵坐标代表生物量。
图2为不同葡萄糖浓度对海科贝特氏菌絮凝剂产量的影响,图中横坐标代表时间,纵坐标代表絮凝剂产量。
图3为不同氮源种类对海科贝特氏菌生长及絮凝剂积累的影响,图中横坐标代表不同种类的氮源,纵坐标代表生物量及絮凝剂产量。
图4为不同酵母粉浓度对海科贝特氏菌生长及絮凝剂积累的影响,图中横坐标代表不同酵母粉浓度,纵坐标代表生物量及絮凝剂产量。
图5为不同谷氨酸浓度对海科贝特氏菌生长及絮凝剂积累的影响,图中横坐标代表不同谷氨酸浓度,纵坐标代表生物量及絮凝剂产量。
图6为复合氮源对海科贝特氏菌生长及絮凝剂积累的影响,图中横坐标代表不同比例的复合氮源,纵坐标代表生物量及絮凝剂产量。
具体实施方式
下面通过实施例具体说明本发明的内容:
实施例
一种促进海科贝特氏菌生长及絮凝剂积累的方法,包括:
1)菌种活化:将保藏于-70℃的海科贝特氏菌菌种(cobetiamarinamccc1113,购买于国家海洋局第三海洋研究所,中国海洋微生物菌种资源保藏管理中心)转接于平板培养基中,28℃培养48h,观察菌落形态,于4℃冰箱中贮存备用;
所述平板培养基包括:胰蛋白胨10.5g/l,酵母粉5.0g/l,氯化钠30.0g/l,琼脂20.0g/l,ddh2o100%,ph值7.0。
2)一级种子培养:将步骤1)中的平板菌落,用接种环挑取将活化的菌种接入装有50ml种子培养基的250ml锥形瓶,28℃、150rpm培养24h,得到种子液;
所述种子培养基包括:胰蛋白胨10.5g/l,酵母粉5.0g/l,氯化钠30.0g/l,ddh2o100%,ph值7.0。
3)摇瓶发酵:将步骤2)中的种子液,以10%的接种量接入装有发酵培养基的250ml锥形瓶中,在28℃、150rpm发酵培养24~32h,获得海科贝特氏菌及其胞外多糖;其中,
所述发酵培养基在原始培养基的基础上进行了优化,包括:葡萄糖30~50g/l,复合氮源8~10g/l,所述复合氮源包括质量比为4~6:1的酵母粉和谷氨酸;还包括:三羟甲基氨基甲烷(tris-base)1.5g/l,人工海水80%,ddh2o20%,ph值7.0;其中,人工海水包括:nacl24.0g/l,mgcl2·6h2o11.0g/l,na2so44.0g/l,cacl2·6h2o2.0g/l,kcl0.7g/l,kbr0.1g/l,h3bo30.03g/l,na2sio3·9h2o0.005g/l,srcl2·6h2o0.004g/l,naf0.003g/l,nh4no30.002g/l。
上述原始培养基(eps培养基)作为对比使用,包括:胰蛋白胨5.0g/l,酵母粉1.0g/l,三羟甲基氨基甲烷(tris-base)1.5g/l,人工海水80%,ddh2o20%,ph值7.0;其中,人工海水包括:nacl24.0g/l,mgcl2·6h2o11.0g/l,na2so44.0g/l,cacl2·6h2o2.0g/l,kcl0.7g/l,kbr0.1g/l,h3bo30.03g/l,na2sio3·9h2o0.005g/l,srcl2·6h2o0.004g/l,naf0.003g/l,nh4no30.002g/l。
通过以下实验例验证了本实施例的促进海科贝特氏菌生长及絮凝剂积累的方法。
实验例1:不同葡萄糖浓度对海科贝特氏菌生长及絮凝剂积累的影响
参照上述实施例的方法,海科贝特氏菌经平板活化后,用接种环挑取活化的菌种接入装有50ml种子培养基的250ml锥形瓶,28℃、150rpm培养24h。将活化后的菌株接入250ml摇瓶培养,载液量为50ml,在发酵培养基中分别配制不同浓度葡萄糖(终浓度为30g/l或50g/l),28℃,150rpm培养至40h。培养过程中每8h取一次样,测量各实验组的生物量及絮凝剂产量,结果如图1和图2所示。
由图1可知,海科贝特氏菌的生长符合微生物培养的一般生长规律,0~8h为停滞期,8~16h菌体迅速进入对数生长期并于24h趋于平稳,24~32h为稳定期。由于出现底物抑制现象,当碳源浓度为30g/l时生物量积累显著高于50g/l,且在32h生物累积量最高,为2.4g/l,32h后因为培养基中营养匮乏及菌体衰老自溶等因素,2个葡萄糖浓度下的菌体生物量均开始降低。
实验以发酵液上清的醇沉产物代表絮凝剂的含量。如图2所示,相较于50g/l葡萄糖浓度,当葡萄糖浓度为30g/l时更有利于絮凝剂的积累,且在培养至24h时絮凝剂的产量达到最高浓度2.2g/l。继续培养,絮凝剂的产量开始降低,证明细胞衰亡自溶时可能会伴随部分胞外产物的消耗。
由以上的实验结果可知,当发酵培养基中葡萄糖浓度为30g/l时更有利于细胞生长及絮凝剂积累。
实验例2:不同氮源种类对海科贝特氏菌生长及絮凝剂积累的影响
以6g/l氮源浓度为基准,选择6种氮源进行实验,分别为酵母粉、谷氨酸、胰蛋白胨、硝酸铵、氯化铵及尿素,葡萄糖浓度为30g/l的情况下发酵培养至32h取样测定各参数,结果如图3所示。有机氮源对海科贝特氏菌的生物量及絮凝剂积累效果要显著优于无机氮源。其中,酵母粉条件下絮凝剂产量最高,而以谷氨酸为氮源的条件下菌体生物量最高,分析认为,酵母粉能更好地促进胞外产物的生成,而谷氨酸则可以促进生物量的积累。同时,酵母粉、谷氨酸和胰蛋白胨每500g市场价格分别为215.00、170.00、515.00元,因此,酵母粉和谷氨酸作该培养基的氮源是最好的选择。
实验例3:不同氮源浓度对海科贝特氏菌生长及絮凝剂积累的影响
葡萄糖浓度为30g/l的情况下发酵培养至32h取样测定各参数。由图4可知,随着酵母粉浓度的提高,菌体生物量和絮凝剂的产量也随之增多。当酵母粉浓度为10g/l时,发酵培养至32h菌体生物量为2.5g/l,絮凝剂产量为2.0g/l。由图可见,酵母粉浓度从3g/l增至8g/l时,菌体生物量和絮凝剂的产量都有显著的提高;而当浓度继续增至10g/l,菌体生物量和絮凝剂的产量增长趋势减缓,分析认为较高氮源浓度条件下,氮源可能不再作为影响细胞生长和产物合成的主要因素。
图5所示为不同谷氨酸浓度对海科贝特氏菌生长及絮凝剂积累的影响,由图可见,随着谷氨酸浓度的升高,菌体生物量呈现先升高后下降的趋势,当谷氨酸浓度为8g/l时,发酵培养至32h时菌体生物量最高,为2.3g/l,而随着氮源浓度的升高,絮凝剂的积累并没有受到促进。
综上所述,酵母粉对于海科贝特氏菌生长及絮凝剂积累的促进作用优于谷氨酸,但谷氨酸可以在浓度较低的情况下较为显著地促进菌体生长。故本发明将酵母粉和谷氨酸复合使用,较高浓度的酵母粉搭配较低浓度谷氨酸,可以取得协同增效的作用。
实验例4:复合氮源对海科贝特氏菌生长及絮凝剂积累的影响
进一步在发酵培养基中配制不同浓度的复合氮源(酵母粉:谷氨酸的质量比分别为4:1、5:1及6:1),葡萄糖浓度为30g/l的情况下,发酵培养至32h取样测定各参数,结果如图6所示。结果表明,三组复合氮源的培养结果显然优于原始培养基中酵母粉和胰蛋白胨的组合,取得协同增效的作用。酵母粉:谷氨酸为4:1时,菌体生物量达到最高值3.6g/l。而当酵母粉:谷氨酸为5:1时,絮凝剂产量达到最高值2.0g/l,且在保证了最高产物积累的同时,菌体生物量亦达到3.5g/l,此时,菌体生物量和絮凝剂产量分别比原始培养基提高了84.2%和42.8%,因此,酵母粉和谷氨酸浓度比例为5:1作为复合氮源的最佳配比。
综上所述,本发明以eps培养基为基础,通过多方面因素的综合调控,得到了促进海科贝特氏菌生长并提高其胞外多糖产率的最佳条件,包括最佳碳源浓度,复合氮源种类和浓度,即在发酵培养基中,葡萄糖浓度为30g/l,复合氮源总浓度为10g/l(酵母粉:谷氨酸的质量比为5:1)时,发酵培养海科贝特氏菌至32h可获得最高的生物量和絮凝剂产量。
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
-
 0访客 来自[河北省石家庄市电信] 2019年08月17日 10:31海科呗特球菌,也是其中一种吗
0访客 来自[河北省石家庄市电信] 2019年08月17日 10:31海科呗特球菌,也是其中一种吗