一种去氧常山酮类化合物及其制备方法和应用与流程
本发明属于医药技术领域,更具体地,涉及一种去氧常山酮类化合物及其制备方法和应用。
背景技术:
20世纪40年代青霉素的问世将人类带入了抗生素时代,抗感染治疗由此进入了新纪元,感染性疾病的病死率大大降低。半个世纪以来,人类一直把抗菌药物作为抗感染治疗最有力的武器。然而,随着抗菌药物的广泛应用,细菌对抗生素产生了耐药性。有些菌种还产生了交叉抗药性,例如金黄色葡萄球菌,肺炎链球菌,沙门杆菌和结核分枝杆菌,这些菌株找不到合适的治疗药物。近年来,耐药菌正在加速传播,严重威胁着人类的健康与安全。因此,开发能有效抑制剂耐药菌的具有新机制、新靶标和新骨架的抗菌新药迫在眉睫。
氨酰转运核糖核酸合成酶(aminoacyl-trnasynthetase,aars)是生命活动的关键酶。aars催化氨基酸转移到其相应的转运核糖核酸(trna)的末端,提供氨酰trna给核糖体作为其合成生命活动所需的各类蛋白质的原料。一旦aarss的活性受到抑制,细胞内蛋白质的生物合成将被终止,致使细菌或细胞停止生长。真核生物和原核生物的aarss在进化过程中产生了巨大差异,在研发过程中可以利用这一差异开发出能够特异性抑制细菌aars酶系的小分子药物。鉴于aars酶系存在于各种细菌之中,靶向细菌aars酶系有可能研发出广谱抗菌药物。
常山酮(halofuginone)是从我国中药常山中提取出的常山碱的衍生物。文献报道常山酮在底物atp存在的情况下可以结合人源和疟原虫源的脯氨酰转运核糖核酸合成酶(prolyl-trnasynthetase,prorss)的trna3’末端结合口袋以及脯氨酸结合口袋,表现出良好的抗癌与抗疟活性。目前,利用常山酮治疗多种癌症的研究已进入临床试验阶段。至今,仍未发现靶向细菌型prors的抗菌药物。常山酮对人源和疟原虫源prors的双位点抑制模式为新型抗菌抑药物的设计提供了有益参考。因此,合成靶向细菌prors的常山酮类化合物的研究具有重要应用意义。
技术实现要素:
本发明的目的在于提供一种去氧常山酮类化合物。
本发明的另一目的在于提供上述去氧常山酮类化合物的制备方法。
本发明的再一目的在于提供去氧常山酮类化合物在抗细菌感染疾病中的应用。
本发明的上述技术目的通过以下技术方案实现:
一种去氧常山酮类化合物,结构式如下所示:
其中,式中r1为卤基或氢;r2为氢,卤基,c1~c3的烷基,c1~c3的烷氧基或三氟甲基;r3为为氢,卤基,c1~c3的烷基,c1~c3的烷氧基或三氟甲基;;x1或x2为氮或碳;y为氢,羟基或羰基。
优选地,r1为氯或氢。
优选地,r2为氢,氯、氟、c1~c3的烷基,c1~c3的烷氧基或三氟甲基。
优选地,r3为氢,氯、氟、溴、c1~c3的烷基,c1~c3的烷氧基或三氟甲基。
本发明提供所述的去氧常山酮类化合物的制备方法,包括如下步骤:
本发明同时保护所述的去氧常山酮类化合物在制备抗细菌感染药物中的应用。
进一步地,所述的去氧常山酮类化合物靶标细菌型prors。
进一步地,抗细菌感染中细菌为大肠杆菌、福氏志贺杆菌、乙型副伤寒沙门氏菌、标准金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌mrsa(r3708)、耐甲氧西林金黄色葡萄球菌mrsa252、金黄色葡萄球菌亚型或表皮葡萄球菌中的一种或多种。
本发明的抗细菌感染药物中的去氧常山酮类化合物能够与耐甲氧西林金黄色葡萄球菌和大肠杆菌的prors结合。以耐甲氧西林金黄色葡萄球菌的prors(mrsaprors)和化合物4作为代表,我们通过解析常山酮(halofuginoe,hf)和化合物4分别与mrsaprors的三元复合物晶体结构,阐述了常山酮和去氧常山酮结合和抑制mrsaprors的作用机制。我们合成的这些去氧常山酮类化合物能够明显地抑制革兰氏阳性(gram+)和革兰氏阴性(gram-)细菌。其在体外的抗菌能力与阳性对照氨苄青霉素钠,环丙沙星和万古霉素相当,甚至更优。与之对照的是,体外实验显示常山酮自身的抗菌活性很弱,或在实验浓度范围内观察不到对细菌生长有明显抑制效果。此外,此类去氧常山酮类化合物的对宿主的真核细胞的细胞毒性要明显低于常山酮自身。因此,此类去氧常山酮类化合物在治疗细菌感染等方面有良好的发展前景。
去氧常山酮类化合物的制备方法,包括如下步骤:以哌啶为原料,通过氯代、消除、加成、boc基团保护、取代和脱boc保护制得,或进一步还原制得,或通过cbz保护,取代,脱cbz保护制得。其合成路线如下:
相对于现有技术,本发明具有如下的优点及效果:
本发明合成去氧常山酮类化合物以哌啶为原料,原料价廉易得,合成方法简单易操作,产率高,产物稳定。本发明提供的去氧常山酮类化合物对革兰氏阳性(gram+)和革兰氏阴性(gram-)细菌均具有良好抑制效果,在治疗细菌感染方面有良好的发展前景。
附图说明
图1为常山酮和化合物4的结构和活性结果;
图2为常山酮对prors的抑制活性;
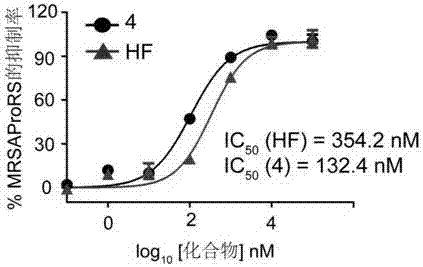
图3为常山酮和化合物4抑制mrsaprors氨酰化的抑制率拟合得到的抑制率和半数抑制浓度ic50值;
图4为在不同atp浓度下常山酮和化合物4与mrsaprors的亲和力;
图5为化合物4对mrsa252和大肠杆菌的获得体外耐药性结果,其中左氧氟沙星和万古霉素为mrsa252的对照,氨苄西林钠和环丙沙星为大肠杆菌的对照;
图6为常山酮与mrsaprors三维结合模式图;
图7为化合物4与mrsaprors三维结合模式图。
具体实施方式
以下结合具体实施例和附图来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,本发明所用试剂和材料均为市购。
实施例1(r)-3-丁基-2-(3-溴-2-丙酰基)哌啶-1-羧酸酯(化合物23)的制备
将哌啶(100mmol),ncs(111.6mmol)在溶剂乙醚(500ml)中快速搅拌,室温反应4h。反应完全后过滤除去残渣,滤液室温浓缩至80ml左右,再冰浴滴加到氢氧化钾(100mmol)乙醇(50ml)溶液中,反应过夜,过滤得滤液a。将氢氧化钠(150mmol)和乙酰乙酸乙酯(100mmol)在溶剂水中,加热50℃反应4h,进一步室温搅拌反应过夜得b。将a和b混合回流反应4h,得黄色溶液。用二氯甲烷(3×75ml)萃取,有机相用无水硫酸镁干燥,减压除去有机溶剂得粗品。粗品再与二碳酸二叔丁酯(100mmol),碳酸氢钠(150mmol)在溶剂乙醇(300ml)室温搅拌反应8h。过滤除去碳酸氢钠,减压除去溶剂,用流动相(环己烷:乙酸乙酯(v/v)=1:4)过硅胶柱,得中间体c。中间体c和三乙胺(200mmol),三氟甲磺酸三甲基硅酯(100mmol)在溶剂thf(500ml)中冰浴搅拌1h,继而缓慢加入nbs(100mmol)反应20min。以tlc检测反应,待反应完全后,加入饱和碳酸氢钠中和,再用二氯甲烷(3×75ml)萃取。萃取的有机相用无水硫酸镁干燥,减压除去有机溶剂得粗品。粗品进而用流动相(己烷:乙酸乙酯(v/v)=1:10)环过硅胶柱,即得到产物23。产率约为35%。
实施例2去氧常山酮类化合物(化合物1-15)的制备
化合物23(2mmol),相应取代的喹唑啉酮(2mmol),碳酸钾(6mmol)在溶剂dmf(5ml)中反应2-8h。以tlc检测反应,待反应完全后,加入过量的水,在室温下析出固体。抽滤即得中间体d。将中间体d溶于1,4-二氧六环(3ml)中,室温滴加4-6d浓盐酸。以tlc检测,待反应完全后,减压除去有机溶剂。以流动相(二氯甲烷:甲醇(v/v)=1:7)过硅胶柱,即得化合物1-15,其产率约为75-90%。
实施例3去氧常山酮类化合物(化合物16)的制备
化合物2(2mmol)和硼氢化钠(2mmol)在溶剂甲醇(2ml)中冰浴反应1h。以tlc检测反应进程,待反应完全后,减压除去有机溶剂。以流动相(二氯甲烷:甲醇(v/v)=1:6)过硅胶柱,即得化合物16。其产率约为100%。
实施例4去氧常山酮类化合物(化合物17-19)的制备
化合物24(10mmol),碳酸钠(20mmol),水(10ml)和氯甲酸苄酯(12mmol)在室温反应4h。待tlc检测显示反应完全后,以二氯甲烷(3×10ml)萃取。萃取所得有机相用无水硫酸镁干燥,并减压除去有机溶剂得粗品。将粗品与nbs(10mmol)和三苯基膦(15mmol)在溶剂二氯甲烷中室温反应过夜。待tlc检测显示反应完全后,减压除去有机溶剂,以流动相(环己烷:乙酸乙酯(v/v)=1:10)过硅胶柱,得中间体25。将中间体25(2mmol),相应取代的喹唑啉酮(2mmol)以及碳酸钾(6mmol)在溶剂dmf(5ml)中反应2-8h。待tlc检测显示反应完全后,加入过量的水,室温析出固体,抽滤得中间体e。将中间体e溶于冰乙酸(3ml)和氢溴酸(1ml)的混合液中,室温反应2h。待tlc检测反应完全后,减压除去有机溶剂,流动相(二氯甲烷:甲醇(v/v)=1:7)过硅胶柱,即得化合物17-19。化合物17-19的产率约为50-57%。
通过上述合成路线制备得到了多种去氧常山酮类化合物,将其中部分产物分别编号为化合物1-19,其产率及h分析见表1。
表1.去氧常山酮类化合物分析
实施例5
1.耐甲氧西林金黄色葡萄球菌(mrsa)的脯氨酰转运核糖核酸合成酶(mrsaprors)的原核表达质粒的构建
将mrsaprors(uniprokb编号q6ghh2)的全长(氨基酸序列1-567)的dna编码序列插入到pet20b(+)载体,并在该dna序列的上游插入编码六组氨酸标签和酵母sumo蛋白标签的相应dna序列,构建成表达his6-sumo-mrsaprors融合蛋白的原核表达质粒。插入的dna序列经过dna测序予以验证。
mrsaprors全长蛋白质(氨基酸序列1-567)的氨基酸序列为:
mkqskvfiptmrdvpseaeaqshrlllkaglikqstsgiysylplatrvlnnitaivrqemeridsveilmpalqqaelweesgrwgaygpelmrlqdrhgrqfalgptheelvtsivrnelksykqlpmtlfqiqskfrdekrprfgllrgrefimkdaysfhadeasldqtyqdmyqaysrifervginarpvvadsgaiggshthefmalsaigedtivyskesdyaaniekaevvyepnhkhttvqpiekietpnvktaqeladflgrpvdeivktmifkvdgeyimvlvrghheindiklksyfgtdnielatqdeivnlvganpgslgpvidkeikiyadnfvqdlnnlvvganedgyhlinvnvgrdfnvdeygdfrfilegeklsdgsgvahfaegievgqvfklgtkysesmnatfldnqgkaqplimgcygigisrtlsaiveqnhddngivwpksvtpfdlhlisinpkkddqreladalyaefntkfdvlyddrqeragvkfndadliglplrivvgkrasegivevkerltgdseevhiddlmtvitnkydnlk。
编码mrsaprors全长蛋白质的dna序列为:
atgaagcaatccaaagtttttataccaacgatgcgtgacgtgccatcagaagcagaagcacaaagtcatcgtttattattgaaatcgggtttgataaaacaaagtacaagtgggatttatagttatttaccgctagcaacacgtgtgttaaataatattactgcaattgtgcgacaagaaatggaacgtatcgattctgttgaaattttaatgccagcgttacaacaagctgaattatgggaagaatcaggacgttggggtgcatatggcccagaattaatgcgtttacaagatagacatggaagacaatttgcattaggtccaacacatgaagaattagttacatcaatagtaagaaatgaattgaaatcatacaaacaattaccgatgacattattccaaattcaatctaaattccgtgatgaaaagagaccacgttttggtttacttcgtgggcgtgaatttattatgaaagatgcatattcattccatgctgacgaggcatcattagatcaaacgtatcaagatatgtatcaagcgtatagccgtatttttgagagagttggcattaacgcaagaccagtagttgcagattcaggtgctataggcggtagccatacacatgaatttatggcattaagtgctatcggtgaggatacaatcgtttacagtaaagaaagtgattatgctgctaacatcgaaaaagcagaagtcgtttacgaaccaaatcataagcatactactgtgcaacctttagaaaaaattgaaacaccaaatgttaagactgcgcaagaattggcagacttcttaggtagaccagtagatgaaatcgttaaaacgatgattttcaaagttgatggcgaatatattatggttttagtgcgtggccatcatgaaattaatgacattaaattaaaatcttatttcggcacagataatattgaattagcaacacaagacgaaattgttaatttagttggtgcaaatcctggttcactaggtcctgtaattgataaagaaatcaaaatttatgcagataattttgtgcaagatttaaataatttagttgtcggtgctaacgaagatggttatcacttaattaatgtaaatgtaggtagagacttcaacgttgatgaatatggcgatttccgttttattttagaaggcgaaaagttaagtgatggttcaggcgttgcacattttgctgaaggtattgaagttggtcaagtattcaaattgggtactaagtattcagaatcaatgaatgctacattcttagataaccaaggaaaagctcaatctttaattatgggttgttacggaattggaatttctagaacgctaagtgcgattgttgaacaaaatcacgatgataatggaattgtttggcctaaatcagttactccgtttgatttacatttaatttctattaatcctaagaaagatgatcaacgagaactagcagatgcactatatgctgaatttaatactaaatttgatgtgttgtacgatgatcgtcaggaacgtgcaggtgttaaatttaatgatgccgatttaattggtttaccactgcgaattgttgttggtaaacgtgcatcggaaggtattgtagaagttaaagaacgtttaacaggtgatagcgaagaagttcacattgatgacttaatgactgtcattacaaataaatatgataacttaaaa。
2、mrsaprors融合蛋白的表达
将上述his6-sumo-mrsaprors质粒转入大肠杆菌bl21(de3)。将转有质粒的bl21(de3)细菌在含有100μg/l的氨苄霉素的luria-bertani(lb)培养基中37℃温度下220rpm震荡培养,直到od600=0.6。然后,在培养基中加入0.15mm的诱导剂异丙基硫代半乳糖苷(iptg),在18℃温度下继续培养,让目标蛋白充分表达。18小时后,离心法收集菌体。
3、mrsaprors的纯化
将上述收集到的菌体用裂解缓冲液(20mmtris-hclph8.0,400mmnacl,20mm咪唑)充分悬浮,然后利用超声破碎法在冰浴温度下裂解细胞。高速离心去除细菌裂解液中的细菌残片、细胞器等,收集上清液。利用ni-nta亲和层析树脂捕获上清液中的目标蛋白,用裂解缓冲液充分清洗残留在ni-nta层析柱上的杂蛋白。在层析柱中加入蛋白酶ulp1低温过夜孵育,将融合蛋白的his6-sumo蛋白标签与mrsaprors目标蛋白切割开。隔天,收集层析柱穿透峰中的切割后的mrsaprors目标蛋白质样品。利用12%sds-page检测目标蛋白的纯度。最后,浓缩mrsaprors蛋白样品,得到2ml浓度为31mg/ml的高纯度mrsaprors蛋白样品,储存在-80℃备用。
应用实施例1:去氧常山酮类化合物1-19与病原细菌prors结合能力的热稳定性迁移实验(thermalshiftassay,tsa)。
在96孔pcr板上配置20μl反应体系(全程在冰上操作),包含:100mmhepes(ph7.5),150mmnacl,2×syproorange荧光染料,8μm大肠杆菌或耐甲氧西林金黄色葡萄球菌的prors蛋白质(ecprors或mrsaprors),1mmmgcl2,1mmamppnp和500μm化合物,轻柔混匀。把96孔pcr板放到steponeplus实时荧光定量pcr仪中,在25℃孵育10min,然后按照1℃/min的升温速率从25℃升到95℃。升温期间,每30秒检测一次每孔的荧光信号。随着温度升高,ecprors或mrsaprors逐渐发生热变性,随之荧光信号增强。以荧光信号作为纵坐标,温度作为横坐标,用origin8软件的玻尔兹曼法拟合绘制蛋白质热变性曲线并推测蛋白质热变性温度tm。某一个化合物对ecprors或mrsaprors热稳定性的贡献可以用含有该化合物是蛋白质的tm值减去不含化合物的空白蛋白质的tm值,即δtm,来评价。δtm越大表示结合能力越强。实验测得的去氧常山酮类化合物对ecprors和mrsaprors的δtm数据见表2。
表2去氧常山酮类化合物与ecprors和mrsaprors的结合能力。
注:ana表示δtm值≤0,表示相应化合物在实验条件下不与蛋白结合发生可以测量到的结合。
应用实施例2:常山酮或化合物4与mrsaprors的复合物晶体的制备、x射线衍射数据收集与共晶结构解析。
(1)常山酮或化合物4与mrsaprors的复合物结晶的制备
常山酮或化合物4与mrsaprors的复合物晶体采用坐滴气相扩散法生长。化合物浓度为2mm,mrsaprors蛋白浓度为30mg/ml。结晶条件为32-40%(v/v)pentaerythritolpropoxylate(5/4po/oh),0.1-0.2mkcl和50mmhepes(ph7.5),在25℃生长5天,即可获得可供x射线衍射的高分辨率晶体。
(2)常山酮或化合物4与mrsaprors的共晶的x射线衍射数据采集与共晶结构解析
衍射数据采集在上海同步辐射光源(ssrf)bl17u1工作站进行。每颗晶体收集180幅衍射画面,每幅图像曝光时间为0.5秒,旋转角度1°。hf和化合物4的两颗晶体分别采集到
衍射数据采用hkl2000软件进行指标化、积分和合并。利用molrep程序,以粪肠球菌prors的三维结构座标(pdb编号:2j3l)为模板,通过分子置换解析衍射相位。利用coot程序,根据实空间的电子密度图形状,手动修正和完善蛋白质结构模型。同时,使用refmac5程序,在倒易空间对结构模型进行自动优化。在实空间与倒易空间之间,交替进行多轮的结构修正,直至结构模型达到较高质量。关于数据采集和结构修正的主要统计参数见表3。晶体结构显示hf和化合物4均为在atp类似物辅助下作用于mrsaprors的trna和氨基酸位点。图6为hf与mrsaprors三维晶体复合物结构图;图7为化合物4与mrsaprors三维晶体复合物结构图。
表3常山酮和化合物4与mrsaprors的晶体收集修正统计表。
a括号内为最高分辨率壳层的数据。
b计算公式为:数据合并的线性r因子=∑h∑k|ihk-<ih>|/∑h∑k<ih>,其中,ihk是第h个衍射点第k次重复手机是的衍射强度,<ih>是第h个衍射点重复收集多次后的平均值。
c工作r因子=∑h||fobs(h)|-|fcal(h)||/∑h|fobs(h)|,其中fobs(h)和fcal(h)分别表示h衍射点实验观察到的和依据结构模型计算得到的结构因子。
d自由r因子的计算方法与工作r因子一致,但自由r因子是由随机挑选出的5%的专用于监测的衍射点来计算的。
应用实施例3:去氧常山酮类化合物对mrsaprors的抑制活性。
采用碱性磷酸酶-孔雀绿定磷法,取反应缓冲液(20mmtris-hcl(ph7.4),10mmmgcl2、1mmdtt和0.1mmedta)54μl加入到96孔板中,加入2μl的2u/ml焦磷酸酶,2μl不同浓度的去氧常山酮类化合物。加入2μl的8μmmrsaprors。室温孵育30min后,加入20μl的底物溶液(含400μmatp和1ml-缬氨酸)起始反应。37℃反应20min后用酶标仪检测620nm处的吸光度。实验含a,b和c三组,其中a、b和c分别是不加化合物空白组,加化合物组和不加底物组。抑制率计算采用公式:抑制率%=(od620(a)–od620(b))/(od620(a)–od620(c))×100。ic50用graphpadprism拟合计算,结果见图2和图3。
应用实施例4:去氧常山酮类化合物与mrsaprors的亲和力测定。
首先通过nanotemper提供的脱盐柱,置换mrsaprors里的trisbuffer为:(10mmhepesph7.5,50mmnacl),蛋白浓度为20μm,将200μl的蛋白溶液和40μm的荧光标记物混合,避光孵育30min后,用试剂盒里的小分子筛柱除去过量的荧光标记物,获得已标记的蛋白质。将100nm标记的mrsaprors与不同浓度的化合物在室温条件下混合孵育20min,随后加入到标准毛细管中,用monolithnt.115微量热泳动仪(nanotempertechnologiesgmbh,germany)进行测定,参数设定为:ledpower:25%,mstpower:20%、40%和80%。测定完成后,用nanotemperanalysis1.2.20软件分析实验数据,获得不同浓度化合物下的mrsaprors的热泳动系数。以化合物浓度为x轴,mrsaprors热泳动系数为y轴,拟合得到化合物与蛋白的kd值,结果见图4。
应用实施例5:去氧常山酮类化合物的体外抗菌活性的测定。
采用国际标准培养基,最小抑菌浓度(mic)实验评价去氧常山酮类化合物1-19的抗菌活性。测试的菌株有大肠杆菌(atcc25922),福氏志贺杆菌(cmcc51572),乙型副伤寒沙门氏菌(cmcc50094),标准金黄色葡萄球菌(atcc29213),耐甲氧西林金黄色葡萄球菌mrsa(r3708),耐甲氧西林金黄色葡萄球菌mrsa252,金黄色葡萄球菌亚型(atcc25923)和表皮葡萄球菌(atcc1228)。阳性对照用万古霉素(vancomycin),氨苄西林钠(ampicillin),环丙沙星(ciprofloxacin)。
首先96孔板中第一列加入培养基90μl,其他除空白对照均加入培养基50μl。然后,第一列中加入用dmso溶解的化合物10μl,混合均匀。吸取第一列中的混合物50μl,置于第二列中混合均匀,再吸取50μl加入第三列。以此类推,最终将化合物1-19和阳性对照药进行梯度稀释(256、128、64、32、16、8、4、2、1、0.5、0.25μg/ml)。在每孔中分别加入50μl各种菌液。其中最后一列为培养基和菌液的空白对照,最后一排为阳性对照。将96孔板置于37℃,培养12h。测量600nm处各孔的吸收值,确定化合物对不同菌种的最小抑菌浓度(mic)值。
分析去氧常山酮类化合物(化合物1-19)对8种细菌的抑菌活性,结果见表4。结果表明,针对大肠杆菌,福氏志贺杆菌,乙型副伤寒沙门氏菌,标准金黄色葡萄球菌,耐甲氧西林金黄色葡萄球菌mrsa(r3708),耐甲氧西林金黄色葡萄球菌mrsa252,金黄色葡萄球菌亚型和表皮葡萄球菌这八种感染性细菌,去氧常山酮类化合物(化合物2~5)均有显著的活性。特别是化合物4,对这八种细菌的mic分别为1μg/ml,1μg/ml,2μg/ml,2μg/ml,1μg/ml,2μg/ml,4μg/ml和1μg/ml,与阳性对照药万古霉素,氨苄西林钠和环丙沙星相当,甚至活性更好。其余化合物(含常山酮自身)均未显示出明显的抗菌活性。
表4去氧常山酮类化合物体外最小抑菌浓度(mic)测试结果。
注a最小抑菌浓度;nt,没有测试。
应用实施例6:去氧常山酮类化合物的体外耐药性的测定。
与细菌的mic测试类似,首先在96孔板的第一列加入培养基90μl,其他除空白对照均加入培养基50μl;然后第一列中加入用dmso溶解的化合物10μl,混合均匀;吸取第一列中的混合物50μl,置于第二列中混合均匀,以此类推,最终将化合物4和阳性对照药进行梯度稀释(256、128、64、32、16、8、4、2、1、0.5、0.25μg/ml);最后分别加入50μl前面所待用的菌液;其中最后一列为培养基和菌液的空白对照,最后一排为阳性对照;将96孔板置于37℃,5%co2培养箱培养12h;并用酶标仪测试od600,选取od600≥1的最高药物浓度作为mic值,然后将其菌液稀释1000倍作为下一代的接种液,继续测试mic值,并将菌液取出适量放入含有20%甘油的菌种管内,置于-80℃冰箱保存留用。依照此方法,每天传代一次,连续传代15天。所用的对照抗生素采用同样的方法和实验过程。然后,以天数为横坐标,mic值为纵坐标,即可得到细菌对化合物的诱导耐药曲线图,结果见图5。
综上所述,去氧常山酮类化合物对靶标细菌型脯氨酰转运核糖核酸合成酶(prors)具有很强的抑制活性。三维共晶结构揭示去氧常山酮类化合物在底物atp的帮助下同时占据细菌型prors的trnapro的3’末端结合口袋和脯氨酸位点。此类去氧常山酮类化合物(特别是化合物4)对于革兰氏阳性菌和革兰氏阴性菌(包括耐药菌)均具有明显的抑制作用,展现出广谱抗菌活性,说明此类去氧常山酮类化合物在细菌感染类疾病的治疗方面具有良好的发展前景。
以上所述仅以实施例来进一步说明本发明的技术内容,以便于读者更容易理解,但不代表本发明的实施方式仅限于此。任何依本发明所做的技术延伸或再创造,均受本发明的保护。
序列表
<110>中山大学
<120>一种去氧常山酮类化合物及其制备方法和应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>567
<212>prt
<213>mrsaprors(mrsaprors)
<400>1
metlysglnserlysvalpheileprothrmetargaspvalproser
151015
glualaglualaglnserhisargleuleuleulysalaglyleuile
202530
lysglnserthrserglyiletyrsertyrleuproleualathrarg
354045
valleuasnasnilethralailevalargglnglumetgluargile
505560
aspservalgluileleumetproalaleuglnglnalagluleutrp
65707580
glugluserglyargtrpglyalatyrglyprogluleumetargleu
859095
glnasparghisglyargglnphealaleuglyprothrhisgluglu
100105110
leuvalthrserilevalargasngluleulyssertyrlysglnleu
115120125
prometthrleupheglnileglnserlyspheargaspglulysarg
130135140
proargpheglyleuleuargglyargglupheilemetlysaspala
145150155160
tyrserphehisalaaspglualaserleuaspglnthrtyrglnasp
165170175
mettyrglnalatyrserargilephegluargvalglyileasnala
180185190
argprovalvalalaaspserglyalaileglyglyserhisthrhis
195200205
gluphemetalaleuseralaileglygluaspthrilevaltyrser
210215220
lysgluserasptyralaalaasnileglulysalagluvalvaltyr
225230235240
gluproasnhislyshisthrthrvalglnproileglulysileglu
245250255
thrproasnvallysthralaglngluleualaasppheleuglyarg
260265270
provalaspgluilevallysthrmetilephelysvalaspglyglu
275280285
tyrilemetvalleuvalargglyhishisgluileasnaspilelys
290295300
leulyssertyrpheglythraspasnilegluleualathrglnasp
305310315320
gluilevalasnleuvalglyalaasnproglyserleuglyproval
325330335
ileasplysgluilelysiletyralaaspasnphevalglnaspleu
340345350
asnasnleuvalvalglyalaasngluaspglytyrhisleuileasn
355360365
valasnvalglyargasppheasnvalaspglutyrglyaspphearg
370375380
pheileleugluglyglulysleuseraspglyserglyvalalahis
385390395400
phealagluglyilegluvalglyglnvalphelysleuglythrlys
405410415
tyrserglusermetasnalathrpheleuaspasnglnglylysala
420425430
glnproleuilemetglycystyrglyileglyileserargthrleu
435440445
seralailevalgluglnasnhisaspaspasnglyilevaltrppro
450455460
lysservalthrpropheaspleuhisleuileserileasnprolys
465470475480
lysaspaspglnarggluleualaaspalaleutyralaglupheasn
485490495
thrlyspheaspvalleutyraspaspargglngluargalaglyval
500505510
lyspheasnaspalaaspleuileglyleuproleuargilevalval
515520525
glylysargalasergluglyilevalgluvallysgluargleuthr
530535540
glyaspserglugluvalhisileaspaspleumetthrvalilethr
545550555560
asnlystyraspasnleulys
565
<210>2
<211>1701
<212>dna
<213>mrsaprors(mrsaprors)
<400>2
atgaagcaatccaaagtttttataccaacgatgcgtgacgtgccatcagaagcagaagca60
caaagtcatcgtttattattgaaatcgggtttgataaaacaaagtacaagtgggatttat120
agttatttaccgctagcaacacgtgtgttaaataatattactgcaattgtgcgacaagaa180
atggaacgtatcgattctgttgaaattttaatgccagcgttacaacaagctgaattatgg240
gaagaatcaggacgttggggtgcatatggcccagaattaatgcgtttacaagatagacat300
ggaagacaatttgcattaggtccaacacatgaagaattagttacatcaatagtaagaaat360
gaattgaaatcatacaaacaattaccgatgacattattccaaattcaatctaaattccgt420
gatgaaaagagaccacgttttggtttacttcgtgggcgtgaatttattatgaaagatgca480
tattcattccatgctgacgaggcatcattagatcaaacgtatcaagatatgtatcaagcg540
tatagccgtatttttgagagagttggcattaacgcaagaccagtagttgcagattcaggt600
gctataggcggtagccatacacatgaatttatggcattaagtgctatcggtgaggataca660
atcgtttacagtaaagaaagtgattatgctgctaacatcgaaaaagcagaagtcgtttac720
gaaccaaatcataagcatactactgtgcaacctttagaaaaaattgaaacaccaaatgtt780
aagactgcgcaagaattggcagacttcttaggtagaccagtagatgaaatcgttaaaacg840
atgattttcaaagttgatggcgaatatattatggttttagtgcgtggccatcatgaaatt900
aatgacattaaattaaaatcttatttcggcacagataatattgaattagcaacacaagac960
gaaattgttaatttagttggtgcaaatcctggttcactaggtcctgtaattgataaagaa1020
atcaaaatttatgcagataattttgtgcaagatttaaataatttagttgtcggtgctaac1080
gaagatggttatcacttaattaatgtaaatgtaggtagagacttcaacgttgatgaatat1140
ggcgatttccgttttattttagaaggcgaaaagttaagtgatggttcaggcgttgcacat1200
tttgctgaaggtattgaagttggtcaagtattcaaattgggtactaagtattcagaatca1260
atgaatgctacattcttagataaccaaggaaaagctcaatctttaattatgggttgttac1320
ggaattggaatttctagaacgctaagtgcgattgttgaacaaaatcacgatgataatgga1380
attgtttggcctaaatcagttactccgtttgatttacatttaatttctattaatcctaag1440
aaagatgatcaacgagaactagcagatgcactatatgctgaatttaatactaaatttgat1500
gtgttgtacgatgatcgtcaggaacgtgcaggtgttaaatttaatgatgccgatttaatt1560
ggtttaccactgcgaattgttgttggtaaacgtgcatcggaaggtattgtagaagttaaa1620
gaacgtttaacaggtgatagcgaagaagttcacattgatgacttaatgactgtcattaca1680
aataaatatgataacttaaaa1701
- 还没有人留言评论。精彩留言会获得点赞!