基于数字LAMP技术检测猪链球菌的引物及其试剂盒与方法与流程
本发明涉及一种猪链球菌测试装备,具体涉及一种基于数字lamp技术检测猪链球菌的试剂盒,属于分子生物学
技术领域:
。
背景技术:
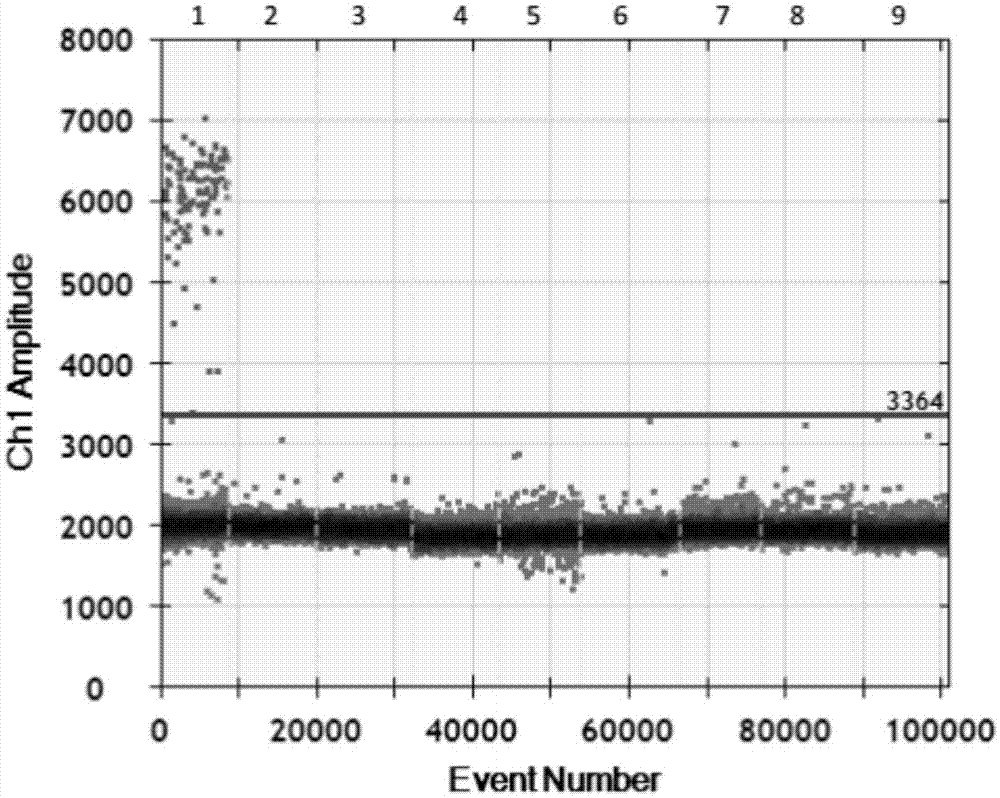
猪链球菌(streptococcussuis,ss)是猪群中一种常见的条件致病菌,其通常在猪的上呼吸道(尤其是扁桃体和鼻腔)、生殖道或消化道内定居,在严重时感染猪会出现脑膜炎、败血症、肺炎及关节炎等病症,可导致青年猪猝死。根据链球菌菌体荚膜抗原特性的不同,猪链球菌可以分为35个血清型(1~34型和1/2型),其中1,2,7,9型是猪的致病菌。猪链球菌还能感染人类,感染后也会出现脑膜炎、败血症、肺炎、关节炎、心内膜炎、腹膜炎及眼内炎等严重病症,甚至会引起死亡,严重威胁到人类健康和公共卫生。1968年丹麦首次报道人感染猪链球菌,随后南亚、北欧等国家和地区也相继出现了人感染猪链球菌的报道。距今为止,该病已报道超过700例,全球范围内几乎所有养猪国家和地区均有猪链球菌病的报道,其中主要分布在亚洲地区。根据《中华人民共和国动物防疫法》及其相关规定,猪链球菌病为二类动物防疫病。该病的传播对我国食品安全、畜牧业生产安全以及相关从业人员也带来巨大的威胁。因此,加强对猪链球菌检测技术的研究,开展猪链球菌的检测,防止猪链球菌的传入传出,对进出口贸易的技术保障具有重要意义。目前,实验室常用的检测猪链球菌的方法有细菌分离、血清学诊断技术(凝集反应和酶联免疫吸附试验等)和分子生物学检测技术(常规pcr,实时荧光定量pcr和环介导等温扩增技术等)。传统的细菌分离和血清学检测方法,存在耗时长、对检测人员技术要求高、操作复杂以及敏感性差等诸多不足。pcr操作复杂,需进行跑胶分析,并且灵敏度低;实时荧光pcr需使用昂贵的仪器设备并依赖标准曲线进行定量检测,灵敏度仍存在一定的局限性;环介导等温扩增技术由于引物间的非特异性扩增而易产生假阳性结果。数字环介导等温扩增技术(digitalloop-mediatedisothermalamplification,dlamp)是基于第三代数字pcr技术原理,将预混的lamp体系进行微滴化处理,形成几万至几十万个油包水的液化微滴中,保证每个微滴中含有一个或不含有核酸模板,经过lamp扩增后,经过荧光检测每个微滴中的阳性微滴数和阴性微滴数,根据泊松分布原理即可计算出核酸模板的初始拷贝数。该方法具有以下优点:①特异性强:针对靶基因的不同区域设计多对特异引物,不会受到反应混合物中存在的其他非靶序列的影响,同时可根据熔解曲线鉴别非特异性扩增;②灵敏性高:dlamp检测的是荧光信号,能检测到普通pcr的1/10-1/100的拷贝数;③恒温:该技术反应体系只需在恒定温度下就能扩增反应,不需要预先进行双链的变性;④快速:lamp反应在15-60min即可完成;⑤设备简单:不需要特殊的变温设备。为了解决上述传统方法检测猪链球菌面临的问题,迫切需要开发一种快速、高效、低成本的检测技术。技术实现要素:有鉴于此,本发明的目的在于提供一种数字lamp技术检测猪链球菌的试剂盒,能够应用于猪链球菌的快速、精准检测。本发明的第一个技术目的是提供用于检测猪链球菌的特异性引物,其核苷酸序列分别:外引物f3:cgtcttgactggtcttcc(seqidno:1);外引物b3:ttaccagaacctgagataagga(seqidno:2);内引物fip:aaccaatctcacgaccaccgacacatcggaccttcact(seqidno:3);内引物bip:aacgcctccgccagttcggatcaatgaaccaccaa(seqidno:4);环引物lf:ccgatgtcaccagcagg(seqidno:5);环引物lb:gcaggtgtcttgactggtaa(seqidno:6);优选地,扩增反应时,内引物fip和bip,环引物lf和lb,与外引物f3和b3的摩尔比为8:4:1。本发明提供了上述的特异性引物在制备猪链球菌检测试剂盒或检测试剂中的应用。本发明提供了一种含有上述特异性引物的试剂盒。所述试剂盒优选为微滴数字lamp绝对定量检测试剂盒。本发明的另一技术目的在于提供一种具有高灵敏度、高特异性、高准确度和精确度的、操作简单的检测猪链球菌的微滴数字lamp绝对定量检测试剂盒,其特征在于,试剂盒包含权利要求1中所述的引物。优选地,基于数字lamp技术检测猪链球菌的试剂盒还包括以下成分的部分或者全部:(1)2×ddlampsupermix;(2)无rna酶的蒸馏水;(3)阳性对照和阴性对照;(4)细菌总dna提取试剂。优选地,内引物fip和bip各160μmol/l,外引物f3和b3各80μmol/l,环引物lf和lb各160μmol/l,1×te,50mmol/ltris-hcl(ph8.8),250mmol/lkcl,200mmol/lmgso4,250mmol/l(nh4)2so4,2.8%tween-20,7.14mol/l甜菜碱,10mmol/ldntp,bst大片断dna聚合酶160u,20×evagreen,rnasecocktail。优选地,阳性对照为猪链球菌dna,阴性对照为超纯水。优选地,细菌总dna提取试剂包括裂解液a、洗液b、洗液c、洗脱液d、吸附柱和收集管。再有,本发明还公开了一种基于数字lamp技术检测猪链球菌的方法,包括如下步骤:(1)细菌总dna的提取1)取待检样品1g,加入600μl裂解液a研磨后,涡旋混匀20秒,室温静置10分钟;2)将混合液移至吸附柱中,12,000×g离心30~60秒;3)丢弃收集管中液体,加入500μl洗液b至吸附柱中,12,000×g离心30~60秒;4)丢弃收集管中液体,加入500μl洗液c至吸附柱中,12,000×g离心30~60秒;5)丢弃收集管中液体,12,000×g离心2分钟以甩干柱子;6)将吸附柱移入新的1.5ml离心管中,向柱子中央加入洗脱液50μl,室温静置2分钟,12,000×g离心1分钟,离心管中液体即为模板dna;(2)数字lamp操作1)待检样品、阴性对照和阳性对照每个反应管各加入数字lamp反应液19μl;分别取1μl模板dna,加入相应的反应管中,配置成20μl数字lamp反应体系;所述模板dna包括待检样品、阴性对照和阳性对照;2)将20μl样品反应液加入到微滴发生卡内,制备微滴;3)将微滴转入pcr板中,放入水浴锅或pcr仪中进行扩增;4)将扩增完成的pcr板放入微滴分析仪中,检测微滴中的荧光信号,分析数据,显示检测结果;5)结果判定及描述:阳性对照:40±2个拷贝,阴性对照:<1个拷贝时,实验结果成立;待检测样品结果≥1个拷贝时为阳性;待检测样品结果<1个拷贝时为阴性。优选地,数字lamp反应体系为20μl反应体系,其含有2×ddlampsupermix10μl,超纯水9μl,加入1μl模板后为20μl。优选地,扩增程序为:63℃反应35min,并在80℃持续2min。本发明以lamp和数字pcr微滴生成系统及检测系统为依托,开发数字lamp技术绝对定量检测猪链球菌的试剂盒及检测方法。目前尚未有将微滴数字lamp技术应用于检测猪链球菌的试剂盒。本试剂盒能够在短时间内实现猪链球菌的快速、精准定量,为猪链球菌的早期诊断提供有力的技术支持,有着广阔的应用前景和产业化前景。因此,相比于现有的其他检测技术,本发明技术具有快速、精准、灵敏、适用性广、操作简单等优点:①特异性强:针对靶基因的不同区域设计多对特异引物,不会受到反应混合物中存在的其他非靶序列的影响,同时可根据熔解曲线鉴别非特异性扩增;②灵敏性高:dlamp检测的是荧光信号,能检测到普通pcr的1/10-1/100的拷贝数;③恒温:该技术反应体系只需在恒定温度下就能扩增反应,不需要预先进行双链的变性;④快速:lamp反应在15-60min即可完成;⑤设备简单:不需要特殊的变温设备。附图说明图1是本发明实施例3中特异性实验的检测结果图。图1中,1:阳性对照;2:伪狂犬病毒;3:猪圆环病毒2型;4:猪传染性胸膜肺炎放线杆菌;5:副猪嗜血杆菌;6:大肠杆菌;7:沙门氏菌;8:阴性对照。具体实施方式以下结合实施例对本发明作进一步的说明,但并不局限于此。实施例1基于数字lamp技术绝对定量检测猪链球菌的试剂盒的建立基于数字lamp技术绝对定量检测猪链球菌的试剂盒,包括引物组、2×ddlampsupermix、无rna酶的超纯水、细菌总dna提取试剂、阳性对照和阴性对照。(1)数字lamp扩增引物设计:以猪链球菌35个血清型(1~34型和1/2型)特异性保守序列为靶基因进行引物的设计。引物序列见表1。表1引物序列表(2)扩增反应时,内引物fip和bip,环引物lf和lb和外引物f3和b3的摩尔比为8:4:1。(3)2×ddlampsupermix包含以下试剂:内引物fip和bip各160μmol/l,外引物f3和b3各80μmol/l,环引物lf和lb各160μmol/l,1×te,50mmol/ltris-hcl(ph8.8),250mmol/lkcl,200mmol/lmgso4,250mmol/l(nh4)2so4,2.8%tween-20,7.14mol/l甜菜碱,10mmol/ldntp,bst大片断dna聚合酶160u,20×evagreen,rnasecocktail。(4)阳性对照为猪链球菌dna,阴性对照为超纯水。(5)细菌总dna提取试剂包括裂解液a、洗液b、洗液c、洗脱液d、吸附柱和收集管。实施例2基于数字lamp技术绝对定量检测猪链球菌的检测方法利用实施例1的试剂盒检测猪链球菌的方法,包括如下步骤:(1)细菌dna的提取:1)取待检样品1g,加入600μl裂解液a研磨后,涡旋混匀20秒,室温静置10分钟;2)将混合液移至吸附柱中,12,000×g离心30~60秒;3)丢弃收集管中液体,加入500μl洗液b至吸附柱中,12,000×g离心30~60秒;4)丢弃收集管中液体,加入500μl洗液c至吸附柱中,12,000×g离心30~60秒;5)丢弃收集管中液体,12,000×g离心2分钟以甩干柱子;6)将吸附柱移入新的1.5ml离心管中,向柱子中央加入洗脱液50μl,室温静置2分钟,12,000×g离心1分钟,离心管中液体即为模板dna。(2)数字lamp操作1)设待检样品、阴性对照和阳性对照样品数总和为n,反应体系配置如下:表2数字lamp反应体系名称体系2×ddlampsupermix14×(n+1)μl无rna酶的蒸馏水5×(n+1)μl将以上配置的反应体系充分混匀后,分装至每个反应管各19μl。其中,2×ddlampsupermix包含以下试剂:160μmol/l内引物fip和bip各0.2μl,80μmol/l外引物f3和b3各0.05μl,160μmol/l环引物lf和lb各0.1μl,te0.3μl,50mmol/ltris-hcl(ph8.8)0.8μl,250mmol/lkcl0.8μl,200mmol/lmgso40.8μl,250mmol/l(nh4)2so40.8μl,2.5%tween-200.8μl,7.14mol/l甜菜碱2.8μl,10mmol/ldntp3.2μl,bst大片断dna聚合酶1μl,20×evagreen1μl,rnasecocktail1μl。2)分别取1μl模板dna(包括待检样品、阴性对照和阳性对照),加入相应的反应管中,终体积为20μl。3)将一个新的微滴发生卡放入卡托中,将20μl样品反应液加入到微滴发生卡中间一排的8个孔中,不足8个样品时用20μl去离子水补足,建议使用8通道排枪,加样时枪头接近孔一侧底部,与侧壁呈现大约15°角,缓慢打出液体,打出一部分后缓慢提升枪头位置再打出余下液滴,不要将枪打至第一档位置以免引入气泡;4)在微滴发生卡最底下一排8个孔中加入70μl微滴生成油,同样不能有空着的孔;5)盖上胶垫,注意两边的小孔都要钩牢;6)将卡托轻轻地平稳放置于微滴生成仪中,开始生成微滴,注意仪器上指示灯状态,一般2分钟之内完成;7)微滴生成于微滴发生卡最上面一排孔内,建议使用8通道排枪小心缓慢吸取,调整吸取体积为40μl,将卡托放平,枪头以与孔壁呈30~45°角放入,轻触孔底,约5秒吸取40μl,再同样缓慢地打入96孔板相应位置孔内(约5秒),枪头贴近孔壁接近孔底,注意封上盖以防油挥发,每次弃去已使用过的微滴发生卡和胶垫;8)转移油滴进入96孔板内完成后,用预热好的px1热封仪对其进行封膜(红线朝上),运行程序为:180℃,5s,无需颠倒方向二次封膜;9)封好膜之后应该在30分钟内进行lamp反应,或者放于4℃冰箱4小时之内进行lamp。扩增程序为:63℃反应35min,并在80℃持续2min。10)将pcr扩增完成的96板放入微滴分析仪的plateholder中,注意板斜角方位,组装好之后轻轻地平稳放入微滴读取仪中。11)打开quantasoft软件,建议每次实验之前做一次flushsystem,若一周以上未使用建议先做一次prime再做flushsystem。然后对96孔板中样品信息进行设置,完成后即可进行检测,结束后结果会被自动分析,人工核实后保存结果。12)结果判定及描述:阳性对照:40±2个拷贝,阴性对照:<1个拷贝时,实验结果成立;待检测样品结果≥1个拷贝时为猪链球菌阳性;待检测样品结果<1个拷贝时为猪链球菌阴性。实施例3特异性验证用本发明试剂盒分别检测临床得到的伪狂犬病毒、猪圆环病毒2型、猪传染性胸膜肺炎放线杆菌、副猪嗜血杆菌、大肠杆菌及健康猪的血清样本,并设阳性对照和阴性对照样品,共8份样品,所有样品均经过测序法验证,检测结果见图1。1:阳性对照;2:伪狂犬病毒;3:猪圆环病毒2型;4:猪传染性胸膜肺炎放线杆菌;5:副猪嗜血杆菌;6:大肠杆菌;7:健康猪的血清样本;8:阴性对照。实验结果显示,阳性对照经数字lamp扩增后,阈值线以上出现阳性液滴,拷贝数为40±2个拷贝,即有扩增。而伪狂犬病毒、猪圆环病毒2型、猪传染性胸膜肺炎放线杆菌、副猪嗜血杆菌、大肠杆菌及健康猪的血清样本和阴性对照拷贝数<1,即无扩增(见图1)。由此可见,利用本发明的数字pcr试剂盒检测结核猪链球菌显示出良好的特异性。实施例4实际样品验证用本发明试剂盒对实际样本进行检测,检测临床得到的猪链球菌疑似病料70份,同时用测序法验证,其中,本发明试剂盒和测序法检测均为阳性的有35例,检测方法均为阴性的有35例,检测结果表3所示:表3上表的实验结果可以说明本试剂盒及方法准确性高,特异性强,与测序法有很高的一致性。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。sequencelisting<110>暨南大学,华南理工大学<120>基于数字lamp技术检测猪链球菌的引物及其试剂盒与方法<130>2018<160>6<170>patentinversion3.3<210>1<211>18<212>dna<213>人工序列(artificialsequence)<400>1cgtcttgactggtcttcc<210>2<211>22<212>dna<213>人工序列(artificialsequence)<400>2ttaccagaacctgagataagga<210>3<211>38<212>dna<213>人工序列(artificialsequence)<400>3aaccaatctcacgaccaccgacacatcggaccttcact<210>4<211>35<212>dna<213>人工序列(artificialsequence)<400>4aacgcctccgccagttcggatcaatgaaccaccaa<210>5<211>17<212>dna<213>人工序列(artificialsequence)<400>5ccgatgtcaccagcagg<210>6<211>20<212>dna<213>人工序列(artificialsequence)<400>6gcaggtgtcttgactggtaa当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1