水溶性铂-卟啉配合物及其制备方法与流程
本发明涉及一类水溶性铂-卟啉配合物及其制备方法。
背景技术:
癌症即恶性肿瘤,是由于控制细胞分裂增殖机制失常而致使癌细胞无限增殖引发的疾病。我国是癌症高发区,目前每年因癌症去世的人数达到250万。因而对于癌症的研究是十分必要的。治疗癌症通常有三种方法,包括化学疗法,手术疗法,以及放射疗法。化学疗法使用化学试剂抑制癌细胞的增殖、浸润和转移,从而治疗癌症。铂类抗癌药物作为一类重要的金属化疗药物,在临床一线癌症治疗中被广泛应用,主要用于卵巢癌、前列腺癌、睾丸癌、肺癌、鼻咽癌、食道癌、恶性淋巴瘤、头颈部癌、甲状腺癌及成骨肉瘤等。
光动力疗法(photodynamictherapy,pdt)是一种重要的肿瘤治疗新技术,具有高效、简便、无毒、靶向、安全等特点,临床已被用于浅表性膀胱癌、肺癌、食管癌、头颈部癌和皮肤癌等治疗中。pdt作为一种新型精准疗法被日益瞩目。其基本要素是氧、光敏剂和可见光(常用激光)。该疗法利用特定波长光局部照射肿瘤部位,使光敏药物活化,引发光化学反应产生单线态氧,破坏肿瘤,进而引起肿瘤细胞坏死或凋亡。光敏剂通常是一类具有环状平面二维结构的卟啉类分子,具有四吡咯基结构。其水溶性较差,常通过中心部位插入金属或者对外周基团进行改造以提高其生物相容性。
目前,已有很多研究将光动力疗法和以铂类药物为基础的化学疗法相结合,开发双功能抗肿瘤药物。该药物既可以规避单一疗法存在的缺点,如药效差、正常细胞损伤、肾毒性明显等,又可保留或者增强各个疗法的优点,获得最大化的治疗收益。所以,开发铂-卟啉及铂-金属卟啉双功能抗肿瘤光敏剂是非常具有应用前景的工作。
技术实现要素:
本发明的目的之一在于提供一类水溶性铂-卟啉配合物。
本发明的目的之二在于提供该类配合物的制备方法。
本发明的目的之三在于提供该类铂-卟啉配合物在肿瘤光动力治疗中的应用。
为达到上述目的,本发明采用如下技术方案:
一种水溶性铂-卟啉配合物,其特征在于该化合物的结构式为:
其中:m表示h或插入卟啉中心的金属元素,其中金属元素独立地选自ga(iii)、in(iii)、zn(ii)、cu(ii)、co(ii)、fe(ii)、pt(ii)、pd(ii)、sn(iv)或si(iv);a代表含氮杂环化合物,独立地选自咪唑、噻唑、吡咯、吡唑、吡啶、嘧啶、喹啉、喋啶或嘌呤类基团;n代表1~6间任意数字;r1,r2,r3,和r4为非桥联十字型的铂基团,独立选自以下任一结构
上述配合物为下列结构之一:
一种制备上述的配合物的方法,其特征在于该方法的具体步骤为:将含氯的铂配合物溶于n,n-二甲基甲酰胺中,加入一倍量或四倍量硝酸银,20-60度反应12-36小时,砂芯漏斗过滤除去沉淀;将卟啉母核或者金属卟啉母核悬浮于n,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应12-36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
本发明还包括化合物(i)的药学上可以接受的盐,是通式(i)化合物的硝酸盐、盐酸盐、氢溴酸盐、磷酸盐、硫酸盐、富马酸盐、水杨酸盐、苯磺酸盐、丙酮酸盐、乙酸盐、或杏仁酸盐。
本发明的化合物作为光敏剂,同时具备光疗和化疗的作用,可以作为抗肿瘤药物应用与光动力治疗中。化合物单线态氧产率高,且具有较高光细胞毒活性,体内光动力治疗效果显著。光照射后,其ic50可达60nm左右,均优于阳性对照药。本发明中的光敏剂制备方法设计合理,操作方便,适用于工业化生产。
附图说明
图1.colon26肿瘤小鼠中在配合物2给药后的体内pdt评估图。
图2.在pdt处理配合物2后,在光照射前(1a和2a),6天(1b和2b)和18天(3a和3a),balb/c小鼠colon26模型的肿瘤光动力治疗效果图。
具体实施例方式
实施例1:目标化合物1的结构式、收率、紫外、核磁数据和元素分析数据
将含奥沙利铂前药配体(c6h14n2ptcl2,12.25mg,0.032mmol)溶于3mln,n-二甲基甲酰胺中,加入一倍量硝酸银(5.5mg,0.032mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将卟啉母核(20mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:72%;紫色固体;λmax(dmso,nm)(ε,104m-1cm-1)415(29.6),515(1.68),549(0.57),588(0.54),and643(0.22).1hnmr(400mhz;dmso-d6):δ9.20(o-pyridyl,d,8h),8.83(β-pyrrole,s,8h),8.30(m-pyridyl,d,8h,j=6.4hz),6.65-5.72(nh2,m,4h),2.03(ch,m,2h),1.54-1.13(ch2,m,8h),7.95(ch,dmf),2.89(ch3,dmf),2.73(ch3,dmf).
实施例2:目标化合物2的结构式、收率、紫外、核磁数据和质谱数据
将含奥沙利铂前药配体(c6h14n2ptcl2,49.02mg,0.129mmol)溶于3mln,n-二甲基甲酰胺中,加入硝酸银(22mg,0.129mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将卟啉母核(20mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:78%;紫色固体;λmax(dmso,nm)(ε,104m-1cm-1)423(29.6),516(1.68),550(0.57),589(0.54),and644(0.22).1hnmr(400mhz;dmso-d6):δ9.23(o-pyridyl,d,8h),9.02(β-pyrrole,s,8h),8.51(m-pyridyl,d,8h,j=6.4hz),6.67-5.74(nh2,m,16h),2.04(ch,m,8h),1.59-1.16(ch2,m,32h),7.95(ch,dmf),2.89(ch3,dmf),2.73(ch3,dmf),2.09(ch3,ch3coch3);ms(esi):m/z=2115.0[m-no3-2cl+3h]+,1893.9[m-2no3-2(dach)+h]+,1307.6[m-4no3-2{pt(dach)cl}]+,963.5[m-4no3-3{pt(dach)cl}]+,812.4[m-4no3-3{pt(dach)cl}-{(dach)cl}]+。
实施例3:目标化合物3的结构式、收率、紫外、核磁数据和元素分析数据
将含奥沙利铂前药配体(c6h14n2ptcl2,12.25mg,0.032mmol)溶于3mln,n-二甲基甲酰胺中,加入硝酸银(5.5mg,0.032mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将锡卟啉(24.8mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:68.6%;紫色固体;λmax(h2o,nm)(ε,104m-1cm-1)418(31.1),554(1.9),592(0.5);1hnmr(400mhz;dmso-d6):δ9.23(o-pyridylandβ-pyrrole,m,16h),δ8.31(m-pyridyl,d,8h),δ6.24-5.76(νη2,m,4h),δ2.06(ch,m,2h),δ1.74-1.05(ch2,m,8h);c46h40n11clpto5sn·11h2o(m=1175.5,m’=1373.5),calcd.c:41.41,h:4.76,n:11.33;obsd.c:41.18,h:4.51,n:11.21.
实施例4:目标化合物4的结构式、收率、紫外、核磁数据和元素分析数据
将含奥沙利铂前药配体(c6h14n2ptcl2,49.02mg,0.129mmol)溶于3mln,n-二甲基甲酰胺中,加入硝酸银(22mg,0.129mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将锡卟啉(24.8mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:69.6%;紫色固体;λmax(h2o,nm)(ε,104m-1cm-1)426(35.2),555(2.8),593(0.7);1hnmr(400mhz;dmso-d6):δ9.26(o-pyridylandβ-pyrrole,m,16h),δ8.51(m-pyridyl,d,8h),δ6.26-5.77(νη2,m,16h),δ2.06(ch,m,8h),δ1.82-1.04(ch2,m,32h),δ7.95(ch,dmf),δ2.89(ch3,dmf),δ2.73(ch3,dmf);c64h82n20cl4pt4o14sn·2dmf·15h2o(m=2395,m’=2811),calcd.c:29.75,h:4.60,n:10.98;obsd.c:29.88,h:4.48,n:10.96。
实施例5:目标化合物5的结构式、收率、紫外、核磁数据和元素分析数据
将含顺铂前药配体(pth6n2cl2,38.7mg,0.129mmol)溶于3mln,n-二甲基甲酰胺中,加入硝酸银(22mg,0.129mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将锡卟啉母核(24.8mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:62.3%;紫色固体;λmax(h2o,nm)(ε,104m-1cm-1)421(38.3),554(2.2),592(0.5);1hnmr(400mhz;dmso-d6):δ9.23(o-pyridylandβ-pyrrole,m,16h),δ8.45(m-pyridyl,d,8h),δ4.97(νη3,s,12h),δ4.51(νh3,s,12h),δ7.95(ch,dmf),δ2.89(ch3,dmf),δ2.73(ch3,dmf);c40h50n20pt4cl4o14sn·dmf·8h2o(m=2075,m’=2292),calcd.c:22.15,h:3.15,n:12.94;obsd.c:22.51,h:3.18,n:12.80.
实施例6:目标化合物6的结构式、收率、紫外和核磁数据
将含顺铂前药配体(ptc6h10n2cl2,43.9mg,0.129mmol)溶于3mln,n-二甲基甲酰胺中,加入硝酸银(22mg,0.129mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将铟卟啉母核(24.5mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:68%;紫色固体;λmax(h2o,nm)(ε,104m-1cm-1)427(32.3),556(2.0),595(0.3);1hnmr(400mhz;dmso-d6):δ9.25(o-pyridylandβ-pyrrole,m,16h),δ8.48(m-pyridyl,d,8h),δ8.37(ar-h,d,4h),δ7.69(ar-h,dd,4h),δ7.19(ar-h,dd,4h),δ7.15(ar-h,dd,4h),δ4.97(νη3,s,12h),δ2.51(ch3,s,12h)。
实施例7:目标化合物7的结构式、收率、紫外和核磁数据
将含顺铂前药配体(ptc6h14n2cl2,44.4mg,0.129mmol)溶于3mln,n-二甲基甲酰胺中,加入硝酸银(22mg,0.129mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将镓卟啉母核(23mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:60.5%;紫色固体;λmax(h2o,nm)(ε,104m-1cm-1)425(28.4),550(1.6),588(0.2);1hnmr(400mhz;dmso-d6):δ9.25(o-pyridylandβ-pyrrole,m,16h),δ8.47(m-pyridyl,d,8h),δ4.97(νη3,s,12h),δ4.51(νh3,s,12h),δ2.67(ch2,d,16h),δ1.99(ch,m,8h),δ1.72(ch2,m,16h)。
实施例8:目标化合物8的结构式、收率、紫外和核磁数据
将含顺铂前药配体(ptc8h18n2cl2,56.8mg,0.129mmol)溶于3mln,n-二甲基甲酰胺中,加入硝酸银(22mg,0.129mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将钴卟啉母核(21.6mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:71%;紫色固体;λmax(h2o,nm)(ε,104m-1cm-1)426(33.5),551(1.9),590(0.4);1hnmr(400mhz;dmso-d6):δ9.21(o-pyridylandβ-pyrrole,m,16h),δ8.43(m-pyridyl,d,8h),δ5.33(ch,m,4h),δ4.95(νη3,s,12h),δ4.48(νh3,s,12h),δ3.57(ch,m,8h),δ2.72(ch2,m,16h),δ2.05(ch,m,4h),δ0.90(ch3,s,24h)。
实施例9:目标化合物9的结构式、收率、紫外和核磁数据
将含顺铂前药配体(ptc6h14n2cl2,73.5mg,0.192mmol)溶于3mln,n-二甲基甲酰胺中,加入硝酸银(32.7mg,0.192mmol),60度反应24小时,砂芯漏斗过滤除去沉淀;将硅卟啉母核(21.7mg,0.032mmol)悬浮于3mln,n-二甲基甲酰胺中,滴加上述反应液于悬浮液中,氮气保护下反应36小时。用乙醚沉淀,过滤,冷甲醇、氯仿和乙醚洗涤,得到目标产物。
收率:65%;紫色固体;λmax(h2o,nm)(ε,104m-1cm-1)429(39.2),561(3.2),599(0.7);1hnmr(400mhz;dmso-d6):δ9.24(o-pyridyl,d,8h),9.06(β-pyrrole,s,8h),8.53(m-pyridyl,d,8h,j=6.4hz),6.69-5.77(nh2,m,24h),2.048(ch,m,12h),1.62-1.16(ch2,m,48h)。
本发明配合物的理化实验及药理学实验数据,实验中各种化合物的编号与实施例中编号一致,对应的结构及相关分析结果如下:
表1:配合物的结构、单线态氧产率及体外抗肿瘤活性
a水溶液中的单线态氧产率(三次重复试验求平均值±sd);
b在100μm浓度下药物对小鼠结肠癌细胞colon26的抑制率(三次重复试验求平均值±sd);
c‘n.a.’表示没活性,化合物定义为“没活性”表示药物在100μm浓度下,对酶的抑制率低于5%。
单线态氧产率:通过稳态光解9,10-蒽二基-双(亚甲基)二丙二酸(abda)的光氧化测定单重态氧量子产率(φδ)。在水溶液中选用玫瑰红(rb)
其中kr和ks分别是样品和参比化合物abda的动力学斜率。ir和is分别是样品和参比化合物的吸收光强度。实验重复三次。
表1表明,发明的配合物表现出中等到较高水平的单线态氧量子产率。配合物4的单线态氧量子产率最高(φδ为0.82±0.06),这意味着4作为光敏剂具有相当大的潜力。比较1、2和3-9可知,中心插入金属可以提高单线态氧产率。同时对比1、3和2、4和5-9可知,外周铂基团数量增多,对单线态氧产率贡献大。
体外抗肿瘤活性:将colon26细胞系以5×103个细胞每孔的密度接种在96孔板中。将细胞与不同浓度的配合物和对照药物孵育24小时。孵育一段时间后,通过用pbs缓冲液洗涤除去配合物并更换培养基。用红光灯灯照射或不照射处理30分钟。将96孔板放入co2培养箱中培养48小时。通过标准mtt测定法用酶标仪在570nm吸光度下测定细胞活力。所有实验均在黑暗和光照条件下进行,并独立重复三次。
如表1所示,所有配合物均显示较低的暗毒性。光照后,细胞活力大大降低,尤其是配合物4,ic50值为0.06μm。对比1、3和2、4、5-9可知,引入铂基团后抗肿瘤活性增大。因此,铂族元素与卟啉骨架的配位产生较大的φδ,对光细胞毒性有重大贡献。同时,对比1、2和3、4可知,引入金属元素之后,细胞毒活性增大。
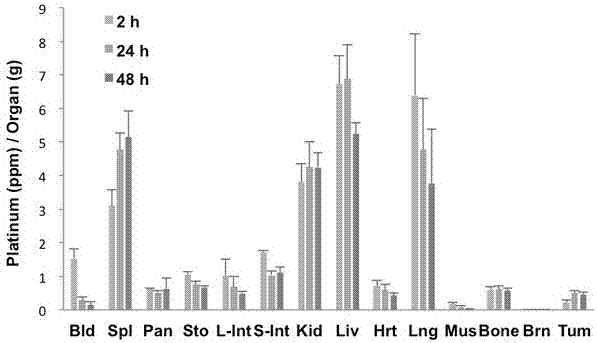
体内分布实验:每组三只小鼠以配合物4给药。在给药后2、24和48小时收集主要组织和血液。通过icp-aes监测pt含量分析处理过的样品。
如图1,静脉给药后,早期阶段主要分布在脾、肾、肝脏和肺。24小时后,血液中的铂浓度显著降低。由于基于卟啉的光敏剂可以选择性地积聚在肿瘤中,因为癌细胞的低密度脂蛋白过表达,这些卟啉将被转运到肿瘤细胞中发挥重要作用。选血液和肌肉作为参考,肿瘤与血液和肿瘤与肌肉的比例随时间增加而增加,在48小时其比值分别达到2.9和31.5。而与其他器官相比,没有发现显著蓄积。
动物体内光动力治疗:雌性balb/c小鼠(5周),分别在右肩和左肩皮下制作colon26肿瘤模型。当肿瘤体积达到约100mm3时,将小鼠用于光动力疗法实验。第1组小鼠静脉注射配合物4,第2组小鼠作为对照。这两组中的每只小鼠均对左肩膀上的肿瘤进行了光照,右肩部没有光照。为了评估毒副作用,测量小鼠体重。
如图2a所示,组2的肩部和组1的右肩上的肿瘤未被抑制,并且显示出相似的生长速度。当control组2的肿瘤体积时,左肩和右肩之间没有显着差异,表明光照仅仅不影响肿瘤生长。两组右侧肿瘤之间没有明显差异,因此配合物2的细胞毒性不明显;然而,组4中的左侧肿瘤在配合物4介导的pdt后第4天消失且在18天内保持无增长(p<0.05)。因此,该配合物可以完全杀死肿瘤细胞。在治疗组中,小鼠没有明显的体重减轻(小于6%,图2b)。所有结果表明配合物2能够在colon26荷瘤小鼠中杀死肿瘤,有望成为未来pdt临床应用的有效药物。
- 还没有人留言评论。精彩留言会获得点赞!