柑橘褪绿矮缩病毒的实时荧光定量PCR检测试剂盒和检测方法与流程
本发明属于分子生物学领域,涉及一种柑橘褪绿矮缩病毒的实时荧光定量pcr检测试剂盒和检测方法。
背景技术:
柑橘褪绿矮缩病是一种由柑橘褪绿矮缩病毒(citruschloroticdwarf-associatedvirus,ccdav)引起的新发危险性病害,可侵染大多数的柑桔种,引起植株叶片变形、扭曲、花叶等症状,造成果实变小,产量降低。ccdav最早于上世纪80年代发现于土耳其,目前已成为在土耳其为害最严重的柑桔病毒类病害。近年在中国云南也有ccdav发生的报道。ccdav为双生病毒科(geminiviridae)成员,主要通过嫁接和杨梅粉虱(parabemisiamyricae)传播。
目前尚无ccdav的有效防治药剂,准确、灵敏、快速的检测方法是柑橘安全生产和建立无病毒苗木繁殖体系的前提和保障。实时荧光定量pcr(qpcr)法具有快速、灵敏和准确的特点,能对未知样品进行定量分析。由于ccdav是近年来新发病害,目前对于还缺少一套低成本、快速、灵敏、准确的检测方法。
技术实现要素:
针对我国现ccdav检测技术不足的问题,本发明提供了一种准确度高、特异性强、灵敏度高的柑橘褪绿矮缩病毒的实时荧光定量pcr检测试剂盒和检测方法。
本发明实现其目的采用的技术方案是:
一种柑橘褪绿矮缩病毒的实时荧光定量pcr检测试剂盒,包括总核酸提取试剂,引物el4-f4、el4-r4,gotaqqpcrmastermix,所述引物序列为:
el4-f4:5′-ctacagggacaggtttattg-3′,
el4-r4:5′-acagacccaccgtcctca-3′。
一种柑橘褪绿矮缩病毒的实时荧光定量pcr检测方法,包括如下步骤:
(1)取待测植株组织,抽提总核酸;
(2)以提取的总核酸为模板,利用上述的检测试剂盒进行qpcr检测。
qpcr的20μl反应体系包含:模板2μl、gotaqqpcrmastermix10μl、10μmol/l上下游引物各0.4μl,超纯水7.2μl。
qpcr扩增程序为:95℃预变性5min;95℃变性15s,退火30s,72℃延伸30s,40个循环;扩增后采集熔解曲线程序:95℃变性15s后,从60℃开始,每升高0.5℃停留30s采集荧光信号,直到温度升高到95℃融解曲线采集完成。
本发明的有益效果是:本发明所建立的ccdavqpcr检测方法操作简便、特异性强且重复性好,与常规pcr法相比,其灵敏度提高了100倍,检测的“窗口期”缩短了2个月,更适用于低浓度ccdav样品的检测。虽然目前ccdav在田间的发生率不高,但是杨梅粉虱在中国分布广泛,因此加强ccdav的监测十分重要,本发明方法灵敏度高、特异性强、能快速检测到极低含量的病毒,为柑桔褪绿矮化病的大规模检测、预测预报、病害流行监控,早期ccdav的检控等,以及无病毒苗木生产提供了重要的技术支撑;争取从源头和传播途径上控制该病的传播和流行,从而保障柑橘产业的可持续发展和进出口贸易安全。
附图说明
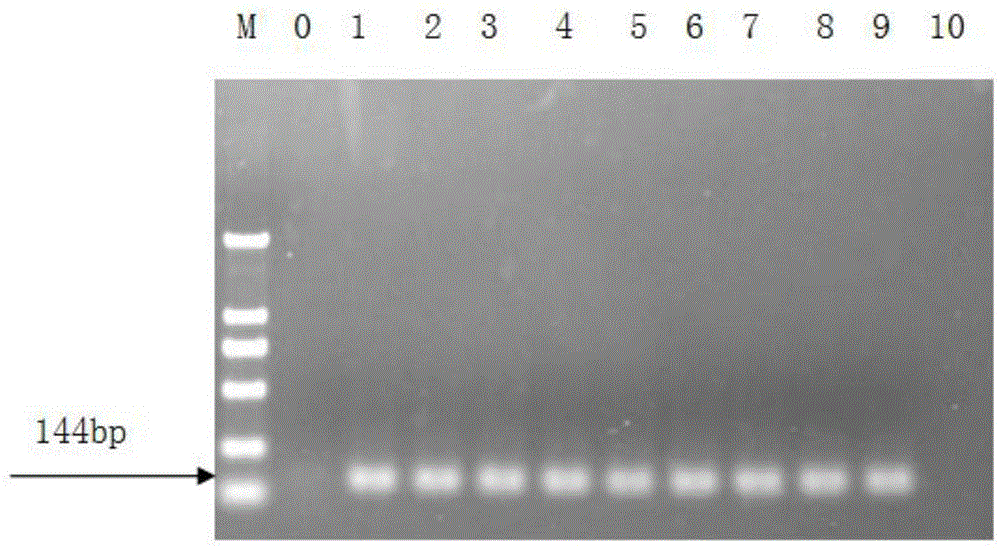
图1为ccdav目的基因扩增结果图,其中:1-9为阳性对照,10为阴性对照,0为水对照。
图2为引物浓度为200nm/l时的熔解曲线图。
图3为退火温度为50℃时的扩增曲线图。
图4为50℃退火温度下的标准曲线图。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
本发明的实验材料:
本实验所用分别感染从分别感染柑橘褪绿矮缩病毒(citruschloroticdwarf-associatedvirus,ccdav)、柑桔衰退病毒(citrustristezavirus,ctv)、柑桔黄化脉明病毒(citrusyellowveinclearingvirus,cyvcv)、柑桔碎叶病毒(citrustatterleafvirus,ctlv)、柑桔裂皮病类病毒(citrusexocortisviroid,cevd)、柑桔鳞皮病毒(citruspsorosisvirus,cpv)、温州蜜柑萎缩病毒(satsumadwarfvirus,sdv)的植株样品来源于西南大学柑桔研究所脱毒中心保存毒源。
实施例1
一、用于检测ccdav的引物对
根据genbank中ccdav分离株yn-el4(kx840470)外壳蛋白的保守序列,使用primerexplorer5.0设计了5对qpcr检测引物(引物序列见表1),通过实验筛选出具有稳定特异性的引物el4-f4、el4-r4,并用genbank的blast进行比对,保证引物的特异性,最后确定引物el4-f4、el4-r4为本发明qpcr的扩增引物。引物由上海英骏生物公司合成。
表1qpcr检测ccdav所用引物序列
二、提取待测样品总核酸
取0.08~0.1g表现ccdav症状的柑桔叶片的侧脉及附近组织,放入两颗钢珠,装于无菌离心管中,加入ctab1ml,盖紧离心管盖,研磨器研磨后,65℃水浴30min(期间轻轻颠倒两次),10000rpm室温离心5min,取上清液转至新的离心管中,加入等体积的tris饱和酚:氯仿:异戊醇(25:24:1),振荡混匀,室温静置5min分层,12900rpm室温离心5min,取上清液转至新的离心管中,加入等体积的氯仿:异戊醇(24:1),振荡混匀,室温静置5min分层,12900rpm室温离心3min,取上清液转至新的离心管中,加入上清1/10体积的3mol/l的醋酸钠和上清等体积的异丙醇,颠倒混匀至絮状沉淀产生,放入-20℃沉淀半小时,12000rpm室温离心10min,弃上清,加入1ml75%乙醇清洗沉淀,7500rpm室温离心2min,弃上清保留沉淀(共清洗2~3次),65℃水浴干燥至无乙醇痕迹即可,溶解于30-50μlddh2o中,即获得ccdav核酸提取液。-20℃保存。
三、目的基因的扩增与鉴定
以上述获得的ccdav的核酸为模板进行pcr扩增,pcr的具体方法为:20μl反应体系:模板2μl、2×taqmastermix(购自中国novoprotein公司)10μl、10μmol/l上下游引物(即引物el4-f4、el4-r4)各0.4μl,超纯水7.2μl。扩增条件:95℃预变性5min;95℃变性15s,50℃退火30s,72℃延伸30s,40个循环,72℃延伸5min。
取60μlpcr产物用于琼脂糖凝胶电泳,电泳结果如图1所示:泳道1-9的阳性对照(即从表现典型ccdav症状的植株中提取的总核酸进扩增后的产物)都有特异的条带,且无引物二聚体和其他非特异扩增,片段长度为144bp;而泳道10的阴性对照(即从健康的植株中提取的总核酸进行扩增后的产物)和泳道0的水对照(即以ddh2o代替总核酸进行扩增后的产物)均无扩增。阳性对照的pcr产物经电泳、切胶回收纯化后与pmd19-t载体连接,转化pmd-19t,接种于含有amp的lb平板,37℃过夜,挑取单菌落白斑接种于含amp的la培养基,37℃震荡过夜。采用菌液pcr的方法来鉴定是否有插入片段。将阳性菌液送上海英骏生物公司进行测序。序列测序后,在ncbi经blast分析,与ccdav序列同源性最高达100%,由此确定,ccdav目的基因扩增片段是正确的。
四、ccdav质粒的提取与质粒标准品的制备
选取步骤三中pcr检测为阳性的菌液,采用美国omegabio-tek公司的质粒纯化试剂盒进行质粒纯化:10000rpm室温离心1min,倒掉上清,留沉淀;加入250μlsolutionⅰ,涡旋10s;加入250μlsolutionⅱ,上下轻轻颠倒混匀,再室温静置2min;加入350μlsolutionⅲ,上下轻轻颠倒,13000rpm室温离心10min;上清过柱后,分别用500μlbufferhb和700μldnawashbuffer,进行离心清洗,然后13000rpm室温离心2min;最后向滤柱中加入30μlelutionbuffer,室温静置1min;13000rpm室温离心1min,将离心管中产物(即为纯化后的ccdav质粒)放入-20℃冰箱保存备用。
用紫外分光光度计(smartspectmplus,bio-rad)测定其浓度和纯度。根据摩尔定律,计算质粒拷贝数,即单位体积质粒所含的dna拷贝数浓度。
经计算,本实验所得的质粒浓度为4×1010拷贝/μl,以10倍梯度稀释后的4×101~4×109拷贝/μl质粒为质粒标准品。
五、实时荧光定量pcr条件的优化及体系的确定
(1)引物浓度的确定
以步骤四得到的4×105拷贝/μl的质粒作为模板,设定100nm、200nm、300nm、400nm、500nm的引物浓度梯度,进行引物浓度优化,以熔解曲线峰单一且ct值小为标准,筛选最佳引物浓度。结果表明,当引物浓度为200nm时,ct值小,熔解曲线呈单峰,且扩增效果最佳,因此确定200nm为该体系的最佳引物浓度,引物浓度为200nm/l时的熔解曲线图如图2所示。
(2)退火温度的确定
以4.0×109拷贝/μl到4.0×101拷贝/μl的质粒作为模板,引物终浓度为200nm,分别设置60.0、59.5、58.3、56.4、53.9、52.1、50.8、50.0℃共8个退火温度,以熔解曲线峰单一且ct值小为标准,筛选最佳退火温度。结果表明,当退火温度50℃时,ct值小,熔解曲线呈单峰,且扩增效果最佳,因此确定50℃为该体系的最佳退火温度,退火温度为50℃时的扩增曲线图如图3所示。
(3)标准曲线的建立
以10倍梯度稀释后的4×101~4×109拷贝/μl质粒为模板,在最优的反应条件下进行定量pcr,每一浓度设定3个重复,制作标准曲线。50℃退火温度下的标准曲线图如图4所示,结果表明扩增效率达98.9%,相关性为0.994,表明该体系可以准确检测ccdav。
(4)qpcr的检测方法确定
实时荧光定量反应体系(20μl):模板2μl、gotaqqpcrmastermix(美国promega公司)10μl、10μmol/l上下游引物(el4-f4、el4-r4)各0.4μl,超纯水7.2μl。
扩增程序为:95℃预变性5min;95℃变性15s,退火30s,72℃延伸30s,40个循环。扩增后采集熔解曲线程序:95℃变性15s后,从60℃开始,每升高0.5℃停留30s采集荧光信号,直到温度升高到95℃融解曲线采集完成,每个样品3个技术重复,同时设阴性对照(从健康植株中提取的总核酸)和空白对照(以ddh2o代替检测样品)。
实施例2qpcr体系的评价
对实施例1中确定的qpcr的检测方法进行评价。
(1)特异性评价
从分别感染柑桔衰退病毒(citrustristezavirus,ctv)、柑桔黄化脉明病毒(citrusyellowveinclearingvirus,cyvcv)、柑桔碎叶病毒(citrustatterleafvirus,ctlv)、柑桔裂皮病类病毒(citrusexocortisviroid,cevd)、柑桔鳞皮病毒(citruspsorosisvirus,cpv)、温州蜜柑萎缩病毒(satsumadwarfvirus,sdv)的病株中提取总核酸为模板,利用建立的ccdavqpcr体系进行检测,评估其特异性。结果表明,只有ccdav样品有明显的扩增曲线,且熔解曲线为单一峰,其它病毒样品的荧光信号均无增加,说明建立的qpcr方法特异性强,只能检测出ccdav。
(2)灵敏度评价
以10倍梯度稀释后的4×101~4×109拷贝/μl质粒为模板,运用常规pcr和所建qpcr法平行进行ccdav检测,评价其灵敏度。结果表明:实时荧光定量pcr可检测到4×101拷贝/μl,而常规pcr只能检测到4×103拷贝/μl的质粒,这表明本发明的实时荧光定量pcr检测灵敏度比常规pcr检测提高了100倍。
(3)重复性评价
包括批内和批间重复性测试,批内重复性测试是一次对浓度高低不同(4×104~4×106拷贝/μl)的质粒标准品重复测定3次,通过测得的标准差进而计算最大变异系数(cv值);批间重复性测试是连续3天对同一标准品进行检测并计算cv值。结果如表2所示,结果表明:组内重复的cv值为2.26%,说明该方法具有较好组内重复性。组间重复的cv值为2.13%,表面该方法具有较好的组间重复性,可同时或分批对样品进行稳定准确的定量检测。
表2重复性试验结果
实施例3检测试验
(1)ccdav通过嫁接的方法接种于西蒙斯甜橙、墨西哥莱檬、强德勒柚、红桔、粗柠檬、邓肯葡萄柚健株上,1、2、3个月后分别应用常规pcr法和所建qpcr法进行检测。结果表明:嫁接接种1个月后,常规pcr法在西蒙斯甜橙、墨西哥莱檬、强德勒柚、红桔、粗柠檬和邓肯葡萄柚中均未检测到ccdav,qpcr法在所有接种植株上都检测出了ccdav。嫁接接种3个月后,常规pcr法和qpcr法在上述品种中均可检测出ccdav。可见,与常规pcr相比,qpcr检测的“窗口期”缩短了2个月,更适用于低浓度ccdav样品的检测。
(2)应用建立的qpcr检测体系,对来自四川、重庆、贵州、广西、浙江、云南6个省(区、市)采集了83个柑桔属样品进行检测。结果表明:仅有2个采自云南省的柠檬样品检测到ccdav。qpcr结果与常规pcr法一致,表明该体系具有良好的适用性。
本发明所建立的ccdavqpcr检测方法操作简便、特异性强且重复性好,与常规pcr法相比,其灵敏度提高了100倍,检测的“窗口期”缩短了2个月,更适用于低浓度ccdav样品的检测。虽然目前ccdav在田间的发生率不高,但是杨梅粉虱在中国分布广泛,因此加强ccdav的监测十分重要。本发明为柑桔褪绿矮化病的大规模检测、流行监控,以及无病毒苗木生产提供了重要的技术支撑。
序列表
<110>西南大学
<120>柑橘褪绿矮缩病毒的实时荧光定量pcr检测试剂盒和检测方法
<160>10
<210>1
<211>18
<212>dna
<213>人工序列
<223>el4-f1
<400>1
ggagaaagtcgagcaaag18
<210>2
<211>19
<212>dna
<213>人工序列
<223>el4-r1
<400>2
ctcatcacctcggtcaata19
<210>3
<211>18
<212>dna
<213>人工序列
<223>el4-f2
<400>3
aaagaagcccaagattgc18
<210>4
<211>19
<212>dna
<213>人工序列
<223>el4-r2
<400>4
ctcatcacctcggtcaata19
<210>5
<211>20
<212>dna
<213>人工序列
<223>el4-f3
<400>5
ctacagggacaggtttattg20
<210>6
<211>18
<212>dna
<213>人工序列
<223>el4-r3
<400>6
tccaagtcaagctcgtca18
<210>7
<211>20
<212>dna
<213>人工序列
<223>el4-f4
<400>7
ctacagggacaggtttattg20
<210>8
<211>18
<212>dna
<213>人工序列
<223>el4-r4
<400>8
acagacccaccgtcctca18
<210>9
<211>18
<212>dna
<213>人工序列
<223>el4-f5
<400>9
caggagaaagtcgagcaa18
<210>10
<211>19
<212>dna
<213>人工序列
<223>el4-r5
<400>10
cgcccatcgtgataaatag19
- 还没有人留言评论。精彩留言会获得点赞!
- 高灵敏监测POPs的转荧光蛋白基因鱼的制作与应用的制造方法与工艺
- 一种收发一体式开放光路大气检测系统的制造方法与工艺
- 一种用于鉴别西红花的荧光PCR检测引物组、试剂盒及检测方法和应用与流程
- 转基因玉米MON87403品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种具有蓝色荧光的手性有机染料分子及其制备方法与应用与流程
- 一种基于直接竞争荧光免疫法定量检测叶酸功能化二氧化硅靶向纳米药物载体的方法与流程
- 螯合剂的定量方法及螯合剂定量系统与流程
- 一种棒状杆菌属细菌和克氏棒状杆菌多重荧光定量PCR引物、探针、试剂盒和检测方法与流程
- 一种染料定量输送装置的制造方法
- 一种基于半阈值追踪算法的荧光分子断层成像重建方法与流程