用于检测5种血流感染病原体的引物组、试剂盒及建库方法与流程
本发明涉及病原微生物检测
技术领域:
,具体涉及一种用于检测5种血流感染病原体的引物组、试剂盒及建库方法。
背景技术:
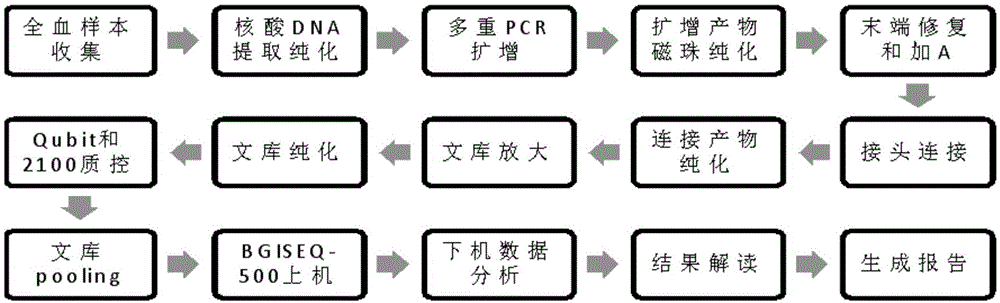
:血流感染是一种严重的全身感染性疾病,目前临床的诊断方法仍然以血培养为主,该方法耗时较长,且培养阳性率较低,不利于及时诊断和用药判断。临床上常常会根据医生经验性诊断进行用药,一方面增加了患者的经济负担,另一方也增加了抗生素滥用导致的耐药风险,因此,精准快速的查找致病病原体是当前临床诊断的趋势。利用多重靶向富集的方法可以实现对样本中不同靶标的同时检测,目前已经有肿瘤基因检测和遗传病筛查方面的应用案例。通过这种技术,可以实现同时对血液样本中多种病原体靶标进行检测,及时有效的提供病原学证据。目前国内尚无类似的血流感染检测技术或产品,国外相关技术包括:1)法国梅里埃的filmarray血流感染检测试剂盒,针对血培养物进行病原体鉴定。该技术是以多重实时pcr为基础,以pcr扩增过程中的不同引物和不同靶标反应过程中熔解温度的不同为物种鉴定的判断依据来实现多种目标区域的鉴定,可在1个小时内出报告。但该方法的鉴定依赖于温度的改变,故此对设备的温度敏感性要求很高;此外一次只能检测1例样本,通量低;物种判断依赖于温度改变,故此鉴定物种种类的可扩展性低。2)芬兰的prove-ittmsepsis(mobidiag,芬兰)血流感染检测产品,通过多重pcr和杂交的方式,可在3.5h内鉴定19种革兰阴性菌,15种革兰阳性菌,8种真菌和耐药基因,但由于多重pcr本身的技术限制,可拓展性较低,此外,基于杂交的方法进行检测容易出现非特异性杂交而影响检测结果的准确性。3)韩国seegene公司推出的magicplextmsepsis实时检测技术通过多重荧光pcr检测技术实现对不同病原体的检测,其基本原理是通过16s引物进行多重扩增,然后通过特异性探针进行靶标识别。但由于16s鉴定的局限性,部分靶标无法鉴定到种水平。4)luminex血流感染病原体多重检测试剂盒(液相芯片法)是基于多重pcr和液相捕获的方法实现对特异性病原体的检测,但由于该方法荧光检测分辨率的限制,检测灵敏度不高。现有血流感染检测技术或产品存在以下缺陷:1)检测病原体的扩展性较低。以filmarray为代表的多重pcr检测技术,在经过多重pcr扩增以后,或通过溶解曲线进行分辨,或通过荧光信号进行检测,由于技术本身的局限性,多重pcr体系的扩展一方面可能会影响体系中其他靶标的检测,另一方面会增加后续信号检测的负荷,因此该类技术扩展性较差,技术局限性较高。2)病原体分辨率较低。以seegene公司推出的magicplextmsepsis实时检测为例,由于采用16s引物进行检测,部分引物只能在属水平上进行物种鉴定,无法精确到种水平,对特定的物种无法实现精确分辨。3)检测结果假阳性率高。目前市面上的分子类多重检测产品,绝大部分都是通过间接检测序列信号实现对靶标分子的检测,期间会由于非特异扩增或其他嵌合现象导致假阳性的情况。4)检测通量低。以filmarray为例,单次检测只能检测1例样本,远远不能达到临床通量需求。5)检测灵敏度低。filmarray检测样本类型为血培养物,适用于对高浓度靶标样本进行检测;luminex血流感染病原体多重检测试剂盒可以直接对全血样本进行检测,但其检测灵敏度较低,一般只能达到10^4至10^5拷贝/毫升。技术实现要素:本发明提供一种用于检测5种血流感染病原体的引物组、试剂盒及建库方法,根据第一方面,一种实施例中提供一种用于检测5种血流感染病原体的引物组,其中上述5种血流感染病原体包括金黄色葡萄球菌、大肠杆菌、鲍曼不动杆菌、肺炎克雷伯菌、屎肠球菌;上述引物组包括:用于检测金黄色葡萄球菌的引物对seqidno:1~2、seqidno:3~4和seqidno:5~6中的至少之一,用于检测大肠杆菌的引物对seqidno:7~8、seqidno:9~10和seqidno:11~12中的至少之一,用于检测鲍曼不动杆菌的引物对seqidno:13~14、seqidno:15~16和seqidno:17~18中的至少之一,用于检测肺炎克雷伯菌的引物对seqidno:19~20、seqidno:21~22和seqidno:23~24中的至少之一,用于检测屎肠球菌的引物对seqidno:25~26、seqidno:27~28和seqidno:29~30中的至少之一,上述引物组用于在同一反应体系中,对上述5种血流感染病原体的特异序列进行多重pcr靶向扩增。作为本发明的优选方案,上述引物组包括:用于检测金黄色葡萄球菌的引物序列seqidno:1~6,用于检测大肠杆菌的引物序列seqidno:7~12,用于检测鲍曼不动杆菌的引物序列seqidno:13~18,用于检测肺炎克雷伯菌的引物序列seqidno:19~24,用于检测屎肠球菌的引物序列seqidno:25~30。作为本发明的优选方案,上述引物组还包括用作内参的引物对seqidno:31~32。根据第二方面,一种实施例中提供一种用于检测5种血流感染病原体的试剂盒,其包括第一方面的引物组。作为本发明的优选方案,上述试剂盒还包括靶向扩增试剂组分、末端修复试剂组分、接头连接试剂组分、文库pcr扩增试剂组分、阳性对照品试剂组分、阴性对照品试剂组分、纯化磁珠试剂组分中的一种或多种。作为本发明的优选方案,上述靶向扩增试剂组分包括靶向扩增缓冲液和靶向扩增酶,优选地,上述靶向扩增酶是taqdna聚合酶。作为本发明的优选方案,上述末端修复试剂组分包括末端修复缓冲液和末端修复酶,优选地,上述末端修复酶包括t4dna聚合酶、t4pnk和rtaq。作为本发明的优选方案,上述接头连接试剂组分包括连接缓冲液、连接酶和接头序列;优选地,上述连接酶是t4dna连接酶;优选地,上述接头序列如seqidno:33~34所示。作为本发明的优选方案,上述文库pcr扩增试剂组分包括pcr反应缓冲液、pcr反应聚合酶和pcr反应引物;优选地,上述pcr反应聚合酶是taqdna聚合酶;上述pcr反应引物如seqidno:35~36所示。作为本发明的优选方案,上述阳性对照品试剂组分包括选自上述5种血流感染病原体中至少一种的dna序列和人源细胞dna;优选地,选自上述5种血流感染病原体中至少一种的dna序列是金黄色葡萄球菌和大肠杆菌的dna序列;上述人源细胞dna是hela细胞dna。作为本发明的优选方案,上述阴性对照品试剂组分是人源细胞dna,优选hela细胞dna。作为本发明的优选方案,上述纯化磁珠试剂组分包括磁珠和缓冲液;优选地,上述磁珠是agencourtampurexp磁珠;上述缓冲液是te缓冲液。根据第三方面,一种实施例中提供一种用于检测5种血流感染病原体的建库方法,包括采用第一方面的引物组对血液样本核酸提取物进行多重pcr靶向扩增;然后对上述多重pcr靶向扩增的产物进行测序文库构建。该建库方法中建库步骤没有特别限定,只要使用本发明的多重pcr靶向扩增的产物为材料可以按照现有任何建库方法进行。本发明的用于检测5种血流感染病原体的引物组特异性较强,一方面有效减少了非特异性扩增的情况,另一方面通过特异性引物扩增可以直接鉴定到细菌的种水平。采用本发明的引物组进行血流感染病原体的检测无需进行血培养操作,可直接对血液样本中的病原体进行检测,最快可在48h得到检测结果,大大缩短了检测周期。采用本发明的引物组进行特异性靶向扩增结合二代测序技术直接对检测序列进行读取,避免了信号转化或传递过程中导致的假阳性情况,检测结果可信度高,另外通过二代测序平台进行检测,具有检测通量高,检测成本低的特点,可以同时对上百例样本进行检测,单样本检测成本大大降低。附图说明图1为本发明一个实施例中检测5种血流感染病原体的全流程示意图;图2为本发明一个实施例中构建的检测5种血流感染病原体的文库采用agilent2100生物分析仪检测文库片段大小的结果图。具体实施方式下面通过具体实施方式结合附图对本发明作进一步详细说明。在以下的实施方式中,很多细节描述是为了使得本发明能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他元件、材料、方法所替代。另外,说明书中所描述的特点、操作或者特征可以以任意适当的方式结合形成各种实施方式。同时,方法描述中的各步骤或者动作也可以按照本领域技术人员所能显而易见的方式进行顺序调换或调整。因此,说明书和附图中的各种顺序只是为了清楚描述某一个实施例,并不意味着是必须的顺序,除非另有说明其中某个顺序是必须遵循的。本发明提供了一种血流感染常见病原体检测引物组和试剂盒,弥补国内全血样本直接检测病原体产品的空白。本发明是一种可扩展性强的多重病原体检测技术,可实现对多个病原体或耐药基因同时进行检测,并且随着临床检测的需求,可随时扩展检测病原靶标。本发明针对特定感染症候群中的特定病原,通过kmer序列比对的方法,设计种水平特异性强的引物对,并且通过引物效率筛选,将不同病原体的引物组合成引物集以实现同时对多种病原体进行检测的目的。本发明采用多重pcr和二代测序相结合的技术,对扩增后的产物直接进行序列读取,有效避免了间接检测信号导致的假阳性的情况。本发明基于二代测序平台进行检测,具有通量高、成本低的检测特点。可以同时对上百例样本进行检测,最快可以2天内完成,预期检测成本150-200元/样本。本发明提供一种高灵敏度的检测试剂盒,可以直接对全血样本进行检测,检测灵敏度可达到50-300cfu/ml。以下通过一个实施例对本发明进行详细描述,需要说明的是,该实施例仅是示例性的,不能理解为对本发明保护范围的限制。1)血流感染靶标病原体的确定目标病原体的确定主要通过文献调研、卫生部全国细菌耐药监测网监测结果以及目前市面上的主流检测产品的目标病原信息,并且综合调研全国几所大型医院每年血培养阳性率结果,通过整理整合后确定了可引起血流感染的常见病原体及耐药基因集,分别为金黄色葡萄球菌、大肠杆菌、鲍曼不动杆菌、肺炎克雷伯菌、屎肠球菌。2)靶标病原体特异性引物设计将确定的病原体在ncbi上查找所有的参考序列集,并且通过kmer序列比对的方式分别与病原微生物数据库和人参考基因组进行比对,寻找所有参考序列集中特异序列,进一步在种水平上进行特异序列筛选,挑选出种内共有率高,种间特异性强的序列作为靶标序列进行引物设计,每种靶标病原体筛选多个满足上述条件的特异性序列备用,此外,筛选一段人源特异片段作为反应体系内参对照。将筛选出的靶标特异序列打包成序列集提交至引物设计系统(例如https://ampliseq.com/browse.action)进行特异引物设计,引物序列如表1,将设计的引物按照一定的比例进行混合后用于后续扩增反应。表1检测靶标引物序列需要说明的是:本发明实施例中,针对每种血流感染病原体设计3对靶标引物序列,例如针对金黄色葡萄球菌,tg-1-f和tg-1-r是一对引物序列、tg-2-f和tg-2-r是一对引物序列、tg-3-f和tg-3-r是一对引物序列,每对引物序列分别用于检测一个靶标,其余血流感染病原体的靶标引物序列情况类似。发明人已经证实,针对每种血流感染病原体只要采用1对或2对相应的靶标引物序列检测一个靶标即可实现该种血流感染病原体的检测。同时,发明人进一步证实,针对每种血流感染病原体同时采用3对靶标引物序列进行检测能够取得更加准确、有效的结果,相对于仅采用1对或2对靶标引物序列,其特异性和灵敏度更佳。因此,作为本发明的优选方案,针对每种血流感染病原体同时采用3对靶标引物序列进行检测。众所周知,在进行多重靶向扩增时,由于引物序列众多往往造成互相之间的干扰或竞争现象存在,也可能产生非特异性扩增,因此多重靶向扩增对于引物选择非常苛刻,需要结合序列设计软件和实验验证才能最终确定效果良好的引物组合。本发明人经过反复设计和大量实验验证,采用本发明的引物序列,即使在针对每种血流感染病原体同时采用3对靶标引物序列的情况下,也不存在非特异性扩增及引物序列之间的干扰、竞争等现象,因此完全满足多重靶向扩增的要求,并且其特异性和灵敏度都非常好。3)血流感染病原体检测实验流程本发明一个实施例中提供一种用于检测血流感染常见病原体的试剂盒,包括多重pcr反应试剂和二代测序文库构建试剂,试剂盒组成如表2所示。表2试剂盒组分表3r7接头和r9pcr引物对如图1所示,本发明一个实施例中检测血流感染常见病原体的方法流程如下:(1)全血样本玻璃珠研磨处理,提取全血样本中的dna;(2)将提取的dna进行纯化以彻底去除其中的杂质和反应抑制物;(3)多重pcr扩增:使用特异性的pcr引物(表1)对样本中可能存在的病原体靶标进行扩增富集,每种病原体设置3个不同的区域进行富集,得到相应区域的pcr产物;(4)pcr产物纯化:对(3)得到的pcr产物进行纯化,以去除产物中的剩余引物二聚体和其他干扰物质;(5)纯化产物末端修复和加“a”:对(4)中得到的纯化产物进行末端修复,补平末端并在3’端添加a碱基形成粘性末端;(6)接头连接:对(5)得到的产物进行接头连接,得到包含测序接头的文库;(7)连接产物纯化:对连接接头以后的产物进行纯化,去除多余的接头序列和杂质;(8)文库pcr:对(7)中的纯化产物进行pcr扩增,放大文库信号,满足上机需求;(9)文库纯化和质控:对放大文库进行纯化,然后通过qubit定量方式测定文库浓度,并通过agilent2100生物分析仪检测文库片段大小;(10)bgiseq-500测序:将质控后的多个文库混合(pooling),然后按照bgiseq-500测序流程进行上机测序。4)血流感染病原体检测信息分析流程对测序样本的下机数据进行生物信息学分析,主要分析流程如下:(1)对下机样本测序数据量进行质控:首先对下机的原始数据进行过滤,去除接头序列和低质量序列,去除读长不满足要求的序列;对过滤后的序列数进行质控,是否满足测序数据量要求;(2)序列比对及内参质控:使用比对软件对质控后的数据与人源序列库进行比对,去除比对上的宿主序列,然后再与靶标序列库进行比对,生成靶标序列比对结果;对比对结果中的内参靶标占比进行质控,评估整个流程是否成功;(3)比对结果标准化处理:对比对结果进行标准化处理,得到标准化的比对序列数结果。5)病原体靶标阈值确定流程通过测试200余例临床阴性样本,得到阴性样本中病原体靶标检出序列分布,根据阴性检测值分布情况,分别选取95%和99%分位点作为阈值进行测试,每种病原体测试10例模拟阳性样本,评估其在不同阈值下的检出准确性,最终确定以95%分为点阈值作为最终阈值结果,不同病原体靶标阈值如下表4:表4靶标阈值情况6)血流感染病原体检测结果解读流程根据标准化后的序列比对结果,与对应的靶标阈值进行比对,根据比对结果生成解读报告,解读逻辑如下:(1)对于每个靶标,当靶标检出序列数大于靶标阈值序列数,则判断为检出;(2)对于每个病原体,分别有3个靶标区域,如果有2个及以上的靶标序列检出,则判断为该病原体检出;(3)如果阴性对照样本中检出病原体靶标并超过阈值序列数,则本批次内该靶标检测失控,不予报告。以下通过具体实施例详细说明本发明的技术方案和效果,应当理解实施例仅是示例性的,不能理解为对本发明保护范围的限制。以下实施例中采用的引物序列和试剂组分等如上述描述。实施例1选取临床血培养阳性样本和阴性全血样本以及r10和r11阴阳性对照品(如表2)进行测试,共10例样本。1)样本前处理与核酸提取:取450μl全血样本加入预先装有250μl0.5mm玻璃珠的2.0ml离心管中,用封口膜封好管口,室温震荡20min,震荡完成后,去掉封口膜,将离心管放入离心机8000rpm离心30s,用移液器小心吸取200μl破壁后的全血样本进行核酸提取。核酸提取流程参照magpureblooddnakfkit说明书进行操作,核酸最终回融体积为40μl。2)提取核酸纯化将提取的核酸用1倍体积的r1磁珠(如表2)进行纯化,操作如下:核酸中加入40μl磁珠充分混匀,室温静置5min,将96孔板置于24头磁力架上,静置10min至澄清(若10min后液体仍不澄清,可以多静置2-3min;静置期间可用200μl或10μl无滤芯吸头将妨碍磁珠吸附的气泡戳破),用200μl带滤芯枪头小心吸去上清,加入200μl70%乙醇,吹打8次,用200μl带滤芯枪头吸弃上清,重复乙醇清洗步骤一次,将乙醇清除干净,室温静置至磁珠干裂,往96孔板中加入40μlr2溶解液,充分溶解,静置5min,然后置于磁力架上吸附至液体澄清,吸取上清进行下一步反应操作。3)多重pcr反应将纯化后的核酸按照以下表5的反应体系进行多重pcr扩增:表5反应试剂用量r1靶向扩增缓冲液(如表2)9.6μlr2靶向扩增酶(如表2)0.4μldna10μl反应体积20μl将上述反应液充分震荡混匀后放入pcr仪,按照以下反应程序进行反应:99℃2min;40个循环(99℃15s,60℃2min);4℃保持。4)多重pcr反应产物纯化将pcr反应产物用1倍体积的r1磁珠进行纯化,纯化操作按照2)中操作进行,最终用r2溶解液回融至43μl用于下一步反应。5)末端修复和加“a”反应将纯化后的pcr产物按照以下表6的反应体系进行末端修复和加“a”反应:表6反应体系充分震荡混匀后,放入pcr仪,按照以下程序进行反应:37℃,10min;65℃,15min,4c℃保持。6)接头连接反应将5)中得到的反应产物按照以下表7的体系进行接头连接反应:表7反应试剂用量r5连接缓冲液(如表2)27μlr6连接酶(如表2)1μlr7接头(如表2)2μl末修加a产物50μl反应体积80μl将反应液充分震荡混匀后,按以下反应条件进行反应:23℃,20min,4c℃保持。7)连接产物纯化将6)中的连接产物用0.5倍体积(40μl)的r1磁珠进行纯化,纯化操作按照2)中操作进行,最终回融至21μl用于下一步反应。8)文库pcr将上一步纯化产物按照以下表8的反应体系进行反应:表8反应条件如下:98℃2min;10个循环(98℃15s,56℃15s,72℃30s);72℃5min;4℃保持。9)产物纯化将文库pcr产物用1倍体积的r1磁珠进行纯化,纯化操作按照2)中所述操作进行,最终用r2溶解液回融至20μl。10)文库定量和检测将构建好的文库用qubit进行定量,浓度大于2ng/μl时,视为文库合格,进一步用agilent2100生物分析仪进行检测文库片段大小,当检测到260bp左右有明显的内参峰值时,视为合格,结果如图2所示,可进行下一步测序反应。11)bgiseq-500上机测序将质控合格的文库按照bgiseq-500或bgiseq-50上机流程进行上机测序,详细流程参考相应试剂盒操作说明书。12)下机数据信息分析将10例样本下机后的数据首先按照信息分析流程进行数据过滤,然后将过滤后的数据分别与人源数据库和靶标数据库进行比对,生成比对结果。根据比对结果先判断内参占比是否满足要求,然后将比对结果进行标准化处理,生成标准化比对结果。13)结果解读将10例样本生成的标准化比对结果分别与相应靶标阈值进行对比。首先判断阴阳性对照品是否受控:阴性样本中应检测不出任何靶标病原体,阳性样本中对应的靶标病原体检测结果应为阳性。阴性对照和阳性对照解读结果如表9所示。表9阴性对照和阳性对照解读结果确定阴性对照和阳性对照样本都受控以后,说明该批次临床样本检测结果真实可靠,对待测临床样本按照上述方法进行解读,结果如表10所示,表中s1-s8代表8例临床样本。表10临床样本解读结果经过阈值对比分析,检测到s1-s5为细菌阳性样本,s6-s8检测结果为靶标阴性。此外,s4样本中同时检测到金黄色葡萄球菌和屎肠球菌混合感染,并且sanger验证结果证实金黄色葡萄球菌和屎肠球菌均为阳性(表11)。14)与临床结果对比表11与临床结果对比结果不同检测方法检测结果对比发现,本发明与sanger方法检出一致性100%,临床血培养阳性样本通过本发明方法检测可以全部检出,此外,对于血培养阴性样本,本发明可检出阳性,并且sanger验证结果也为阳性,说明本发明可有效提高临床样本中病原体的检出。以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属
技术领域:
的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。sequencelisting<110>天津华大医学检验所有限公司<120>用于检测5种血流感染病原体的引物组、试剂盒及建库方法<130>18i26933<160>36<170>patentinversion3.3<210>1<211>29<212>dna<213>人工序列<400>1caattaaaatagaggtgttgcaaaatggg29<210>2<211>23<212>dna<213>人工序列<400>2tcgactacgcgaatagattggac23<210>3<211>26<212>dna<213>人工序列<400>3actgctagtgtaggaatctctttgtc26<210>4<211>22<212>dna<213>人工序列<400>4cccatccagctgtgatgacaat22<210>5<211>22<212>dna<213>人工序列<400>5tagcgacaggtcctcttacgaa22<210>6<211>25<212>dna<213>人工序列<400>6gtaatcccactttcaaaaacacgct25<210>7<211>20<212>dna<213>人工序列<400>7cactgcgtccatctcgaaga20<210>8<211>21<212>dna<213>人工序列<400>8tggccaggtaaaacgcttcat21<210>9<211>22<212>dna<213>人工序列<400>9cgctgcaccagaaagatctcaa22<210>10<211>22<212>dna<213>人工序列<400>10gaagcaacatctttggctgctt22<210>11<211>29<212>dna<213>人工序列<400>11gcatatttgcgtccaatatttctataccc29<210>12<211>24<212>dna<213>人工序列<400>12cgattatggctgcacagtctcatc24<210>13<211>23<212>dna<213>人工序列<400>13taatgagctcagcattgcccaaa23<210>14<211>26<212>dna<213>人工序列<400>14ggttgggcatattcaaattgattggc26<210>15<211>22<212>dna<213>人工序列<400>15cttaaagcgaatggcggattca22<210>16<211>22<212>dna<213>人工序列<400>16tgagccacttcgttttggtcat22<210>17<211>22<212>dna<213>人工序列<400>17cgtcaaacacgtggcgatgata22<210>18<211>28<212>dna<213>人工序列<400>18cccatacataacatgatcttcaacttcg28<210>19<211>22<212>dna<213>人工序列<400>19tgtttaaacgccacgagcagta22<210>20<211>22<212>dna<213>人工序列<400>20gcagtcgataagtccagccaaa22<210>21<211>20<212>dna<213>人工序列<400>21ctacgacaacatgttcgccg20<210>22<211>19<212>dna<213>人工序列<400>22aaaaccgcctggatcgccc19<210>23<211>21<212>dna<213>人工序列<400>23atgatgaagcgcaacatcacc21<210>24<211>24<212>dna<213>人工序列<400>24ccctgatagtcattgatgtcgttg24<210>25<211>25<212>dna<213>人工序列<400>25gggagcaaaaggtccaaatactttt25<210>26<211>22<212>dna<213>人工序列<400>26gtgagtaacaccggaagaaggt22<210>27<211>27<212>dna<213>人工序列<400>27tccatttgcatctactacaattcctgt27<210>28<211>24<212>dna<213>人工序列<400>28atacgccgttcaagcaacaaatac24<210>29<211>29<212>dna<213>人工序列<400>29ggtaacgtctcataaatatctgatagcct29<210>30<211>23<212>dna<213>人工序列<400>30caccagttacagtgatggacaca23<210>31<211>21<212>dna<213>人工序列<400>31caagccagttatccctgtggt21<210>32<211>21<212>dna<213>人工序列<400>32ggtgtcctaaggcgagctcag21<210>33<211>58<212>dna<213>人工序列<220><221>misc_feature<222>(32)..(41)<223>nisa,c,g,ort<400>33agtcggaggccaagcggtcttaggaagacaannnnnnnnnncaactccttggctcaca58<210>34<211>38<212>dna<213>人工序列<400>34ttgtcttcctaaggaacgacatggctacgatccgactt38<210>35<211>17<212>dna<213>人工序列<400>35gaacgacatggctacga17<210>36<211>17<212>dna<213>人工序列<400>36tgtgagccaaggagttg17当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1