两种甾体类化合物和一种三萜类化合物及其提取方法与应用与流程
本发明属于医药领域,具体涉及两种甾体类化合物和一种三萜类化合物及其提取方法与应用。
背景技术:
炎症是具有血管系统的活体组织对损伤因子所产生的防御反应,大多数疾病都伴有炎症的发生,炎症会加重疾病的发生和发展,有些慢性炎症会导致肿瘤的发生,因此,对炎症的控制和治疗具有非常重要的意义。肿瘤是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物,它是目前威胁人类健康的主要杀手之一,目前尚无有效治愈的药物,对于肿瘤的治疗,一直是科研不断研究的内容。
天然药物尤其是来源于植物的药物具有化学结构多样性和生物活性多样性的特点,一直是人类预防和治疗疾病的主要来源。临床上应用的许多药物都直接或间接来源于天然产物,天然产物不仅可以作为药物半合成的前体物,还可以作为化学合成药物的模板,为新药设计提供新思路,目前,天然产物已成为发现新药物或先导化合物的主要源泉之一。
大花紫薇(lagerstroemiaspeciosa(l.)pers),又称大叶紫薇(lagerstroemiaflos-reginaeretz),俗称百日红,千屈菜科(lythraceae)紫薇属(lagerstroemia)植物,落叶高大乔木。原产于亚洲热带,分布于斯里兰卡,印度,马来西亚,菲律宾,越南,我国广东、广西、福建有栽培。性平,味微苦、涩,归肝、胃、大肠经。树皮及叶可作泻药;种子具有麻醉性;根含单宁,可作收敛剂;叶子有降血糖、抗氧化和抗真菌的活性。
现代药理实验研究表明:大花紫薇具有降糖、降脂、抗氧化、抗真菌等活性。它的主要活性成分为三萜及甾体类成分,但现有研究对大花紫薇的化学成分研究仍不够彻底,因而大花紫薇中的三萜及甾体类化学成分仍值得进一步研究和开发利用。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供大花紫薇中分离提取的两种新甾体类化合物和一种新三萜类化合物,及其提取方法与应用。
本发明所采取的技术方案是:
本发明对大花紫薇的三萜及甾体类成分进行了系统分离,获得了两种新型甾体类化合物和一种新型三萜类化合物,并对其化学结构和抗炎抗肿瘤活性进行了研究分析。
两种甾体类化合物和一种三萜类化合物,其互变异构体、及其药学可接受的盐,该化合物的结构式如下所示:
优选地,上述两种甾体类化合物和一种三萜类化合物药学上可接受的盐为其钠、钾、钙、镁、铁、亚铁、铅、钡、铜、铵或锌盐。
上述两种甾体类化合物和一种三萜类化合物的提取方法,包括如下步骤:
(1)将大花紫薇的果实粉碎干燥、醇提、得提取液;
(2)将提取液依次用低极性溶剂、中极性溶剂和高极性溶剂进行萃取,得中极性层;
(3)将中极性层进行硅胶柱层析,中极性-高极性溶剂进行梯度洗脱,得到体积比80:1的洗脱部分,记为样品a(干燥样品);
(4)对样品a进行硅胶柱层析,中极性-高极性溶剂梯度洗脱后、通过反相薄层分析,对中极性和高极性溶剂体积比为3:1的洗脱部分-进行ods柱层析,低级醇或其水溶液梯度洗脱后,通过硅胶和反相薄层分析,对其40%低级醇水溶液洗脱部分进行半制备反相hplc得到化合物1;
(5)对样品a进行硅胶柱层析,中极性-高极性溶剂梯度洗脱后,对中极性和高极性溶剂体积比为6:1的洗脱部分进行ods柱层析,低级醇或其水溶液梯度洗脱后,通过薄层分析,对其50%低级醇水溶剂洗脱部分进行硅胶柱层析,中极性-高极性溶剂梯度洗脱后,通过反相和硅胶薄层色谱分析,对中极性和高极性溶剂的体积比为15:1的洗脱部分进行半制备反相hplc得到化合物2;
(6)对样品a进行硅胶柱层析,中极性-高极性溶剂梯度洗脱后,对中极性和高极性溶剂体积比为8:1的洗脱部分进行硅胶柱层析,经中极性-高极性溶剂梯度洗脱后,通过反相薄层分析,对中极性和高极性溶剂体积比为5:1的洗脱部分进行中低压ods柱层析,低级醇或其水溶液梯度洗脱后,通过反相和硅胶薄层色谱分析,对其40%低级醇水溶液洗脱部分进行半制备反相hplc得到化合物3;
其中,低级醇是指c1-6的烷基醇。
优选地,步骤(1)中大花紫薇果实粉碎至粒径为35μm~64μm。
优选地,步骤(1)采用60~90%的醇进行提取。
更优选地,步骤(1)采用70%的醇进行提取。
优选地,步骤(1)醇提中使用的醇为乙醇。
在未特别声明的情况下,本发明的特定浓度的醇指的是在其水溶液中的浓度。
优选地,步骤(1)醇提1次及以上。
优选地,步骤(1)醇提1~5次。
更优选地,步骤(1)醇提4次。
优选地,步骤(1)中醇的体积与大花紫薇果实的重量比为(3~5)l:1kg。
更优选地,步骤(1)中醇的体积与大花紫薇果实的重量比为4.8l:1kg。
优选地,步骤(2)、(3)、(4)、(5)、(6)中的低极性溶剂选自环己烷、石油醚、己烷、异辛烷、三甲基戊烷、环戊烷、庚烷等烃类溶剂中的至少一种;中极性溶剂选自乙酸乙酯、氯仿、二氯甲烷、乙醚、甲酸甲酯、硝基甲烷、乙酸丁酯、异丙醚中的至少一种;高极性溶剂选自正丁醇、甲醇、叔丁醇、丙醇、异丙醇、乙醇、丙酮、四氢呋喃、吡啶中的至少一种。
优选地,步骤(2)中低极性溶剂选自环己烷;中极性溶剂选自乙酸乙酯;高极性溶剂选自正丁醇。
优选地,步骤(3)中的中极性-高极性溶剂梯度洗脱顺序为:100:1、80:1、50:1、30:1、20:1、15:1、10:1、5:1、3:1、1:1、0:1。其中,所述中极性溶剂为氯仿,高极性溶剂为甲醇。
优选地,步骤(4)、(6)中的中极性溶剂选自氯仿;高极性溶剂选自丙酮。
优选地,步骤(5)对样品a进行硅胶柱层析,中极性-高极性溶剂梯度洗脱中的中极性溶剂选自氯仿;高极性溶剂选自丙酮。第二次中极性-高极性溶剂梯度洗脱中,中极性溶剂选自环己烷,高极性溶剂选自乙酸乙酯。
优选地,步骤(4)、(5)、(6)中的低级醇选自甲醇、乙醇、丙醇中的至少一种。其中,所述的低级醇水溶液中的浓度指的是溶液中低级醇的体积百分数。
更优选地,步骤(4)、(5)、(6)中的低级醇选自甲醇。
优选地,当步骤(4)中的中极性溶剂选自氯仿,高极性溶剂选自丙酮,低级醇选自甲醇时,氯仿-丙酮梯度洗脱顺序为100:1~0:1(体积比)的氯仿-丙酮溶液,甲醇水梯度洗脱顺序为10%甲醇水溶液~100%甲醇水溶液。
优选地,当步骤(5)对样品a进行硅胶柱层析,中极性-高极性溶剂梯度洗脱的中极性溶剂选自氯仿,高极性溶剂选自丙酮,低级醇选自甲醇时,甲醇水梯度洗脱顺序为10%甲醇水溶液~100%甲醇水溶液,氯仿-丙酮梯度洗脱顺序为100:1~0:1(体积比)的氯仿-丙酮溶液。第二次中极性-高极性溶剂梯度洗脱中,中极性溶剂选自环己烷,高极性溶剂选自乙酸乙酯,环己烷-乙酸乙酯梯度洗脱顺序为20:1~0:1(体积比)。
优选地,当步骤(6)中的中极性溶剂选自氯仿,高极性溶剂选自丙酮,低级醇选自甲醇时,氯仿-丙酮梯度洗脱顺序为100:1~0:1(体积比),甲醇水梯度洗脱顺序为10%甲醇水溶液~100%甲醇水溶液。
本发明还提供上述两种甾体类化合物和一种三萜类化合物药学上可接受的盐的制备方法为:将甾体类化合物与相应的碱性盐溶解在溶剂中,从溶液中沉淀出甾体类化合物药学上可接受的盐;将三萜类化合物与相应的碱性盐溶解在溶剂中,从溶液中沉淀出三萜类化合物药学上可接受的盐。
优选地,上述两种甾体类化合物和一种三萜类化合物药学上可接受的盐的制备方法为:将本发明提取的化合物1、2、3中的任意一种与碱性盐在溶剂中混合、搅拌溶解、静置、分离出沉淀物,即得药学上可接受的盐。
优选地,上述碱性盐选自碱式醋酸铅、碱式醋酸钙、碱式醋酸镁、碱式醋酸铁、碱式醋酸亚铁、碱式醋酸锌、氢氧化钡、氢氧化钠、氢氧化钾中的任意一种。
优选地,上述的溶剂选自水、乙醇、甲醇、丁醇、戊醇中的至少一种。
优选地,搅拌时间为0.1~30min,搅拌温度为40~80℃。
更优选地,搅拌时间为8~12min,搅拌温度为45~60℃。
优选地,置于2~6℃中静置0.1~60min。
更优选地,置于3~5℃中静置20~40min。
优选地,化合物1与碱性盐的摩尔比为1:1~6,化合物2与碱性盐的摩尔比为1:1~2,化合物3与碱性盐的摩尔比为1:1~4。
经研究表明:上述提取的甾体类化合物对炎症介质no的抑制作用较显著,且其效果明显优于抗炎症药物米洛环素,说明该甾体类化合物、其互变异构体、及其药学可接受的盐具有作为制备新型抗炎症药物的巨大潜力。
另外,阿尔兹海默病(ad)是一种进行性认知障碍和记忆力损伤的中枢神经退行性疾病,伴有情感及性格的改变,严重影响患者的工作能力和生存质量。现如今阿尔治海默症的发病率逐年增高。ad的主要病理特征是细胞外β-淀粉蛋白沉积形成的蛋白斑块和细胞内微观相关的蛋白过度磷酸化形成的神经元纤维缠结,最终导致炎症,氧化应激,神经元死亡等造成一系类ad病症。小胶质细胞(bv-2)是中枢免疫细胞,激活状态下能抑制β-淀粉样蛋白沉积和聚集。大量研究表明,多种因素引起bv-2激活进而引发的神经炎症反应在ad的发展中扮演重要的角色,试验证明:提取的甾体类化合物对bv-2细胞具有抗炎活性,因而该甾体类化合物、其互变异构体、及其药学可接受的盐具有作为制备新型治疗阿尔兹海默病药物的巨大潜力。
上述甾体类化合物和三萜类化合物,其互变异构体、及其药学可接受的盐在制备抗炎症药物或治疗阿尔兹海默病或抗肿瘤药物中的应用。
优选地,上述炎症为神经炎症、肺炎、肝炎、乳腺炎、胃炎、滑囊炎、血栓闭塞性脉管炎、心肌炎中的任意一种炎症。
一种抗炎症或治疗阿尔兹海默病或抗肿瘤药物,其活性成分包含上述的甾体类化合物,其互变异构体、及其药学可接受的盐,还包括药学可接受的载体、稀释剂、赋形剂、稳定剂、抗氧剂。
优选地,载体选自淀粉、壳聚糖、海藻酸、琼脂、纤维蛋白、胶原蛋白、聚磷酸酯类、聚氨酯类、聚酸酐类、脂质体、聚乙二醇、甘露糖、半乳糖、聚维酮中的至少一种。
优选地,稀释剂选自微晶纤维素、乳糖、甘露醇、淀粉、糖精中的至少一种。
优选地,赋形剂选自甘露糖、甘氨酸、乳糖、氯化钠、葡萄糖中的至少一种。
优选地,稳定剂选自白蛋白、胶原、环糊精及其衍生物、聚乙二醇、吐温、司盘、右旋糖苷、甘露醇中的至少一种。
优选地,抗氧剂选自vc、ve、安息香酸、枸橼酸及其盐、山梨酸、亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠、硫代硫酸钠中的至少一种。
优选地,上述抗炎症或治疗阿尔兹海默病药物选自口服剂、注射剂、散剂、颗粒剂、胶囊剂、丸剂、片剂、栓即、膜剂、气雾剂、喷雾剂、粉雾剂、缓释与控释剂、靶向制剂、粉剂中的任意一种剂型。
上述甾体类化合物和三萜类化合物,其互变异构体、及其药学上可接受的盐在制备保健品中的应用。
一种保健品,所述保健品中包含上述甾体类化合物和/或三萜类化合物,其互变异构体、及其药学上可接受的盐。
本发明实验证明上述三种化合物对于三种不同类型的癌细胞的抗增殖能力较阳性药顺铂劣之,但是也具有一定的抗增殖作用。而且所述化合物是从大花紫薇果实中提取出来的,所以具备添加到保健品中作为常规保健使用的前景。
本发明的有益效果是:
1、本发明从大花紫薇果实中提取出两种甾体类化合物和一种三萜类化合物,通过理化常数和现代波谱学进行鉴定,明确了其理化性质和化学结构,为进一步研究和开发利用大花紫薇果实中甾体类和三萜类化学成分的价值提供有力的参考资料。
2、本发明的分离与提纯方法简单、高效,且温和,能完好地保存甾体类和三萜类化合物的组分,且其结构明确,质量可控。
3、药效学试验表明:本发明提供的甾体类化合物及三萜类化合物具有较好的体外抗炎活性,对bv-2细胞具有抗炎活性,表明该甾体类化合物、其互变异构体、及其药学可接受的盐具有作为制备新型抗炎症或治疗阿尔兹海默病药物的巨大潜力,为抗炎症或治疗阿尔兹海默病药物的进一步开发奠定了基础。
4、本发明实验证明上述三种化合物对于三种不同类型的癌细胞的抗增殖能力较阳性药顺铂劣之,但是也具有一定的抗增殖作用。而且所述化合物是从大花紫薇果实中提取出来的,所以具备添加到保健品中作为常规保健使用的前景。
附图说明
图1为化合物1的1h-nmr谱图;
图2为化合物1的13c-nmr谱图;
图3为化合物1的dept135谱图;
图4为化合物1的hr-esi-ms谱图;
图5为化合物1的hsqc谱图;
图6为化合物1的hmbc谱图;
图7为化合物2的1h-nmr谱图;
图8为化合物2的13c-nmr谱图;
图9为化合物2的dept135谱图;
图10为化合物2的hr-esi-ms谱图;
图11为化合物2的hsqc谱图;
图12为化合物2的hmbc谱图;
图13为化合物2的noesy谱图;
图14为化合物3的1h-nmr谱图;
图15为化合物3的13c-nmr谱图;
图16为化合物3的dept135谱图;
图17为化合物3的hr-esi-ms谱图;
图18为化合物3的hsqc谱图;
图19为化合物3的hmbc谱图;
图20中(a)为不同浓度的化合物对lps诱导的bv-2细胞cox-2和inos的蛋白表达图;(b)为对(a)的蛋白表达量量化图。
具体实施方式
下面进一步列举实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域技术人员根据本发明阐述的原理做出的一些非本质的改进和调整均属于本发明的保护范围。下述示例具体的工艺参数等也仅是合适范围中的一个示例,即本领域技术人员可以通过本发明的说明做合适范围内的选择,而并非要限定于本发明说明书示例的具体数据。
实施例1
一、甾体类化合物及三萜类化合物的提取
(1)取干燥大花紫薇果实20kg,分成等量的两批提取,每批用60升70%乙醇在60℃下回流提取四次,合并所有提取液并减压浓缩至提取液体积为15l;
(2)将步骤1)中的提取液依次用等体积的环己烷、氯仿、乙酸乙酯和正丁醇进行萃取,得到109.5g氯仿层;
(3)将氯仿层(114.9g)进行硅胶柱层析,利用氯仿甲醇梯度洗脱(100:1、80:1、50:1、30:1、20:1、15:1、10:1、5:1、3:1、1:1、0:1;v/v),得80:1洗脱部分的样品a(26.7863g);
(4)将a经硅胶柱层析,以氯仿-丙酮梯度洗脱(100:1~0:1:v/v),分为10个部份,通过反相薄层分析,对其第4部分a-8(体积比为3:1的氯仿-丙酮溶液的洗脱部分,即:3:1氯仿-丙酮洗脱部分)进行中低压ods柱层析,以甲醇水溶液(20%~100%)进行梯度洗脱后,通过硅胶和反相薄层分析,对其中第3个流份(40%甲醇水洗脱部分),再进行hplc制备,得化合物1;
(5)将a-5(样品a经体积比为6:1的氯仿-丙酮溶剂洗脱的洗脱部分)经中低压ods柱层析,以甲醇水(30%~100%)进行梯度洗脱,通过硅胶薄层色谱分析,对其第4个流份(50%甲醇水洗脱部分)进行硅胶柱层析,以环己烷-乙酸乙酯梯度洗脱(20:1~0:1;v/v)后分为5个部分,对其第3个流份(15:1环己烷-乙酸乙酯洗脱部分)再进行hplc制备,即得化合物2;
(6)将a-4样品a经体积比为8:1的氯仿-丙酮溶剂洗脱的洗脱部分,即:8:1氯仿-丙酮洗脱部分)经硅胶柱层析,以氯仿-丙酮梯度洗脱(30:1~0:1;v/v),分为10个部分份,通过反相薄层分析后,将第6部分(5:1氯仿-丙酮洗脱部分)进行中低压ods柱层析,用甲醇水(20%~100%)进行梯度洗脱后,通过反相和硅胶薄层色谱分析后,对其中第2个流份(40%甲醇水洗脱部分)再进行hplc制备,即得化合物3。
二、甾体类化合物的鉴定
1、化合物1的鉴定:
分离纯化得到的化合物1为白色无定形粉末,10%硫酸-乙醇显红色。
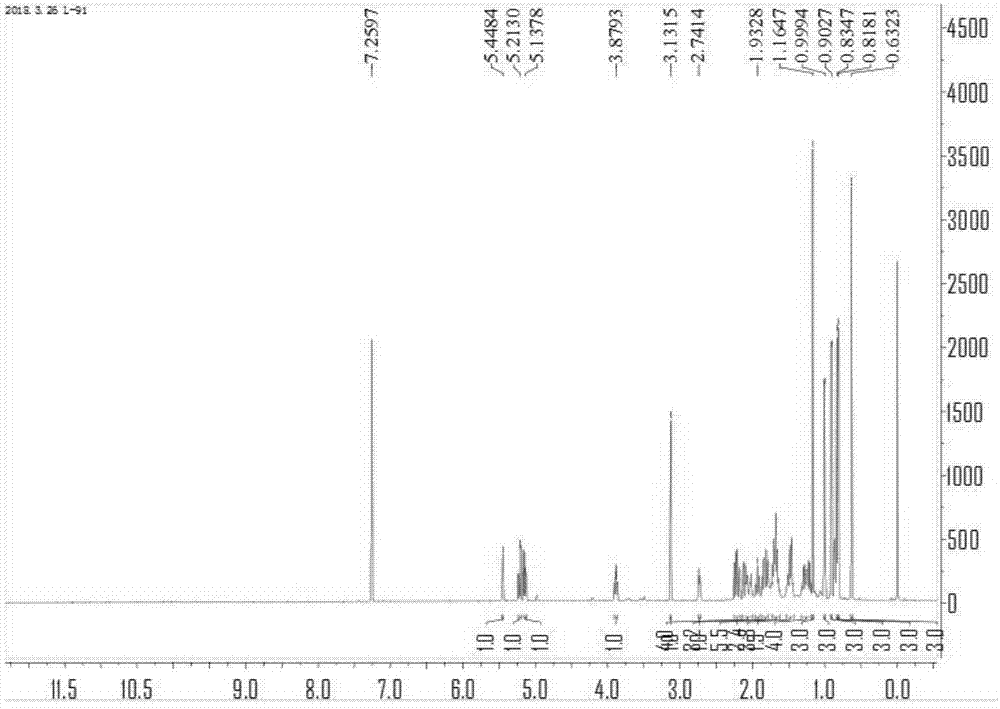
进一步对化合物1进行1h-nmr、13c-nmr、dept135、hr-esi-ms、hsqc、hmbc谱分析,结果见图1~6:
由图1的1h-nmr图谱可知:在高场区有两个甲基单峰信号δh0.63(3h,s)和1.16(3h,s),四个甲基双峰信号δh0.81(3h,d,j=6.9hz),0.83(3h,d,j=6.6hz),0.90(3h,d,j=6.9hz),0.99(3h,d,j=6.5hz)。在δh3.13(1h,s)和3.87(1h,m)处,推测可能存在两个连氧的质子信号,另外在δh5.13(1h,dd,j=15.2,7.8hz),5.21(1h,dd,j=15.2,7.8hz),,5.44(1h,m)出提示存在三个烯氢信号,且其中两个烯氢信号相互耦合,为一组烯氢信号。具体数据见表1中的1列。
由图2的13c-nmr图谱可知:该化合物共有28个碳信号,δc62.6,68.2,68.6为三个连氧的碳信号,δc121.0,132.4,135.4,136.9为四个烯碳信号,且δc132.4,135.4为麦角甾醇类化合物22,23位的双键特征信号,δc208.2为一个羰基碳信号。再由图3的dept135可得,其中伯碳有6个,仲碳有6个,叔碳11个,季碳有5个。具体数据见表1中的1列。
图4的hr-esi-ms图谱显示准分子离子峰m/z449.3024[m+na]+(calcdforc28h42o3na,449.3026),提示其分子量为426,结合1h-nmr,13c-nmr,dept135可确定其分子式为c28h42o3。
由图5的hsqc图谱可知:首先从δh3.87(h-3)出发,与δc68.6(c-3)直接相关;再从δc62.6(c-6)出发,与δh3.13(h-6)直接相关;且δc68.2(c-5)无直接相关氢信号,判定c-5,c-6间存在连氧环结构;由δh5.13(h-22),δh5.21(h-23)与δc135.4(h-22),132.4(h-23)直接相关确定存在麦角甾醇的双键信号。
由图6的hmbc图谱中可观察到δh5.44(1h,m)与δc38.7(c-10),41.4(c-12),48.1(c-14)存在远程相关,δc136.9,121与δh2.21(h-12)存在远程相关,δh1.16(h-19)与δc136.9存在远程相关。最后确定双键位置在c9与c11处。
综合上述分析,可以确定化合物1为5α,6α-epoxy-3β-hydroxy-(22e,24r)-ergosta-9(11),22-diene-7-one,其结构式如下:
2、化合物2的鉴定:
分离纯化得到的化合物2为绿色无定形粉末,10%硫酸-乙醇显红色。
进一步对化合物2进行1h-nmr、13c-nmr、dept135、hr-esi-ms、hsqc、hmbc及noesy谱的分析,结果见图7~13:
由图7的1h-nmr图谱可知:在高场区出现了六个甲基氢信号,分别是δh0.54(3h,s),0.81(3h,d,j=6.8hz),0.84(3h,d,j=6.8hz),0.91(3h,d,j=6.8hz),1.00(3h,s),1.01(3h,s),两个连氧碳上的氢信号,分别是δh4.21(1h,brs)和4.38(1h,brs),另外,还有四个烯氢的信号,分别是δh5.16(1h,dd,j=15.2,7.8hz),5.21(1h,brs),5.23(1h,dd,j=15.2,7.8hz),5.63(1h,brd,j=6.5hz),其中两个烯氢信号相互耦合,由耦合常数判断,化合物2也是麦角甾醇类化合物。具体数据见表1中的2列。
由图8的13c-nmr图谱可知:图谱中共出现28个碳信号,其中,δc68.3,71.9,77.7为三个连氧的碳信号,δc120.8,122.6,132.3,135.5,137.3,139.0为六个双键碳信号,且其中δc132.3,135.5为麦角甾醇类化合物支链上特征的双键碳信号。再由图9的dept135图谱可得,该化合物中,伯碳有6个,仲碳有6个,叔碳有11个,季碳有5个。具体数据见表1中的2列。
图10的hr-esi-ms图谱显示准分子离子峰m/z451.3181[m+na]+(calcdforc28h44o3na,451.3182),提示化合物2的分子量为428,结合化合物2的1h-nmr,13c-nmr,dept135可确定其分子式为c28h44o3。
由图11的hsqc图谱可知:从δh4.21(h-3)出发,可以找到δc68.6(c-3)与其直接相关,从δh4.38(h-6)出发,可以找到δc62.6(c-6)与其直接相关,最后由δh5.16(h-22),5.23(h-23)出发,可以找到δc135.5(c-22)和132.2(c-23)分别与之直接相关。
由图12的hmbc图谱可知:从δh4.38(h-6)出发,可以找到δc77.7(c-5)和δc120.8(c-7)与其远程相关,从δh1.01(h-19)出发,可以找到δc122.6(c-11)与其远程相关。从而判断出另外两组双键位于c-7,8和c-9,11的位置。
由图13的noesy谱,可以观察到δh4.35(6-oh)andh-12(α),判断6-oh为α构型,由δh4.21(h-3),w1/2≈7.0hz,可得5-oh为β构型。
综合上述分析,可以确定化合物2为(22e,24r)-ergosta-7,9(11),22-triene-3β,5β,6α-triol,其结构式如下:
三、三萜类化合物的鉴定
1、化合物3的鉴定:
分离纯化得到的化合物3为白色无定形粉末,且其对香兰素-硫酸以及10%硫酸-乙醇显蓝紫色,推测该化合物为三萜类化合物。
针对上述推测进一步对化合物3进行1h-nmr、13c-nmr、dept135、hr-esi-ms、hsqc、hmbc图谱的分析,结果见图14~19:
由图14的1h-nmr图谱可知:高场区出现了三萜类化合物的6个特征甲基信号,分别是δh0.83(3h,d,j=6.2hz),δh0.94(6h,overlapped),δh1.07(3h,s),1.28(3h,s),1.99(3h,s),在δh5.32(1h,brs),6.30(1h,s)处,可能存在有两个烯氢的信号,而在6.43(1h,brs)处则可能存在一个酚羟基的氢信号,具体数据见表1中的3列。
由图15的13c-nmr图谱可知:图谱共出现了29个碳信号,其中,δc10.8,17.0,17.1,21.2,21.7,23.1为甲基的信号,δc125.2,125.5,126.1,138.6,144.4,167.3,181.6,182.5为不饱和的碳信号,且δc125.5和138.6为乌苏烷型三萜结构的特征碳信号。又由图16的dept135图谱可得,其中,伯碳有6个,仲碳有7个,叔碳有6个,季碳有10个。具体数据见表1中的3列。
图17的hr-esi-ms图谱显示准分子离子峰m/z475.2818[m+na]+(calcdforc29h40o4na,475.2818),提示化合物3的分子量为452,结合1h-nmr,13c-nmr,dept135可确定其分子式为c29h40o4。
由图18的hsqc图谱可知:从δh6.30(h-1)出发,δc125.2(c-1)与其直接相关,从δh5.32(h-12)出发,δc125.5(c-12)与其直接相关。
由图19的hmbc图谱可知:从δh1.28(ch3-25)出发,可以找到δc125.2(c-1)与之远程相关,再从δh1.99(ch3-23)出发,可以找到δc126.1(c-4),δc167.3(c-5)与之远程相关,从而判定有两组双键分别位于c-1,2和c-4,5的位置。然后,从δh6.30(h-1)出发,可以找到δc144.4(c-2),δc181.6(c-3),δc167.3(c-5)与之远程相关,从δh1.99(ch3-23)出发,可以找到δc181.6(c-3),δc126.1(c-4),δc167.3(c-5),δc43.6(c-10)与之相关,从而可以确定羰基位于c-3位置。
综合上述分析,可以确定化合物3为2-hydroxy-3-oxo-24-norursa-1,4,12-triene-28-oicacid,其结构式如下:
表1
注:a样品均使用氘代氯仿作为溶剂,氢谱在600mhz的条件下测试,碳谱在151mhz的条件下测试。
b所有信号归属都依据于dept,hsqc,hmbc和noesy图谱。
四、甾体类和三萜类化合物的抗炎活性试验
采用lps(脂多糖)诱导的bv-2(小鼠小胶质细胞)建立体外炎症模型,利用mtt和griess实验,考察本发明化合物对经lps诱导后的bv-2炎症介质no的影响,抗炎药minocycline(米洛环素)作为阳性对照。
1、mtt试验
将bv-2细胞接种于96孔板中,培养24小时后,加入待测供试品,再培养24h后用mtt法测定样品对肿瘤细胞增殖的抑制率,细胞增殖抑制率=(阴性对照组od值平均值-样品组od值平均值)÷(阴性对照组od值平均值-空白对照组od值平均值)×100%,并用calcusyn软件计算被测试样品的半数抑制浓度(ic50)。
2、griess实验
将bv-2细胞接种于96孔板中,培养24小时后,加入待测供试品,再培养24h后,吸取各孔培养液50μl,加入50μlgriessa试剂和50μlgriessb试剂混匀,用酶标仪于546nm处测定od值,计算对no产生的抑制率,no抑制率=(模型对照组od值平均值-样品组od值平均值)÷(模型对照组od值平均值-阴性对照组od值平均值)×100%,并用calcusyn软件计算被测试样品的半数抑制浓度(ic50)。
上述试验结果见下表2:
表2
3、westernblot实验
将处于指数生长期的细胞种于96孔板中,分别加入不同浓度的化合物1~2(5、10、20μmol·l-1),化合物3(15、30、60μmol·l-1),并于相应时间点提取各组总蛋白,采用10%的聚丙烯酰胺凝胶进行电泳,按常规操作方法进行westernblot实验,最后采用ecl试剂盒显影并成像。每组实验重复3次,实验结果见图20,其中图中的“*”表示lps相对于ctl的显著性,“#”表示三萜皂苷类化合物相对于肌动蛋白(actin)的显著性,#p<0.05,##p<0.01,###p<0.001;*p<0.05,***p<0.01,***p<0.001)。
综上,由表2实验结果中的ic50值可知,化合物1,2对bv-2细胞的抗炎作用较阳性药吲哚美辛要强,且化合物1,2同为甾体类化合物。化合物3的抗炎作用较弱。此结果表明上述提取的甾体类化合物对炎症介质no的抑制作用较显著,且其效果明显优于抗炎症药物米洛环素。由图20可知:当浓度为5μmol·l-1,化合物1能显著下调lps诱导的bv-2细胞的inos蛋白表达,当浓度为15μmol·l-1,化合物3能显著下调lps诱导的bv-2细胞的cox-2和inos蛋白表达,而化合物2则不存在浓度与蛋白表达的显著性差异。提示:化合物1可通过抑制inos的表达,从而下调no的生物合成,而化合物3则能通过抑制cox-2和inos两种蛋白的表达来下调no的生物合成,这可能是化合物1、3抗炎机制之一,而化合物2的抗炎机制则需进一步研究。
阿尔兹海默症(ad)是一种进行性认知障碍和记忆力损伤的中枢神经退行性疾病,伴有情感及性格的改变,严重影响患者的工作能力和生存质量,多发于70岁以上的老年人,现如今发病率逐年增高。ad的主要病理特征是细胞外β-淀粉蛋白沉积形成的蛋白斑块和细胞内微观相关的蛋白过度磷酸化形成的神经元纤维缠结,最终导致炎症,氧化应激,神经元死亡等造成一系类ad病症。小胶质细胞(bv-2)是中枢免疫细胞,激活状态下能抑制β-淀粉样蛋白沉积和聚集。大量研究表明,多种因素引起bv-2激活进而引发的神经炎症反应在ad的发展中扮演重要的角色,实验证明:提取的甾体类及三萜类化合物对bv-2细胞具有不同程度的抗炎活性,因而该甾体类及三萜类化合物、其互变异构体、及其药学可接受的盐具有作为制备新型治疗阿尔兹海默病药物的巨大潜力。
五、甾体类和三萜类化合物的抗癌活性试验
采用mtt法测试了从大花紫薇果实中分离得到的三个新化合物对hela(人宫颈癌细胞),hepg2(人肝癌细胞),sgc-7901(人胃癌细胞)三种人体肿瘤细胞的细胞毒性以及正常细胞l-929(小鼠成纤维细胞)的毒性。抗癌药cis-dichlorodiamineplatinum(ⅱ)(顺铂)作为阳性对照。
1、细胞的培养及供试样品的配置
将hela等人肿瘤细胞及正常细胞l-929培养于rpmi-1640培养液中,加入10%胎牛血清,1%抗生素,于5%co2、37℃条件下培养。每两天继代培养,使细胞保持在对数生长期。各单体化合物均用dmso配置成储备液保存于4℃下,使用时用完全培养基稀释至相应浓度。mtt用pbs(phosphatebuffersolution)溶液配成5mg/ml,于4℃避光保存。使用时用基础培养基稀释至0.5mg/ml。
2、活性的测试(mtt法)
四唑盐比色实验是一种检测细胞存活和生长的方法。所用的显色剂四唑盐化学名为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名为噻唑兰,简称mtt。活细胞线粒体中的琥珀酸脱氢酶能使外源性的mtt还原为难溶性的结晶紫(甲瓒)并沉淀在细胞中,而死细胞无此功能。十二烷基磺酸钠(sds)能溶解细胞中的甲瓒。使用酶标仪在546nm处测定吸收值,可间接反映活细胞的数量。
在96孔培养板的每一孔中加入100μl生长良好的肿瘤细胞(约含5000个细胞),在5%co2、37℃条件下培养12h后加入供试样品,每组平行设3个复孔,同时设空白对照(无细胞及供试品的细胞培养液)和阴性对照(无供试品加入的细胞液)。在5%co2、37℃条件下培养48h后,离心弃去培养液,每孔加入100μl的mtt溶液(0.5mg/ml)继续培养4h,加入100μlsds,6h后用酶标仪于546nm处测定od值,按如下公式计算细胞增殖抑制率,用药理学软件计算半数抑制浓度ic50值。
细胞增殖抑制率=(阴性对照组od值平均值-样品组od值平均值)÷(阴性对照组od值平均值-空白对照组od值平均值)×100%
上述试验结果见下表3:
表3
由表3数据可得,在抗增殖活性上,化合物1对hela细胞和sgc-7901细胞均有一定的抗增殖作用,化合物2对sgc-7901也有一定的抗增殖作用,但与顺铂相比,作用都不是很强。
癌症,也叫恶性肿瘤,相对的有良性肿瘤。肿瘤是指机体在各种致瘤因素作用下,局部组织的细胞异常增生而形成的局部肿块。良性肿瘤容易清除干净,一般不转移、不复发,对器官、组织只有挤压和阻塞作用。但恶性肿瘤还可以破坏组织、器官的结构和功能,引起坏死出血合并感染,患者最终可能由于器官功能衰竭而死亡。癌症病变的基本单位是癌细胞。人体细胞老化死亡后会有新生细胞取代它,以维持机体功能。可见,人体绝大部分细胞都可以增生,但这种增生是有限度的,而癌细胞的增生则是无止境的,这使患者体内的营养物质被大量消耗。实验证明,通过抑制癌细胞增殖,也是治疗癌症的一种有手段。虽然上述三种化合物对于三种不同类型的癌细胞的抗增殖能力较阳性药顺铂劣之,但是也具有一定的抗增殖作用。因此,这两类化合物对于抗癌细胞增殖,也具有一定的指导意义和实践基础。
- 还没有人留言评论。精彩留言会获得点赞!