一种稻瘟菌基因Movan及其应用的制作方法
本发明属于植物病害防治
技术领域:
。更具体地,涉及一种稻瘟菌基因movan及其应用。
背景技术:
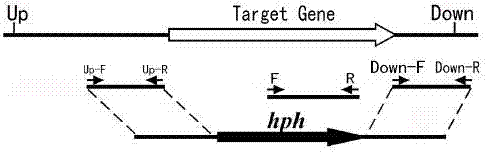
:由稻瘟菌(magnaportheoryzae)引起的稻瘟病是水稻生产上最重要的病害之一,造成世界范围内水稻平均减产10%~30%,给粮食安全带来严重威胁。稻瘟菌主要以分生孢子作为侵染寄主植物的初侵染源和再侵染源。在适宜的条件下,稻瘟菌通过附着在叶片上的分生孢子萌发形成芽管,芽管顶端分化形成附着胞;成熟的附着胞再形成侵染钉刺透水稻表皮细胞,进而在细胞内形成侵染菌丝;侵染菌丝通过在水稻细胞内和细胞间的扩展和定殖,最终在水稻叶片上形成病斑。随着病原分子生物学的发展,大量的研究表明,许多的致病相关基因与植物病原菌的病理过程有着密切的关系。因此通过对致病基因的研究对致病菌的防治具有重要的价值和意义。技术实现要素:本发明要解决的技术问题是克服现有稻瘟菌防治技术的不足,提供一种稻瘟菌致病相关基因,即基因movan,其可调控稻瘟菌菌丝生长、分生孢子的产生、黑色素沉积等,调控稻瘟菌对水稻的致病性。将该基因movan被潮霉素磷酸转移酶基因(hph)和荧光蛋白基因(sgfp)置换后,所得突变体的菌落生长速度缓慢,气生菌丝较稀疏,菌落颜色呈现灰白色,黑色素沉积明显降低,产孢量明显降低,稻瘟菌致病力明显下降。本发明的目的是提供一种稻瘟菌基因movan。本发明再一目的是提供所述稻瘟菌基因movan在防治稻瘟病方面的应用。本发明上述目的通过以下技术方案实现:本发明克隆得到一种稻瘟菌致病相关基因,即稻瘟菌基因movan,其核苷酸序列如seqidno.1所示。因此,含有所述基因movan或其功能片段的细胞系,含有所述基因movan或其功能片段的载体,以及基因movan的检测引物,均应在本发明的保护范围之内。具体地一种可选择的基因movan检测引物,序列如下:movan-f:5’-aaacgagacagagttgccaagtatt-3’;movan-r:5’-gggtgactgcttttgttctaaatag-3’。本发明经过了大量的实验证明,将基因movan从稻瘟菌中成功敲除后,所得到的稻瘟菌敲除突变体的菌落生长速度缓慢,气生菌丝较稀疏,菌落颜色呈现灰白色,黑色素沉积明显低于野生型稻瘟菌;此外,突变体的产孢量明显低于野生型稻瘟菌。致病性实验表明,稻瘟菌敲除突变体在水稻叶片上不能形成明显病斑;基因movan的缺失可导致稻瘟菌对水稻侵染能力的下降。因此以下应用也均应在本发明的保护范围之内:所述基因movan防治稻瘟菌及其引起的植物病害方面的应用。所述基因movan在防治稻瘟病方面的应用。所述基因movan在构建抗稻瘟病植物方面的应用。所述基因movan在构建抗稻瘟病水稻方面的应用。本发明还提供了一种可选择的防治稻瘟病的方法,是抑制或沉默稻瘟病中的基因movan的表达。具体方法可选择敲除稻瘟病中的基因movan或其功能片段。具体地,作为一种可选择的实施方案,防治稻瘟病的方法如下:(1)构建稻瘟菌基因敲除载体所用引物如下:movan-upf(seqidno.2):ggtaccgtccaaagcaagatgcccctgtgtt;movan-upr(seqidno.3):gggccctgtgacacaagcttgaagttcaatg;movan-downf(seqidno.4):gaattcgaagcaaaggtgtcagtggtttaac;movan-downr(seqidno.5):tctagacatgctaaagaatacgccaagagtc。以稻瘟菌基因组dna为模板,分别这两对引物扩增获得基因movan的上游同源片段和下游同源片段;先用kpni、apai分别酶切pct74-movan上游同源臂和pct74质粒,酶切产物回收、连接;再将movan下游同源臂和上一步已经连上上游同源臂的载体用ecori和xbai双酶切,切产物回收、连接、转化,经鉴定获得阳性转化子,即为敲除载体;(2)稻瘟菌原生质体的转化及筛选将上述敲除载体进行稻瘟菌原生质体转化,筛选验证得到抗潮霉素的阳性转化子。其中,步骤(2)中验证方法为pcr验证分析基因片段a-hph,所用引物为:a-hph-f:ttttcatgcggaaggaccga,a-hph-r:acattggggagttcagcgag。pcr反应体系如实施例中表3所示。pcr反应条件为:94℃反应5min;98℃反应10s,56℃反应30s,68℃反应1min,共35个循环;68℃反应7min,94℃反应5min获得扩增产物。因此,上述构建稻瘟菌基因敲除载体所用的引物movan-upf/movan-upr和movan-downf/movan-downr,以及该引物在防治稻瘟菌、防治稻瘟病方面的应用,也均在本发明的保护范围之内。本发明具有以下有益效果:本发明提供了一种新的稻瘟菌致病相关基因movan,将该基因从稻瘟菌中成功敲除后,所得到的稻瘟菌敲除突变体的菌落生长速度缓慢,气生菌丝较稀疏,菌落颜色呈现灰白色,黑色素沉积明显低于野生型稻瘟菌;此外,突变体的产孢量明显低于野生型稻瘟菌。致病性实验表明,稻瘟菌敲除突变体在水稻叶片上不能形成明显病斑;基因movan的缺失可导致稻瘟菌对水稻侵染能力的下降。本发明所提供的方法和应用在稻瘟病的防控方面具有重要意义。附图说明图1为稻瘟菌基因movan的敲除载体构建示意图。图2为稻瘟菌敲除突变体基因movan的pcr检测;注:泳道m:dnamarker;泳道1:稻瘟菌野生型;泳道2~9:稻瘟菌敲除突变体的不同转化子。图3为稻瘟菌敲除突变体潮霉素基因的pcr检测;注:泳道m:dnamarker;泳道1:稻瘟菌野生型;泳道2~7:稻瘟菌敲除突变体的不同转化子。图4为稻瘟菌敲除突变体△movan在pda培养基上的菌落形态;a:稻瘟菌野生型;b:稻瘟菌突变体△movan。图5为稻瘟菌野生型与△movan在pda培养基上的菌落直径比较;注:mozc13表示稻瘟菌野生型,mozc13-△van表示稻瘟菌敲除突变体;a和b表示p<0.05。图6为稻瘟菌野生型与△movan在西红柿燕麦培养基上的产孢量比较;注:mozc13表示稻瘟菌野生型,mozc13-△van表示稻瘟菌敲除突变体;a和b表示p<0.05。图7为稻瘟菌敲除突变体△movan分生孢子的gfp观察;a:暗场;b:明场。图8为稻瘟菌野生型与敲除突变体△movan对水稻的致病性;注:稻瘟菌分生孢子接种浓度为1×105个/ml,于接种7d后进行观察;a:清水对照b:稻瘟菌野生型;c:稻瘟菌△movan。具体实施方式以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本
技术领域:
常规试剂、方法和设备。除非特别说明,本发明所用试剂和材料均为市购。以下实施例中所用的实验材料:(1)供试菌株及植物稻瘟菌小种为广东省优势小种zc13,供试水稻为籼稻品系co39(不含已知抗稻瘟病基因)。(2)宿主菌及质粒载体克隆载体为pmd18-tvector,基因敲除载体为双元载体pct74。实施例1稻瘟菌基因movan的克隆1、引物设计及pcr扩增根据基因movan的核苷酸序列,在起始密码子和终止密码子处分别设计该基因的上游和下游同源扩增引物movan-f/movan-r,序列如下:movan-f:5’-aaacgagacagagttgccaagtatt-3’;movan-r:5’-gggtgactgcttttgttctaaatag-3’。采用ctab法抽提稻瘟菌野生型基因组dna;取1μl的基因组dna,用引物van-f/van-r进行pcr扩增。其反应体系如表1:表1稻瘟菌基因movan的pcr扩增体系模板dna1.0μlmovan-f(10μmol/l)1.0μl10×extaqbuffer(mg2+plus)5.0μldntps(2.5mmol/l)4.0μlextaq(5u/μl)0.5μlddh2o37.5μltotal50.0μlpcr反应条件为:94℃反应5min;94℃反应1min,58℃反应1min,72℃反应1min,共35个循环;72℃反应10min,获得扩增产物。2、稻瘟菌基因movan的t载体连接及转化参考pmdtm18-tvectorcloningkit(takara公司)试剂盒说明书方法,进行基因movan的载体连接,取1μlpmd18-t载体,加入4μl上述pcr产物和5μlsolutioni,于16℃连接过夜。取连接产物10μl加入到100μl大肠杆菌dh5α感受态细胞中,冰上放置30min;42℃水浴中热击90s,冰上冷却5min;加入800μllb液体培养基,于37℃、150rpm振荡培养1.5h;4000rpm离心5min,将沉淀涂布于lb培养基(含50μg/mlamp);37℃培养16~24h;观察菌落生长状况,挑取白色菌落进行筛选。3、经过进一步的基因克隆和验证得到一个新的功能基因,其核苷酸序列如seqidno.1所示。并进一步对其功能进行了详细的研究。实施例2稻瘟菌基因movan的功能研究1、实验方法(1)稻瘟菌敲除载体的构建在基因movan的上游和下游各选取长度大小约为1000bp左右的序列,并设计引物(表2)。表2稻瘟菌基因movan上游序列和下游序列同源片段的扩增引物以稻瘟菌基因组dna为模板,分别用表2所示两对引物扩增获得基因movan的上游同源片段(a片段)和下游同源片段(b片段)(图1)。先用kpni、apai分别酶切pct74-movan上游同源臂和pct74质粒,酶切产物回收后用t4连接酶连接;再将movan下游同源臂和上一步已经连上上游同源臂的载体用ecori和xbai双酶切,切产物回收后用t4连接酶连接,转化大肠杆菌dh5α;采用经菌落pcr、双酶切鉴定法,对具有amp抗性的转化子进行鉴定,所获阳性转化子即为敲除载体△movan。(2)稻瘟菌原生质体的转化将敲除载体△movan用kpni和xbai进行双酶切,所获片段为a-hph-b基因片段。将约2μg的a-hph-b基因片段加入稻瘟菌原生质体,冰浴20min;加入1mlptc缓冲液,室温放置20min;于4℃下3500rpm离心10min;用4ml液体再生培养基(酵母提取物6.0g,水解酪蛋白6.0g,蔗糖200.0g,蒸馏水定容至1l)重悬沉淀,于28℃下100rpm震荡培养16~18h;加入40ml再生固体培养基(液体再生培养基中含1.5%琼脂粉,200μg/ml潮霉素),混匀倒板,于28℃黑暗培养3~4d;挑取抗性转化子,转移到含有200μg/ml潮霉素的见里培养基(酵母浸膏5.0g,可溶性淀粉0g,琼脂粉17.0g,蒸馏水定容至1l),于28℃黑暗培养3~4d。(3)稻瘟菌敲除突变体的筛选验证将在含潮霉素抗性的培养基上获得的阳性转化子进行pcr验证分析。分别用引物movan-f/movan-r进行基因片段movan的pcr分析,用引物a-hph-f/a-hph-r(a-hph-f:ttttcatgcggaaggaccga,a-hph-r:acattggggagttcagcgag)进行基因片段a-hph的pcr分析。用接种针挑取菌丝,加入50.0μl无菌水用于菌丝pcr分析。反应体系如表3:表3稻瘟菌敲除突变体验证的pcr扩增体系pcr反应条件为:94℃反应5min;98℃反应10s,56℃反应30s,68℃反应1min,共35个循环;68℃反应7min,94℃反应5min获得扩增产物。(4)稻瘟菌菌落形态的观察和生长速度的测量将取稻瘟菌野生型菌株和突变体菌株菌块(直径0.5cm),接种于见里培养基上,28℃黑暗培养。分别在第3d、5d、7d、9d时测量菌落直径,观察菌落形态。(5)稻瘟菌分生孢子产生和萌发率的测定取稻瘟菌野生型菌株和突变体菌株菌块(直径0.5cm),接种于直径为8.5cm的西红柿燕麦产孢培养基(生燕麦40g,加入500ml双蒸水,煮沸1h,过滤后加入纯西红柿汁150ml,0.06g碳酸钙,2.5%~3%琼脂粉,双蒸水定容至1l)。于28℃下光照培养14d左右。每皿加入5ml无菌水清洗分生孢子,用四层擦镜纸过滤后即为分生孢子悬浮液,用血球计数板进行计数。将分生孢子悬浮液置于玻片上,用显微镜观察分生孢子萌发和gfp表达情况。(6)稻瘟菌分生孢子的及稻瘟病菌分生孢子的致病力实验取5叶期水稻幼苗的第5片叶(约5cm),置于培养皿内保湿。用浓度为1×105个/ml的分生孢子悬浮液(含0.02%吐温-20)接种。于28℃黑暗放置24h。再于28℃光照培养3~5d。2、实验结果与分析(1)稻瘟菌基因movan敲除载体的构建将movan上游同源臂连入pct74质粒,再将movan下游同源臂和上一步已经连上上游同源臂的载体双酶切,并进行连接转化大肠杆菌;经pcr扩增、双酶切鉴定,获得了大小为3000bp的基因片段,表明基因movan的上下游同源臂都已连接到敲除载体抗性基因hph的两端,即得到了敲除载体△movan。(2)稻瘟菌敲除突变体的筛选基因片段movan的pcr验证:经稻瘟菌基因组dna的提取,movan特异性引物的pcr扩增,对8个稻瘟菌潮霉素阳性转化子进行了分析。结果表明(图2),在8个稻瘟菌阳性转化子中,有7个扩增到约2100bp的目的基因,说明这7个转化子仍含有基因movan;有1个转化子没有扩增到基因movan,说明这1个转化子不含有基因movan。基因片段a-hph的pcr验证:经稻瘟菌基因组dna的提取、a-hph特异性引物的pcr扩增,对8个稻瘟菌潮霉素阳性转化子进行了分析。结果表明(图3),上述没有扩增到基因movan的7个转化子,仍没有扩增到1800bp的目的片段,说明这7个转化子不含有潮霉素基因,即为假阳性克隆。上述没有扩增到基因movan的1个转化子,扩增到了约1800bp的潮霉素基因目的片段,说明该转化子为阳性转化子。(3)稻瘟菌菌落形态和生长速率分析将稻瘟菌野生型和突变体△movan于见里培养基中培养11d后,分别对其菌落形态和生长速率进行了分析。结果表明,稻瘟菌野生型的气生菌丝浓密,菌落颜色呈灰褐色,黑色素沉积多;稻瘟菌突变体△movan的气生菌丝较稀疏,菌落颜色呈现灰白色,黑色素沉积减少(图4)。与野生型相比,突变体△movan的菌落生长速度缓慢(图5)。(4)稻瘟菌产孢量、及gfp观察分析将稻瘟菌野生型和突变体△movan于西红柿燕麦培养基中培养14d后,进行了产孢量分析。结果表明(图6),稻瘟菌野生型的产孢量为(1.68±0.04)×107个/皿,突变体△movan的产孢量为(1.66±0.04)×107个/皿,与野生型的产孢量有明显差异。在稻瘟菌分生孢子萌发4h后,用荧光显微镜对其荧光信号进行了观察。结果表明(图7),突变体△movan分生孢子中有特异的荧光信号,而野生型中不能观察到荧光信号。(5)稻瘟病菌分生孢子的致病力分析将稻瘟菌分生孢子悬浮液接种水稻离体叶片,于7d后进行观察。结果表明,稻瘟菌野生型接种后,水稻叶片上出现了大量病斑;而稻瘟菌突变体△movan接种后,不能形成明显病斑(图8)。该结果说明敲除稻瘟菌基因movan后,其致病力明显下降。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。序列表<110>华南农业大学<120>一种稻瘟菌基因movan及其应用<160>5<170>siposequencelisting1.0<210>1<211>1788<212>dna<213>稻瘟菌movan基因序列(movan)<400>1atgtctgggatccccattcttcctcccaccggtgagcctgccgagtacaacaacaactac60attctttactggaacaacctcgccctggacttgaaccgactgtctcactccctggcagca120aacccccaagttggccccgctgcctcgtcccgggtgcttggtgtcttgcaccttgccatc180catgacgcctttttcgccatccaccctccggctgacgaggccttcactccatacctccct240gagctgccaccccacgatggcttgactgaagcacgcaccgccgtagcagctgccgccatc300accgtccttgaggctctgtacacgacaccctcgccaagcatcgccaggaaaacgaccttt360gccctgaggcagatgatcagccagtccattgatcgcttctccaacctggatgccagactt420cccgagtaccaattcggcgccagcattgccagggccatcatcgcgcttctcattcctccc480agcgaccccggcgtcggccagggtgcttaccgccccaaggacggtccctacaagttccgc540cccgagcccaaccacccagtcaggctgatccccattgaccccaacaaccccaatggtccc600aagcaggccgtggccgagtcatatgcccccttttatggcaacgccagacggttcgccgtc660cagactgacaaccacctcctcgccgaccccccggctggtgccgaacgagaggaccccgtc720gaggacatcgactcgctgctctacgcgatccgctcgggcgccctcccggacgacaaccgc780aaccgccgcagcccggcgcagtcggtcacgggatacttttgggcctacgacggcaccaac840ctgatcggcaccccgccgcgtctgtacaaccagatgctgcgcaagctcgcctttgatcgc900cgcccggaccagtccgacatcagcagcgacgccaacacggccgactttgcccggctgttc960gccctctgcaatgccgccatgagcgacgccggcgtctttgcctggcgcgaaaagtacacc1020tttgagttctggcggcccctgagcggcatccgcgagcacccctccggtctgggcgacccc1080ttcttccagaccgtcggcagccccgagaccaacaacaacggcatcaacttcaagcccccc1140ttccccgcctacccgtccggccacgccacctttggcggcgccaccttccagatggcccgt1200ctgtactacaagcagcgcgacaacctcgacttccccgacgacggcgccgacgacatctcc1260atcgagttcgtgtcggacgagctcaacggcatcaaccgggacctgcgggaggactacgac1320gcgtcgcgccccatcacggagcaggtcgggacggtgcgcacgcgcgtgcccgtcaggttc1380gagtcgctgtggtcgtgcatccacgacaatgcgctctcgcgcgtctttttgggcgtgcac1440tggcgcttcgacgcctttgccgcccaggacgtcctggtgcccaacccgaaccaggagccc1500agcgaggggccgtaccagctcaacccggacgggtcggacaagtacaagcccgcggccgag1560gtgaagtacgaggcgcgcgccaccaggttcgacagggagggcttgttccccatcggcggt1620gtgccgctcggcctgggcatcgcggacgagatctttgccgcgaacctcaagcctacgccc1680gaggaggcccagcctggcggtgcgggtgtgagccagactcagtggctgaaggaccaagtt1740aagcaaaagacgctggatggagccaacggatccaatgggaccaagtaa1788<210>2<211>31<212>dna<213>引物movan-upf(primermovan-upf)<400>2ggtaccgtccaaagcaagatgcccctgtgtt31<210>3<211>31<212>dna<213>引物movan-upr(primermovan-upr)<400>3gggccctgtgacacaagcttgaagttcaatg31<210>4<211>31<212>dna<213>引物movan-downf(primermovan-downf)<400>4gaattcgaagcaaaggtgtcagtggtttaac31<210>5<211>31<212>dna<213>引物movan-downr(primermovan-downr)<400>5tctagacatgctaaagaatacgccaagagtc31当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1