蛋白质的修饰与分离纯化以及巯基蛋白酶的酶活调控方法与流程
本发明公开了一种蛋白质的修饰与分离纯化以及巯基蛋白酶的酶活调控方法。
背景技术:
目前,蛋白质的分离纯化方法有很多种:(1)根据分子大小不同进行分离纯化,可分为透析、超滤、离心和凝胶过滤;(2)根据溶解度不同进行分离纯化,常用的方法有等电点沉淀和ph值调节、蛋白质的盐溶和盐析、有机溶剂法、双水相萃取法、反胶团萃取法等;(3)根据蛋白质的电荷即酸碱性质不同分离蛋白质的方法,有电泳和离子交换层析两类。上述分离方法或操作繁琐或分离不彻底,有些还需要几种分离方法结合使用。
蛋白质尤其是蛋白酶在各种环境变化中如温度变化、ph变化、紫外照射等条件下容易失去活力,所以酶活力的保护是一项非常重要的课题。目前对蛋白酶活力的保护方案主要是封闭酶活力中心的关键基团。巯基蛋白酶的酶活力就由其表面巯基控制,一些环境的变化导致巯基破坏、断裂、氧化等就会导致巯基蛋白酶丧失酶活力。目前保护巯基蛋白酶酶活力的方法主要是添加一些还原剂如半胱氨酸、三(2-羧乙基)膦等保护其巯基不受氧化损害。这些方法需要一直添加试剂维持蛋白酶的巯基不受氧化损害,耗费成本较高且操作麻烦。
技术实现要素:
本发明的一个目的在于提供一种蛋白质的修饰与分离纯化,在蛋白质巯基上接上聚合物高分子,利用聚合物nipam在32℃的临界温度特性,在温度超过32℃时蛋白-聚合物从溶液中析出,此时再将蛋白-聚合物离心沉淀下来,将纯净的蛋白-聚合物用dtt或其他硫醇类还原剂处理,断掉高分子以得到原蛋白,达到纯化目的蛋白的目的。
一种含巯基蛋白质的修饰与分离纯化方法,包括蛋白质的修饰以及修饰后的蛋白质的分离纯化,所述蛋白质的修饰是在蛋白质的巯基上偶联nipam聚合物,得到蛋白-nipam聚合物;所述蛋白质的分离纯化方法为:将含有蛋白-nipam聚合物和其它物质的混合溶液加热至32℃以上,使得蛋白-nipam聚合物从混合溶液中析出,离心收集沉淀,得到纯的蛋白-nipam聚合物,最后用硫醇类还原剂处理蛋白-nipam聚合物,然后透析,得到纯化的蛋白质。
具体的,所述蛋白质的修饰方法包括以下步骤:
1)将蛋白质和硫醇类还原剂(比如tcep)分别溶解于醋酸缓冲液中,分别连接氮气除氧装置除氧7-10min,分别得到蛋白溶液和硫醇类还原剂溶液;将硫醇类还原剂溶液缓慢滴加到蛋白溶液中,在氮气除氧条件下磁力搅拌反应7-10min,反应后将混合液移入透析袋,透析袋置入缓冲液中透析三次,第一次透析使用醋酸缓冲液,后两次透析使用磷酸盐缓冲液,整个透析过程连接氮气除氧装置,透析结束后收集透析袋内的液体即透析液a;
2)调节透析液a的ph值至不小于8.0,将引发剂双[2-(2′-溴代异丁酰氧基)乙基]二硫化物(bis[2-(2′-bromoisobutyryloxy)ethyl]disulfide,以下简称biboeds)溶液缓慢逐滴加入透析液a中,磁力搅拌反应30-35min,将反应后的混合液转移到透析袋中,采用磷酸缓冲液透析三次,每次透析分别加入终浓度为7.7%、3.85%、1%的二甲亚砜到磷酸缓冲液中,透析结束后,用0.22μm的过滤器过滤透析袋内的液体,得到透析液b;
3)取5ml透析液b移入圆底烧瓶a中并连接氮气除氧装置除氧至少23min;
取6mgcucl2,10ml纯水,5ml甲醇,7μlpmdeta和600mgnipam单体加入到圆底烧瓶b中,氮气除氧25min后加入7mg抗坏血酸再除氧20min,以上操作在避光条件下进行;将圆底烧瓶b中的反应体系用氮气压入圆底烧瓶a中并保持氮气除氧反应30min,反应结束后将混合物移入透析袋并在磷酸盐缓冲液中透析三次,透析结束后,用0.22μm的过滤器过滤透析袋内的液体,得到修饰后的蛋白质,即蛋白-nipam聚合物。
具体的,所述修饰后的蛋白质的分离纯化包括以下步骤:
1)将蛋白-nipam聚合物在不低于32℃的温度下水浴3-4min,然后11000rpm离心并重悬,重复三次以上,获得纯的蛋白-nipam聚合物;
2)在上述蛋白-nipam聚合物中加入硫醇类还原剂(比如dtt),处理10-15min,,反应液用缓冲液透析三次得到纯化的蛋白质。
本发明的另一个目的在于提供一种巯基蛋白酶的酶活调控方法,在巯基蛋白酶的巯基上接上聚合物高分子,用高分子封闭巯基,这样可以在剧烈的环境变化下保护巯基不受损伤,并且可以在特定的不需要酶活力的情况下使酶活力暂时封闭。在较温和的环境下或者需要酶活力的时候用二硫苏糖醇还原剂断掉聚合物,则可以还原巯基蛋白酶的活性。
为了实现上述目的本发明采用以下技术方案:
一种巯基蛋白酶的酶活调控方法,其包括巯基蛋白酶的酶活抑制方法和巯基蛋白酶的酶活恢复方法;所述巯基蛋白酶的酶活抑制方法为:在巯基蛋白酶的巯基上偶联nipam聚合物,得到巯基蛋白酶-nipam聚合物,所述巯基蛋白酶-nipam聚合物使得巯基蛋白酶的巯基被nipam聚合物所封闭,从而抑制酶活;
所述巯基蛋白酶的酶活恢复方法为:将含有巯基蛋白酶-nipam聚合物的混合溶液加热至32℃以上,使得巯基蛋白酶-nipam聚合物从混合溶液中析出,离心收集沉淀,将沉淀溶解于pbs中以去除杂质,得到巯基蛋白酶-nipam聚合物溶液,最后用硫醇类还原剂处理巯基蛋白酶-nipam聚合物溶液,然后透析,得到恢复酶活的巯基蛋白酶。
所述巯基蛋白酶为木瓜蛋白酶或菠萝蛋白酶。
具体的,所述巯基蛋白酶的酶活抑制方法包括以下步骤:
1)将巯基蛋白酶和硫醇类还原剂(比如tcep)分别溶解于醋酸缓冲液中,分别连接氮气除氧装置除氧7-10min,分别得到蛋白酶溶液和硫醇类还原剂溶液;将硫醇类还原剂溶液缓慢滴加到蛋白酶溶液中,在氮气除氧条件下磁力搅拌反应7-10min,反应后将混合液移入透析袋,透析袋置入缓冲液中透析三次,第一次透析使用醋酸缓冲液,后两次透析使用磷酸盐缓冲液,整个透析过程连接氮气除氧装置,透析结束后收集透析袋内的液体即透析液a;
2)调节透析液a的ph值至不小于8.0,将引发剂溶液biboeds(缓慢逐滴加入透析液a中,磁力搅拌反应30-35min,将反应后的混合液转移到透析袋中,采用磷酸缓冲液透析三次,每次透析分别加入终浓度为7.7%、3.85%、1%的二甲亚砜到磷酸缓冲液中,透析结束后,用0.22μm的过滤器过滤透析袋内的液体,得到透析液b;
3)取5ml透析液b移入圆底烧瓶a中并连接氮气除氧装置除氧至少23min;
取6mgcucl2,10ml纯水,5ml甲醇,7μlpmdeta和600mgnipam单体加入到圆底烧瓶b中,氮气除氧25min后加入7mg抗坏血酸再除氧20min;
将圆底烧瓶b中的反应体系用氮气压入圆底烧瓶a中并保持氮气除氧反应30min,反应结束后将混合物移入透析袋并在磷酸盐缓冲液中透析三次,透析结束后,用0.22μm的过滤器过滤透析袋内的液体,得到酶活被抑制的巯基蛋白酶-nipam聚合物,以上操作在避光条件下进行。
具体的,所述巯基蛋白酶的酶活恢复方法包括以下步骤:
1)将巯基蛋白酶-nipam聚合物在不低于32℃的水浴中孵育3-4min后,收集乳液并在37℃以11000rpm离心5min,然后用移液管除去上清液,室温下将沉淀物溶解于pbs中,得到纯化的巯基蛋白酶-nipam聚合物溶液;
2)终浓度10mm的dtt溶液加入到纯化的巯基蛋白酶-nipam聚合物溶液中,反应后将溶液用磷酸盐缓冲液透析,得到恢复酶活的巯基蛋白酶。
本发明涉及蛋白-聚合物制备(蛋白修饰)、蛋白分离纯化、酶活力调控的新技术。这是利用一种称之为“可控原子聚合”的方法给蛋白接枝上聚合物的新技术,经过偶联聚合物修饰的蛋白质可以改善其性质和功能,改善蛋白质溶解性和稳定性等。由于nipam聚合物溶液在32℃以上时产生浑浊,可在高速离心下让nipam聚合物沉淀下来,所以在nipam聚合物与其它物质混溶的溶液中可以将其加热到32℃以上,以此方法将nipam聚合物与其它物质分离开来,以达到将nipam聚合物分离纯化的目的。本发明正是利用nipam聚合物的这一特性进行蛋白的分离纯化以及巯基蛋白酶的酶活调控。
木瓜蛋白酶等巯基蛋白酶与牛血清蛋白(或其它含巯基的蛋白)表面都具有裸露的巯基,将蛋白与引发剂按一定摩尔比(如1:5)混合搅拌后在蛋白的巯基位点接上引发剂;将接上引发剂后的蛋白与nipam单体按一定的质量比(如1:40)混合反应后得到蛋白-聚合物产物,然后利用nipam聚合物的独特性质,在不低于32℃的条件下将蛋白质从与其它物质混溶的溶液中分离出来,最后用还原剂二硫苏糖醇(dtt)断掉蛋白与聚合物连接的键,以暴露出蛋白表面的巯基使蛋白恢复原状。
木瓜蛋白酶等巯基蛋白酶的表面裸露巯基与其酶活性密切相关,表面巯基被破坏后其酶活性也会丧失。所以在以巯基蛋白酶的表面巯基为连接点对木瓜蛋白酶等巯基蛋白酶进行修饰后,其活性就会丧失,这样就可以实现在不同的环境需要下可控地对巯基蛋白酶的活性进行开关调节;在巯基蛋白酶巯基位点共轭上聚合物后,就可以在环境骤然变化时对其巯基进行保护而较好地保护其酶活性。而用还原剂dtt从连接点断掉偶联聚合物后巯基蛋白酶的活性又得以恢复。
附图说明
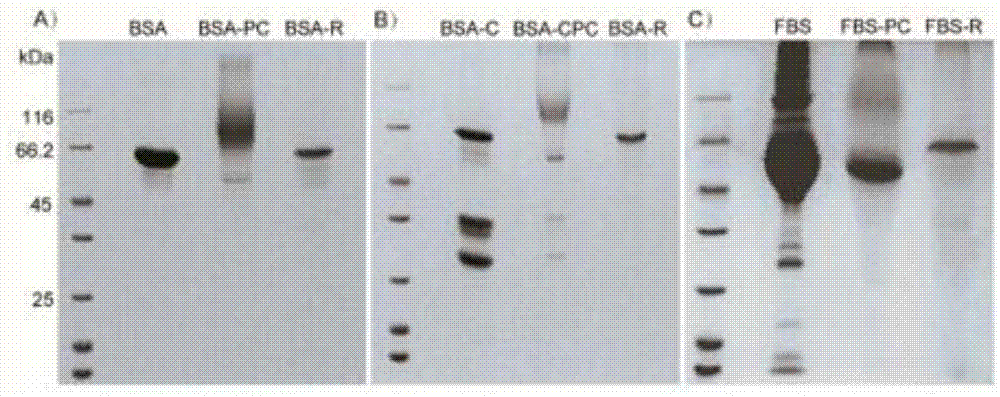
图1为sds-page电泳后牛血清白蛋白(bsa)、牛血清白蛋白和酪蛋白混合物(bsa-c)、胎牛血清(fbs)中bsa的聚合修饰与纯化图;
图2为木瓜蛋白酶和菠萝蛋白酶聚合修饰纯化图;
其中,左图lane1:mark;lane2:pap(papain,木瓜蛋白酶);lane3:pap-pc(papain-polymercomplex木管蛋白酶-聚合物偶联物);
右图lane1:mark;lane2:bro(bromelain,菠萝蛋白酶);lane3:bro-r(bromelain-polymercomplex菠萝蛋白酶-聚合物偶联物);
图3为蛋白浓度标准曲线图;
图4为木瓜蛋白酶和菠萝蛋白酶的酶活实验结果图。
具体实施方式
实施例1蛋白质的修饰与分离纯化
一、蛋白质-聚合物制备(蛋白修饰)
1tcep蛋白表面还原巯基
1)按摩尔比1:1将80mgbsa和11mg的tcep分别溶解到10ml的醋酸缓冲液,分别连接氮气除氧装置除氧7min;分别得到tcep溶液和蛋白溶液;
2)将tcep缓慢滴加到蛋白溶液中,氮气除氧条件下磁力搅拌反应7min,反应后将混合液移入透析袋,透析袋置入缓冲液中透析三次,第一次用醋酸缓冲液,后两次用磷酸盐缓冲液,整个透析过程连接氮气除氧装置,透析结束后收集透析袋内的液体即透析液a。
2蛋白表面巯基修饰引发剂
1)取10ml透析液a加入大小合适的称量瓶中,加入2mlbuffer8.2后调节溶液ph值不小于8.0。
2)将1ml引发剂溶液biboeds缓慢逐滴加入称量瓶中,磁力搅拌器搅拌反应30min,将充分反应后的混合液转移到透析袋中透析,用磷酸缓冲液透析三次,每次透析分别加入终浓度7.7%、3.85%、1%的二甲亚砜到透析液中,透析完成后,收集用0.22μm的一次性滤器过滤后的样品,得到透析液b。
3蛋白基底原子转移自由基聚合
1)5ml透析液b移入一个50ml的圆底烧瓶a,连接到氮气除氧装置除氧至少23min;
2)在圆底烧瓶b中加入6mgcucl2,10ml纯水,5ml甲醇,7μlpmdeta和600mgnipam单体,氮气除氧25min后加入7mg抗坏血酸再除氧20min(黑塑料袋罩住烧瓶避光);
3)用中空的细钢丝连接圆底烧瓶a和圆底烧瓶b,将圆底烧瓶b中包含单体的聚合反应体系用氮气压入圆底烧瓶a中与蛋白混合并保持氮气除氧反应30min(黑塑料袋罩住烧瓶避光),。反应结束后将混合物移入透析袋在磷酸盐缓冲液中透析三次,0.22μm过滤器过滤后收集滤透析袋内的液体,得到修饰后的蛋白质,即bsa蛋白-nipam聚合物。
二、蛋白质的分离纯化
1)将上述bsa蛋白-nipam聚合物在45℃水浴3min,11000rpm离心并重悬,重复三次以获得纯的蛋白-nipam聚合物。
2)加入dtt,处理10min后,反应液用缓冲液透析三次,得到纯化的bsa蛋白。
三、电泳检测
用sds-page电泳检测蛋白-nipam聚合物以及用dtt还原后的蛋白,结果如图1所示。
本实施例还在牛血清白蛋白和酪蛋白混合物中、胎牛血清中聚合修饰纯化牛血清白蛋白,进一步验证聚合修饰以及纯化的成功,具体实施方式同牛血清白蛋白,结果如图1所示。
图1显示了sds-page电泳后牛血清白蛋白(bsa)、牛血清白蛋白和酪蛋白混合物(bsa-c)、和胎牛血清(fbs)中bsa的聚合修饰与纯化图。
实施例2巯基蛋白酶的酶活调控
一、巯基蛋白酶的酶活抑制
1tcep蛋白表面还原巯基
1)按摩尔比1:1将80mg的巯基蛋白酶蛋白(本实施例分别以菠萝蛋白酶bromelain和papain木瓜蛋白酶为例)和11mg的tcep分别溶解到10ml的醋酸缓冲液,分别连接氮气除氧装置除氧7min;分别得到蛋白酶溶液和tcep溶液;
2)将tcep溶液缓慢滴加到蛋白溶液中,氮气除氧条件下磁力搅拌反应7min,反应后将混合液移入透析袋,透析袋置入缓冲液中透析三次,第一次用醋酸缓冲液,后两次用磷酸盐缓冲液,整个透析过程连接氮气除氧装置,透析结束后收集透析袋内的液体即透析液a。
2蛋白酶表面巯基修饰引发剂
1)取10ml透析液a加入大小合适的称量瓶中,加入2mlbuffer8.2后调节溶液ph值不小于8.0。
2)将1ml引发剂溶液biboeds缓慢逐滴加入称量瓶中,磁力搅拌器搅拌反应30min,将充分反应后的混合液转移到透析袋中透析,用磷酸缓冲液透析三次,每次透析分别加入终浓度7.7%、3.85%、1%的二甲亚砜到透析液中,透析完成后,收集用0.22μm的一次性滤器过滤后的样品,得到透析液b。
3蛋白酶基底原子转移自由基聚合
1)5ml透析液b移入一个50ml的圆底烧瓶a,连接到氮气除氧装置除氧至少23min;
2)在圆底烧瓶b中加入6mgcucl2,10ml纯水,5ml甲醇,7μlpmdeta和600mgnipam单体,氮气除氧25min后加入7mg抗坏血酸再除氧20min(黑塑料袋罩住烧瓶避光);
3)用中空的细钢丝连接圆底烧瓶a和圆底烧瓶b,将圆底烧瓶b中包含单体的聚合反应体系用氮气压入圆底烧瓶a中与蛋白混合并保持氮气除氧反应30min(黑塑料袋罩住烧瓶避光),。反应结束后将混合物移入透析袋在磷酸盐缓冲液中透析三次,0.22μm过滤器过滤后收集滤透析袋内的液体,分别得到酶活被抑制的papain-nipam聚合物和bromelain-nipam聚合物。
二、巯基蛋白酶的酶活恢复
1)papain-nipam聚合物(或bromelain-nipam聚合物)在40℃水浴中孵育3min后,溶液变成白色和不透明状,将乳液在37℃以11000rpm离心5min,然后用移液管除去上清液,室温下将沉淀物溶解于pbs中,重复该程序3次以彻底除去其他可溶性杂质,得到纯化的papain-nipam聚合物(或bromelain-nipam聚合物)。
2)终浓度10mm的dtt溶液加入到纯化的papain-nipam聚合物(或bromelain-nipam聚合物)中以断开二硫键,然后将溶液用磷酸盐缓冲液透析以除去多余的dtt和断掉的高分子,收集还原后的papain或bromelai,此时酶活以得到恢复。
三、电泳检测
用sds-page电泳检测papain-nipam聚合物和bromelain-nipam聚合物以及用dtt还原后的papain和bromelain,结果如图2所示。
实施例3
分别用papain和bromelain做聚合物对巯基蛋白酶活力的保护实验,采用4种不同处理方法,进行酶活力对比。
根据图3蛋白浓度标准曲线测定papain、papain-nipam聚合物、bromelain和bromelain-nipam聚合物的浓度,并将浓度都调为0.1mg/ml测酶活,因为此浓度酶解酪蛋白后测定吸光值在紫外分光光度计可测的合适范围内。
1)四种处理方式如下:
papain、papain-nipam聚合物和bromelain、bromelain-nipam聚合物的处理方式相同,以下以papain为例说明。
a)ph2.0处理
综合考虑样品量、实验误差、方便ph调节等因素,各取一定量的papain和papain-nipam聚合物到50ml离心管,用pbs缓冲液稀释到15ml,用盐酸溶液调节ph至2.0,过夜后(约12h)再将ph调节回7.4,定容至20ml,浓度为0.1mg/ml。
b)ph12.0处理
处理方式同a)
c)±80℃处理
将papain和papain-nipam聚合物都调节到0.1mg/ml的浓度,80℃水浴30min,等待温度冷却至室温后置于-80℃冰箱冷冻30min。
d)papain-nipam聚合物处理
加dtt断掉polymer后暴露papain表面巯基,恢复其活性后测酶活。
2)处理结果如图4所示。
a)图和c)图中,pap和bro为木瓜蛋白酶和菠萝蛋白酶原酶的酶活力;
pap-i和bro-i为两种酶接上引发剂后的酶活力;
pap-pc和bro-pc为两种酶聚合上nippam后的酶活力;
pap-r和bro-r为两种酶的聚合物经ddt断掉后的回复活性的酶活力。
b)图和d)图中,pap和pap-r分别是原酶和经ddt还原处理断掉聚合物后的酶;
conrol组为原酶和聚合物酶不做条件处理,将聚合物酶酶活性还原后的对照组酶活力;
ph2.0组为原酶和聚合物酶经ph2.0酸性条件处理后ph调回7.0测得的酶活力,(dtt恢复聚合物酶的酶活力);
ph12.0组为原酶和聚合物酶经ph12.0酸性条件处理后ph调回7.0测得的酶活力,(dtt恢复聚合物酶的酶活力);
temp组为原酶和聚合物酶经±80℃处理后常温条件下测得酶活力(dtt恢复聚合物酶的酶活力)。
实验结果:
a)和c)图中木瓜蛋白酶(pap)和菠萝蛋白酶(bro)的酶活力都在比较高的水平,而经过反应修饰后的蛋白-高分子聚合物pap-pc和bro-pc酶活性几乎消失。这是因为聚合反应的修饰位点在蛋白质的巯基,而木瓜蛋白酶表面巯基与其酶活性密切相关,所以巯基的封闭直接导致酶活力的丧失。图中当用还原剂二硫苏糖醇(dtt)断开蛋白质和连接引发剂和聚合物高分子的二硫键后蛋白的巯基重新暴露出来,此时酶的活力得到恢复,如图a)和c)中pap-r和bro-r。木瓜蛋白酶和菠萝蛋白酶的酶活力恢复程度分别达到88%(pap-r/pap)和83%(bro-r/bro)。
木瓜蛋白酶和菠萝蛋白酶修饰高分子后仍然可以恢复其大部分的酶活力,说明蛋白质在聚合反应一系列的过程中酶活性的损失是比较小的,蛋白质的活性并没有收到很大的影响。更进一步的是,反过来考虑高分子封闭蛋白巯基使蛋白酶暂时失去酶活性的现象,这种封闭也是对蛋白酶活性位点巯基的保护。高分子封闭巯基后可以使蛋白酶巯基活性位点不会在剧烈环境变化中被彻底地破坏。
本实施例分别测定在极酸性条件(ph2.0)、极碱性条件(ph12.0)和±80℃条件下高分子对蛋白巯基及酶活力的保护。结果如图b)和d),其中control组是不做环境处理的对照,pap和bro是木瓜蛋白酶和菠萝蛋白酶的原蛋白酶经过各种处理后的酶活力,pap-r和bro-r是高分子修饰的木瓜蛋白酶和菠萝蛋白酶在经过各种处理后加dtt断掉高分子暴露巯基后的酶活力。在ph2.0的酸性环境处理下,pap和bro酶活力分别保留5%[pap(ph2.0)/pap(control)]和1%[bro(ph2.0)/bro(control)],pap-r和bro-r酶活力分别保留56%[pap-r(ph2.0)/pap-r(control)]和31%[bro-r(ph2.0)/bro-r(control)];在ph12.0的碱性环境处理下,pap和bro酶活力分别保留44%[pap(ph12.0)/pap(control)]和2%[bro(ph12.0)/bro(control)],pap-r和bro-r酶活力分别保留87%[pap-r(ph12.0)/pap-r(control)]和62%[bro-r(ph12.0)/bro-r(control)];在±80℃环境处理下,pap和bro酶活力分别保留64%[pap(±80℃)/pap(control)]和4%[bro(±80℃)/bro(control)],pap-r和bro-r酶活力分别保留68%[pap-r(±80℃)/pap-r(control)]和58%[bro-r(±80℃)/bro-r(control)]。实验结果充分说明蛋白酶修饰后高分子对其在剧烈变化的环境下酶活力有非常好的保护效果。
- 还没有人留言评论。精彩留言会获得点赞!