杂交瘤细胞株及其产生的单克隆抗体和应用的制作方法
本发明涉及生物
技术领域:
,特别涉及杂交瘤细胞株及其产生的单克隆抗体和应用。
背景技术:
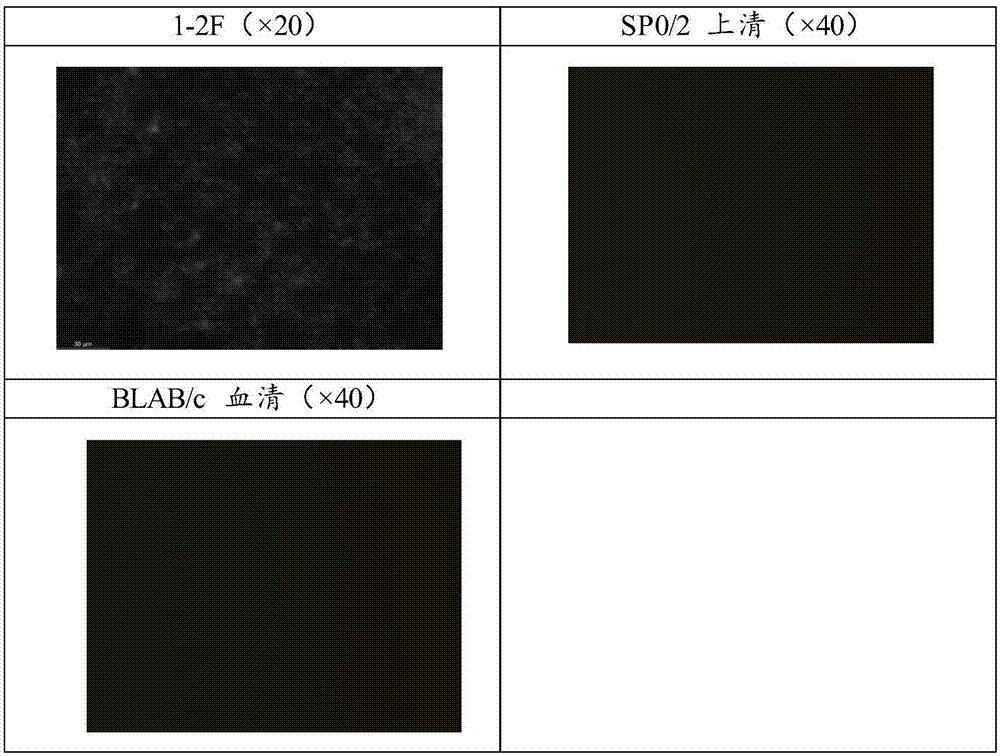
:在所有女性生殖系统恶性肿瘤中,子宫肉瘤(uterinesarcoma)是较为罕见的一种,它来源于结缔组织、子宫平滑肌和子宫内膜间质。它可以按照组织发生来源的不同,分为以下几种类型:其中40%为子宫平滑肌肉瘤(leiomyosarcoma);其次为子宫内膜间质肉瘤(endometrialstromalsarcoma),占15%;其余为上皮和间质混合性肿瘤、混合的间叶细胞肿瘤(miscellaneousmesenchymaltumors)以及未分化子宫肉瘤(undifferentiateduterinesarcoma),其中上皮和间质混合性肿瘤又分为癌肉瘤(carcinosarcoma)和腺肉瘤(adenosarcoma)。子宫肉瘤虽然罕见,发病率仅占子宫恶性肿瘤的2-4%,但其恶性程度高,预后差,5年生存率仅为30%-50%,在子宫恶性肿瘤死亡原因中占比高达25%。导致这种现象的重要原因是因为大部分子宫肉瘤对放疗和化疗不敏感,拥有很强的侵袭、转移能力,并且容易复发。所以,寻找出子宫肉瘤发生和发展过程中的主要机制,为子宫肉瘤的治疗找出有效的方法,是目前迫切需要解决的难题。技术实现要素:有鉴于此,本发明提供一种杂交瘤细胞株及其产生的单克隆抗体和应用。本发明利用husslcs免疫balb/c小鼠,建立功能性单抗库,从中筛选出识别husslcs并对其具有抑制作用的特异性功能性单克隆抗体。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了杂交瘤细胞株,其保藏编号为cctccno:c2018182。本发明还提供了单克隆抗体,选自:(i)、通过保藏编号为cctccno:c2018182的杂交瘤细胞株产生的单克隆抗体;(ii)、与能够结合由保藏编号为cctccno:c2018182的杂交瘤细胞株产生的单克隆抗体的表位结合的单克隆抗体;(iii)、在竞争结合测定中与由保藏编号为cctccno:c2018182的杂交瘤细胞株产生的单克隆抗体竞争的单克隆抗体;(iv)、具有(i)~(iii)任一项所述的单克隆抗体的抗原结合片段的单克隆抗体,其中所述片段保持特异性结合cd133或其变体的能力。在此基础上,本发明还提供了所述的单克隆抗体的制备方法,以人子宫肉瘤干细胞样细胞(husslcs)为抗原,获得b淋巴细胞;取所述b淋巴细胞与sp2/0细胞融合产生杂交瘤细胞株;筛选获得阳性杂交瘤细胞;所述人子宫肉瘤干细胞样细胞为由人子宫肉瘤sk-ut-1细胞中获得的高表达干细胞标志物cd133的悬浮细胞球。具体的,所述人子宫肉瘤干细胞样细胞的制备方法为:(1)取ssm中对数生长期的sk-ut-1细胞,按常规方法把亲本细胞制成悬液,离心、弃上清,加入无血清培养液,计数后以20000/ml的密度接种于六孔超低黏附板中,放于co2温箱中培养。隔天补充1ml无血清培养基。(2)sfm中培养10天左右,将悬浮细胞球收集于离心管中,离心、去上清,加0.25%胰酶在37℃下消化5min,用含10%fbs的培养液终止消化,轻轻吹打细胞悬液,离心,洗涤,计数细胞,加sfm,细胞密度仍为20000/ml,接种于新的六孔板中培养。隔天补充1ml无血清培养基。其中,人子宫平滑肌肉瘤细胞系sk-ut-1的培养、传代、冻存、复苏具体包括如下步骤:(1)sk-ut-1细胞系由含10%一级胎牛血清的dmem培养基(serumsupplementedmedium,ssm)常规培养,在37℃,5%co2,饱和湿度的培养箱中培养,贴壁2-3天后换液,当贴壁融合达到80%-90%时,传代一次。(2)将ssm中呈对数生长期的sk-ut-1亲本细胞的培养基弃除,用pbs洗涤细胞2次。向培养瓶内加入胰酶消化液(1ml/25cm2,2ml/75cm2)消化2-5min,在倒置显微镜下观察,当发现细胞间隙增大,细胞形态开始变圆时,加入2ml培养液终止消化,1000r×5min离心,弃上清。将细胞1:2传代,重新接种于新的培养瓶中,继续培养。(3)配制细胞冻存液,10%dmso,70%dmem,20%fbs,将处于对数生长期的sk-ut-1亲本细胞制备成单细胞悬液,计数,离心,去上清,加入冻存液,使细胞浓度达到5×106/ml,分装于无菌冻存管中,1ml/管。将冻存管先后放于40℃冰箱30min,-20℃冰箱2h,-80℃超低温冰箱过夜,然后置于液氮保存。(4)将冻存的细胞从液氮中取出,立即将冻存管放入37℃水浴中,摇动使其融化,完全融化后取出冻存管,用酒精消毒,用吸管将冻存管中细胞悬液吸出,移入已加10倍培养液的离心管中,1000rpm×5min低速离心,除去上清液,再重复用培养液洗一次。接种于培养瓶中,接种密度为5×105/ml。干细胞是机体内是一类特殊存在细胞,拥有既能自我更新又能多向分化的显著生物学特性。随着对干细胞的研究,人们对肿瘤发生、发展的认识也逐步加深,并提出了肿瘤来源于干细胞,肿瘤中存在tscs等学说。肿瘤中存在着小部分细胞群,它们能够自我更新、可以分化成具有各种表型的肿瘤细胞,由于这些特性与干细胞性质相似,因此,这小部分细胞群被命名为tscs。研究发现,肿瘤细胞中tscs含量越高,肿瘤的恶性程度也越高,但目前研究证据尚未能证明是否所有肿瘤组织中都含有tscs。近年来,随着越来越多的tscs相继在肿瘤组织中分离成功,分离鉴定tscs并对它的生物学特性进行研究已经成为一个新的热点,这为恶性肿瘤的研究与治疗指出了新的方向。1997年,bonnet等人在研究人急性髓性白血病(acutemyelocyticleukemia,aml)时发现,aml中存在tscs,并可以把这些细胞从aml中分离出来。这是人类首次从人体肿瘤中发现并分离出tscs。该研究发现,其中占全部aml细胞的0.2%,表型为cd34+cd38-的细胞亚群,拥有持续形成克隆的能力。用这小部分细胞接种非肥胖糖尿病/重症联合免疫缺陷(non-obesediabetic/severecombinedimmunodeficient,nod/scid)小鼠以后,可在小鼠体内形成aml。由于实体瘤的组织结构特性不同于血液系统肿瘤,相较而言,实体瘤的分离及研究过程更为艰难。在肿瘤的整个发生发展过程中,tscs都发挥着重要的作用。这种重要性在肿瘤转移方面表现的尤其明显。肿瘤的转移是一个牵涉到多个步骤的复杂经过,大部分恶性肿瘤患者最后死于肿瘤转移。肿瘤细胞可以从其原发病灶迁移到其它的组织、器官,关于其具体分子机制的研究目前仍比较浅显。有研究者提出了克隆选择学说,其认为在肿瘤发展的后期,部分肿瘤细胞可通过发生突变来获得转移的能力,进而使肿瘤转移到其它的组织、器官。也有学者认为,细胞的转移能力并不需要后期突变,而是在一开始就存在,然后通过一些信号因子的引导转移至其他部位,并在外界条件适宜时形成新的肿瘤组织。目前尚缺乏有力证据来支撑这种假说,但在很久以前就有人通过研究证明,只需要一个肿瘤细胞就能形成新的肿瘤病灶。而形成肿瘤并维持的这种能力,只有tscs才具有。其它肿瘤细胞即使迁移至新的环境,由于没有自我更新的能力,也不能无限分化,所以不能在新环境中生成肿瘤,也无法维持肿瘤生长及肿瘤细胞的异质性。另外,比起普通肿瘤细胞,tscs更具有遗传不稳定性,更能够在新环境中适应并且生存下来。因此,在tscs假说提出后,研究人员又提出了转移tscs假说,该假说认为,在tscs中有部分细胞具有转移能力,它们被称为转移tscs,转移tscs的周围微环境与其转移能力大小有关。很多研究者在对tscs的耐药性进行研究后发现,肿瘤患者之所以产生化疗失败现象,主要是因为肿瘤组织中tscs的存在。大部分tscs的细胞膜上都会表达abc转运蛋白,abc转运蛋白参与运输以及外排包含毒性物质、代谢产物、药物等在内的多种物质。neumanovaz等人研究发现,abcg2——人abc蛋白家族的一种,参与了人体几大屏障的形成,包括血睾、胎盘及血脑屏障。stacyae等人研究发现abcg2参与了细胞的新陈代谢,因其可以排出代谢产物,故被称作为“泵”,abcg2还可以使人体避免外源物质的侵犯。因为abcg2具备上述特殊功能,其与肿瘤细胞化疗药物抵抗性之间的关系已成为研究者们在抗癌治疗方面的一个新的研究靶点。abcg2的作用机理为通过结合和水解三磷酸腺苷来获得排出细胞内药物所需的能量,进而降低药物在细胞内的浓度、减轻药物对细胞的毒作用,从而使肿瘤细胞产生耐药。有研究者采用多聚酶链反应检测aml病人在接受化疗之前细胞中abc蛋白的表达,发现白血病干细胞abcb1和abcg2的表达与病人的治疗效果密切相关,abcb1和abcg2高表达的患者大部分未显疗效,而不表达的患者大部分完全缓解。在aml细胞中,表达abcb1和abcg2较多的,对柔红霉素的抵抗性也更强,维拉帕米作为abc转运体抑制剂,可以减弱这种耐药性。这可以表明abcg2在aml干细胞中的表达情况与aml化疗耐药相关。因此,靶向tscs的治疗方式有望成为逆转肿瘤耐药的关键点。现有的抗癌疗法尚不能将肿瘤细胞“一网打尽”,有一个不能忽视的重要原因。目前主要的抗癌疗法都只能对付肿瘤周边的非增殖细胞,对于肿瘤内部起到关键作用的增殖细胞,即tscs,还无能为力。因此对肿瘤的治疗只能停留于表面,却不能伤其根本。部分药物主要通过肿瘤体积的缩小程度来衡量其有效性,通常,仅消除肿瘤周边的非增殖细胞即能有效的减小肿瘤体积。tscs类似于成体干细胞,拥有其大部分特性,对化疗药物具有更好的耐受性。经化疗药物处理以后,tscs可停留在细胞周期中的g0/g1期,即转变成休眠的状态,借以逃脱化疗药物的进攻后存活下来,还能在化疗后继续形成新的癌细胞,导致癌症的复发。研究发现,在经过传统治疗,即放疗、化疗和手术以后,患者的体内仍然存留部分“历经磨练”的tscs,其拥有高于普通癌细胞数百倍的生存活力,转移能力也强于普通癌细胞。促分化疗法是指使肿瘤组织中的未分化干细胞向终末细胞分化,并可使肿瘤细胞对细胞毒性药物增敏。malumbres等人发现,可以通过抑制能引起染色体及基因不稳定的促细胞周期蛋白激酶的活性,使tscs进入细胞周期中期,进而使肿瘤细胞对化疗药物敏感。yanada等人发现,因为全反式维甲酸能够使白细胞进行分化,急性早幼粒细胞白血病可以通过全反式维甲酸来治愈,细胞毒性药物联合全反式维甲酸治疗晚期患者,也可达到较好的效果。piccirillo等人发现,骨成型蛋白在结合其自身受体以后,能够使成人胶质瘤细胞产生分化,显著减少cd133+细胞群的数量,代表抑制了tscs的生长。综上所述,tscs在恶性肿瘤的转移、耐药及复发过程中发挥着关键性作用,所以,靶向tscs的治疗方式可能为抗癌治疗开辟一条充满希望的、全新的道路。本发明还提供了所述的单克隆抗体或所述的制备方法制得的单克隆抗体在制备抑制人子宫肉瘤干细胞样细胞(husslcs)自我更新、无限制增殖、锚定非依赖性生长、致瘤、迁移、侵袭、多药耐药的药物和/或制剂中的应用。本发明还提供了所述的单克隆抗体或所述的制备方法制得的单克隆抗体在制备抑制肿瘤干细胞标志物cd133蛋白表达的药物和/或制剂中的应用。本发明还提供了所述的单克隆抗体或所述的制备方法制得的单克隆抗体在制备治疗肿瘤的药物和/或制剂中的应用。本发明还提供了所述的单克隆抗体或所述的制备方法制得的单克隆抗体在制备检测肿瘤的试剂和/或试剂盒中的应用。在本发明的一些具体实施方案中,所述肿瘤为子宫肉瘤。本发明还提供了药物,包括所述的单克隆抗体或如所述的制备方法制得的单克隆抗体及药学上可接受的辅料。在本发明的一些具体实施方案中,所述药物能够抑制人子宫肉瘤干细胞样细胞(husslcs)自我更新、无限制增殖、锚定非依赖性生长、致瘤、迁移、侵袭或多药耐药。在本发明的一些具体实施方案中,所述药物能够抑制肿瘤干细胞标志物cd133蛋白表达。本发明还提供了试剂盒,包括所述的单克隆抗体或所述的制备方法制得的单克隆抗体。在本发明的一些具体实施方案中,所述试剂盒能够检测肿瘤。本发明以husslcs为抗原,制备大量增殖的b淋巴细胞;elisa法测血清抗体滴度;b淋巴细胞与sp2/0细胞融合产生杂交瘤细胞;elisa法筛选阳性杂交瘤细胞;有限稀释法扩大培养阳性杂交瘤细胞;elisa法检测抗体亚型;免疫荧光法鉴定单抗;球形成法、琼脂集落形成法、创口愈合法、流式细胞术、蛋白质印迹实验检测单抗对husslcs球形成、琼脂集落形成、细胞迁移以及肿瘤干细胞标志蛋白cd133、cd44、abcg2、bmi1、nanog、oct4、aldh1表达的影响。本发明利用分离出的husslcs免疫balb/c小鼠,建立功能性单抗库,从中筛选出识别husslcs并对其具有抑制作用的特异性功能性单克隆抗体,并对其性质进行鉴定、对其功能进行研究。以期为靶向husslcs的治疗提供有应用价值的候选治疗剂,并为鉴定husslcs新的分子靶标奠定基础。有益效果包括但不限于:1、husslcs免疫小鼠产生的抗体效价达到制备单抗的要求;2、husslcs致敏的b淋巴细胞与骨髓瘤sp2/0细胞融合产生的杂交瘤细胞,经筛选、克隆可获得稳定分泌抗husslcs单抗的杂交瘤细胞株;3、抗husslcs单抗可抑制husslcs自我更新、增殖、迁移、侵袭、耐药;4、经第二、三次和冲击免疫,血清抗体效价较初次明显上升(p<0.05);5、sp2/0细胞培养3天达65%融合度,死细胞<2%;6、elisa法检测杂交瘤细胞发现阳性孔;7、阳性孔克隆培养后,获得1株稳定分泌抗husslcs单抗的杂交瘤细胞株;8、单抗亚型为igg2a;9、杂交瘤细胞株1-2f上清孵育的红色荧光细胞最多;10、1-2f上清以浓度依赖方式降低husslcs球形成率、琼脂集落形成率、细胞迁移率以及cd133、cd44、abcg2、bmi1、nanog、oct4、aldh1的表达。生物保藏说明分类命名:杂交瘤细胞株1-2f;于2018年08月14日保藏于中国典型培养物保藏中心(cctcc);,保藏中心地址为:中国武汉武汉大学;保藏编号为cctccno:c2018182。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示间接elisa法检测husslcs免疫小鼠血清(1:1000000)的抗体效价;图2示倒置相差显微镜下sp-2/0细胞半贴壁生长图像(×20);图3示倒置相差显微镜下融合的杂交瘤细胞单层贴壁生长图像(×20);图4示间接elisa法检测阳性杂交瘤细胞分泌特异性抗体的亚型;图5示单克隆抗体检测husslcs的细胞免疫荧光图像;图6示1-2f单克隆抗体抑制husslcs球形成能力;注:a,相差显微镜下典型子宫肉瘤细胞球图像(×100);b,成球率测定;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图7示1-2f单克隆抗体抑制husslcs琼脂集落形成能力;注:a,相差显微镜下典型子宫肉瘤细胞图像(×100);b,琼脂集落形成率测定;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图8示1-2f单克隆抗体抑制husslcs细胞迁移能力;注:a,相差显微镜下典型子宫肉瘤细胞图像(×100);b,细胞迁移率测定;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图9示1-2f单克隆抗体减少husslcscd133阳性细胞;注:a,典型流式细胞仪分析图像;b,cd133阳性细胞百分率测定;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图10示1-2f单克隆抗体抑制husslcscd44蛋白表达;注:a,典型蛋白质印迹条带图谱;b,蛋白质印迹分析;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图11示1-2f单克隆抗体抑制husslcsabcg2蛋白表达;注:a,典型蛋白质印迹条带图谱;b,蛋白质印迹分析;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图12示1-2f单克隆抗体抑制husslcsbmi1蛋白表达;注:a,典型蛋白质印迹条带图谱;b,蛋白质印迹分析;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图13示1-2f单克隆抗体抑制husslcsnanog蛋白表达;注:a,典型蛋白质印迹条带图谱;b,蛋白质印迹分析;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图14示1-2f单克隆抗体抑制husslcsoct4蛋白表达;注:a,典型蛋白质印迹条带图谱;b,蛋白质印迹分析;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3);图15示1-2f单克隆抗体抑制husslcsaldh1蛋白表达;注:a,典型蛋白质印迹条带图谱;b,蛋白质印迹分析;对照sp2/0细胞上清处理细胞(cont):*p<0.05(mean±sd,n=3);对照1-2f单克隆细胞上清(1:1000)处理细胞:#p<0.05(mean±sd,n=3)。具体实施方式本发明公开了一种杂交瘤细胞株及其产生的单克隆抗体和应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。自1997年bonnet等人成功从人急性髓性白血病中分离出肿瘤干细胞(tscs)以来,人们已陆续从乳腺癌、胰腺癌、前列腺癌、肝癌等多种恶性肿瘤中分离出tscs,并通过一系列研究发现,tscs与恶性肿瘤的耐药、转移、复发有着密切的关系,因此,靶向tscs的治疗有望成为恶性肿瘤的一种新型、有效的治疗方式。现有的针对tscs的靶向治疗,主要包括三种:分子靶向治疗、促分化治疗及抗体治疗。通过对多种tscs的研究发现,tscs表面存在多种标志物,其中分布最广的是cd133,例如肝癌、脑癌、结肠癌,其cd133阳性细胞比起cd133阴性细胞致瘤性明显增强。本课题组在前期研究中已成功从子宫肉瘤细胞系sk-ut-1细胞中分离、培养出高表达干细胞标志物cd133的悬浮细胞球,实验证实该cd133阳性细胞球具有明显干细胞特性,增殖、侵袭、转移、耐药能力均强于亲本子宫肉瘤细胞。因此,cd133有希望成为子宫肉瘤干细胞样细胞的治疗靶点。动物在受到抗原刺激以后可产生抗体,特异性抗体针对的是抗原表面的某种特定决定簇,由于抗原表面决定簇的多样性,因此被免疫动物所产生的抗体是多种抗体的混合物,要把这些不同的抗体分开极为困难,而且得到的抗体量较少。而单克隆抗体技术的出现,很好的解决了这一问题。1975年,milstein和kohler发明了单克隆抗体技术,该技术的原理是:仅由一种类型的细胞产生抗体。b淋巴细胞虽然可以产生抗体,但却不能在体外无限分裂;而瘤细胞虽然可以在体外无限传代,但不能产生抗体。因此,将这两种细胞融合后得到的杂交瘤细胞兼具两种细胞的特性,既能无限分裂,也能产生抗体。制备单克隆抗体分为以下几个步骤:第一,通过抗原免疫小鼠获得大量增殖的能分泌抗体的b淋巴细胞;第二,将具有无限传代功能的瘤细胞与b淋巴细胞融合产生杂交瘤细胞;第三,通过筛选获得只产生专一抗体的杂交瘤细胞;第四,单克隆抗体的生产,有两种方法:一种是大规模体外培养杂交瘤细胞,然后从杂交瘤细胞培养液中获取单抗;另一种是在小鼠腹腔内注射杂交瘤细胞,然后从小鼠腹腔中获取单抗。单克隆抗体作为重要的肿瘤治疗方式,已陆续有研究者通过分离、纯化肿瘤干细胞来制备其相应的单克隆抗体,以期为肿瘤干细胞靶向治疗提供有效的候选抗体药物。已有研究者获得与肝癌tscs表面标志物cd133共定位的抗肝癌tscs单克隆抗体,并通过体外研究证明这些单克隆抗体能显著抑制tscs的增殖与成球生长。本发明利用分离出的cd133阳性子宫肉瘤干细胞样细胞,制备靶向子宫肉瘤干细胞样细胞并对其增殖、侵袭、转移等干细胞特性有显著抑制作用的单克隆抗体,也有望成为子宫肉瘤的一种新的、有价值的治疗方式。单克隆抗体的制备及鉴定balb/c小鼠拥有良好的免疫条件,且随着动物年龄增加,免疫力逐渐降低,相比于雄性鼠,雌性小鼠更便于操作,因此,首选6-8周龄的雌性balb/c小鼠作为免疫动物。实验2.4.1.1取经husslcs免疫过的6周龄雌性balb/c小鼠的血清用间接elisa法进行抗体效价的检测。阴性对照组为未免疫的小鼠血清,以阴性对照组抗体效价的2.1倍作为临界值来判断结果是否为阳性。实验结果示:小鼠体内抗体水平,在第一次免疫后效价较低;在进行第二次、第三次及冲击免疫后,抗体效价升高明显,说明husslcs能引起小鼠体内较强的免疫反应,免疫原性良好。在评价制备单克隆抗体时好的免疫效果的指标为:血清效价达一万以上。酶标仪读数,选择吸光度值在0.7-1.2的抗血清稀释倍数,即为抗体效价。我们的实验数据显示,第二次免疫以后,百万倍稀释的小鼠血清抗体的吸光度值符合这个范围,远超过单克隆抗体的制备要求。p3、sp2/0、nso/1等瘤细胞株与balb/c小鼠同源,且sp2/0细胞株的生长与融合最占优势,因此目前应用最广的瘤细胞株为骨髓瘤sp2/0。在融合前,骨髓瘤细胞必须保持非常良好的状态才可以保证有较高的融合率,一般保证生长至60-80%左右密度时认为是对数生长强壮期。本发明培养的骨髓瘤细胞在培养3天后可达65%密度,台盼蓝染色细胞计数的结果证实:死细胞百分率小于2%;说明sp2/0细胞生存活力高。细胞融合的方法主要分三种:生物方法诱导效率低、诱导不稳定、可重复性差;物理方法虽然销量高,但成本也高,且操作复杂;我们选用的是简单、实惠的化学方法,采用聚乙二醇作为细胞融合剂。本发明采用peg1500作为助溶剂使用化学方法进行细胞融合。单克隆抗体制备过程包括两次筛选,第一次筛选出杂交瘤细胞,第二次筛选出能产生特异性抗体的杂交瘤细胞。第一次筛选在细胞融合后,杂交瘤细胞的选择性培养是关键。hat选择性培养液是在普通的动物细胞培养液中加入次黄嘌呤(h)、甲氨蝶呤(a)和胸腺嘧啶核苷酸(t)。其依据是细胞中的dna合成有两条途径:一条途径是“d途径”(生物合成途径),即由氨基酸与其他小分子化合物合成核苷酸,为dna分子的合成提供原料。叶酸作为重要的辅酶参与这一过程,而hat培养液中甲氨蝶呤是一种叶酸的拮抗物,可以阻断“d途径”。另一条途径是“s途径”(应急途径),它是利用次黄嘌呤—鸟嘌呤磷酸核苷转移酶和胸腺嘧啶核苷激酶催化次黄嘌呤和胸腺嘧啶核苷生成相应的核苷酸,两种酶缺一不可。因此,在hat培养液中,未融合的b淋巴细胞和两个b淋巴细胞的自身融合细胞的“d途径”被甲氨蝶呤阻断,虽“s途径”正常,但因缺乏在体外培养液中增殖的能力,一般7-10天左右会死亡。对于骨髓瘤细胞以及自身融合细胞而言,由于次黄嘌呤—鸟嘌呤磷酸核苷转移酶缺陷,因此自身没有“s途径”,且“d途径”又被甲氨蝶呤阻断,所以在hat培养液中也不能增殖而很快死亡。只有骨髓瘤细胞与b淋巴细胞相互融合形成的杂交瘤细胞,既具有b淋巴细胞的“s途径”,又具有骨髓瘤细胞在体外培养液中长期增殖的特性,因此能在hat培养液中选择性存活下来,并不断增殖。用液体培养基培养法筛选8天,融合的杂交瘤细胞成簇生长形成小的细胞集落,细胞混匀透亮,增殖速率高。本发明利用间接elisa法检测阳性杂交瘤细胞的筛选发现有6个阳性孔。对这6个阳性孔,采用有限稀释法进行克隆化,经过4次克隆化获得6株稳定分泌抗husslcs单克隆抗体的杂交瘤细胞株。通过免疫荧光检测发现,细胞株1-2f的上清能呈现最多的红色荧光。单抗通过husslcs表面的特定靶点与其结合,因为我们筛选的单抗均为igg抗体,因此带有荧光标记的抗igg二抗能与单抗结合。通过洗去未能与husslcs结合的单抗,最终能显现出红色荧光的为与husslcs结合的单抗。因此本发明提供的1-2f细胞株分泌的单抗最有可能是能与husslcs特异性结合的功能性单抗,所以后面的功能实验,我们均选择1-2f单克隆细胞株。抗husslcs单克隆抗体体外功能研究husslcs球形成实验不同于一般细胞,肿瘤细胞不发生接触抑制,尤其是tscs,所以更容易成球。成球能力是tscs体外功能实验的一个重要方法,它可以判断单个细胞在适合的条件培养基中自我更新的能力,一般用细胞球形成率表示。测定husslcs球形成率:发现不同稀释比例1-2f单克隆细胞上清以浓度依赖方式降低husslcs球形成率,说明1-2f单克隆抗体具有抑制husslcs自我更新作用。husslcs琼脂集落形成实验肿瘤细胞可以在软琼脂培养基中无限增殖,从而形成细胞集落,而成熟分化的细胞则丧失了软琼脂中形成集落的能力。琼脂集落形成法通常用于检测肿瘤干细胞的锚定非依赖性生长和失巢性凋亡耐受能力,并与肿瘤细胞的体内肿瘤形成潜能呈正相关。本实验的琼脂集落形成率结果表明,不同稀释比例1-2f单克隆细胞上清以浓度依赖方式降低husslcs琼脂集落形成率。说明1-2f单克隆抗体具有抑制husslcs锚定非依赖性生长和致瘤作用。husslcs细胞迁移实验有研究表明,肿瘤干细胞呈现上皮-间充质转化(epithelial-mesenchymaltransition,emt)表型,具有更强的体外细胞迁移、侵袭和体内转移能力。本发明的创口愈合法测细胞迁移率的结果表明,不同稀释比例1-2f单克隆细胞上清以浓度依赖方式降低husslcs细胞迁移率。说明1-2f单克隆抗体具有抑制husslcs迁移和运动能力的作用。husslcscd133表达实验cd133是一种跨膜糖蛋白,是包括肝癌、子宫肉瘤在内的各种组织的干细胞及其肿瘤干细胞的一个重要表面标记物,并与多种类型肿瘤病人的不良预后相关。本实验使用的husslcs为前期实验分离的高表达cd133的人子宫肉瘤干细胞样细胞。pe标记cd133抗体流式细胞术结果表明,不同稀释比例1-2f单克隆细胞上清以浓度依赖方式降低husslcscd133阳性细胞百分率。说明1-2f单克隆细胞培养基上清具有抑制husslcs肿瘤干细胞标志物cd133蛋白表达的作用或者说能有效减少肿瘤干细胞数目。husslcs表面标志蛋白cd44、abcg2、bmi1、nanog、oct4、aldh1表达的蛋白印迹实验研究发现,cd44的过表达可促进和维持肿瘤干细胞的自我更新、迁移和侵袭,是多种肿瘤干细胞的标志性蛋白;abcg2过表达促成和维持肿瘤干细胞多药耐药;bmi1异常表达促成和维持肿瘤干细胞自我更新、无限制增殖和多药耐药性质;nanog异常表达与肿瘤干细胞自我更新、无限制增殖功能相关;oct4异常表达与肿瘤干细胞自我更新、无限制增殖功能和emt表型相关;aldh1异常表达增强干细胞和肿瘤干细胞耐受药物和其他化合物的细胞毒性作用,并促成和维持肿瘤干细胞多药耐药和细胞失巢性凋亡抵抗。本实验的蛋白质印迹分析结果显示,不同稀释比例的1-2f单克隆细胞上清以浓度依赖方式降低husslcscd44、abcg2、bmi1、nanog、oct4、aldh1蛋白表达水平(p<0.05)。这些结果说明,1-2f单克隆抗体具有抑制husslcs以上多种肿瘤干细胞标志物的表达作用,说明该单抗能有效抑制husslcs自我更新、无限制增殖、迁移、侵袭、多药耐药等肿瘤干细胞特性。目前国内外尚未见到针对子宫肉瘤干细胞的功能性单克隆抗体的研究报道。本课题组目前正在进行下一步的体内功能试验,使用含不同肿瘤标记物的细胞致瘤裸鼠,再使用阳性单抗对致瘤裸鼠进行抗体治疗实验。深入探讨这些功能性单抗是否能够有效抑制子宫肉瘤移植瘤的生长、转移,延长荷瘤小鼠的生存期。以期为靶向husslcs的治疗提供有应用价值的候选治疗剂,并为鉴定husslcs新的分子靶标奠定基础。本发明提供的杂交瘤细胞株及其产生的单克隆抗体和应用中所用原料及试剂均可由市场购得。细胞系及实验动物sk-ut-1细胞系第2代cd133+球细胞(命名为husslcs)来自前期实验,保存于湘雅医院细胞中心。骨髓瘤sp2/0细胞系细胞,由湖南师范大学刘如石教授惠赠,冻存于湖南师范大学医药学中心实验室。5周龄雌性balb/c小鼠:购于北京维通利华实验动物技术有限公司,所有的动物实验均由湖南师范大学医学院实验动物伦理委员会批准。主要仪器与用品名称来源公司二氧化碳细胞培养箱美国shel-lab公司医用净化工作台苏州净化设备公司倒置显微镜日本olympus公司漩涡振荡器美国seientifichidvstries高速离心机上海安亭科学仪器厂电子恒温水浴锅中国北京中兴伟业仪器有限公司微量移液器德国eppendorf公司细胞吹打管维尔公司电热恒温培养箱上海精宏实验设备有限公司细胞培养皿美国corning公司细胞培养板美国corning公司细胞培养瓶美国corning公司不锈钢细胞筛上海生工生物有限公司脱色摇床江苏金坛公司扫描仪ranongis-2008上海天能科技有限公司稳压稳流电泳仪北京六一仪器厂转膜仪美国bio-rad公司主要实验试剂英文缩写统计学方法实验数据用均数±标准差(mean±sd)表示,运用spss(statisticalproductandservicesolutions,“统计产品与服务解决方案”软件)18.0统计、anova分析方差。方差齐性均数间的比较运用lsd,方差不齐的多组均数运用tukey's检验。p<0.05差异有统计学意义。下面结合实施例,进一步阐述本发明:实施例1建立大容量抗husslcs单克隆抗体库,筛选、鉴定能特异性识别husslcs的单克隆抗体间接elisa法检测husslcs免疫balb/c小鼠的血清效价小鼠免疫试验取6周龄雌性balb/c小鼠2只,每只腹腔注射husslcs1×107/0.5ml生理盐水;在初次免疫2周后,按照初次免疫方法进行第二次免疫;在第二次免疫2周后,按照初次免疫方法进行第三次免疫;在第三次免疫2周后,每只小鼠脾脏注射husslcs5×105/0.1ml生理盐水进行冲击免疫。3天后,制备脾细胞悬液。间接elisa法检测血清的抗体滴度(1)每次免疫2周后,从小鼠眼眶取血检测血清效价。按住小鼠头部,用毛细管插入小鼠的内眼角,取血15μl,移入小离心管中,3000转/分钟,离心10分钟。用加样器吸取血浆适量,按1:10、1:100、1:1000、1:10000、1:100000、1:1000000的浓度梯度用pbs稀释血清。然后,进行酶联免疫吸附测定。(2)96孔细胞培养板每孔加入50μl10μg/ml的l-左旋多聚赖氨酸,室温下放置30分钟后,用pbs洗涤2次;每孔加入50μlhusslcs细胞悬液(2.5×106细胞/ml),4℃过夜,次日用pbs洗涤1次;每孔内加入50μl0.5%戊二醛,4℃固定15分钟,用pbs洗涤2次;每孔加内加入0.1mol/l甘氨酸溶液400μl,4℃放置30分钟,pbs洗涤3次;每孔加入不完全dmem培养基,置-20℃保存备用;检测时将细胞培养板从-20℃冰箱中取出,待孔内液体融化后,用pbs洗涤2次;每孔内加入100μl待测的免疫小鼠血浆,每个梯度设置三孔重复,37℃放置2小时,用pbs洗涤4次;每孔内加入100μl酶标羊抗小鼠igg抗体,37℃作用2小时,用pbs洗涤6次;每孔内加入200μl新配制的底物tmb,37℃作用10分钟;每孔加入终止液50μl终止反应;用酶标分光光度仪,在450nm波长处检测吸光度值。骨髓瘤sp2/0细胞系细胞的体外培养按照文献[29]的方法,sp2/0细胞系在含链霉素100μg/ml和青霉素g100iu/ml以及10%fbs的1640细胞培养基中维持。放置于37摄氏度、5%二氧化碳的培养箱中,使sp2/0细胞呈半贴壁生长,常规每2天(1:4)传代1次进行细胞扩增。细胞融合(1)处死1只未经免疫的balb/c小鼠,用75%的酒精浸泡5至10分钟后消毒小鼠;在超净工作台中,将小鼠仰卧于解剖盘上。用灭菌剪刀剪开小鼠腹部皮肤,沿切口将皮肤拉开,再次用酒精消毒;用注射器向腹腔注入5ml无血清1640培养液,轻揉腹腔1至2分钟之后用注射器抽吸小鼠腹腔内的液体。将腹腔内液体转移入20%fbs-hat-1640培养基(400ml)中。(2)取经husslcs冲击免疫后的小鼠1只,将小鼠摘掉眼球、放血、处死,用75%的酒精浸泡5至10分钟后消毒小鼠;在超净工作台中,将小鼠仰卧于解剖盘上,剪除小鼠脾脏,去除周围脂肪、结缔组织,用无血清培养液清洗脾脏数次;将脾脏放入细胞筛内,向培养皿中加入无血清1640培养液3ml,把细胞筛转至培养皿中,把脾脏研磨碎,再用无血清培养液清洗脾脏组织,收集细胞悬液。将脾脏细胞悬液1000g离心2分钟,去除上清,再在无血清1640培养液中重悬脾脏细胞,反复洗涤脾脏细胞,直至成无团状颗粒。(3)选取良好生长的sp2/0细胞,使用无血清1640培养液洗涤sp2/0细胞3次,最后一次洗涤时将sp2/0细胞和处理后的脾脏细胞混合在一起。将细胞混合液1000g离心2分钟,去除上清;将沉淀物加入1ml37℃peg1500中,吹打细胞使其混合均匀,1分钟后加30ml无血清培养液,终止细胞融合;再将融合后的细胞混合液1000g离心2分钟,去除上清;将沉淀物用制作好的含饲养细胞的20%fbs-hat-1640培养液进行细胞重悬。将融合细胞按200μl/孔接种到96孔培养板中,放置于37摄氏度、5%二氧化碳的培养箱中,每日观察细胞生长状态;2天更换1次培养液,每次去除2/3旧培养液,加入等量新鲜培养液。在培养8天以后,改用ht培养基培养,等细胞集落长满培养孔的1/3-1/2时,进入下一步实验操作。elisa法筛选阳性杂交瘤细胞(1)取杂交瘤细胞培养上清液50μl/孔,加入酶标板中,阴性对照为每板选取2个无细胞生长的孔,阳性对照为再选取2个无细胞生长的孔加入阳性血清。将酶标板在37℃下孵育半小时。(2)每孔加入100ul酶标二抗,37℃下孵育半小时。(3)每孔加入200ml底物,37℃显色半小时。(4)用酶标分光光度仪,在450nm波长处检测吸光度值(od值),对比阴性对照孔的od值,p/n大于2.1作为临界点。有限稀释法克隆培养阳性杂交瘤细胞(1)当细胞融合和选择性培养成功后,取elisa检测为阳性的细胞孔,制成细胞悬液;(2)将上述细胞悬液按1:2、1:4、1:8、1:16、1:32的比例稀释,分别接种到96孔板中,每个细胞浓度重复8孔;(3)观察细胞生长状态,隔两天换液一次;(4)待细胞融合度达70%,取上清采用elisa进行阳性检测;(5)挑取阳性单集落孔重复1-4步骤,直至阳性率达100%;(6)取阳性克隆细胞分别用普通24孔板培养,最终转用25cm2培养瓶培养扩增。间接elisa法检测单克隆抗体的亚型(1)96孔细胞培养板每孔加入50μl10μg/ml的l-左旋多聚赖氨酸,室温下放置30分钟后,用pbs洗涤2次。(2)每孔加入50μlhusslcs细胞悬液(2.5×106细胞/ml)。4℃过夜,次日用pbs洗涤1次。(3)每孔内加入50μl0.5%戊二醛,4℃固定15分钟,用pbs洗涤2次。(4)每孔加内加入0.1mol/l甘氨酸溶液400μl,4℃放置30分钟,pbs洗涤3次。(5)每次加入不完全dmem培养基,置-20℃保存备用。(6)检测时将细胞培养板从-20℃冰箱中取出,待孔内液体融化后,用pbs洗涤2次。(7)每孔内加入100μl待测的杂交瘤细胞上清,室温放置2小时,用pbs洗涤4次,37℃孵育1小时。(8)每孔内加入100μl酶标二抗(羊抗鼠igm、羊抗鼠igg、羊抗鼠igg1、羊抗鼠igg2a、羊抗鼠igg2b和羊抗鼠igg3),室温作用2小时,用pbs洗涤6次,37℃孵育30min。(9)每孔内加入200μl新配制的底物tmb,37℃作用30分钟。(10)用酶标分光光度仪,在450nm波长处检测吸光度值。间接免疫荧光实验鉴定单克隆抗体(1)取husslcs,接种至普通6孔板中;(2)细胞融合度达70%后,pbs漂洗2次,4%多聚甲醛室温固定10min;(3)pbs漂洗3次,每次3min,杂交瘤细胞培养上清37℃孵育1h;(4)pbs漂洗3次,每次3min,羊抗鼠-cy7-荧光二抗(1:500稀释)37℃孵育1h;(5)pbs漂洗3次,每次3min,荧光染料dapi(1:100,pbs稀释)室温避光孵育10min,pbs漂洗3次,每次3min;显微镜下观察。结果:间接elisa法检测husslcs免疫原性取经husslcs免疫过的小鼠的血清用间接elisa法进行抗体效价的检测。阴性对照组为未免疫的小鼠血清,以阴性对照组抗体效价的2.1倍作为临界值来判断结果是否为阳性。免疫血清实验结果(表1、图1)显示:小鼠体内抗体水平,在第一次免疫后效价较低,与阴性对照无明显差异;在进行第二次、第三次及冲击免疫后,抗体效价升高明显,p<0.05,差异有统计学意义。表1间接elisa法检测husslcs免疫小鼠血清(1:1000000)的抗体效价注:*:第一只小鼠血清抗体效价与免疫前对比,差异有统计学意义(p<0.05);#:第二只小鼠血清抗体效价与免疫前对比,差异有统计学意义(p<0.05)sp2/0骨髓瘤细胞半贴壁生长骨髓瘤sp2/0细胞系细胞在10%fbs的完全1640培养基中,呈半贴壁生长(图2),细胞呈圆形、形态完整、排列整齐,在培养3天以后密度可以达到65%。细胞融合及阳性杂交瘤细胞筛选用液体培养基培养法筛选培养8天后,融合的杂交瘤细胞成簇生长形成小的细胞集落,细胞混匀透亮,增殖很快(如图3)。利用间接elisa法检测阳性杂交瘤细胞,发现有6个阳性孔,培养孔编号分别命名为4-2、9-15、10-2、10-4、10-11和10-12。有限稀释法克隆培养阳性杂交瘤细胞通过有限稀释法对阳性孔进行4次克隆化后,间接elisa法发现1株杂交瘤细胞株可以稳定分泌抗husslcs单克隆抗体,命名为1-2f。常规液氮冻存。间接elisa法测定单克隆抗体亚型间接elisa法结果显示:细胞株1-2f所分泌抗体的亚型为igg2a(图4)。间接免疫荧光实验鉴定单克隆抗体间接细胞免疫荧光检测结果表明,1-2f单克隆细胞上清孵育husslcs呈现不同程度的红色荧光。且1-2f单克隆细胞上清孵育的红色荧光阳性细胞数最多(图5)。实施例2球形成实验检测单克隆抗体对husslcs成球的影响(1)分别取sp2/0细胞上清和不同稀释比例阳性杂交瘤细胞上清(1:1000、1:500、1:100)作用husslcs48小时。(2)成球培养:按照文献[27,28,29]所述方法,制备干细胞培养基,在无血清dmem/f12培养基中添加egf和bfgf20ng/ml、胰岛素5μg/ml、b27添加物以及0.4%bsa。悬浮husslcs细胞,将调节密度至10000个细胞/ml,再将细胞悬液接种至6孔超低粘附板,2.0ml/孔。接种第3天更换1次新鲜培养基。(3)成球率的测定:培养6天后,得到非粘附、克隆生长的肿瘤球,直径≥50.0μm被定义为肿瘤球。对每孔的肿瘤球进行计数。成球率=每孔肿瘤球平均数/接种活细胞总数×100%。球形成率测定结果(表2、图6)表明,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500、1000倍的1-2f单克隆细胞上清处理后husslcs的成球率均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100倍的1-2f单克隆细胞上清处理后husslcs的成球率较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1:100)以浓度依赖方式降低husslcs成球率。表2不同稀释比例的1-2f单克隆细胞上清作用下husslcs成球率的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例3琼脂集落形成实验检测单克隆抗体对husslcs琼脂集落形成的影响(1)分别取sp2/0细胞上清和不同稀释比例阳性杂交瘤细胞上清(1:1000、1:500、1:100)作用husslcs48小时。(2)制备琼脂:使用三蒸水制备浓度为1.2%、0.6%的2种低溶点琼脂糖液体,高压灭菌,在40℃条件下使之保持溶解状态。等比例混合20%fbs的dmem培养基和1.2%的低溶点琼脂糖液体,将混合液转移至24孔板中,0.5ml/孔,待混合液凝固,作为底层琼脂。等比例混合20%fbs的dmem培养基和0.6%的低溶点琼脂糖液体,将混合液转移至24孔板中,每孔加入husslcs细胞1000个,充分混匀,作为上层琼脂。在上层琼脂糖液凝固以后,转移至培养箱中培养14天,每5天需加入20%fbs的dmem培养基500μl。(3)集落形成率的测定:细胞数≥20个被定义为集落,使用荧光倒置显微镜计数集落个数。集落形成率=每孔集落平均数/接种活细胞总数×100%。琼脂集落形成率测定结果(表3、图7)表明,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500、1000倍的1-2f单克隆细胞上清处理后husslcs的琼脂集落形成率均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100倍的1-2f单克隆细胞上清处理后husslcs的琼脂集落形成率较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1:100)以浓度依赖方式降低husslcs成球率。表3不同稀释比例的1-2f单克隆细胞上清作用下husslcs集落形成率的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例4创口愈合实验检测单克隆抗体对husslcs迁移的影响(1)分别取sp2/0细胞上清和不同稀释比例阳性杂交瘤细胞上清(1:1000、1:500、1:100)作用husslcs48小时。(2)将处理后的husslcs细胞接种到6孔细胞培养板,用含10%fbsdmem完全培养基稀释至5×105个细胞/孔,待细胞融合达90%时拍照。(3)用tip头划过6孔板底部中央来制造划痕。然后用pbs冲洗去除碎片及漂浮细胞2遍。(4)制造划痕后继续培养细胞,24小时后在同一伤口位置拍照,对伤口区域的细胞进行计数。sp2/0细胞上清处理的细胞作为对照组,计算相对细胞迁移率。创口愈合试验的结果(表4、图8)显示,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500、1000倍的1-2f单克隆细胞上清处理后husslcs的迁移率均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100倍的1-2f单克隆细胞上清处理后husslcs的迁移率较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1:100)以浓度依赖方式降低husslcs成球率。表4不同稀释比例的1-2f单克隆细胞上清作用下husslcs细胞迁移率的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例5流式细胞术检测单克隆抗体对husslcscd133表达的影响(1)分别取sp2/0细胞上清和不同稀释比例阳性杂交瘤细胞上清(1:1000、1:500、1∶100)作用husslcs48小时。(2)按105细胞/ml接种到william'se培养基(含20%fbs)并在室温下孵育15-30分钟以阻断非特异性位点。用pbs冲洗细胞2遍,再悬浮于990μlpbs。然后,将10μl抗体(包括pe-cd133抗体和同种型对照pe-igg)添加到细胞悬液中。4℃、避光孵育30分钟后,用pbs冲洗细胞2遍,用0.1%甲醛固定并用facscaliburtm系统检测。所有数据用flowjo7.6.1软件分析,图像输出为pdf格式;再使用adobephotoshop进行图像编辑。pe标记cd133抗体流式细胞术分析结果(表5、图9)显示,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500、1000倍的1-2f单克隆细胞上清处理后husslcs的cd133阳性细胞百分率均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100、500倍的1-2f单克隆细胞上清处理后husslcs的cd133阳性细胞百分率均较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1:100)以浓度依赖方式降低husslcscd133阳性细胞百分率。表5不同稀释比例1-2f单克隆细胞上清作用下husslcscd133阳性细胞百分率的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例6蛋白印记实验检测单克隆抗体对husslcscd44蛋白表达的影响(1)分别取sp2/0细胞上清和不同稀释比例阳性杂交瘤细胞上清(1∶1000、1∶500、1∶100)作用husslcs48小时。(2)制备全细胞提取物:配制细胞裂解缓冲液供后续实验使用:150mmnacl、0.2%np-40、50mmtris-hclph7.4、0.2mmedta、0.1mmna3vo4、0.5mm4npp、0.5mmnaf、1mβ-me、10%丙三醇、1μg/ml抑肽酶、0.5μg/ml抑酶醛肽、蛋白酶抑制剂。用pbs冲洗细胞后加入细胞裂解酶缓冲液1ml,4℃孵育半小时。收集细胞裂解液,13200g离心5分钟,取上清液。(3)bradford试验检测细胞裂解液(上清液)中的蛋白质含量。(4)取40μg提取的蛋白质,使用sds-聚丙烯酰胺凝胶电泳分离,再转移至聚偏二氟乙烯膜上。(5)使用5%bsa在常温下封闭膜2小时。(6)分别用鼠抗人β-actin单克隆抗体、兔抗人cd44多克隆抗体作为一抗在4℃下孵育膜过夜。(7)用1xtris洗涤聚偏二氟乙烯膜,并与辣根过氧化物酶二抗常温下孵育2小时。(8)用1xtbs洗涤聚偏二氟乙烯膜,用增强化学发光剂检测蛋白的表达。(9)用图像分析软件分析、计算cd44与β-actin蛋白条带灰度的比值。把以sp2/0培养基上清处理husslcs后的cd44与β-actin蛋白条带灰度比值定义为1.00,标化成相对密度。(10)上述实验重复3遍,3次独立实验的数据以均数±标准差(n=3)表示。蛋白质印迹分析结果(表6、图10)显示,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500倍的1-2f单克隆细胞上清处理后husslcs的cd44蛋白相对密度均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100倍的1-2f单克隆细胞上清处理后husslcs的cd44蛋白相对密度较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1∶100)以浓度依赖方式降低husslcscd44蛋白表达水平。表6不同稀释比例的1-2f单克隆细胞上清作用下husslcscd44蛋白表达的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例7蛋白印记实验检测单克隆抗体对husslcsabcg2蛋白表达的影响将实施例6中的兔抗人cd44多克隆抗体替换成鼠抗人abcg2单克隆抗体,步骤同实施例6。蛋白质印迹分析结果(表7、图11)显示,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500、1000倍的1-2f单克隆细胞上清处理后husslcs的abcg2蛋白相对密度均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100倍的1-2f单克隆细胞上清处理后husslcs的abcg2蛋白相对密度较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1:100)以浓度依赖方式降低husslcsabcg2蛋白表达水平。表7不同稀释比例的1-2f单克隆细胞上清作用下husslcsabcg2蛋白表达的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例8蛋白印记实验检测单克隆抗体对husslcsbmi1蛋白表达的影响将实施例6中的兔抗人cd44多克隆抗体替换成兔抗人bmi1单克隆抗体,步骤同实施例6。蛋白质印迹分析结果(表8、图12)显示,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500倍的1-2f单克隆细胞上清处理后husslcs的bmi1蛋白相对密度均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100倍的1-2f单克隆细胞上清处理后husslcs的bmi1蛋白相对密度较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1:100)以浓度依赖方式降低husslcsbmi1蛋白表达水平。表8不同稀释比例的1-2f单克隆细胞上清作用下husslcsbmi1蛋白表达的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例9蛋白印记实验检测单克隆抗体对husslcsnanog蛋白表达的影响将实施例6中的兔抗人cd44多克隆抗体替换成兔抗人nanog单克隆抗体,步骤同实施例6。蛋白质印迹分析结果(表9、图13)显示,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500倍的1-2f单克隆细胞上清处理后husslcs的nanog蛋白相对密度均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100倍的1-2f单克隆细胞上清处理后husslcs的nanog蛋白相对密度较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1∶100)以浓度依赖方式降低husslcsnanog蛋白表达水平。表9不同稀释比例的1-2f单克隆细胞上清作用下husslcsnanog蛋白表达的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例10蛋白印记实验检测单克隆抗体对husslcsoct4蛋白表达的影响将实施例6中的兔抗人cd44多克隆抗体替换成兔抗人oct4单克隆抗体,步骤同实施例6。蛋白质印迹分析结果(表10、图14)显示,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500倍的1-2f单克隆细胞上清处理后husslcs的oct4蛋白相对密度均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100倍的1-2f单克隆细胞上清处理后husslcs的oct4蛋白相对密度较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1∶1000、1∶500、1∶100)以浓度依赖方式降低husslcsoct4蛋白表达水平。表10不同稀释比例的1-2f单克隆细胞上清作用下husslcsoct4蛋白表达的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。实施例11蛋白印记实验检测单克隆抗体对husslcsaldh1蛋白表达的影响将实施例6中的兔抗人cd44多克隆抗体替换成兔抗人aldh1单克隆抗体,步骤同实施例6。蛋白质印迹分析结果(表11、图15)显示,与sp2/0细胞上清(cont)处理husslcs相比,使用稀释100、500、1000倍的1-2f单克隆细胞上清处理后husslcs的aldh1蛋白相对密度均较低,p<0.05,差异有统计学意义;与稀释1000倍的1-2f单克隆细胞上清相比,使用稀释100、500倍的1-2f单克隆细胞上清处理后husslcs的aldh1蛋白相对密度均较低,p<0.05,差异有统计学意义。不同稀释比例的1-2f单克隆细胞上清(1:1000、1:500、1:100)以浓度依赖方式降低husslcsaldh1蛋白表达水平。表11不同稀释比例的1-2f单克隆细胞上清作用下husslcsaldh1蛋白表达的比较注:*:与sp2/0细胞上清对比,差异有统计学意义(p<0.05);#:与1-2f单克隆细胞上清(1:1000)对比,差异有统计学意义(p<0.05)。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1