有机电致发光材料和装置的制作方法
本申请是2015年11月5日所提交的同在申请中的美国专利申请第14/933,684号的部分继续申请,所述美国专利申请是2015年5月5日所提交的pct申请第pct/us15/29269号的部分继续申请,所述pct申请要求2014年5月8日所提交的美国临时申请第61/990,239号和2014年11月21日所提交的美国临时申请第62/082,970号的优先权,所述申请的全部内容以引入的方式并入本文中。
本发明大体上涉及新颖化合物;包含所述化合物的组合物;和所述化合物和组合物的应用,包括包含所述化合物和/或组合物的有机电致发光装置。
背景技术:
一般来说,oled包含至少一个有机层,其安置于阳极与阴极之间并且与阳极和阴极电连接。当施加电流时,阳极注入空穴并且阴极注入电子到所述有机层中。所注入的空穴和电子各自朝带相反电荷的电极迁移。当电子和空穴局限于同一分子上时,形成“激子”,其为具有激发能态的局部化电子-空穴对。当激子通过光发射机制弛豫时,发射光。在一些情况下,激子可以局限于激元(excimer)或激态复合物上。非辐射机制(例如热弛豫)也可能发生,但通常被视为不合需要的。
最初的oled利用发射分子从其单态发射光(“荧光”),如例如美国专利第4,769,292号中所公开,其以全文引用的方式并入。荧光发射通常在小于10纳秒的时帧内发生。
最近,已经证实了具有从三重态发射光(“磷光”)的发射材料的oled。巴尔多(baldo)等人,“有机电致发光装置高效发射磷光(highlyefficientphosphorescentemissionfromorganicelectroluminescentdevices)”,自然(nature),第395卷,151-154,1998;(“巴尔多-i”)和巴尔多等人,“基于电致磷光的极高效绿色有机发光装置(veryhigh-efficiencygreenorganiclight-emittingdevicesbasedonelectrophosphorescence)”,应用物理学报(appl.phys.lett.),第75卷,第3、4-6期(1999)(“巴尔多-ii”),所述文献以全文引用的方式并入本文中。磷光可以称为“禁戒”跃迁,原因是所述跃迁需要自旋状态发生变化,并且量子力学表明这种跃迁是不利的。因此,磷光通常在超过至少10纳秒并且典型地大于100纳秒的时帧内发生。如果磷光的自然辐射寿命太长,那么三重态可以通过非辐射机制而衰减,以致无光发出。在非常低的温度下,在含有具有非共用电子对的杂原子的分子中往往还观察到有机磷光。2,2'-联吡啶就是这类分子。非辐射衰减机制典型地具有温度依赖性,因此在液氮温度下展现磷光的有机材料在室温下典型地不展现磷光。但是,如巴尔多所证实,这个问题可以通过选择在室温下发磷光的磷光化合物而得到解决。代表性发射层包括掺杂或未掺杂的磷光有机金属材料,例如美国专利第6,303,238号、第6,310,360号、第6,830,828号和第6,835,469号、美国专利申请公开第2002-0182441号和wo02/074015中所公开。
磷光之前可以是三重激发态跃迁为中间的非三重态,由此发生发射衰减。举例来说,与镧系元素配位的有机分子往往从局域化于镧系金属上的激发态发射磷光。然而,这类材料不是直接从三重激发态发射磷光,而是从集中于镧系金属离子上的原子激发态发射。铕二酮络合物说明了一组这些类型的物质。
可以通过约束、优选通过键结有机分子紧密接近于具有高原子序数的原子来增强从三重态发射磷光而非荧光。称为重原子效应的这种现象是通过称为自旋轨道耦合的机制而产生。可以从有机金属分子(例如三(2-苯基吡啶)铱(iii))的金属到配体电荷转移(mlct)激发态观察到这种磷光跃迁。
出于多种原因,利用有机材料的光电装置变得越来越受欢迎。用于制造所述装置的许多材料相对较为便宜,因此有机光电装置具有优于无机装置的成本优势的潜力。另外,有机材料的固有性质(例如其柔性)可以使其较适用于特定应用,如在柔性衬底上的制造。有机光电装置的实例包括有机发光装置(oled)、有机光电晶体管、有机光伏电池和有机光电检测器。对于oled,有机材料可以具有优于常规材料的性能优势。举例来说,有机发射层发射光的波长通常可以容易地用适当的掺杂剂来调节。
oled利用有机薄膜,其在电压施加于装置上时会发射光。oled正成为用于如平板显示器、照明和背光的应用中的日益受关注的技术。美国专利第5,844,363号、第6,303,238号和第5,707,745号中描述若干oled材料和配置,所述专利以全文引用的方式并入本文中。
磷光发射分子的一个应用是全色显示器。针对此类显示器的行业标准需要适合于发射特定颜色(称为“饱和”色)的像素。具体来说,这些标准需要饱和红色、绿色和蓝色像素。或者,oled可经设计以发射白光。在常规液晶显示器中,使用吸收滤光器过滤来自白色背光的发射以产生红色、绿色和蓝色发射。相同技术也可以用于oled。白色oled可以是单eml装置或堆叠结构。可以使用所属领域中所熟知的cie坐标来测量色彩。
绿色发射分子的一个实例是三(2-苯基吡啶)铱,表示为ir(ppy)3,其具有以下结构:
在这个图和下文的图中,我们以直线形式描绘氮与金属(此处是ir)的配价键。
如本文所用,术语“有机”包括可以用于制造有机光电装置的聚合材料和小分子有机材料。“小分子”是指并非聚合物的任何有机材料,并且“小分子”可能实际上相当大。在一些情况下,小分子可以包括重复单元。举例来说,使用长链烷基作为取代基并不会将某一分子从“小分子”类别中去除。小分子还可以并入聚合物中,例如作为聚合物主链上的侧接基团或作为主链的一部分。小分子还可以充当树枝状聚合物的核心部分,所述树枝状聚合物由一系列构建在核心部分上的化学壳层组成。树枝状聚合物的核心部分可以是荧光或磷光小分子发射体。树枝状聚合物可以是“小分子”,并且认为当前在oled领域中使用的所有树枝状聚合物都是小分子。
如本文所用,“顶部”意指离衬底最远,而“底部”意指最靠近衬底。在第一层被描述为“安置于”第二层“上方”的情况下,第一层被安置于离基板较远处。除非规定第一层“与”第二层“接触”,否则第一与第二层之间可以存在其它层。举例来说,即使阴极和阳极之间存在各种有机层,仍可以将阴极描述为“安置于”阳极“上方”。
如本文所用,“溶液可处理”意指能够以溶液或悬浮液的形式在液体介质中溶解、分散或传输和/或从液体介质沉积。
当认为配体直接促成发射材料的光敏性质时,所述配体可以被称为“光敏性的”。当认为配体并不促成发射材料的光敏性质时,所述配体可以被称为“辅助性的”,但辅助性配体可以改变光敏性配体的性质。
如本文所用,并且如所属领域的技术人员通常将理解,如果第一能级较接近真空能级,那么第一“最高占用分子轨道”(highestoccupiedmolecularorbital,homo)或“最低未占用分子轨道”(lowestunoccupiedmolecularorbital,lumo)能级“大于”或“高于”第二homo或lumo能级。由于将电离电位(ip)测量为相对于真空能级的负能量,因此较高homo能级对应于具有较小绝对值的ip(较不负(lessnegative)的ip)。类似地,较高lumo能级对应于具有较小绝对值的电子亲和性(ea)(较不负的ea)。在顶部是真空能级的常规能级图上,材料的lumo能级高于相同材料的homo能级。“较高”homo或lumo能级表现为比“较低”homo或lumo能级更靠近这个图的顶部。
如本文所用,并且如所属领域的技术人员通常将理解,如果第一功函数具有较高绝对值,那么第一功函数“大于”或“高于”第二功函数。因为通常将功函数测量为相对于真空能级的负数,所以这意指“较高”功函数是更负的(morenegative)。在顶部是真空能级的常规能级图上,“较高”功函数经说明为在向下方向上离真空能级较远。因此,homo和lumo能级的定义遵循与功函数不同的定则。
关于oled和上文所述的定义的更多细节可以见于美国专利第7,279,704号中,所述专利以全文引用的方式并入本文中。
技术实现要素:
根据本公开的一个方面,公开了一种具有根据式1的结构(la)nmlm的化合物
其中a是选自由下文所示的a1到a222组成的群组的连接基团;
其中r1b到r1g连接的任一环原子可以被氮原子置换,其中当所述环原子被氮原子置换时,相应r基团不存在;并且
其中l是被取代或未被取代的环金属化配体;
其中r1a选自由以下组成的群组:
其中r1b选自由以下组成的群组:
其中r1c选自由以下组成的群组:
其中r1d选自由以下组成的群组:
其中r1e选自由以下组成的群组:
其中r1f选自由以下组成的群组:
其中r1g=h;
其中结构a1到a222是:
根据本发明的另一方面,公开了一种有机发光装置。所述oled包含阳极;阴极;和安置在所述阳极与所述阴极之间的有机层,其中所述有机层包含具有根据式1的结构的化合物。
根据本发明的另一方面,还公开了一种调配物,其包含具有根据式1的结构的化合物。
附图说明
当结合例示性实施例的附图阅读时,将更好地理解前述发明内容以及根据本发明的化合物、组合物和装置的例示性实施例的以下详细描述。然而,应理解,本发明不限于所示的精确布置和器具。
在附图中:
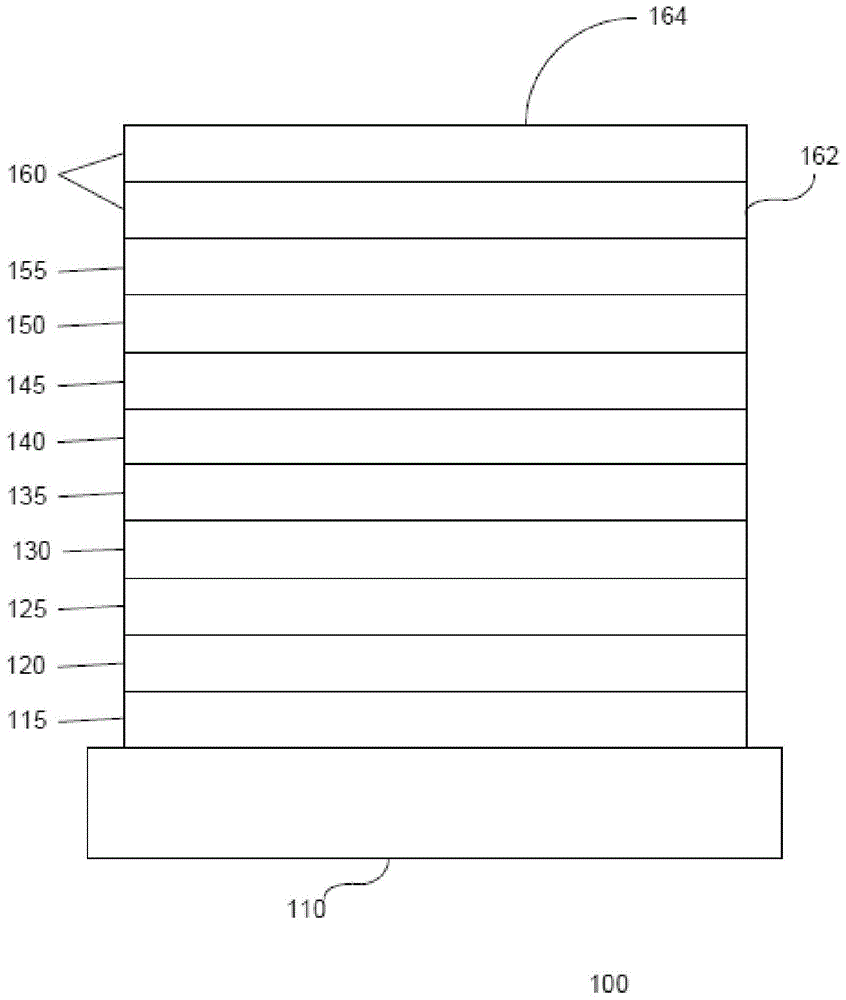
图1展示了例示性有机发光装置100;并且
图2说明根据本公开的例示性有机发光装置200。
图3a和3b说明了比较实例1的最小化断键几何构型(顶部)和最小化非断键几何构型(底部)的计算模型。
图4说明了比较化合物4的maldi负模式质谱。最高强度峰对应于咪唑环的断裂。
图5说明了3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的x射线晶体结构。
图6说明了3,3-二甲基-3,4-二氢-1,2a1-二氮杂-3-硅杂苯并[fg]乙烯合蒽的x射线晶体结构。
图7描绘了化合物49在77k和室温2-甲基thf溶剂和固态pmma基质中的发射光谱。
具体实施方式
一般来说,oled包含至少一个有机层,其安置于阳极与阴极之间并且与阳极和阴极电连接。当施加电流时,阳极注入空穴并且阴极注入电子到有机层中。所注入的空穴和电子各自朝带相反电荷的电极迁移。当电子和空穴定位在同一分子上时,形成“激子”,其为具有激发能态的定域电子-空穴对。当激子通过光发射机制弛豫时,发射光。在一些情况下,激子可以定位于准分子(excimer)或激态复合物上。非辐射机制(如热弛豫)也可能发生,但通常被视为不合需要的。
最初的oled使用从单态发射光(“荧光”)的发射分子,如例如美国专利第4,769,292号中所公开,其以全文引用的方式并入。荧光发射通常在小于10纳秒的时帧内发生。
最近,已经展示了具有从三重态发射光(“磷光”)的发射材料的oled。巴尔多(baldo)等人,“来自有机电致发光装置的高效磷光发射(highlyefficientphosphorescentemissionfromorganicelectroluminescentdevices)”,自然(nature),第395卷,151-154,1998;(“巴尔多-i”);和巴尔多等人,“基于电致磷光的极高效绿色有机发光装置(veryhigh-efficiencygreenorganiclight-emittingdevicesbasedonelectrophosphorescence)”,应用物理快报(appl.phys.lett.),第75卷,第3,4-6期(1999)(“巴尔多-ii”),所述文献以全文引用的方式并入。美国专利第7,279,704号第5-6栏中更详细地描述磷光,所述专利以引用的方式并入。
咪唑并啡啶是当连接到铂和铱金属两者时可以提供460nm发射的适用配体。磷光咪唑并啡啶络合物可以按范围介于接近零到单一的可调光致发光量子产率提供深蓝光发射。不幸的是,对于基于铱和铂两者的蓝光发射络合物来说,装置寿命受到限制。我们在本文中提供了通过定址配体上的键来改进咪唑并啡啶配体稳定性的策略,根据计算理论、质谱片段分析和光氧化研究,所述键显示为弱键,这归因于多环环应力和电子结构。
图1展示有机发光装置100。图不一定按比例绘制。装置100可以包括衬底110、阳极115、空穴注入层120、空穴传输层125、电子阻挡层130、发射层135、空穴阻挡层140、电子传输层145、电子注入层150、保护层155、阴极160和阻挡层170。阴极160是具有第一导电层162和第二导电层164的复合阴极。装置100可以通过按顺序沉积所述层来制造。这些各种层和实例材料的性质和功能在us7,279,704第6-10栏中更详细地描述,所述专利以引用的方式并入。
可以得到这些层中的每一个的更多实例。举例来说,柔性并且透明的衬底-阳极组合公开于美国专利第5,844,363号中,所述专利以全文引用的方式并入。经p掺杂的空穴传输层的实例是以50:1的摩尔比掺杂有f4-tcnq的m-mtdata,如美国专利申请公开第2003/0230980号中所公开,所述专利以全文引用的方式并入。发光和主体材料的实例公开于汤普森(thompson)等人的美国专利第6,303,238号中,所述专利以全文引用的方式并入。经n掺杂的电子传输层的实例是以1:1的摩尔比掺杂有li的bphen,如美国专利申请公开第2003/0230980号中所公开,所述公开案以全文引用的方式并入。以全文引用的方式并入的美国专利第5,703,436号和第5,707,745号公开了阴极的实例,所述阴极包括具有含上覆的透明、导电、溅镀沉积的ito层的金属(如mg:ag)薄层的复合阴极。阻挡层的理论和使用更详细地描述于美国专利第6,097,147号和美国专利申请公开第2003/0230980号中,所述专利以全文引用的方式并入。注入层的实例提供于美国专利申请公开第2004/0174116号中,其以全文引用的方式并入。保护层的描述可以见于美国专利申请公开第2004/0174116号中,其以全文引用的方式并入。
图2展示倒置式oled200。所述装置包括衬底210、阴极215、发射层220、空穴传输层225和阳极230。装置200可以通过按顺序沉积所述层来制造。因为最常见oled配置具有安置于阳极上方的阴极,并且装置200具有安置于阳极230下的阴极215,所以装置200可以被称为“倒置式”oled。可以在装置200的对应层中使用与关于装置100所述的那些材料类似的材料。图2提供如何可以从装置100的结构省去一些层的一个实例。
图1和2中所说明的简单分层结构借助于非限制性实例提供,并且应理解本发明的实施例可以与各种其它结构结合使用。所描述的具体材料和结构本质上是示范性的,并且可以使用其它材料和结构。可以通过以不同方式组合所述的各种层来获得功能性oled,或可以基于设计、性能和成本因素完全省略各层。也可以包括未具体描述的其它层。可以使用除具体描述的材料以外的材料。尽管本文中所提供的许多实例将各种层描述为包括单一材料,但应理解,可以使用材料的组合,如主体和掺杂剂的混合物,或更一般来说,混合物。此外,所述层可以具有各种子层。本文中给予各种层的名称并不意图具有严格限制性。举例来说,在装置200中,空穴传输层225传输空穴并且将空穴注入到发射层220中,并且可以被描述为空穴传输层或空穴注入层。在一个实施例中,可以将oled描述为具有安置于阴极与阳极之间的“有机层”。这一有机层可以包含单个层,或可以进一步包含如例如关于图1和2所述的不同有机材料的多个层。
还可以使用未具体描述的结构和材料,例如包含聚合材料的oled(pled),例如弗兰德(friend)等人的美国专利第5,247,190号中所公开,所述专利以全文引用的方式并入。借助于另一实例,可以使用具有单个有机层的oled。oled可以堆叠,例如如在以全文引用的方式并入的福利斯特(forrest)等人的美国专利第5,707,745号中所述。oled结构可以偏离图1和2中所说明的简单分层结构。举例来说,衬底可以包括有角度的反射表面以改进出耦(out-coupling),例如如在福利斯特等人的美国专利第6,091,195号中所述的台式结构,和/或如在布尔维克(bulovic)等人的美国专利第5,834,893号中所述的凹点结构,所述专利以全文引用的方式并入。
除非另外规定,否则可以通过任何合适的方法来沉积各个实施例的层中的任一个。对于有机层,优选方法包括热蒸发、喷墨(如以全文引用的方式并入的美国专利第6,013,982号和第6,087,196号中所述)、有机气相沉积(ovpd)(如以全文引用的方式并入的福利斯特等人的美国专利第6,337,102号中所述)和通过有机蒸气喷射印刷(ovjp)的沉积(如以全文引用的方式并入的美国专利第7,431,968号中所述)。其它合适的沉积方法包括旋涂和其它基于溶液的工艺。基于溶液的工艺优选在氮气或惰性气氛中进行。对于其它层,优选的方法包括热蒸发。优选的图案化方法包括通过掩模的沉积、冷焊(如以全文引用的方式并入的美国专利第6,294,398号和第6,468,819号中所述)和与例如喷墨和ovjp的沉积方法中的一些方法相关联的图案化。还可以使用其它方法。可以将待沉积的材料改性以使其与具体沉积方法相适合。举例来说,可以在小分子中使用支链或非支链并且优选含有至少3个碳的例如烷基和芳基的取代基来增强其经受溶液处理的能力。可以使用具有20个或更多个碳的取代基,并且3到20个碳是优选范围。具有不对称结构的材料可以比具有对称结构的材料具有更好的溶液可处理性,因为不对称材料可能具有更低的再结晶倾向性。可以使用树枝状聚合物取代基来增强小分子经受溶液处理的能力。
根据本发明实施例制造的装置可以进一步任选地包含阻挡层。阻挡层的一个用途是保护电极和有机层免受暴露于包括水分、蒸气和/或气体等的环境中的有害物质的损害。阻挡层可以沉积在衬底、电极上,沉积在衬底、电极下或沉积在衬底、电极旁,或沉积在装置的任何其它部分(包括边缘)上。阻挡层可以包含单个层或多个层。阻挡层可以通过各种已知的化学气相沉积技术形成,并且可以包括具有单一相的组合物和具有多个相的组合物。任何合适的材料或材料组合都可以用于阻挡层。阻挡层可以并有有无机化合物或有机化合物或两者。优选的阻挡层包含聚合材料与非聚合材料的混合物,如以全文引用的方式并入本文中的美国专利第7,968,146号、pct专利申请第pct/us2007/023098号和第pct/us2009/042829号中所述。为了被视为“混合物”,构成阻挡层的前述聚合材料和非聚合材料应在相同反应条件下沉积和/或同时沉积。聚合材料与非聚合材料的重量比可以在95:5到5:95范围内。聚合材料和非聚合材料可以由同一前体材料产生。在一个实例中,聚合材料与非聚合材料的混合物基本上由聚合硅和无机硅组成。
根据本发明的实施例而制造的装置可以并入到多种多样的电子组件模块(或单元)中,所述电子组件模块可以并入到多种电子产品或中间组件中。所述电子产品或中间组件的实例包括可以为终端用户产品制造商所利用的显示屏、照明装置(如离散光源装置或照明面板)等。所述电子组件模块可以任选地包括驱动电子装置和/或电源。根据本发明的实施例而制造的装置可以并入到多种多样的消费型产品中,所述消费型产品具有一或多个电子组件模块(或单元)并入于其中。所述消费型产品应包括含一或多个光源和/或某种类型的视觉显示器中的一或多个的任何种类的产品。所述消费型产品的一些实例包括平板显示器、曲面显示器、计算机监视器、医疗监视器、电视机、告示牌、用于内部或外部照明和/或发信号的灯、平视显示器、全透明或部分透明的显示器、柔性显示器、可卷曲显示器、可折叠显示器、可拉伸显示器、激光打印机、电话、蜂窝电话、平板电脑、平板手机、个人数字助理(pda)、可佩戴装置、膝上型计算机、数码相机、摄像机、取景器、微型显示器(对角线小于2英寸的显示器)、3-d显示器、虚拟现实或增强现实显示器、交通工具、包含多个平铺在一起的显示器的视频墙、剧院或体育馆屏幕,或指示牌。可以使用各种控制机制来控制根据本发明而制造的装置,包括无源矩阵和有源矩阵。意图将所述装置中的许多装置用于对人类来说舒适的温度范围中,例如18摄氏度到30摄氏度,并且更优选在室温下(20-25摄氏度),但可以在这一温度范围外(例如-40摄氏度到+80摄氏度)使用。
本文所述的材料和结构可以应用于除oled以外的装置中。举例来说,如有机太阳能电池和有机光电检测器的其它光电装置可以采用所述材料和结构。更一般来说,如有机晶体管的有机装置可以采用所述材料和结构。
如本文所用,术语“卤”、“卤素”或“卤基”包括氟、氯、溴和碘。
如本文所用,术语“烷基”意指直链或分支链饱和非环烃基,其可以任选地被任何适合取代基取代。因此,根据本发明的烷基可以包含伯、仲、叔和季碳原子的任何组合。例示性烷基包括(但不限于)c1-c20烷基、c1-c18烷基、c1-c16烷基、c1-c14烷基、c1-c12烷基、c1-c10烷基、c1-c8烷基、c1-c6烷基、c1-c4烷基、c1-c3烷基和c2烷基。特定实例包括甲基、乙基、1-丙基、2-丙基、2-甲基-1-丙基、1-丁基、2-丁基、叔丁基、正辛基、正癸基和正十六烷基。
如本文所用,术语“杂烷基”是指其中一或多个碳原子被杂原子置换的如本文所述的烷基。适合杂原子包括氧、硫、氮、磷等。杂烷基实例包括(但不限于)烷氧基、氨基、硫酯、聚(乙二醇)和被烷基取代的氨基。
如本文所用,术语“环烷基”涵盖环状烷基。优选的环烷基是含有3到7个碳原子的环烷基,并且包括环丙基、环戊基、环己基等。另外,环烷基可以任选地被取代。
如本文所用,术语“烯基”意指具有一或多个碳-碳双键的非环状分支链或非支链烃基。例示性烯基包括(但不限于)c1-c20烯基、c2-c18烯基、c2-c16烯基、c2-c14烯基、c2-c12烯基、c2-c10烯基、c2-c8烯基、c2-c6烯基、c2-c4烯基、c2-c3烯基,和c2烯基。特定实例包括(但不限于)乙烯基、丙烯基、1-丁烯基、2-丁烯基、异丁烯基、1-戊烯基、2-戊烯基、3-甲基-1-丁烯基、2-甲基-2-丁烯基和2,3-二甲基-2-丁烯基。
如本文所用,术语“亚烷基”意指任选地被取代的饱和直链或分支链烃基。例示性亚烷基包括(但不限于)c1-c20亚烷基、c2-c18亚烷基、c2-c16亚烷基、c2-c14亚烷基、c2-c12亚烷基、c2-c10亚烷基、c2-c8亚烷基、c2-c6亚烷基、c2-c4亚烷基、c2-c3亚烷基,和c2亚烷基。亚烷基的特定实例包括(但不限于)亚甲基、二亚甲基和三亚甲基。
如本文所用,术语“炔基”意指具有至少一个碳-碳三键的非环状支链或非支链烃。例示性炔基包括(但不限于)c1-c20炔基、c2-c18炔基、c2-c16炔基、c2-c14炔基、c2-c12炔基、c2-c10炔基、c2-c8炔基、c2-c6炔基、c2-c4炔基、c2-c3炔基,和c2炔基。炔基的特定实例包括(但不限于)炔丙基和3-戊炔基、乙炔基、丙炔基、1-丁炔基、2-丁炔基、1-戊炔基、2-戊炔基和3-甲基-1-丁炔基。
如本文所用,术语“芳烷基”意指如本文所定义的一或多个芳基通过烷基桥连接(例如-烷基-(芳基)j,其中j是1、2或3)。芳烷基的特定实例包括(但不限于)苯甲基(-ch2-苯基,即,bn)、二苯基甲基(-ch2-(苯基)2)和三苯甲基(-c-(苯基)3)。另外,芳烷基可以任选地被取代。
除非另外说明,否则如本文所用,术语“杂环”和所述术语的变化形式(包括“杂环基(heterocyclicgroup)”和“杂环基”)意指具有至少两种不同元素作为环成员原子的任选地被取代的单环或多环系统,并且其中所述单环或多环系统是饱和、不饱和或芳香族的。在一些实施例中,杂环包含碳原子和至少一个杂原子。在一些实施例中,杂环包含碳原子和至少一个选自氮、氧、硅、硒和硫的杂原子,并且其中氮、氧、硅、硒和硫杂原子可以任选地氧化,并且氮杂原子可以任选地季铵化。杂环的实例包括(但不限于)呋喃基、苯并呋喃基、噻吩基、苯并噻吩基、吡咯基、吲哚基、异吲哚基、氮杂吲哚基、吡啶基、喹啉基、异喹啉基、噁唑基、异噁唑基、苯并噁唑基、吡唑基、咪唑基、苯并咪唑基、噻唑基、苯并噻唑基、异噻唑基、哒嗪基、嘧啶基、吡嗪基、三嗪基、噌啉基、酞嗪基和喹唑啉基。因此,除了上文所列的芳香族杂芳基之外,杂环还包括(但不限于)吗啉基、吡咯烷酮基、吡咯烷基、哌嗪基、哌啶基、乙内酰脲基、戊内酰胺基、环氧乙烷基、氧杂环丁烷基、四氢呋喃基、四氢吡喃基、四氢吡啶基、四氢嘧啶基、四氢噻吩基、四氢硫吡喃基、四氢嘧啶基、四氢噻吩基和四氢硫吡喃基。
如本文所用,术语“芳基”意指任选地被取代的单环或多环芳香族烃。芳基的特定实例包括(但不限于)苯基、苯基、4-甲基苯基、2,6-二甲基苯基、萘基、蒽基和菲基。如本文所使用,术语“芳基”或“芳香族基团”涵盖单环基团和多环系统。多环可以具有其中两个碳为两个邻接环(所述环是“稠合的”)共用的两个或更多个环,其中所述环中的至少一个是芳香族的,例如其它环可以是环烷基、环烯基、芳基、杂环和/或杂芳基。另外,芳基可以是任选地被取代的。
如本文所用,术语“杂芳基”意指具有至少一个杂原子和至少一个碳原子的任选地被取代的单环或多环芳香族烃。在一些实施例中,至少一个杂原子选自氮、氧、硅、硒和硫。杂芳基的特定实例包括(但不限于)呋喃基、苯并呋喃基、噻吩基、苯并噻吩基、吡咯基、吲哚基、异吲哚基、氮杂吲哚基、吡啶基、喹啉基、异喹啉基、噁唑基、异噁唑基、苯并噁唑基、吡唑基、咪唑基、苯并咪唑基、噻唑基、苯并噻唑基、异噻唑基、哒嗪基、嘧啶基、吡嗪基、三嗪基、噌啉基、酞嗪基和喹唑啉基。
烷基、环烷基、烯基、炔基、芳烷基、杂环基、芳基以及杂芳基可以任选地被一或多个选自由以下组成的群组的取代基取代:氢、氘、卤素、烷基、环烷基、杂烷基、芳基烷基、烷氧基、芳氧基、氨基、环氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸、醚、酯、腈、异腈、硫基、亚磺酰基、磺酰基、膦基以及其组合。
如本文所使用,术语“被取代的”是指除h以外的取代基键结到相关位置,如碳。举例来说,如果r1表示单取代,则一个r1必须不是h。类似地,如果r1是二取代,则两个r1必须不是h。类似地,如果r1未被取代,则r1对于所有可用位置来说都是氢。
本文所述的片段,即氮杂-二苯并呋喃、氮杂-二苯并噻吩等中的“氮杂”名称意指相应片段中的c-h基团中的一或多个可以被氮原子置换,例如并且无任何限制性,氮杂三亚苯涵盖二苯并[f,h]喹喔啉和二苯并[f,h]喹啉。所属领域的一般技术人员可以容易地预想上文所述的氮杂-衍生物的其它氮类似物,并且所有此类类似物都意图由如本文所阐述的术语涵盖。
应理解,当将分子片段描述为取代基或另外连接到另一部分时,其名称可以如同其是片段(例如苯基、亚苯基、萘基、二苯并呋喃基)一般或如同其是整个分子(例如苯、萘、二苯并呋喃)一般书写。如本文所用,这些不同的命名取代基或连接片段的方式被视为等效的。
如本文所用,并且如所属领域的技术人员通常所理解,如果第一能级更接近真空能级,那么第一“最高占用分子轨道”(highestoccupiedmolecularorbital,homo)或“最低未占用分子轨道”(lowestunoccupiedmolecularorbital,lumo)能级“大于”或“高于”第二homo或lumo能级。由于电离电位(ip)是按照相对于真空能级的负能量测量,因此更高homo能级对应于具有更小绝对值的ip(负性更小的ip)。类似地,更高lumo能级对应于具有更小绝对值的电子亲和性(ea)(负性更小的ea)。在顶部是真空能级的常规能级图上,材料的lumo能级高于相同材料的homo能级。“更高”homo或lumo能级似乎比“更低”homo或lumo能级更接近这个图的顶部。
如本文所用,术语“三重态能量”是指对应于既定材料的磷光光谱中可辩别的最高能量特征的能量。最高能量特征未必是在磷光光谱中具有最大强度的峰,并且可以是例如这个峰的高能量侧上的明显肩部的局部最大值。
根据本公开的一个方面,公开了一种具有根据式1的结构(la)nmlm的化合物
其中a是选自由下文所示的a1到a222组成的群组的连接基团;
其中r1b到r1g连接的任一环原子可以被氮原子置换,其中当所述环原子被氮原子置换时,相应r基团不存在;并且
其中l是被取代或未被取代的环金属化配体;
其中r1a选自由以下组成的群组:
其中r1b选自由以下组成的群组:
其中r1c选自由以下组成的群组:
其中r1d选自由以下组成的群组:
其中r1e选自由以下组成的群组:
其中r1f选自由以下组成的群组:
其中r1g=h;
其中结构a1到a222是:
在化合物的一些实施例中,配体la是lai所定义之配体之一,lai是利用式az-r1aj-r1bk-r1cl-r1dm-r1en-r1fo-r1g所指定,其中z是1到222的整数,从而az表示a1到a222;其中j是1到6的整数;并且k、l、m、n和o是1到5的整数;其中i=222((6((5((5((5((5(o-1)+n)-1)+m)-1)+l)-1)+k)-1)+j)-1)+z。
在所述化合物的一些实施例中,所述化合物具有三重态激发态,并且其中当所述化合物处于三重激发态时,连接基团a使n2与c1b之间的键稳定以免裂解。
在一个实施例中,所述化合物具有三重激发态,并且其中当所述化合物处于三重激发态时,连接基团a使n2与c1b之间的键稳定以免裂解。
在一个实施例中,化合物的峰值发射波长小于500nm。在另一实施例中,所述化合物的峰值发射波长小于480nm。在又另一个实施例中,所述化合物的峰值发射波长在400nm到500nm范围内。
在一些实施例中,所述化合物选自由以下组成的群组:
在具有式1的组合物的一些实施例中,金属选自由以下组成的群组:re、ru、os、rh、ir、pd、pt和au。在一些实施例中,金属选自由ir和pt组成的群组。
在式1化合物的一些实施例中,配体l选自由以下组成的群组:
其中各x1到x13独立地选自由碳和氮组成的群组;
其中x选自由以下组成的群组:br'、nr'、pr'、o、s、se、c=o、s=o、so2、cr'r"、sir'r"和ger'r";
其中r'和r"任选地稠合或连接而形成环;
其中各ra、rb、rc和rd可以表示单取代到可能最大数目个取代,或无取代;
其中r'、r"、ra、rb、rc和rd各自独立地选自由以下组成的群组:氢、氘、卤素、烷基、环烷基、杂烷基、芳烷基、烷氧基、芳氧基、氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸、酯、腈、异腈、硫基、亚磺酰基、磺酰基、膦基,以及其组合;并且
其中ra、rb、rc和rd的任两个相邻取代基任选地稠合或连接而形成环或形成多齿配体。
在式1化合物的一些实施例中,配体l选自由以下组成的群组:
在式1化合物的一些实施例中,配体l选自由以下组成的群组:
在式1化合物的一些实施例中,配体l选自由以下组成的群组:
在式1化合物的一些实施例中,配体l选自由以下组成的群组:
在式1化合物的一些实施例中,化合物是(la)3ir,其中la如上文所定义。
在式1化合物的一些实施例中,化合物是(la)ir(l)2或(la)2ir(l),其中la和l如上文所定义。
根据权利要求2所述的化合物,其中所述化合物是具有式(lai)3ir的化合物a-x、具有式(lai)ir(lq)2的化合物b-y,或具有式(lai)2ir(lq)的化合物c-z;
其中i如权利要求2所定义,q是1到254的整数;
其中x=i,y=254(i-1)+q,z=254(i-1)+q,
其中l1至l254具有以下结构:
在所述化合物的一些实施例中,所述化合物具有式2的结构:
其中m是pt;
其中a1和a2是连接基团,其各自独立地选自由a1到a222组成的群组;
其中r2b、r2c、r2d、r2e和r2f独立地选自分别对应于r1b、r1c、r1d、r1e和r1f的相同群组;
其中r1b到r1f和r2b到r2f连接的任一环原子可以被氮原子置换,其中当环原子被氮原子置换时,相应r基团不存在;并且
其中rab与rac和/或rga与rgb可以键结而形成具有一到三个连接原子的第二连接基团,所述连接原子各自独立地选自由以下组成的群组:b、n、p、o、s、se、c、si、ge或其组合。
在式2化合物的一些实施例中,所述化合物具有三重激发态,并且其中当所述化合物处于三重激发态时,连接基团a使n2与c1b之间的键稳定以免裂解。
在式2化合物的一些实施例中,所述化合物的峰值发射波长小于500nm。在一些实施例中,所述化合物的峰值发射波长小于480nm。在一些实施例中,所述化合物的峰值发射波长在400nm到500nm范围内。
根据本公开的另一方面,公开了一种有机发光装置(oled)。所述oled包含:阳极;阴极;和有机层,所述有机层安置于阳极与阴极与之间且包含具有根据式1的结构(la)nmlm的化合物:
其中m是原子量大于40的金属,n具有至少1的值且m+n是可以连接到所述金属的配体的最大数目;
其中a是选自由下文所示的a1到a222组成的群组的连接基团;
其中r1b到r1g连接的任一环原子可以被氮原子置换,其中当所述环原子被氮原子置换时,相应r基团不存在;并且
其中l是被取代或未被取代的环金属化配体;
其中r1a选自由以下组成的群组:
其中r1b选自由以下组成的群组:
其中r1c选自由以下组成的群组:
其中r1d选自由以下组成的群组:
其中r1e选自由以下组成的群组:
其中r1f选自由以下组成的群组:
其中r1g=h;
其中结构a1到a222是:
根据另一方面,公开了一种包含oled的消费型产品,其中所述oled包含:阳极;阴极;和安置于阳极与阴极之间的有机层。所述有机层包含具有根据式1的结构(la)nmlm的化合物:
本文所定义的
在oled的一些实施例中,有机层是发射层并且所述化合物是发射掺杂剂或非发射掺杂剂。
在oled的一些实施例中,所述有机层进一步包含主体,其中所述主体包含含有苯并稠合噻吩或苯并稠合呋喃的三亚苯;
其中所述主体中的任何取代基为独立地选自由以下组成的群组的非稠合取代基:cnh2n+1、ocnh2n+1、oar1、n(cnh2n+1)2、n(ar1)(ar2)、ch=ch-cnh2n+1、c≡ccnh2n+1、ar1、ar1-ar2和cnh2n-ar1,或无取代的主体;
其中n是1到10;并且
其中ar1及ar2独立地选自由以下组成的群组:苯、联苯、萘、三亚苯、咔唑和其杂芳族类似物。
在oled的一些实施例中,有机层进一步包含主体,其中主体包含至少一种选自由以下组成的群组的化学基团:三亚苯、咔唑、二苯并噻吩、二苯并呋喃、二苯并硒吩、氮杂三亚苯、氮杂咔唑、氮杂-二苯并噻吩、氮杂-二苯并呋喃和氮杂-二苯并硒吩。
根据本发明的另一方面,还公开了一种调配物,其包含式1化合物。调配物可以包括一或多种本文所公开的选自由以下组成的群组的组分:溶剂、主体、空穴注入材料、空穴传输材料和电子传输层材料。
根据本发明的各种实施例的有机发光材料可以展现多种所期望的特征。在一些实施例中,所述有机发光材料可以展现量子效率高、光谱宽度窄且峰值发射波长位于所期望的波长范围(例如可见范围或近红外范围)内的光致发光。此外,这些光致发光特征在广泛范围的激发波长内可以是相对不变的。所述有机发光材料可以具有其它所期望的特征,例如关于其带隙能量和电导率。有利的是,所述有机发光材料可以低成本地并且容易地形成而用于各种应用,包括消费型产品和照明面板。
在一些实施例中,按照包含发光材料的发光层的总质量计,根据本发明的发光材料中的光致发光物质的含量在0.1质量%到50质量%之间(包括0.1质量%和50质量%)。在一些实施例中,按照包含发光材料的发光层的总质量计,根据本发明的发光材料中的光致发光物质的含量在0.3质量%到40质量%之间(包括0.3质量%和40质量%)。在一些实施例中,按照包含发光材料的发光层的总质量计,根据本发明的发光材料中的光致发光物质的含量在0.5质量%到30质量%之间(包括0.5质量%和30质量%)。在一些实施例中,根据本发明的发光材料中的光致发光物质附接到聚合物链或并入树枝状聚合物材料中。
iv.装置
在一些方面中,本发明提供了一种有机电致发光装置,其包含至少一种具有式1、式2或式3的结构的金属络合物。在一些实施例中,根据本发明的有机电致发光装置包含第一有机发光装置,所述第一有机发光装置进一步包含阳极;阴极;有机层,其安置在所述阳极与所述阴极之间,并且包含至少一种具有式1、式2或式3的结构的金属络合物。在有机电致发光装置的一些优选实施例中,所述有机层进一步包含主体材料。在有机电致发光装置的一些优选实施例中,所述主体材料包含有机化合物。在有机电致发光装置的一些优选实施例中,所述主体材料包含分子中含有至少一个选自由以下组成的群组的基团的有机化合物:咔唑、二苯并噻吩、二苯并呋喃、氮杂咔唑、氮杂-二苯并噻吩和氮杂-二苯并呋喃。
一般来说,适用于本发明的有机电致发光装置的有机层可以具有任何适合的层配置,这取决于例如有机电致发光装置的应用和目的。因此,在有机电致发光装置的一些实施例中,所述有机层在透明电极或半透明电极上形成。在一些此类实施例中,所述有机层是在透明电极或半透明电极的顶表面或任何适合表面上形成。此外,所述有机层的适合形状、尺寸和/或厚度可以根据例如有机电致发光装置的应用和目的来采用。具有衬底、阴极、阳极和有机层的本发明有机电致发光装置的配置的特定实例包括(但不限于)以下:
(a)阳极/空穴传输层/发光层/电子传输层/阴极;
(b)阳极/空穴传输层/发光层/阻挡层/电子传输层/阴极;
(c)阳极/空穴传输层/发光层/阻挡层/电子传输层/电子注入层/阴极;
(d)阳极/空穴注入层/空穴传输层/发光层/阻挡层/电子传输层/阴极;和
(e)阳极/空穴注入层/空穴传输层/发光层/阻挡层/电子传输层/电子注入层/阴极。
(f)阳极/空穴注入层/电子阻挡层/空穴传输层/发光层/阻挡层/电子传输层/电子注入层/阴极。
包括有机电致发光装置的衬底、阴极和阳极的其它装置配置描述于日本专利公开第2008-270736号中。
<衬底>
本发明的有机电致发光装置中可使用的适合衬底优选当用于显示器应用时使从有机层发射的光不散射或减少的衬底。当用于照明或某些显示器应用时,使光散射的衬底是可接受的。在一些实施例中,所述衬底优选由有机材料组成,所述有机材料展现优良的耐热性、尺寸稳定性、耐溶剂性、电绝缘特性和/或可加工性。
适用于本发明的衬底优选使从有机化合物层发射的光不散射或减弱的衬底。用于衬底的材料的特定实例包括(但不限于)无机材料,例如氧化锆稳定化钇(ysz)和玻璃;聚酯,例如聚对苯二甲酸乙二酯、聚邻苯二甲酸丁二酯和聚萘二甲酸乙二酯;和有机材料,例如聚苯乙烯、聚碳酸酯、聚醚砜、聚芳酯、聚酰亚胺、聚环烯烃、降冰片烯树脂、聚氯三氟乙烯等。
在一些实施例中,当玻璃用作衬底时,优选使用无碱玻璃。适合无碱玻璃的特定实例见于2013年9月12日公开的川口贵广(takahirokawaguchi)的美国专利申请公开第2013/0237401号中。在一些实施例中,当碱石灰玻璃用作衬底时,优选使用其上已经涂覆了二氧化硅屏障涂层等的玻璃。在一些实施例中,当有机材料用作衬底时,优选使用具有一或多种以下属性的材料:优良的耐热性、尺寸稳定性、耐溶剂性、电绝缘性能和可加工性。
一般来说,关于衬底的形状、结构、尺寸等不存在特定限制,但这些属性中的任一种可以根据发光元件的应用、目的等适合地选择。一般来说,板状衬底优选为衬底的形状。衬底结构可以是单层结构或层合结构。此外,衬底可以由单个元件或两个或更多个元件形成。
尽管衬底可以是透明并且无色的或透明并且有色的,但从衬底不使从有机发光层发射的光散射或减弱的观点来看,衬底优选是透明并且无色的。在一些实施例中,水分渗透阻止层(气障层)可以提供于衬底的顶表面或底表面上。水分渗透阻止层(气障层)的材料的实例包括(但不限于)无机物质,例如氮化硅和氧化硅。水分渗透阻止层(气障层)可以根据例如高频溅镀方法等形成。
在应用热塑性衬底的情况下,可以按需要进一步提供硬涂层或底涂层。
<阳极>
任何阳极都可以用于本发明的有机电致发光装置,只要其充当向有机层中供应空穴的电极。在本发明的有机电致发光装置的一些实施例中,可以根据例如有机电致发光装置的应用和目的来使用已知电极材料的任何适合形状、结构和/或尺寸。在一些实施例中,优选透明阳极。
阳极通常可以是任何材料,只要其充当用于向有机化合物层供应空穴的电极,并且关于形状、结构、尺寸等不存在特定限制。然而,其可以根据发光元件的应用和目的,适合地从众所周知的电极材料中选择。在一些实施例中,阳极是作为透明阳极提供。
阳极的材料优选包括例如金属、合金、金属氧化物、导电化合物和其混合物。功函数为4.0ev或更大的材料是优选的。阳极材料的特定实例包括导电金属氧化物,例如掺杂有锑、氟等的锡氧化物(ato和fto)、氧化锡、氧化锌、氧化铟、氧化铟锡(ito)和氧化铟锌(izo);金属,例如金、银、铬、铝、铜和镍;这些金属和导电金属氧化物的混合物或层合物;无机导电材料,例如碘化铜和硫化铜;有机导电材料,例如聚苯胺、聚噻吩和聚吡咯;和这些无机或有机导电材料与ito的层合物。其中,考虑到生产率、高电导率、透明度等,优选导电金属氧化物并且特别优选ito。
考虑材料构成阳极的适合性,阳极可以根据适当地选自以下的方法在衬底上形成:湿式方法,例如印刷方法、涂布方法等;物理方法,例如真空沉积方法、溅镀方法、离子电镀方法等;和化学方法,例如cvd(化学气相沉积)和等离子体cvd方法等。举例来说,当ito被选作阳极材料时,阳极可以根据dc或高频溅镀方法、真空沉积方法、离子电镀方法等形成。
在本发明的有机电致发光元件中,待形成阳极的位置不受特别限制,但其可以根据发光元件的应用和目的适合地选择。阳极可以在衬底的任一侧的整个表面或一部分表面上形成。
为了进行图案化以形成阳极,可以应用化学蚀刻方法(例如光刻法)、物理蚀刻方法(例如激光蚀刻)、通过叠置掩模进行的真空沉积或溅镀,或剥离方法或印刷方法。
阳极厚度可以根据构成阳极的材料适合地选择,并且因此无法明确地确定,但其通常在10nm到50μm并且优选50nm到20μm范围内。阳极层的厚度可以根据其所用材料来正确控制。阳极的电阻优选103ω/平方或更小,并且更优选102ω/平方或更小,更优选30ω/平方或更小。在阳极透明的情况下,其可以是透明并且无色的,或透明并且有色的。为了从透明阳极侧提取发光,阳极的透光率优选60%或更高,并且更优选70%或更高。透明阳极的详细描述可以见于c.m.c.在1999年出版的“toumeidennkyoku-makunoshintenkai(透明电极薄膜的新颖开发(noveldevelopmentsintransparentelectrodefilms))”(泽田丰(yutakasawada)编辑)。
在本发明使用耐热性低的塑料衬底的情况下,优选使用ito或izo获得透明阳极,所述透明阳极是通过在150℃或更低的低温下形成膜来制备。
<阴极>
任何阳极都可以用于本发明的有机电致发光装置,只要其充当向有机层中供应空穴的电极。在本发明的有机电致发光装置的一些实施例中,可以根据例如有机电致发光装置的应用和目的来使用已知电极材料的任何适合形状、结构和/或尺寸。在一些实施例中,优选透明阳极。
阴极通常可以是任何材料,只要其充当用于向有机化合物层注入电子的电极,并且关于形状、结构、尺寸等不存在特定限制。然而,其可以根据发光元件的应用和目的,适合地从众所周知的电极材料中选择。
构成阴极的材料包括例如金属、合金、金属氧化物、导电化合物和其混合物。功函数为4.0ev或更大的材料是优选的。其特定实例包括碱金属(例如li、na、k、cs等)、碱土金属(例如mg、ca等)、金、银、铅、铝、钠-钾合金、锂-铝合金、镁-银合金、稀土金属(例如铟和镱)等。其可以单独使用,但从满足稳定性和电子可注入性两者的观点来看,优选将其中的两种或更多种组合使用。
在一些实施例中,考虑到电子可注入性,优选碱金属或碱土金属作为构成阴极的材料,并且考虑到优良的保存稳定性,优选含有铝作为主要组分的材料。
术语“含有铝作为主要组分的材料”是指仅由铝构成的材料;包含铝和0.01重量%到10重量%碱金属或碱土金属的合金;或其混合物(例如锂-铝合金、镁-铝合金等)。例示性阴极材料详细地描述于jp-a第2-15595号和第5-121172号中。
形成阴极的方法不受特别限制,但其可以根据众所周知的方法形成。举例来说,考虑材料构成阴极的适合性,阴极可以根据适当地选自以下的方法形成:湿式方法,例如印刷方法、涂布方法等;物理方法,例如真空沉积方法、溅镀方法、离子电镀方法等;和化学方法,例如cvd和等离子体cvd方法等。举例来说,当(一或多种)金属被选作(一或多种)阴极材料时,其中的一或两种或更多种可以根据溅镀方法等同时或依序施加。
为了进行图案化以形成阴极,可以应用化学蚀刻方法(例如光刻法)、物理蚀刻方法(例如激光蚀刻)、通过叠置掩模进行的真空沉积或溅镀,或剥离方法或印刷方法。
在本发明中,待形成阴极的位置不受特别限制,但其可以在有机化合物层的全部或一部分上形成。
此外,由碱金属或碱土金属的氟化物、氧化物等制成的介电材料层可以按0.1nm到5nm的厚度插入阴极与有机化合物层之间。介电材料层可以被视为一类电子注入层。介电材料层可以根据例如真空沉积方法、溅镀方法、离子电镀方法等形成。
阴极厚度可以根据构成阴极的材料适合地选择,并且因此无法明确地确定,但其通常在10nm到5μm并且优选50nm到1μm范围内。
此外,阴极可以是透明或不透明的。透明阴极可以通过以下方式形成:制备具有1nm到10nm的小厚度的阴极材料,并且进一步将透明导电材料(例如ito或izo)层压于其上。
<保护层>
本发明的有机el元件的全身可以通过保护层保护。任何材料都可以应用于保护层,只要材料具有防止例如水分、氧气等成分渗透的功能即可,所述成分通过进入所述元件中来加快所述元件劣化。用于保护层的材料的特定实例包括金属,例如in、sn、pb、au、cu、ag、al、ti、ni等;金属氧化物,例如mgo、sio、sio2、al2o3、geo、nio、cao、bao、fe2o3、y2o3、tio2等;金属氮化物,例如sinx、sinxoy等;金属氟化物,例如mgf2、lif、alf3、caf2等;聚乙烯;聚丙烯;聚甲基丙烯酸甲酯;聚酰亚胺;聚脲;聚四氟乙烯;聚氯三氟乙烯;聚二氯二氟乙烯;氯三氟乙烯与二氯二氟乙烯的共聚物;通过使含有四氟乙烯与至少一种共聚单体的单体混合物共聚而获得的共聚物;各自在共聚主链中具有环状结构的含氟共聚物;各自具有1%或更大的吸水系数的吸水材料;各自具有0.1%或更小的吸水系数的水分渗透阻止物质等。
关于形成保护层的方法不存在特定限制。举例来说,可以应用真空沉积方法、溅镀方法、反应性溅镀方法、mbe(分子束外延)方法、团簇离子束方法、离子电镀方法、等离子体聚合方法(高频激发离子电镀方法)、等离子体cvd方法、激光cvd方法、热cvd方法、气源cvd方法、涂布方法、印刷方法或转印方法。
<密封>
本发明的整个有机电致发光元件可以用密封盖密封。此外,可以利用吸湿剂或惰性液体将密封盖与发光元件之间所界定的空间密封。尽管吸湿剂不受特别限制,但其特定实例包括氧化钡、氧化钠、氧化钾、氧化钙、硫酸钠、硫酸钙、硫酸镁、五氧化二磷、氯化钙、氯化镁、氯化铜、氟化铯、氟化铌、溴化钙、溴化钒、分子筛、沸石、氧化镁等。尽管惰性液体不受特别限制,但其特定实例包括石蜡;液体石蜡;基于氟的溶剂,例如全氟烷烃、全氟胺、全氟醚等;基于氯的溶剂;硅酮油等。
<驱动>
在本发明的有机电致发光元件中,当跨越阳极和阴极施加dc(需要时可以含有ac分量)电压(通常为2伏到15伏)或dc时,可以获得发光。对于本发明的有机电致发光元件的驱动方法来说,jp-a第2-148687号、第6-301355号、第5-29080号、第7-134558号、第8-234685号和第8-241047号;日本专利第2784615号、美国专利第5,828,429号和第6,023,308号中所述的驱动方法是适用的。
<应用>
根据本文所述的本发明实施例制成的装置可以并入各种各样的消费型产品中,包括(但不限于)平板显示器、计算机监视器、电视机、告示牌、用于内部或外部照明和/或发信号的灯、平视显示器、全透明显示器、柔性显示器、激光打印机、电话、蜂窝电话、个人数字助理(pda)、膝上型计算机、数码相机、摄像机、取景器、微型显示器、交通工具、大面积墙壁、剧院或体育馆屏幕,或指示牌。
<有机层>
适用于本发明的有机电致发光装置的有机层可以包含多个层,包括例如发光层、主体材料、电荷传输层、空穴注入层和空穴传输层。阻挡层还可以包括例如空穴(和或激子)阻挡层(hbl)或电子(和或激子)阻挡层(ebl)。在本发明的有机电致发光装置的一些实施例中,每个有机层可以通过以下方法形成:干式成膜法,例如沉积法或溅镀法;或溶液涂布工艺,例如转印法、印刷法、旋涂法或棒涂法。在本发明的有机电致发光装置的一些实施例中,有机层的至少一个层优选通过溶液涂布工艺形成。
a.发光层
发光材料:
根据本发明的发光材料优选包括至少一种具有式1、式2或式3的结构的金属络合物。本发明的有机电致发光装置的一些实施例包含按构成发光层的化合物的总质量计,约0.1质量%到约50质量%的量的发光材料。在一些实施例中,按构成发光层的化合物的总质量计,本发明的有机电致发光装置包含约1质量%到约50质量%的量的发光材料。在一些实施例中,本发明的有机电致发光装置包含按构成发光层的化合物的总质量计,约2质量%到约40质量%的量的发光材料。在一些实施例中,按发光层中所含的化合物的总量计,发光层中的发光材料的总量优选约0.1重量%到约30重量%。在一些实施例中,考虑到耐久性和外部量子效率,发光层中的发光材料的总量优选约1重量%到约20重量%。在一些实施例中,发光层中的主体材料的总量优选约70重量%到约99.9重量%。在一些实施例中,考虑到耐久性和外部量子效率,发光层中的主体材料的总量优选约80重量%到99重量%。在一些实施例中,发光层内可以使用梯度发光层或梯度界面。梯度可以例如通过混合两种或更多种不同材料、按照不形成一个层向另一层的突然变化的方式来形成。梯度发光层和/或界面已经显示可改进装置寿命并且这种装置架构对于改进pholed寿命和一般性能来说可以是有益的。在这种情况下,发光材料可以按约0质量%到约100质量%的量存在于发光层内的任何既定位置。
在一些实施例中,本发明中的发光层可以包括发光材料和发光层中所含的主体材料,其为通过单重态激子发光(荧光)的荧光发射材料与主体材料的组合,或通过三重态激子发光(磷光)的磷光发光材料与主体材料的组合。在一些实施例中,本发明中的发光层可以包括发光材料和发光层中所含的主体材料,其为磷光发光材料与主体材料的组合。
在一些实施例中,所述第一化合物可以是发射掺杂剂。在一些实施例中,所述化合物可以经由磷光、荧光、热激活延迟荧光,即tadf(也称为e型延迟荧光)、三重态-三重态湮灭或这些工艺的组合来产生发射。
b.主体材料
适用于本发明的主体材料可以是空穴传输主体材料(有时称为空穴传输主体)和/或电子传输主体材料(有时称为电子传输主体)。
有机层还可以包括主体。在一些实施例中,优选两种或更多种主体。在一些实施例中,所用主体可以是在电荷传输中起很小作用的a)双极性、b)电子传输、c)空穴传输或d)宽带隙材料。在一些实施例中,主体可以包括金属络合物。主体可以是含有苯并稠合噻吩或苯并稠合呋喃的三亚苯。所述主体中的任何取代基可以是独立地选自由以下组成的群组的非稠合取代基:cnh2n+1、ocnh2n+1、oar1、n(cnh2n+1)2、n(ar1)(ar2)、ch=ch-cnh2n+1、c≡ccnh2n+1、ar1、ar1-ar2和cnh2n-ar1,或所述主体无取代。在前述取代基中,n可以在1到10范围内;并且ar1和ar2可以独立地选自由以下组成的群组:苯、联苯、萘、三亚苯、咔唑和其杂芳香族类似物。在一些实施例中,所述主体也可以是无机化合物。例如含zn无机材料,例如zns。
所述主体可以是包含至少一种选自由以下组成的群组的化学基团的化合物:三亚苯、咔唑、二苯并噻吩、二苯并呋喃、二苯并硒吩、氮杂三亚苯、氮杂咔唑、氮杂-二苯并噻吩、氮杂-二苯并呋喃和氮杂-二苯并硒吩。主体可包括金属络合物。主体可以是选自由以下组成的群组的特定化合物:
和其组合。
空穴传输主体材料
空穴传输主体材料的特定实例包括(但不限于)吡咯、咔唑、氮杂咔唑、吡唑、吲哚、氮杂吲哚、咪唑、聚芳基烷、吡唑啉、吡唑啉酮、苯二胺、芳胺、氨基取代的查耳酮、苯乙烯基蒽、芴酮、腙、芪、硅氮烷、芳香族叔胺化合物、苯乙烯胺化合物、芳香族二亚甲基化合物、卟啉化合物、聚硅烷化合物、聚(n-乙烯咔唑)、苯胺共聚物、导电高分子寡聚物(例如噻吩寡聚物、聚噻吩等)、有机硅烷、碳膜、其衍生物等。一些优选的主体材料包括咔唑衍生物、吲哚衍生物、咪唑衍生物、芳香族叔胺化合物和噻吩衍生物。
电子传输主体材料
电子传输主体材料的特定实例包括(但不限于)吡啶、嘧啶、三嗪、咪唑、吡唑、三唑、噁唑、噁二唑、芴酮、蒽醌二甲烷、蒽酮、二苯醌、噻喃二氧化物、碳化二亚胺、亚芴基甲烷、二苯乙烯吡嗪、氟取代的芳香族化合物、萘、苝等的芳香环四羧酸酐、酞菁、其衍生物,包括多种由8-喹啉醇衍生物的金属络合物、金属酞菁表示的金属络合物,和具有苯并噁唑或苯并噻唑作为配体的金属络合物。
优选的电子传输主体是金属络合物、唑衍生物(苯并咪唑衍生物、咪唑并吡啶衍生物等)和吖嗪衍生物(吡啶衍生物、嘧啶衍生物、三嗪衍生物等)。
c.膜厚度
在一些实施例中,发光层的膜厚度优选约10nm到约500nm。在一些实施例中,发光层的膜厚度优选约20nm到约100nm,这取决于例如所期望的亮度均一性、驱动电压和亮度。在一些实施例中,发光层被配置成具有优化电荷从发光层传递到邻近层而不降低发光效率的厚度。在一些实施例中,发光层被配置成具有维持最小驱动电压最大发光效率的厚度。
d.层配置
发光层可以由单个层或两个或更多个层组成,并且相应层可以引起不同发光颜色的光发射。此外,在发光层具有层合结构的情况下,尽管配置层合结构的每个层的膜厚度不受特别限制,但优选每个发光层的总膜厚度属于前述范围内。在一些实施例中,所述层内可以使用梯度层或梯度界面。
e.空穴注入层和空穴传输层
空穴注入层和空穴传输层是功能在于接收来自阳极或阳极侧的空穴和将空穴传输到发射层的层。待引入空穴注入层或空穴传输层的材料不受特别限制,但可以使用低分子化合物或高分子化合物中的任一者。
空穴注入层和空穴传输层中所含的材料的特定实例包括(但不限于)吡咯衍生物、咔唑衍生物、氮杂咔唑衍生物、吲哚衍生物、氮杂吲哚衍生物、咪唑衍生物、聚芳基烷衍生物、吡唑啉衍生物、吡唑啉酮衍生物、苯二胺衍生物、芳胺衍生物、氨基取代的查耳酮衍生物、苯乙烯基蒽衍生物、芴酮衍生物、腙衍生物、芪衍生物、硅氮烷衍生物、芳香族叔胺化合物、苯乙烯胺化合物、芳香族二亚甲基化合物、酞菁化合物、卟啉化合物、有机硅烷衍生物、碳等。
电子接受掺杂剂可以引入本发明的有机el元件的空穴注入层或空穴传输层中。作为待引入空穴注入层或空穴传输层中的电子接受掺杂剂,可以使用无机化合物或有机化合物中的任一者,只要所述化合物具有电子接受特性和氧化有机化合物的功能。
具体来说,无机化合物包括金属卤化物,例如氯化铁、氯化铝、氯化镓、氯化铟、五氯化锑等,和金属氧化物,例如五氧化二钒、三氧化钼等。
在采用有机化合物的情况下,优选可以应用具有取代基的化合物,所述取代基例如硝基、卤素、氰基、三氟甲基等;醌化合物;酸酐化合物;富勒烯(fullerenes)等。
空穴注入和空穴传输材料的特定实例包括专利文件中所述的化合物,例如jp-a第6-212153号、第11-111463号、第11-251067号、第2000-196140号、第2000-286054号、第2000-315580号、第2001-102175号、第2001-160493号、第2002-252085号、第2002-56985号、第2003-157981号、第2003-217862号、第2003-229278号、第2004-342614号、第2005-72012号、第2005-166637号、第2005-209643号等。
空穴注入和空穴传输材料的特定实例包括有机化合物:六氰基丁二烯、六氰基苯、四氰基乙烯、四氰基对醌二甲烷、四氟四氰基对醌二甲烷、对四氟醌、对四氯醌、对四溴醌、对苯醌、2,6-二氯苯醌、2,5-二氯苯醌、1,2,4,5-四氰基苯、1,4-二氰基四氟苯、2,3-二氯-5,6-二氰基苯醌、对二硝基苯、间二硝基苯、邻二硝基苯、1,4-萘醌、2,3-二氯萘醌、1,3-二硝基萘、1,5-二硝基萘、9,10-蒽醌、1,3,6,8-四硝基咔唑、2,4,7-三硝基-9-芴酮、2,3,5,6-四氰基吡啶和富勒烯c60。其中,更优选六氰基丁二烯、六氰基苯、四氰基乙烯、四氰基对醌二甲烷、四氟四氰基对醌二甲烷、对四氟醌、对四氯醌、对四溴醌、2,6-二氯苯醌、2,5-二氯苯醌、2,3-二氯萘醌、1,2,4,5-四氰基苯、2,3-二氯-5,6-二氰基苯醌和2,3,5,6-四氰基吡啶,以及四氟四氰基对醌二甲烷。
由于一或多种电子接受掺杂剂可以引入本发明的有机el元件的空穴注入层或空穴传输层中,因此这些电子接受掺杂剂可以单独或以两种或更多种的组合使用。尽管所用的这些电子接受掺杂剂的确切量将取决于材料类型,但优选空穴传输层或空穴注入层总重量的约0.01重量%到约50重量%。在一些实施例中,这些电子接受掺杂剂的量在空穴传输层或空穴注入层总重量的约0.05重量%到约20重量%范围内。在一些实施例中,这些电子接受掺杂剂的量在空穴传输层或空穴注入层总重量的约0.1重量%到约10重量%范围内。
在一些实施例中,考虑到降低驱动电压或针对光学出耦优化,空穴注入层的厚度和空穴传输层的厚度各自优选约500nm或更小。在一些实施例中,空穴传输层的厚度优选约1nm到约500nm。在一些实施例中,空穴传输层的厚度优选约5nm到约50nm。在一些实施例中,空穴传输层的厚度优选约10nm到约40nm。在一些实施例中,空穴注入层的厚度优选约0.1nm到约500nm。在一些实施例中,空穴注入层的厚度优选约0.5nm到约300nm。在一些实施例中,空穴注入层的厚度优选约1nm到约200nm。
空穴注入层和空穴传输层可以由包含一或两种或更多种上述材料的单层结构构成或由多层结构构成,所述多层结构由具有均匀组成或非均匀组成的多个层构成。
f.电子注入层和电子传输层
电子注入层和电子传输层是具有从阴极或阴极侧接收电子和将电子传输到发光层的功能的层。用于这些层的电子注入材料或电子传输材料可以是低分子化合物或高分子化合物。适用于电子注入和电子传输层的材料的特定实例包括(但不限于)吡啶衍生物、喹啉衍生物、嘧啶衍生物、吡嗪衍生物、酞嗪衍生物、啡啉衍生物、三嗪衍生物、三唑衍生物、噁唑衍生物、噁二唑衍生物、咪唑衍生物、芴酮衍生物、蒽醌二甲烷衍生物、蒽酮衍生物、二苯醌衍生物、噻喃二氧化物衍生物、碳化二亚胺衍生物、亚芴基甲烷衍生物、二苯乙烯吡嗪衍生物、苝、萘等的芳香环四羧酸酐、酞菁衍生物、由8-喹啉醇衍生物的金属络合物、金属酞菁表示的金属络合物,和含有苯并噁唑或苯并噻唑作为配体的金属络合物、以硅罗(silole)为例的有机硅烷衍生物等。
电子注入层或电子传输层可以含有供电子掺杂剂。适用于电子注入层或电子传输层的供电子掺杂剂包括可以使用的任何适合材料,只要其具有供电子特性和还原有机化合物的特性。供电子掺杂剂的特定实例包括碱金属,例如li;碱土金属,例如mg;过渡金属,包括稀土金属;和还原有机化合物。供金属掺杂剂的其它实例包括功函数为4.2v或更小的金属,例如li、na、k、be、mg、ca、sr、ba、y、cs、la、sm、gd、yb等。还原有机化合物的特定实例包括含氮化合物、含硫化合物、含磷化合物等。
供电子掺杂剂可以单独或以两种或更多种的组合使用。在一些实施例中,供电子掺杂剂是按照电子传输层材料或电子注入层材料总重量的约0.1重量%到约99重量%范围内的量包含于电子注入层或电子传输层中。在一些实施例中,供电子掺杂剂是按照电子传输层材料或电子注入层材料总重量的约1.0重量%到约80重量%的量包含于电子注入层或电子传输层中。在一些实施例中,供电子掺杂剂是按照电子传输层材料或电子注入层材料总重量的约2.0重量%到约70重量%范围内的量包含于电子注入层或电子传输层中。
考虑到驱动电压降低,电子注入层的厚度和电子传输层的厚度各自优选500nm或更小。电子传输层的厚度优选1nm到500nm,更优选5nm到200nm,并且甚至更优选10nm到100nm。电子注入层的厚度优选0.1nm到200nm,更优选0.2nm到100nm,并且甚至更优选0.5nm到50nm。
电子注入层和电子传输层可以由包含一或两种或更多种上述材料的单层结构构成,或由多层结构构成,所述多层结构由具有均匀组成或非均匀组成的多个层构成。
与其它材料的组合
本文中描述为适用于有机发光装置中的特定层的材料可以与装置中存在的多种其它材料组合使用。举例来说,本文所公开的发射掺杂剂可以与可能存在的广泛多种主体、传输层、阻挡层、注入层、电极和其它层结合使用。下文描述或提及的材料是可以与本文所公开的化合物组合使用的材料的非限制性实例,并且所属领域的技术人员可以容易地查阅文献以鉴别可以组合使用的其它材料。
hil/htl:
本发明中所用的空穴注入/传输材料不受特别限制,并且可以使用任何化合物,只要化合物通常用作空穴注入/传输材料即可。材料的实例包括(但不限于):酞菁或卟啉衍生物;芳香族胺衍生物;吲哚并咔唑衍生物;含有氟烃的聚合物;具有导电性掺杂剂的聚合物;导电聚合物,如pedot/pss;衍生自如膦酸和硅烷衍生物的化合物的自组装单体;金属氧化物衍生物,如moox;p型半导电有机化合物,如1,4,5,8,9,12-六氮杂三亚苯六甲腈;金属络合物;以及可交联化合物。
用于hil或htl的芳香族胺衍生物的实例包括(但不限于)以下一般结构:
ar1到ar9中的每一个选自:由例如以下的芳香族烃环状化合物组成的群组:苯、联苯、联三苯、三亚苯、萘、蒽、萉、菲、芴、芘、
在一个方面中,ar1到ar9独立地选自由以下组成的群组:
其中k是1到20的整数;x101到x108是c(包括ch)或n;z101是nar1、o或s;ar1具有上文所定义的相同基团。
hil或htl中所用的金属络合物的实例包括(但不限于)以下通式:
其中met是原子量可以大于40的金属;(y101-y102)是双齿配体,y101和y102独立地选自c、n、o、p和s;l101是辅助配体;k'是1到可以与金属连接的最大配体数的整数值;并且k'+k"是可以与金属连接的最大配体数。
在一个方面中,(y101-y102)是2-苯基吡啶衍生物。在另一方面中,(y101-y102)是碳烯配体。在另一方面中,met选自ir、pt、os和zn。在另一方面中,金属络合物具有相较于fc+/fc耦合的小于约0.6v的溶液中最小氧化电势。
可以与本文中所公开的材料组合用于oled中的hil和htl材料的非限制性实例与公开那些材料的参考文献一起例示如下:cn102702075、de102012005215、ep01624500、ep01698613、ep01806334、ep01930964、ep01972613、ep01997799、ep02011790、ep02055700、ep02055701、ep1725079、ep2085382、ep2660300、ep650955、jp07-073529、jp2005112765、jp2007091719、jp2008021687、jp2014-009196、kr20110088898、kr20130077473、tw201139402、us06517957、us20020158242、us20030162053、us20050123751、us20060182993、us20060240279、us20070145888、us20070181874、us20070278938、us20080014464、us20080091025、us20080106190、us20080124572、us20080145707、us20080220265、us20080233434、us20080303417、us2008107919、us20090115320、us20090167161、us2009066235、us2011007385、us20110163302、us2011240968、us2011278551、us2012205642、us2013241401、us20140117329、us2014183517、us5061569、us5639914、wo05075451、wo07125714、wo08023550、wo08023759、wo2009145016、wo2010061824、wo2011075644、wo2012177006、wo2013018530、wo2013039073、wo2013087142、wo2013118812、wo2013120577、wo2013157367、wo2013175747、wo2014002873、wo2014015935、wo2014015937、wo2014030872、wo2014030921、wo2014034791、wo2014104514、wo2014157018。
ebl:
电子阻挡层(ebl)可以用以减少离开发射层的电子和/或激子的数目。与缺乏阻挡层的类似装置相比,在装置中存在此类阻挡层可以产生大体上较高的效率和/或较长的寿命。此外,可以使用阻挡层来将发射限制于oled的所需区域。在一些实施例中,与最接近ebl界面的发射体相比,ebl材料具有较高lumo(较接近真空能级)和/或较高三重态能量。在一些实施例中,与最接近ebl界面的主体中的一或多种相比,ebl材料具有较高lumo(较接近真空能级)和/或较高三重态能量。在一个方面中,ebl中所用的化合物含有与下文所述的主体中的一个所用相同的分子或相同的官能团。
主体:
本发明的有机el装置的发光层优选地至少含有金属络合物作为发光材料,并且可以含有使用金属络合物作为掺杂剂材料的主体材料。在一些实施例中,优选两种或更多种主体。在一些实施例中,所用主体可以是在电荷传输中起很小作用的a)双极性、b)电子传输、c)空穴传输或d)宽带隙材料。主体材料的实例不受特别限制,并且可以使用任何金属络合物或有机化合物,只要主体的三重态能量大于掺杂剂的三重态能量即可。虽然下表将主体材料按照发射各种颜色的装置所优选的进行分类,但是任何主体材料可以与任何掺杂剂一起使用,只要满足三重态准则即可。
用作主体的金属络合物的实例优选具有以下通式:
其中met是金属;(y103-y104)是双齿配体,y103和y104独立地选自c、n、o、p和s;l101是另一配体;k'是1到可以与金属连接的最大配体数的整数值;并且k'+k"是可以与金属连接的最大配体数。
在一个方面中,金属络合物是:
其中(o-n)是具有与o和n原子配位的金属的双齿配体。
在另一方面中,met选自ir和pt。在另一方面中,(y103-y104)是碳烯配体。
用作主体的其它有机化合物的实例选自:由例如以下的芳香族烃环状化合物组成的群组:苯、联苯、联三苯、三亚苯、四亚苯、萘、蒽、萉、菲、芴、芘、
在一个方面中,主体化合物在分子中含有以下基团中的至少一个:
其中r101到r107独立地选自由以下组成的群组:氢、氘、卤素、烷基、环烷基、杂烷基、杂环烷基、芳烷基、烷氧基、芳氧基、氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸、醚、酯、腈、异腈、硫基、亚磺酰基、磺酰基、膦基和其组合,且当其是芳基或杂芳基时,其具有与上文所提及的ar类似的定义。k是0到20或1到20的整数;k'"是0到20的整数。x101到x108选自c(包括ch)或n。z101和z102选自nr101、o或s。
可以与本文中所公开的材料组合用于oled中的主体材料的非限制性实例与公开那些材料的参考文献一起例示如下:ep2034538、ep2034538a、ep2757608、jp2007254297、kr20100079458、kr20120088644、kr20120129733、kr20130115564、tw201329200、us20030175553、us20050238919、us20060280965、us20090017330、us20090030202、us20090167162、us20090302743、us20090309488、us20100012931、us20100084966、us20100187984、us2010187984、us2012075273、us2012126221、us2013009543、us2013105787、us2013175519、us2014001446、us20140183503、us20140225088、us2014034914、us7154114、wo2001039234、wo2004093207、wo2005014551、wo2005089025、wo2006072002、wo2006114966、wo2007063754、wo2008056746、wo2009003898、wo2009021126、wo2009063833、wo2009066778、wo2009066779、wo2009086028、wo2010056066、wo2010107244、wo2011081423、wo2011081431、wo2011086863、wo2012128298、wo2012133644、wo2012133649、wo2013024872、wo2013035275、wo2013081315、wo2013191404、wo2014142472
其它发射体:
一或多种其它发射体掺杂剂可以与本发明化合物结合使用。其它发射体掺杂剂的实例不受特别限制,并且可以使用任何化合物,只要化合物通常用作发射体材料即可。合适发射体材料的实例包括(但不限于)可以经由磷光、荧光、热激活延迟荧光(即tadf,也称为e型延迟荧光)、三重态-三重态消灭或这些工艺的组合产生发射的化合物。
可以与本文中所公开的材料组合用于oled中的发射体材料的非限制性实例与公开那些材料的参考文献一起例示如下:cn103694277、cn1696137、eb01238981、ep01239526、ep01961743、ep1239526、ep1244155、ep1642951、ep1647554、ep1841834、ep1841834b、ep2062907、ep2730583、jp2012074444、jp2013110263、jp4478555、kr1020090133652、kr20120032054、kr20130043460、tw201332980、us06699599、us06916554、us20010019782、us20020034656、us20030068526、us20030072964、us20030138657、us20050123788、us20050244673、us2005123791、us2005260449、us20060008670、us20060065890、us20060127696、us20060134459、us20060134462、us20060202194、us20060251923、us20070034863、us20070087321、us20070103060、us20070111026、us20070190359、us20070231600、us2007034863、us2007104979、us2007104980、us2007138437、us2007224450、us2007278936、us20080020237、us20080233410、us20080261076、us20080297033、us200805851、us2008161567、us2008210930、us20090039776、us20090108737、us20090115322、us20090179555、us2009085476、us2009104472、us20100090591、us20100148663、us20100244004、us20100295032、us2010102716、us2010105902、us2010244004、us2010270916、us20110057559、us20110108822、us20110204333、us2011215710、us2011227049、us2011285275、us2012292601、us20130146848、us2013033172、us2013165653、us2013181190、us2013334521、us20140246656、us2014103305、us6303238、us6413656、us6653654、us6670645、us6687266、us6835469、us6921915、us7279704、us7332232、us7378162、us7534505、us7675228、us7728137、us7740957、us7759489、us7951947、us8067099、us8592586、us8871361、wo06081973、wo06121811、wo07018067、wo07108362、wo07115970、wo07115981、wo08035571、wo2002015645、wo2003040257、wo2005019373、wo2006056418、wo2008054584、wo2008078800、wo2008096609、wo2008101842、wo2009000673、wo2009050281、wo2009100991、wo2010028151、wo2010054731、wo2010086089、wo2010118029、wo2011044988、wo2011051404、wo2011107491、wo2012020327、wo2012163471、wo2013094620、wo2013107487、wo2013174471、wo2014007565、wo2014008982、wo2014023377、wo2014024131、wo2014031977、wo2014038456、wo2014112450。
hbl:
空穴阻挡层(hbl)可以用以减少离开发射层的空穴和/或激子的数目。与缺乏阻挡层的类似装置相比,此类阻挡层在装置中的存在可以产生大体上较高的效率和/或较长的寿命。此外,可以使用阻挡层来将发射限制于oled的所需区域。在一些实施例中,与最接近hbl界面的发射极相比,hbl材料具有较低homo和/或较高三重态能量。
在一个方面中,hbl中所用的化合物含有与上文所述的主体所用相同的分子或相同的官能团。
在另一方面中,hbl中所用的化合物在分子中含有以下基团中的至少一个:
其中k是1到20的整数;l101是另一个配体,k'是1到3的整数。
etl:
电子传输层(etl)可以包括能够传输电子的材料。电子传输层可以是固有的(未经掺杂的)或经掺杂的。可以使用掺杂来增强导电性。etl材料的实例不受特别限制,并且可以使用任何金属络合物或有机化合物,只要其通常用以传输电子即可。
在一个方面中,etl中所用的化合物在分子中含有以下基团中的至少一个:
其中r101选自由以下组成的群组:氢、氘、卤素、烷基、环烷基、杂烷基、杂环烷基、芳烷基、烷氧基、芳氧基、氨基、硅烷基、烯基、环烯基、杂烯基、炔基、芳基、杂芳基、酰基、羰基、羧酸、醚、酯、腈、异腈、硫基、亚磺酰基、磺酰基、膦基和其组合,当其为芳基或杂芳基时,其具有与上述ar类似的定义。ar1到ar3具有与上文所提及的ar类似的定义。k是1到20的整数。x101到x108选自c(包括ch)或n。
在另一方面中,etl中所用的金属络合物包括(但不限于)以下通式:
其中(o-n)或(n-n)是具有与原子o、n或n、n配位的金属的双齿配体;l101是另一个配体;k'是1到可以与金属连接的最大配体数的整数值。
可以与本文中所公开的材料组合用于oled中的etl材料的非限制性实例与公开那些材料的参考文献一起例示如下:cn103508940、ep01602648、ep01734038、ep01956007、jp2004-022334、jp2005149918、jp2005-268199、kr0117693、kr20130108183、us20040036077、us20070104977、us2007018155、us20090101870、us20090115316、us20090140637、us20090179554、us2009218940、us2010108990、us2011156017、us2011210320、us2012193612、us2012214993、us2014014925、us2014014927、us20140284580、us6656612、us8415031、wo2003060956、wo2007111263、wo2009148269、wo2010067894、wo2010072300、wo2011074770、wo2011105373、wo2013079217、wo2013145667、wo2013180376、wo2014104499、wo2014104535,
电荷产生层(cgl):
在串联或堆叠oled中,cgl对性能起基本作用,其由分别用于注入电子和空穴的经n掺杂的层和经p掺杂的层组成。电子和空穴由cgl和电极供应。cgl中消耗的电子和空穴由分别从阴极和阳极注入的电子和空穴再填充;随后,双极电流逐渐达到稳定状态。典型cgl材料包括传输层中所用的n和p导电性掺杂剂。
在oled装置的每个层中所用的任何上文所提及的化合物中,氢原子可以部分或完全氘化。因此,任何具体列出的取代基,如(但不限于)甲基、苯基、吡啶基等,涵盖其非氘化、部分氘化以及和完全氘化形式。类似地,取代基类别(例如(但不限于)烷基、芳基、环烷基、杂芳基等)还涵盖其非氘化、部分氘化和完全氘化形式。
本发明通过以下实例更详细地解释,但不希望受其限制。所属领域的技术人员能够基于不含发明步骤的描述产生其它电子装置且因此能够在所要求的整个范围内实施本发明。
实例
除非另外说明,否则以下合成是在干燥溶剂中、在保护性气体氛围下进行。金属络合物额外地避光处置。溶剂和试剂可以购自例如西格玛-奥德里奇公司(sigma-aldrich)或abcr。
实例1:合成3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪,根据流程1制备。
流程1
a.合成4-氯丁醛:
使乙二酰氯(22.54ml,263mmol)于dcm(400ml)中的溶液在iproh/co2浴中冷却。通过针筒缓慢添加dmso(37.3ml,525mmol)且冷搅拌1小时。逐滴添加4-氯丁-1-醇(19g,175mmol)于50mldcm中的溶液。将冷混合物搅拌一小时,然后缓慢添加三乙胺(110ml,788mmol)。将悬浮液冷搅拌30分钟,然后使其升温到室温。将反应物用水淬灭,酸化并且分离有机物。去除溶剂,随后蒸馏,产生8g无色油状产物。
b.合成2-溴-4-氯丁醛:
将4-氯丁醛(7.939g,74.5mmol)溶解于dcm(300ml)中,并且在冰浴中冷却。经约1小时添加二溴(4.00ml,78mmol)于dcm(50ml)中的溶液。添加之后,将红色溶液冷搅拌30分钟,然后缓慢升温到室温,并且再搅拌一小时。添加水,分离有机物,并且干燥和去除溶剂,产生1.57g浅黄色油状粗产物(80%)。
c.合成4-溴啡啶-6-胺:
将2,6-二溴苯胺(15.33g,61.1mmol)、2-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊-2-基)苯甲腈(7.0g,30.6mmol)和磷酸钾单水合物(21.11g,92mmol)合并于二噁烷(120ml)和水(7.49ml)中。将混合物脱气,然后添加(dppf)pdcl2与dcm的络合物(0.749g,0.917mmol),并且将混合物回流4小时。将黑色混合物分配在etoac与水/盐水之间。将有机层用盐水洗涤,干燥,并且去除溶剂。溶解于500mletoac中,随后通过二氧化硅塞使用etoac洗脱且去除溶剂,产生橙色残余物,通过柱色谱法提纯,得到5.86g黄色/橙色固体状产物(70%)。
d.合成5-溴-3-(2-氯乙基)咪唑并[1,2-f]啡啶:
将4-溴啡啶-6-胺(5.86,21.46mmol)、2-溴-4-氯丁醛(5.36g,28.9mmol)和碳酸氢钠(3.60g,42.9mmol)合并于2-丙醇(102ml)和水(5.11ml)中。将悬浮液在室温下搅拌4小时,然后在回流下搅拌16小时。在真空下去除溶剂,并且将残余物涂布于硅藻土上。柱色谱法产生产物和起始脒的混合物,在dcm中用过量乙酰氯和三乙胺处理。处理之后,通过重复萃取到庚烷中而从乙酰胺中萃取所期望的产物,产生3.93g黄色粘性残余物(51%)。
e.合成3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
将5-溴-3-((2-氯乙基)咪唑并[1,2-f]啡啶(3.93g,10.93mmol)溶解于thf(200ml)中,在冰浴中冷却,并且缓慢添加异丙基氯化镁于thf中的溶液(2.0m,6.01ml,12.02mmol)。将溶液冷搅拌30分钟,然后升温到室温,并且再搅拌2小时。将反应物淬灭,萃取到dcm中,并且使用柱色谱法提纯反应产物,产生1.90g浅米色结晶固体(71%)。
3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的x射线结构展示于图5中。3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的晶体结构可以通过下表中所列的一或多种特征定义。
ar1=σ||fo|-|fc||/σ|fo|;wr2=[σ[w(fo2-fc2)2]/σ[w(fo2)2]]1/2;gof=[σw(|fo|-|fc|)2/(n-m)]1/2
实例2:合成4,4-二甲基-3,4-二氢-1,2a1-二氮杂-4-硅杂苯并[fg]乙烯合蒽和3,3-二甲基-3,4-二氢-1,2a1-二氮杂-3-硅杂苯并[fg]乙烯合蒽:
根据下述流程2制备上述配体。
流程2
a.合成5-溴咪唑并[1,2-f]啡啶:
将4-溴啡啶-6-胺(4.0g,14.7mmol)溶解于100mliproh中。添加氯乙醛(50%于水中,3.6g,22mmol,1.5当量),随后nahco3(2.5g,2当量),且使混合物回流2小时,接着在冰浴中冷却。滤出褐色固体,用meoh洗涤。改变接收瓶,并且用水洗涤固体,得到纯净的3.2g灰白色产物。将水性洗液用etoac萃取,并且将这些萃取物与初始过滤所得的醇洗液合并。去除溶剂,产生1.3g橙色固体,从etoac中再结晶,产生更纯净的0.46g褐色针状产物。总产量:3.5g(80%)。
b.合成3,5-二溴咪唑并[1,2-f]啡啶:
将5-溴咪唑并[1,2-f]啡啶(2.0g,6.73mmol)溶解于dmf(125ml)中,然后在氮气下缓慢添加nbs(1.318g,7.40mmol)于10mldmf中的溶液。在室温下搅拌3小时、然后平缓加热16小时之后,将反应混合物分配于300ml水与etoac之间。进一步用etoac萃取水层,用水洗涤有机物,并且通过柱色谱法分离出1.99g浅黄色固体状产物(79%)。
c.合成5-溴-3-((氯甲基)二甲基矽烷基)咪唑并[1,2-f]啡啶:
将3,5-二溴咪唑并[1,2-f]啡啶(0.48g,1.28mmol)和氯(氯甲基)二甲基硅烷(0.17ml,1.28mmol)溶解于thf(25ml)中,并且在iproh/co2浴中冷却。缓慢添加丁基锂于己烷中的溶液(2.5m,0.51ml,1.28mmol),将混合物冷搅拌30分钟,然后使其升温到室温。添加盐水以淬灭反应,将有机物萃取到etoac中并且通过柱色谱法提纯,产生0.16g呈无色粘性残余物形式的产物(31%)。
d.合成4,4-二甲基-3,4-二氢-1,2a1-二氮杂-4-硅杂苯并[fg]乙烯合蒽和3,3-二甲基-3,4-二氢-1,2a1-二氮杂-3-硅杂苯并[fg]乙烯合蒽:
将5-溴-3-((氯甲基)二甲基硅烷基)咪唑并[1,2-f]啡啶(0.13g,0.322mmol)溶解于thf(25ml)中并且在冰浴中冷却。缓慢添加异丙基氯化镁于thf中的溶液(2.0m,0.18ml,0.36mmol),然后升温到室温。用盐水淬灭反应,用dcm萃取有机物,并且色谱分离混合物,产生16mg呈粘性残余物形式的4,4-二甲基-3,4-二氢-1,2a1-二氮杂-4-硅杂苯并[fg]乙烯合蒽(17%)和33mg呈结晶固体状的3,3-二甲基-3,4-二氢-1,2a1-二氮杂-3-硅杂苯并[fg]乙烯合蒽(36%)。
此外,此实例中所用的全部有机材料均通过高效液相色谱法(tosohtskgelods-100z)升华提纯并且分析,并且使用在254nm下具有99.9%或更高的吸收强度面积比的材料。
3,3-二甲基-3,4-二氢-1,2a1-二氮杂-3-硅杂苯并[fg]乙烯合蒽的x射线结构展示于图6中。3,3-二甲基-3,4-二氢-1,2a1-二氮杂-3-硅杂苯并[fg]乙烯合蒽的晶体结构可以通过下表中所列的一或多种特征定义。
ar1=σ||fo|-|fc||/σ|fo|;wr2=[σ[w(fo2-fc2)2]/σ[w(fo2)2]]1/2;gof=[σw(|fo|-|fc|)2/(n-m)]1/2
实例3:合成6-异丙基-10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的铂(ii)络合物:
流程3
a.合成2-溴-5-甲氧基苯甲腈:
将2-溴-5-甲氧基苯甲醛(100g,0.47mol,1当量)、羟胺盐酸盐(64.8g,0.93mol,2当量)、乙酸钠(76.42g,0.93mol,2当量)和冰乙酸(500ml)的混合物回流16小时。在减压下去除乙酸,并且用二氯甲烷(约400ml)萃取残余物。有机层用饱和盐水(3×200ml)洗涤,经硫酸钠干燥,并且在减压下浓缩。所得残余物用庚烷(50ml)湿磨,并且将固体用额外庚烷(2×50ml)洗涤,得到呈白色粉末状的所期望产物(82.6g,86%产率)。
b.合成5-甲氧基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊-2-基)苯甲腈:
2-溴-5-甲氧基苯甲腈(82.6g,0.39mol,1当量)、双(频哪醇根基)二硼(109.1g,0.43mol,1.1当量)和乙酸钾(115.3g,1.17mol,3当量)于1,4-二噁烷(400ml)和dmso(40ml)混合物中的混合物用氮气鼓泡1小时。添加pd(dppf)cl2(7.13g,5mol%),并且将反应混合物在60℃下平缓地加热2小时,然后回流16小时。通过硅藻土过滤混合物,并且用异丙醇和庚烷洗涤从滤液中分离出的固体,得到呈灰白色固体状的所期望产物(57.41g,57%产率)。从滤液中分离出额外产物(约10g)。
c.合成4-溴-2-异丙基-8-甲氧基啡啶-6-胺:
5-甲氧基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊-2-基)苯甲腈(57.41g,0.22mol,1当量)、2,6-二溴-4-异丙基苯胺(64.92g,0.22mol,1当量)和磷酸钾(153.1g,0.66mol,3当量)于甲苯与水的4:1混合物(1250ml)中的混合物用氮气鼓泡1小时。添加反-pd(pph3)2cl2(7.8g,11mmol,0.05当量),并且将反应混合物回流20小时。添加额外磷酸钾(77g,0.33mol,1.5当量)和反-pd(pph3)2cl2(1g,1.43mmol,0.0065当量),并且将反应混合物再回流3小时。分离各层,并且用热水(2×400ml)洗涤有机层。有机层经硫酸钠干燥并且在减压下浓缩。所得固体依序用二氯甲烷和庚烷湿磨。进行柱色谱法,得到所期望的产物(30g)。
d.合成6-异丙基-10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-3,4-二氢-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
将4-溴-2-异丙基-8-甲氧基啡啶-6-胺(8.9g,25.8mmol,1当量)、对甲苯磺酸单水合物(348mg)、新鲜制备的2-溴-4-氯丁醛(24g,129mmol,5当量)和异丙醇(500ml)的悬浮液在室温下搅拌2.5小时。添加碳酸钠(6.5g,77.4mmol,3当量)和去离子水(32ml),并且将反应混合物回流16小时。冷却到室温之后,将反应混合物体积在减压下减小到约100ml。混合物用乙酸乙酯(350ml)稀释并且用饱和盐水(200ml)洗涤。有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯粗产物,得到8.44g产物(76%产率)。
e.合成6-异丙基-10-甲氧基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪
6-异丙基-10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-3,4二氢-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(8.44g,19.6mmol,1.0当量)于无水thf(250ml)中的溶液用氮气鼓泡30分钟。在冷却到0℃之后,逐滴添加存在于thf中的2m异丙基氯化镁(14.7ml,29.4mmol,1.5当量)。使反应混合物升温达到室温并且搅拌16小时。用水(10ml)淬灭反应并且在减压下去除thf。残余物用乙酸乙酯(400ml)稀释并且用饱和盐水(2×200ml)洗涤。有机层经硫酸钠干燥并且通过柱色谱法提纯残余物,得到3.6g产物(58%产率)。
f.合成6-异丙基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇:
在-78℃下逐滴添加三溴化硼(5.4ml,56.78mmol,5当量)到6-异丙基-10-甲氧基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(3.6g,11.36mmol,1当量)于二氯甲烷(200ml)中的溶液中。使反应物升温达到室温并且搅拌16小时。将反应混合物小心地倾入300ml冰水中,并且过滤所得固体并且依序用水(70ml)、乙酸乙酯(40ml)和庚烷(40ml)洗涤,得到3.6g产物(定量产量)。
g.合成4'-溴-2-硝基-1,1'-联苯:
将碳酸钾(84g,608mmol,3.0当量)于水(450ml)中的溶液添加到2-碘-硝基苯(50g,200mmol,1.0当量)和4-溴苯硼酸(40.7g,202mol,1.0当量)于1,2-二甲氧基乙烷(660ml)中的混合物中。反应物用氮气鼓泡5.0分钟。添加四(三苯基膦)钯(0)(2.32g,2mmol,1mol%),并且混合物用氮气再鼓泡10分钟。回流16小时之后,将反应物冷却到室温并且分离各层。用乙酸乙酯(500ml)萃取水层。合并的有机萃取物用饱和盐水(500ml)洗涤,经硫酸钠干燥,过滤,并且在减压下浓缩。将残余物溶解于含25%乙酸乙酯的庚烷(300ml)中,并且通过硅胶垫(135g)真空过滤。用含25%乙酸乙酯的庚烷(3×350ml)冲洗垫。在减压下浓缩所合并的滤液,得到橙色固体。将此残余物悬浮于庚烷(150ml)中并且加热到40℃维持20分钟。使悬浮液冷却到室温维持1.0小时。通过真空过滤收集固体,用庚烷(50ml)洗涤并且干燥,得到呈黄色固体状的4'-溴-2-硝基-1,1'-联苯(49.16g,88.4%产率)。
h.合成2-溴-9h-咔唑:
经5分钟将三苯膦(156.3g,596mmol,2.5当量)添加到4'-溴-2-硝基-1,1'-联苯(66.25g,238mmol,1.0当量)于1,2-二氯苯(460ml)中的溶液中。反应物用氮气鼓泡5分钟,然后回流16小时。将反应物冷却到室温并且真空蒸馏以去除大部分1,2-二氯苯(450ml)。将此暗色残余物溶解于乙酸乙酯(1.5l)中,并且在50℃下用脱色碳(50g)处理30分钟。冷却之后,将混合物通过硅藻土(200g)过滤,然后用乙酸乙酯洗液(2×650ml)洗涤。将所合并的滤液在减压下浓缩到约500ml体积。将溶液冷却到室温,并且在1.5小时之后,通过过滤去除所得浅褐色固体(三苯基氧化膦)并且舍弃。在减压下浓缩滤液。将残余物溶解于甲醇(600ml)中并且在室温下储存16小时。过滤所得茶色固体,用甲醇(2×100ml)洗涤并且在真空下、在40℃下干燥,得到呈浅褐色固体状的2-溴-9h-咔唑(33.5g,57.2%产率)。
i.合成2-溴-9-(4-异丙基吡啶-2-基)-9h-咔唑:
2-溴-9h-咔唑(13.9g,56.5mmol,1当量)、4-异丙基-2-氯吡啶(15.86g,101.7mmol,1.8当量)、l-脯氨酸(1.3g,11.3mmol,0.2当量)、碘化铜(1)(0.95g,5.65mmol,0.1当量)、碳酸钾(19.48g,141.25mmol,2.5当量)和dmso(80ml)的悬浮液用氮气鼓泡5分钟。在95℃下加热混合物16小时。添加额外4-异丙基-2-氯吡啶(1.58g,10.12mmol,0.18当量),将反应混合物在155℃下再加热24小时。将反应混合物冷却到室温,用乙酸乙酯(750ml)稀释,并且通过硅藻土(70g)真空过滤。用乙酸乙酯洗液(2×100ml)洗涤硅藻土垫。合并的滤液用饱和盐水(3×500ml)洗涤,经硫酸钠干燥,过滤并且在减压下浓缩。通过柱色谱法提纯此残余物,得到1.8g棕色油状产物(8.6%产率)。
j.合成6-异丙基-10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
将6-异丙基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇(1.5g,4.93mmol,1当量)、2-溴-9-(4-异丙基吡啶-2-基)-9h-咔唑(1.8g,4.93mmol,1当量)、磷酸钾(5.68g,24.65mmol,5当量)、碘化铜(i)(0.47g,2.47mmol,0.5当量)、吡啶甲酸(1.52g,12.33mmol,2.5当量)和dmso(150ml)的混合物在150℃下加热4.5小时。冷却到室温之后,将反应混合物倾入水(700ml)中并且用乙酸乙酯(4×150ml)萃取。合并的有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯粗产物,得到1.25g褐色固体状产物(43%产量)。
k.合成6-异丙基-10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪的铂(ii)络合物:
将6-异丙基-10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(400mg,0.68mmol,1当量)溶解于60ml冰乙酸中并且用氮气鼓泡30分钟。然后添加k2ptcl4(283mg,0.68mmol,1当量),并且将反应混合物回流40小时。冷却到室温之后,过滤橙色沉淀物并且依序用水(3×15ml)和庚烷(10ml×2次)洗涤。将粗产物(340mg)溶解于10ml二氯甲烷中并且用额外二氯甲烷(10ml)洗脱、通过硅胶塞过滤以去除残余k2ptcl4。将滤液减少到其一半体积并且用庚烷(10ml)稀释。过滤产物并且用二氯甲烷于庚烷中的10%溶液(10ml)湿磨,得到淡黄色固体状产物(140mg,26%产率)。从乙酸和二氯甲烷/庚烷滤液中分离出额外产物。
实例4:合成(3-苯基-1h-吡唑)2ir(meoh)2(otf)
1-苯基-1h-吡唑
流程4
a.合成(3-苯基-1h-吡唑)2ircl2二聚体
将氯化铱水合物(6.00g,17.02mmol)和1-苯基-1h-吡唑(5.89g,40.9mmol)合并于2-乙氧基乙醇(120ml)和水(40ml)中。在氮气下将反应混合物加热到回流维持16小时。滤出所得固体并且用甲醇洗涤并且干燥,得到8.3g铱二聚体。
将实例4a的铱二聚体(8.3g,8.07mmol)溶解于100mldcm中,并且添加三氟甲磺酸银(4.36g,16.96mmol)于20ml甲醇中的溶液。在室温下、在氮气下搅拌反应混合物1小时。通过硅藻土过滤混合物,并且用dcm洗涤滤饼。蒸发滤液,产生10.85g(3-苯基-1h-吡唑)2ir(meoh)2(otf)(97%)。
实例5:根据流程5制备例示性化合物35。
流程5
a.合成咪唑并[1,2-f]啡啶
2-苯基-1h-咪唑(10.0g,69.3mmol,1当量)、1,2-二溴苯(19.63g,83.2mmol,1.2当量)、碳酸铯(67.79g,208.0mmol,3当量)、xantphos(4.01g,6.9mmol,0.1当量)和四(三苯基膦)钯(8.01g,6.9mmol,0.1当量)于dmf(550ml)中的混合物用氮气流鼓泡15分钟。将混合物在140℃下加热24小时,然后在减压下浓缩。残余物通过柱色谱法提纯,得到呈浅黄色固体状的咪唑并[1,2-f]啡啶(10g,67%产率)。
b.合成3-溴咪唑并[1,2-f]啡啶
在0℃下,将n-溴代丁二酰亚胺(1.62g,9.1mmol,1当量)添加到15(1.99g,9.1mmol,1当量)于dmf(32ml)中的溶液中。在室温下搅拌18小时之后,将反应物用水(300ml)稀释并且依序用含10%二氯甲烷的甲基叔丁基醚(3×500ml)、乙酸乙酯(2×300ml)和二氯甲烷(400ml)萃取。合并的有机层经硫酸钠干燥,过滤并且在减压下浓缩。通过柱色谱法提纯残余物,得到呈灰白色固体状的3-溴咪唑并[1,2-f]啡啶(1.66g,65%产率)。
c.合成2-(咪唑并[1,2-f]啡啶-3-基)乙酸叔丁酯
将二-μ-溴双(三-叔丁基膦)二钯(i)(2.01g,2.5mmol,0.05当量)添加到16(15.4g,51.8mmol,1当量)于无水四氢呋喃(220ml)中的溶液中,并且用氮气流将溶液鼓泡15分钟。在氮气下添加含0.5m2-叔丁氧基-2-氧代乙基溴化锌的乙醚(155ml,77.7mmol,1.5当量)。在60℃下搅拌反应物16小时。添加额外的0.5m2-叔丁氧基-2-氧代乙基氯化锌溶液(155ml,77.7mmol,1.5当量)和二-μ-溴双(三-叔丁基膦)-二钯(i)(2.01g,2.5mmol,0.05当量),并且在60℃下搅拌反应物,直到lc/ms分析指示其完成为止。在减压下浓缩反应混合物。将残余物溶解于二氯甲烷(1l)中并且通过硅藻土垫过滤。在减压下浓缩滤液。通过柱色谱法提纯残余物,得到橙色固体状2-(咪唑并[1,2-f]啡啶-3-基)乙酸叔丁酯(5g,30%产率)。
d.合成2-(咪唑并[1,2-f]啡啶-3-基)乙酸甲酯盐酸盐
将17(2.8g,8.4mmol,1当量)于含1.25mhcl的甲醇(55ml,68.7mmol,6.5当量)中的溶液在60℃下搅拌16小时。在减压下浓缩反应混合物。残余物用乙醚洗涤并且在40℃下、在真空下干燥16小时,得到呈灰白色固体状的2-(咪唑并[1,2-f]啡啶-3-基)乙酸甲酯盐酸盐(2.5g,100%产率)。
e.合成2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酸甲酯
在5℃下,将氢化钠于矿物油中的60%分散液(2.45g,61.2mmol,5当量)和碘甲烷(2ml,32.1mmol,2.6当量)依序添加到2-(咪唑并[1,2-f]啡啶-3-基)乙酸甲酯盐酸盐(4.0g,12.24mmol,1当量)于无水dmf(45ml)中的溶液中。将混合物在冷却浴中搅拌30分钟,升温到室温,并且搅拌6小时。添加额外碘甲烷(1.2ml,19.2mmol,1.6当量)。在室温下搅拌反应物一个周末,用甲醇(32ml)淬灭并且在减压下浓缩。残余油状物用二氯甲烷(350ml)稀释并且用水(100ml)洗涤。用二氯甲烷(2×100ml)萃取水层。合并的有机层用饱和氯化铵(100ml)洗涤,经硫酸钠干燥,过滤并且在减压下浓缩。通过柱色谱法提纯残余物,得到呈灰白色固体状的2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酸甲酯(1.6g,41%产率)。
f.合成2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酸
将2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酸甲酯(1.6g,5.0mmol,1当量)于甲醇(100ml)中的溶液用1n氢氧化钠水溶液(30ml,30mmol,6当量)处理并且进一步用水(100ml)稀释。回流5天之后,在减压下浓缩反应物。将残余物溶解于水(100ml)中并且用浓hcl酸化到ph5-6。所得白色悬浮液用异丙醇与二氯甲烷的1:2混合物(4×200ml)萃取。合并的有机层经硫酸钠干燥,过滤并且在减压下浓缩。残余物在高真空下、在40℃下干燥16小时,得到呈白色固体状的2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酸(1.3g,82%产率)。
g.合成2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酰氯
将亚硫酰氯(1ml,13.7mmol,2当量)和无水dmf(0.05ml,0.6mmol,0.11当量)添加到2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酸(1.3g,4.2mmol,1当量)于无水二氯甲烷(100ml)中的悬浮液中。在室温下搅拌16小时之后,在减压下浓缩混合物,得到呈灰白色固体状的2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酰氯(1.37g,100%产率)。
h.合成3,3-二甲基二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4(3h)-酮
将2-(咪唑并[1,2-f]啡啶-3-基)-2-甲基丙酰氯(1.37g,4.2mmol,1当量)和无水氯化铝(6.0g,44.9mmol,10当量)于无水二氯甲烷(60ml)中的混合物在室温下搅拌6小时。反应物用冰水浴冷却,用冰淬灭,用饱和碳酸氢钠(300ml)稀释并且用二氯甲烷(4×400ml)萃取。合并的有机层经硫酸钠干燥,过滤并且在减压下浓缩。使用柱色谱法提纯残余物,得到呈白色固体状的3,3-二甲基二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4(3h)-酮(1g,81%产率)。
i.合成3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-醇
在5℃下,将硼氢化钠(0.24g,6.3mmol,2当量)一次性添加到3,3-二甲基二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4(3h)-酮(0.9g,3.1mmol,1当量)于乙醇(70ml)中的溶液中。在室温下搅拌反应物1.5小时并且然后用丙酮(2ml)淬灭。在减压下浓缩反应混合物。将残余物溶解于甲基叔丁基醚(300ml)中,用饱和碳酸氢钠(2×60ml)和饱和盐水(60ml)洗涤。有机层经硫酸钠干燥,过滤并且在减压下浓缩。通过柱色谱法提纯粗产物,得到呈白色固体状的3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-醇(0.9g,100%产率)。
j.邻-(3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-基)二硫代碳酸s-甲酯
在0℃下,将氢化钠(0.48g,20.2mmol,5当量)于矿物油中的60%分散液添加到3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-醇(0.71g,2.46mmol,1当量)于无水thf(70ml)中的溶液中。在5℃下搅拌30分钟之后,添加咪唑(0.0168g,0.24mmol,0.1当量)于无水四氢呋喃(3.2ml)中的溶液,随后逐滴添加二硫化碳(0.89ml,14.8mmol,6当量)。经30分钟使反应物缓慢升温到12℃。逐滴添加碘甲烷(0.92ml,14.7mmol,6当量)(放热),并且在室温下搅拌反应物1小时。将反应混合物冷却到5℃,用饱和盐水(140ml)稀释并且用二氯甲烷(5×100ml)萃取。合并的有机层经硫酸钠干燥,过滤并且在减压下浓缩。通过柱色谱法提纯粗产物,得到呈白色固体状的邻-(3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-基)二硫代碳酸s-甲酯(0.86g,93%产率)。
k.合成3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪
将邻-(3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-4-基)二硫代碳酸s-甲酯(0.98g,2.6mmol,1当量)、2,2'-氮杂双(2-甲基丙腈)(0.098g,0.6mmol,0.2当量)和三丁基氢化锡(1.81ml,6.7mmol,2.6当量)于无水甲苯(70ml)中的溶液在80℃下搅拌3.5小时。冷却到室温之后,在35℃下、在减压下浓缩反应混合物并且吸附到硅胶(10g)上。通过柱色谱法提纯粗物质,得到呈白色固体状的3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.53g,72%产率)。
l.合成(3-氯丙基)(甲基)硫烷
将甲硫醇钠(6.14g,88mmol)溶解于150mletoh中,在冰浴中冷却,然后添加1-溴-3-氯丙烷(8.6ml,87mmol)。使溶液升温达到室温并且搅拌2小时。过滤所沉淀的固体,并且使滤液在真空下冷凝。在真空下蒸馏残余物,产生无色油状产物(36%)。
m.合成三-[(3-甲硫基)丙基]铱(iii)
通过将由(3-氯丙基)(甲基)硫烷和镁屑制成的格林纳(grignard)与ircl3(tht)3一起于thf中搅拌来合成(3-氯丙基)(甲基)硫烷,随后进行柱色谱法,产生白色固体(32%)。
n.合成化合物35
将得自实例5m的三-[(3-甲硫基)丙基]铱(iii)(0.020g,0.044mmol)和得自实例5k的3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.036g,0.131mmol)合并于乙二醇(0.5ml)中,通过真空/回填循环脱气,并且在回流下搅拌,变黄,然后变黑。将冷却的残余物分配于水与dcm之间,将有机物干燥并且涂布于硅藻土上。通过柱色谱法提纯,产生4mg呈米色固体状的化合物35(9%)。
实例6:化合物48的合成如流程6中进行。
流程6
将得自实例4的(3-苯基-1h-吡唑)2ir(meoh)2(otf)(0.031g,0.045mmol)和得自实例5k的3,3-二甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.024g,0.090mmol)合并于2-乙氧基乙醇(0.5ml)中,进行快速真空/回填三次,然后在回流下、在氮气下加热2小时。将反应混合物溶解于dcm中,涂布于硅藻土上,并且通过柱色谱法纯化,得到6mg呈近似无色残余物形式的化合物35(18%)。
实例7:化合物49的合成根据下述流程7进行。
a.合成1-甲基啡啶-6-胺:
2-溴-3-甲基苯胺(38.8g,208mmol,1当量)、(氯(2-二环己基膦-2',6'-二甲氧基-1,1'-联苯)[2-(2'-氨基-1,1'-联苯)]钯(ii)(2.99g,4.16mmol,0.02当量)、2-二环己基-膦-2',6'-二甲氧基联苯(1.71g,4.16mmol,0.02当量)于thf(832ml)中的混合物用氮气鼓泡15分钟。将(2-氰基苯基)溴化锌溶液(500ml,0.5m于thf中,250mmol,1.2当量)添加到混合物中,并且使反应物回流16小时。冷却到室温之后,将反应物用饱和盐水(10ml)稀释并且在减压下浓缩。将固体溶解于含10%甲醇的二氯甲烷(500ml)和24wt.%氢氧化钠水溶液(500ml)中。分离各层,并且用二氯甲烷(3×500ml)萃取水溶液。合并的有机层经硫酸钠干燥并且在减压下浓缩。将棕色固体依序用含25%mtbe的庚烷(1.5l)和二氯甲烷(5×25ml)湿磨,得到呈浅黄色固体状的26(10.7g,25%产率,>95%纯度)。
b.合成8-甲基咪唑并[1,2-f]啡啶:
使1-甲基啡啶-6-胺(10.7g,51mmol,1当量)、50wt%氯乙醛水溶液(16ml,102mmol,2当量)、碳酸钠(13.5g,128mmol,2.5当量)于异丙醇(340ml)中的混合物回流2小时。将反应物冷却到4℃并且用二氯甲烷(250ml)和饱和碳酸氢钠(500ml)稀释。分离各层,并且用二氯甲烷(3×250ml)萃取水层。所合并的有机层经硫酸钠干燥,并且在减压下浓缩,得到呈棕色固体状的粗8-甲基咪唑并[1,2-f]啡啶(23.8g),其随后使用。
c.合成3-溴-8-甲基咪唑并[1,2-f]啡啶:
将粗8-甲基咪唑并[1,2-f]啡啶(23.8g)、n-溴代丁二酰亚胺(9.1g,51mmol,1当量)于二氯甲烷(306ml)中的混合物在室温下搅拌2小时。添加水(500ml)并且分离各层。用二氯甲烷(3×500ml)萃取水溶液。合并的有机层经硫酸钠干燥并且在减压下浓缩。将固体预吸附到硅胶上并且通过柱色谱法提纯,得到呈淡棕色固体状的3-溴-8-甲基咪唑并[1,2-f]啡啶(12g,98%纯度)。
d.合成8-甲基-3-(2-甲基丙-1-烯-1-基)咪唑并[1,2-f]啡啶:
3-溴-8-甲基咪唑并[1,2-f]啡啶(12g,38.5mmol,1当量)、4,4,5,5-四甲基-2-(2-甲基丙-1-烯-1-基)-1,3,2-二氧杂硼杂环戊烷(10.5g,58mmol,1.5当量)和碳酸钾(16g,115.5mmol,3当量)于1,4-二噁烷与水的5:1混合物(185ml)中的混合物用氮气鼓泡15分钟。添加(氯(2-二环己基膦-2',6'-二甲氧基-1,1'-联苯)[2-(2'-氨基-1,1'-联苯)]钯(ii)(4.16g,5.78mmol,0.15当量)和2-二环己基膦-2',6'-二甲氧基联苯(2.38g,5.78mmol,0.15当量),并且使反应物回流36小时。冷却到室温之后,用水(200ml)稀释反应物。分离各层,并且用乙酸乙酯(3×200ml)萃取水溶液。合并的有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯粗固体,得到呈淡棕色固体状的8-甲基-3-(2-甲基丙-1-烯-1-基)咪唑并[1,2-f]啡啶(8.5g,70%产率,90%纯度)。
e.合成4,4,7-三甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
将8-甲基-3-(2-甲基丙-1-烯-1-基)咪唑并[1,2-f]啡啶(1.6g,5.69mmol,1当量)和无水氯化铝(3.8g,28.4mmol,5当量)于二氯甲烷(57ml)中的混合物在室温下搅拌16小时。在冰浴中冷却反应物并且逐滴添加水(10ml)。分离各层,并且用二氯甲烷(3×50ml)萃取水层。合并的有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯粗固体,得到呈淡黄色固体状的4,4,7-三甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(1.43g,88%产率,98%纯度)。
f.合成2-溴-4,4,7-三甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
将4,4,7-三甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(500mg,1.75mmol,1当量)和n-溴代丁二酰亚胺(311mg,1.75mmol,1当量)于二氯甲烷(11ml)中的混合物在室温下搅拌2小时。用水(20ml)和二氯甲烷(10ml)稀释反应物。分离各层,并且用二氯甲烷(3×20ml)萃取水溶液。合并的有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯残余物,得到呈淡棕色固体状的2-溴-4,4,7-三甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(575mg,90%产率,97%纯度)。
g.合成2,4,4,7-四甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
2-溴-4,4,7-三甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(265mg,0.73mmol,1当量)、三甲基硼氧杂环己烷(0.6ml,4.4mmol,6当量)和碳酸钾(608mg,4.4mmol,6当量)于1,4-二噁烷与水10:1混合物(7ml)中的混合物用氮气鼓泡15分钟。添加(氯(2-二环己基膦基-2',6'-二甲氧基-1,1'-联苯)[2-(2'-氨基-1,1'-联苯)]钯(ii)(108mg,0.15mmol,0.2当量)和2-二环己基膦基-2',6'-二甲氧基联苯(62mg,0.15mmol,0.2当量),并且使反应物回流16小时。冷却到室温之后,用水(10ml)和乙酸乙酯(10ml)稀释反应物。分离各层,并且用乙酸乙酯(3×20ml)萃取水溶液。合并的有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯残余物,得到呈浅黄色固体状的2,4,4,7-四甲基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(100mg,46%产率,95%纯度)。
h.合成化合物49:
按照与化合物35类似的方法合成化合物49,得到13mg黄色粉末(15%)。
实例8:根据下述流程8进行化合物50的合成。
流程8
a.合成1-氯啡啶-6-胺:
将3-氯-2-碘苯胺(8.77g,34.6mmol)、cyjohnphos(0.462g,1.319mmol)和pd(ch3cn)2cl2(0.171g,0.659mmol)的混合物溶解于二噁烷(80ml)中。通过注射器依序添加三乙胺(13.78ml,99mmol)和4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(10.04ml,69.2mmol)到溶液中。使反应物回流4小时。将反应物冷却到室温,并且向反应混合物中添加2-溴苯甲腈(6g,33.0mmol)、s-phospdg2(0.475g,0.659mmol)、s-phos(0.271g,0.659mmol)和碳酸钾(9.11g,65.9mmol)的固体混合物,随后添加二噁烷(20ml)和水(20ml),并且将反应物加热到85℃维持16小时。用dcm萃取粗产物并且降低真空度,产生橙色油状物。将其溶解于thf(80ml)中,并且在0℃下添加氢化钠(1.978g,49.4mmol)并且搅拌20分钟。反应物用盐水淬灭并且用dcm萃取。蒸发反应混合物,随后用乙醚湿磨,得到呈灰白色固体状的1-氯啡啶-6-胺(52%产率)。
b.合成8-氯咪唑并[1,2-f]啡啶:
将1-氯啡啶-6-胺(864mg,3.78mmol)、2-氯乙醛(50wt%水溶液,1.02ml,7.56mmol)和碳酸氢钠(635mg,7.56mmol)合并于iproh中并且回流1小时。将混合物冷却到室温并且倾入水中并且过滤(99%产率)。
c.合成8-苯基咪唑并[1,2-f]啡啶:
将8-氯咪唑并[1,2-f]啡啶(955mg,3.78mmol)、苯基硼酸(829mg,6.80mmol)、s-phospdg2(109mg,0.151mmol)、s-phos(62.1mg,0.151mmol)和碳酸钾(522mg,3.78mmol)的混合物抽真空并且用氮气回填若干次。添加二噁烷(20ml)和水(4ml)并且回流1小时。粗产物用dcm和盐水萃取并且通过柱色谱法提纯,产生产物(99%产率)。
d.合成3-溴-8-苯基咪唑并[1,2-f]啡啶:
将8-苯基咪唑并[1,2-f]啡啶(1.15mg,3.91mmol)和nbs(0.765g,4.30mmol)合并于dmf中,并且在室温下搅拌30分钟,随后用水淬灭。过滤所得固体并且真空干燥,得到75%产率的3-溴-8-苯基咪唑并[1,2-f]啡啶。
e.合成3-(2-甲基丙-1-烯-1-基)-8-苯基咪唑并[1,2-f]啡啶:
将3-溴-8-苯基咪唑并[1,2-f]啡啶(980mg,2.63mmol)、sphospdg2(76mg,0.105mmol)、sphos(43.1mg,0.105mmol)和碳酸钾(363mg,2.63mmol)的混合物抽真空并且用氮气回填若干次。添加甲苯(15ml)、水(3ml)和4,4,5,5-四甲基-2-(2-甲基丙-1-烯-1-基)-1,3,2-二氧杂硼杂环戊烷(1.077ml,5.25mmol)并且在回流下加热16小时。用dcm和盐水萃取产物并且通过柱色谱法提纯,得到20%产率的3-(2-甲基丙-1-烯-1-基)-8-苯基咪唑并[1,2-f]啡啶。
f.合成4,4-二甲基-7-苯基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
将3-(2-甲基丙-1-烯-1-基)-8-苯基咪唑并[1,2-f]啡啶(160mg,0.459mmol)溶解于dcm(10ml)中,并且添加三氯化铝(184mg,1.378mmol)。在室温下搅拌反应物40分钟。混合物用koh(aq)/盐水淬灭并且用dcm萃取若干次。通过柱色谱法提纯产物,得到63%产率的4,4-二甲基-7-苯基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪。
g.合成化合物50:
将得自实例4的(3-苯基-1h-吡唑)2ir(meoh)2(otf)(0.03g,0.043mmol)和4,4-二甲基-7-苯基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.030g,0.087mmol)合并于2-乙氧基乙醇(0.5ml)中,快速抽真空/用氮气回填三次,然后在回流下、在氮气下加热2小时。通过柱色谱法提纯产物,得到56%产率的化合物50。
实例9:根据下述流程8进行化合物108的合成。
流程9
a.合成(4-((三异丙基硅烷基)氧基)苯基)胺基甲酸叔丁酯:
将三异丙基氯硅烷(32ml,0.15mol,1.2当量)和三乙胺(21ml,0.15mol,1.2当量)依序添加到(4-羟苯基)氨基甲酸叔丁酯(26.1g,0.125mol,1当量)于thf(200ml)中的溶液中。在室温下搅拌反应混合物16小时。过滤反应物并且用thf(2×30ml)洗涤固体。在减压下浓缩所合并的滤液。通过柱色谱法提纯粗产物,得到呈黄色油状的(4-((三异丙基硅烷基)氧基)苯基)氨基甲酸叔丁酯(39.66g,87%产率)。
b.合成4-((三异丙基硅烷基)氧基)苯胺:
在室温下将三氟乙酸(41.51ml,0.54mol,5当量)添加到(4-((三异丙基硅烷基)氧基)苯基)氨基甲酸叔丁酯(39.66g,0.1085mol,1当量)于二氯甲烷(400ml)中的溶液中。搅拌16小时之后,在减压下去除溶剂。使残余物与甲苯(3×50ml)共沸。在二氧化硅上提纯粗产物,得到4-((三异丙基硅烷基)氧基)苯胺(25g,87%产率)。
c.合成2,6-二溴-4-((三异丙基硅烷基)氧基)苯胺:
在0℃下,将溴(8.2ml,0.16mol,2.5当量)逐滴添加到4-((三异丙基硅烷基)氧基)苯胺(17g,64.4mmol,1当量)于二氯甲烷和甲醇1:1混合物(60ml)中的溶液中。使反应混合物升温达到室温并且搅拌16小时。反应混合物用二氯甲烷(200ml)稀释并且依序用1mnaoh(2×100ml)和饱和盐水(2×100ml)洗涤。有机层经硫酸钠干燥并且在减压下浓缩,得到呈棕色油状的2,6-二溴-4-((三异丙基硅烷基)氧基)苯胺(26.37g,97%产率),其随后使用。
d.合成4-溴-8-甲氧基-2-((三异丙基硅烷基)氧基)啡啶-6-胺:
5-甲氧基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊-2-基)苯甲腈(16.14g,62.3mmol,1当量)、51(26.37g,62.3mmol,1当量)和磷酸钾(43.04g,0.187mol,3当量)于甲苯和水4:1混合物(500ml)中的混合物用氮气鼓泡1小时。添加反-pd(pph3)2cl2(2.8g,3.11mmol,0.05当量),并且将反应混合物回流20小时。添加额外5-甲氧基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊-2-基)苯甲腈(2.2g,8.5mmol,0.14当量)和反式pd(pph3)2cl2(0.3g,0.43mmol,0.0069当量),并且使反应混合物再回流4小时。分离各层,并且用热水(2×200ml)洗涤有机层。有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯残余物,得到20%产率的4-溴-8-甲氧基-2-((三异丙基硅烷基)氧基)啡啶-6-胺。
e.合成5-溴-3-(2-氯乙基)-11-甲氧基-7-((三异丙基硅烷基)氧基)咪唑并[1,2-f]啡啶:
将4-溴-8-甲氧基-2-((三异丙基硅烷基)氧基)啡啶-6-胺(5.95g,12.53mmol,1当量)、对甲苯磺酸单水合物(175mg)和新鲜制备的2(6.67g,62.63mmol,5当量)于异丙醇(500ml)中的悬浮液在室温下搅拌2小时。添加碳酸钠(3.25g,37.6mmol,3当量)和去离子水(12ml),并且将反应混合物回流16小时。冷却到室温之后,将反应混合物体积在减压下减小到约60ml。混合物用乙酸乙酯(300ml)稀释并且用饱和盐水(200ml)洗涤。有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯粗产物,得到5-溴-3-(2-氯乙基)-11-甲氧基-7-((三异丙基硅烷基)氧基)咪唑并[1,2-f]啡啶(5.53g,79%产率)。
f.合成10-甲氧基-6-((三异丙基硅烷基)氧基)-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
5-溴-3-(2-氯乙基)-11-甲氧基-7-((三异丙基硅烷基)氧基)咪唑并[1,2-f]啡啶(5.53g,9.84mmol,1.0当量)于无水thf(300ml)中的溶液用氮气鼓泡30分钟。冷却到0℃之后,通过注射器逐滴添加含有2m异丙基氯化镁的thf(7.4ml,14.76mmol,1.5当量)。使反应混合物升温达到室温并且搅拌16小时。用水(10ml)淬灭反应并且在减压下去除thf。用二氯甲烷(500ml)萃取残余物。有机层用水(2×200ml)洗涤,经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯粗产物,得到10-甲氧基-6-((三异丙基硅烷基)氧基)-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(3g,68%产率)。
g.合成10-甲氧基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-醇:
将含有四丁基氟化铵三水合物的thf(30ml)逐滴添加到10-甲氧基-6-((三异丙基硅烷基)氧基)-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(3g,6.72mmol,1当量)于thf(100ml)中的溶液中。在室温下搅拌16小时之后,在减压下去除溶剂,并且用二氯甲烷(80ml)萃取残余物。用饱和盐水(2×100ml)洗涤有机层。用饱和盐水洗涤后,有机层中开始形成大量沉淀物。过滤沉淀物并且用庚烷(2×10ml)洗涤,得到纯10-甲氧基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-醇(1.83g,94%产率)。
h.合成三氟甲烷磺酸10-甲氧基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-基酯:
在0℃下,向三氟乙酸酐(1.14ml,6.77mmol,1.1当量)和吡啶(0.744ml,9.24mmol,1.5当量)依序添加到10-甲氧基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-醇(1.79g,6.16mmol,1当量)于二氯甲烷(100ml)中的混合物中。搅拌15分钟之后,使反应物升温到室温并且搅拌6小时。反应混合物用二氯甲烷(200ml)稀释并且用水(3×100ml)洗涤。有机层经硫酸钠干燥并且在减压下去除溶剂。残余物用庚烷和二氯甲烷10:1混合物(10ml)湿磨,得到三氟甲烷磺酸10-甲氧基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-基酯(2.17g,83%产率)。
i.合成10-甲氧基-6-苯基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
三氟甲磺酸10-甲氧基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-6-基酯(0.65g,1.54mmol,1当量)、苯基硼酸(0.188g,1.54mmol,1当量)和磷酸钾(1.06g,4.62mmol,3当量)于甲苯:1,4-二噁烷:水的3:1:1混合物(500ml)中的混合物用氮气鼓泡1小时。添加反-pd(pph3)2cl2(54mg,0.077mmol,0.05当量),并且使反应混合物回流16小时。用二氯甲烷(200ml)稀释反应混合物。将有机层用温水(2×100ml)洗涤,经硫酸钠干燥,并且在减压下浓缩,得到10-甲氧基-6-苯基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.527g,97%产率)。
j.合成6-苯基-3,4-二氢二苯并[b,ij]咪唑并2,1,5-de]喹嗪-10-醇:
在-78℃下,将含有1m三溴化硼的二氯甲烷(7.5ml,7.5mmol,5当量)逐滴添加到10-甲氧基-6-苯基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.527g,1.5mmol,1当量)于二氯甲烷(100ml)中的溶液中。使反应物升温达到室温并且搅拌16小时。将反应混合物小心地倾入冰水(150ml)中,并且过滤所得固体并且依序用水(30ml)和庚烷(10ml)洗涤,得到6-苯基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇(0.47g,93%产率)。
k.合成10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-6-苯基-3,4-二氢-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪:
将2-溴-9-(4-异丙基吡啶-2-基)-9h-咔唑(0.528g,1.446mmol,1当量)、6-苯基-3,4-二氢二苯并[b,ij]咪唑并[2,1,5-de]喹嗪-10-醇(0.486g,1.446mmol,1当量)、磷酸钾(1.67g,7.23mmol,5当量)、碘化铜(i)(0.138g,0.723mmol,0.5当量)和吡啶甲酸(0.445g,3.62mmol,2.5当量)于dmso(50ml)中的混合物在150℃下加热4.5小时。冷却到室温之后,将反应混合物倾入水(300ml)中并且用乙酸乙酯(4×100ml)萃取。合并的有机层经硫酸钠干燥并且在减压下浓缩。通过柱色谱法提纯粗产物,得到呈褐色固体状的10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-6-苯基-3,4-二氢-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(0.55g,61%产率)。
l.合成化合物108:
10-((9-(4-异丙基吡啶-2-基)-9h-咔唑-2-基)氧基)-6-苯基-3,4-二氢-二苯并[b,ij]咪唑并[2,1,5-de]喹嗪(350mg,0.564mmol,1当量)于冰乙酸(60ml)中的溶液用氩气鼓泡40分钟。添加k2ptcl4(234mg,0.564mmol,1当量),并且使反应混合物回流16小时。冷却到室温之后,过滤黄绿色沉淀物,并且依序用水(4×15ml)和庚烷(2×10ml)洗涤并且在真空下、在20℃下干燥18小时。将粗产物溶解于二氯甲烷(500ml)中并且通过硅胶塞(10g)以去除残余k2ptcl4。在减压下去除溶剂。残余物用二氯甲烷和庚烷1:1混合物(20ml)湿磨,过滤并且用二氯甲烷(2×3ml)洗涤,得到化合物108(40mg,产率:8.7%产率,83.2%)。
讨论:下文展示金属配位的咪唑并啡啶配体的一个实施例的通用结构。计算研究中所关注的键是四种碳-氮(c-n)单键。对于具有三个c-n单键的氮来说,其标记为c-n1、c-n2、c-nph,且对于与金属配位的氮来说,其标记为c-nm。
在gaussian09软件包中使用b3lyp杂化泛函与cep-31g有效核势基组对所有络合物和配体进行几何优化。除非另外陈述,否则在结果和讨论中所有结果都使用此方法。
通过使一键断裂而在咪唑并啡啶配体上形成双自由基物质来计算键强度。键断裂的双自由基物质是按照三重态计算,原因是其能量通常低于双自由基单态并且因此在键断裂事件中形成可能更多的产物。在b3lyp/6-31g(d)水平下进行计算,并且根据基态单态→键断裂的三重态和最低能量三重态(激发态)→键断裂的三重态报告热力学。
最低三重激发态(t1)的td-dft计算值还在b3lyp/cep-31g理论水平下执行,但包括使用thf作为溶剂的cpcm连续区溶剂场,其已经展示更好地匹配实验结果。
对以下化合物执行键强度计算。
所计算的键强度展示于表1中。
表1:
表1展示了一系列比较实例和本发明化合物1的键强度计算值。在同一单元格中见到两个数值的情况下,顶部数值表示激发态三重态→键断裂的三重态之间的热力学差值。下面的数值表示基态单态→键断裂的三重态。如果单元格中仅存在一个数值,那么其表示三重态→三重态键强度(t→t)。对于所有比较化合物1-4来说,c-n1键展示为最弱的键。发现激发三重态下的键强度比基态单态弱。这是因为具有激发态能量的络合物可用作通常更高能量键断裂状态的起点。在一些情况下,如比较化合物2和3所示,键断裂状态的能量比初始三重态低。因此,键断裂事件可以视为热力学上有利的或放热的。发现当芳基取代添加于c-n1键碳原子时,键强度降低,如将比较化合物1与比较化合物2和3比较所见。这种效应可能是因为自由基物质在键断裂位点处出现共振稳定化,所述键断裂位点通过芳基取代而稳定化。
弱c-n1键的稳定化可以通过连接取代来实现,所述连接取代使c-n1碳连接到相邻稠合芳基环上的碳,如式(1a)中的“a”所描绘。这种连接基团优选包含如下元素,其提供正确结构几何构型以形成跨越啡啶环系统的两个碳的桥,从而提供使c-n1键稳定化所必需的刚度,同时不降低所得配体和络合物的三重态能量。
稳定化连接基团对本发明化合物1的作用展示于表1中。在此,三重态c-n1键强度已经从类似比较化合物1的11.81kcal/mol大大提高到本发明化合物的35.38kcal/mol,热力学键强度出现>20kcal/mol的增加。两碳连接取代基阻止配体能够获得cn1键断裂状态的适当松弛几何构型。重要的是,三重态能量不受此取代影响,因为本发明化合物1和比较化合物1根据计算均具有468nm的相同三重态能量。
比较实例1的最小化非断键和断键几何构型展示于图3a和3b中。可以看出,断键几何构型使咪唑并啡啶配体的稠合环系统的环应力松弛。如本发明化合物1所示,系链取代抑制松弛的断键几何构型,从而增加c-n1键的热力学键强度。
c-n1键弱的其它实验证据是通过基质辅助激光解吸电离质谱(maldi-ms)展示。maldi-ms可以用于探测分子在激发态下的键弱处。人们相信,作为光化学稳定性的量度,maldi-ms能够模拟oled装置内所发现的一些条件,其中带电荷状态和激发态均存在。图3展示了以负模式进行的比较化合物3的maldi-ms。在1529amu下鉴别出母体离子的峰。然而,在1275amu下发现最高强度峰。此质量对应于比较化合物3的片段,其中咪唑环已经失去两个碳的质量和联三苯取代。所提出片段的结构展示于图3中。同位素模式证实此片段含有铱并且与所提出片段的化学式一致。如图4中所示,在1083amu下鉴别出配体损失的其它片段且在1020amu下鉴别出两种配体的咪唑环分解。数据表明,主要片段的形成需要c-n1键断裂,所述键根据计算预测为弱键。
本发明化合物的光物理特性
本发明化合物的所测量光物理特性报告于下表2中。在77k下和在室温下,在2-甲基四氢呋喃溶剂中,在高稀释浓度下测量络合物。使用配备有氙气灯、积分球和型号c10027光子多通道分析仪的hamamatsuc9920系统,在1wt%聚甲基丙烯酸甲酯(pmma)固态基质或0.4wt%聚苯乙烯(ps)固态基质中测量光致发光量子效率(plqy,φpl)。通过时间相关单光子计数法,使用与ibh数据站中心集成的horibajobinyvonfluorolog-3,使用335nm纳米led作为激发源,进行pl瞬态测量(τ)。
表2:
化合物35经测量具有深蓝色发射,在77k下的最高能量峰是451nm,然而,络合物的plqy仅为5%。化合物49展现对配体的修饰如何可以用于改进plqy。咪唑环上的甲基取代已经发现可提高非乙基桥连啡啶咪唑类似物的plqy。另外,外部苯环上的甲基取代根据计算表明可影响配体咬角,这是因为相邻芳基环上的甲基取代基和质子具有空间影响。这种空间效应使得啡啶咪唑多环环系统的几何构型更接近非桥连配体的几何构型,其中配位位点可以更紧密地连接到金属。配体几何构型的此细微变化使得金属与中性配位氮之间的相互作用更强,从而提高金属-氮键强度。人们相信,更强的金属-氮键强度可以通过减小金属-氮键断裂非辐射衰减来提高络合物的辐射率。因此,两个甲基取代可能引起化合物49的plqy增强(与化合物35相比)。经测量,化合物49在pmma基质中具有62%的plqy,这极接近非桥连类似物(比较化合物6)的plqy值,所述比较化合物经测量具有68%的plqy。另外,与化合物35的5.1微秒的激发态寿命相比,化合物49经测量在77k下具有2.9微秒的短得多的激发态寿命。这进一步表明,甲基取代基改进化合物49的辐射特性。
具有苯基吡唑配体(ppz)的杂配实例化合物48和化合物50经测量具有深蓝色发射,但plqy低。然而,非桥连参考化合物(比较化合物8)经测量也具有14%的低plqy。人们相信,低效率可能是因为吡唑配体的金属-氮键弱。为了进一步证明此假设,在文献中已经表明三ir(ppz)3在室温溶液中是非发射的,但在77k下是高度发射的。室温下的非发射性归因于金属氮键弱。
还发现具有桥连啡啶咪唑配体的铂络合物以深蓝色高度发射。化合物105和比较化合物7经测量在光学惰性聚苯乙烯基质中分别具有85%和87%的高plqy值。铂络合物可以不需要配体修饰来提高plqy,如关于铱类似物化合物49所述,这是因为铂-氮键强度相对强于铱。
所属领域的技术人员应了解,可以对上文所示和所述的例示性实施例进行变更而这些变更不背离其广泛的发明构思。因此,应理解本发明不限于所示和所述的例示性实施例,而是希望涵盖由权利要求书限定的本发明精神和范围内的修饰。举例来说,例示性实施例的具体特征可以是或可以不是所要求的发明的一部分并且可以将所公开的实施例的特征组合。除非本文具体阐述,否则术语“一个(a/an)”和“所述”不限于一个元件,而是应解释为意指“至少一个”。
应理解,本发明的至少一些图式和描述已经简化以集中于与清除了解本发明相关的元件,同时为了清楚起见,去除了所属领域普通技术人员将了解也可以构成本发明一部分的其它元件。然而,因为这些元件在所属领域中是众所周知的并且因为它们不一定有助于更好地了解本发明,所以本文中未提供这些元件的描述。
另外,就本发明的任何方法不依赖于本文所述步骤的特定次序来说,特定步骤次序不应解释为对权利要求书的限制。涉及此类方法的权利要求不应限于其步骤按照所写次序执行,并且所属领域的技术人员可以容易了解,步骤可以变化并且仍属于本发明的精神和范围内。
本文中所引用的所有参考文献,包括公开、专利申请及专利,都以引用的方式特此并入本文中,其引用程度就如同每个参考文献个别地并且特定地指示以引用的方式并入且在本文中整体阐述一般。
- 还没有人留言评论。精彩留言会获得点赞!