碱性磷酸酶去磷酸化的方法与流程
本发明涉及生物技术领域。更具体地说,本发明涉及一种碱性磷酸酶去磷酸化的方法。
背景技术:
蛋白质磷酸化修饰是最为普遍且重要的一种蛋白质翻译后修饰方式,其反应可逆,经磷酸酶催化发生去磷酸化反应。碱性磷酸酶是普遍存在的一种磷酸酶,可对底物分子起到去磷酸化作用,在医学、免疫学、生物化学和分子生物学等领域应用广泛。碱性磷酸酶作为一种非特异性酶,以同源二聚体形式存在于动物肌肉中,在进行凝胶电泳时会解聚成分子量约为65kda左右的亚基分子。已有研究表明碱性磷酸酶调控宰后肉中蛋白质的磷酸化水平,当宰后肉中蛋白质发生去磷酸化修饰后,可以正向调控肉嫩度、色泽、保水性等品质。普遍认为,碱性磷酸酶可以催化蛋白质发生去磷酸化反应,降低蛋白质磷酸化水平,但碱性磷酸酶自身发生磷酸化/去磷酸化的现象尚未被关注。本发明旨在建立了一种碱性磷酸酶催化自身发生去磷酸化的方法,调控碱性磷酸酶磷酸化水平,为进一步改善肉食用品质提供方法支撑。
技术实现要素:
本发明的一个目的是解决至少上述问题,并提供至少后面将说明的优点。
本发明还有一个目的是提供碱性磷酸酶去磷酸化的方法,在改善肉食用品质上提供更多思路。
为了实现根据本发明的这些目的和其它优点,提供了一种碱性磷酸酶去磷酸化的方法,包括:
步骤一、配制碱性磷酸酶离体模型的缓冲溶液,所述缓冲溶液包括按摩尔份计的如下成分:二硫苏糖醇1份、氯化镁8~12份、三羟甲基氨基甲烷40~60份、5’-三磷酸腺苷二钠盐水合物atp80~120份以及氯化钾300~500份,其中atp预先调节其ph为6.8~7.2;atp溶液的初始ph约为2.5~3.5,ph较低,易对碱性磷酸酶活性产生负面影响,在使用时,预先调节其ph趋于中性。
步骤二、将碱性磷酸酶加入到步骤一中的缓冲溶液中,得到碱性磷酸酶的离体模型,向碱性磷酸酶的离体模型中加入肌原纤维蛋白得混合溶液;所述肌原纤维蛋白是从宰后畜禽肌肉中提取的,在提取冷冻肉中的肌原纤维蛋白时,肉样应置于冰上,在10~20min内开始提取肌原纤维蛋白,避免因冷冻肉解冻时间过长,肌原纤维蛋白发生降解,影响试验结果的准确性;提取后肌原纤维蛋白需用1.0%tritonx-100进行除杂,除杂条件为2000×g,4℃,离心10~15min,2~3次,除杂可以避免肌原纤维蛋白中混入肌浆蛋白,肌浆蛋白中包含碱性磷酸酶等多种酶,影响试验结果的准确性。
步骤三、将步骤二所得混合溶液进行孵育,孵育ph为5.0~10,孵育温度为0~30℃,孵育时间至少为10min;热鲜肉一般室温销售时的温度约为25℃,宰后肉分割加工车间温度为15℃左右,冷链运输及销售时温度约为4℃,因此0~30℃更接近宰后肉的贮藏温度,此处选0~30℃为孵育温度。
优选的是,步骤一所述缓冲溶液包括摩尔份计的如下成分:二硫苏糖醇1份、氯化镁10份、三羟甲基氨基甲烷50份、atp100份以及氯化钾400份。
优选的是,步骤二中肌原纤维蛋白量与碱性磷酸酶的比例为100μg肌原纤维蛋白:
15~30u碱性磷酸酶。
优选的是,步骤三中孵育ph值为5.2~6.4,以羊为例,羊在屠宰后45min内ph会下降到6.4左右,随着贮藏时间延长所达到的ph极限约为5.2,因此ph在5.2~6.4更接近宰后肉在实际贮藏过程中的ph变化。
优选的是,步骤三中孵育ph为6.4,孵育温度为25℃。
优选的是,步骤三中孵育操作在恒温金属浴中进行,振荡速率为900~1200r/min。
本发明至少包括以下有益效果:本发明通过建立离体模型,提供了一种碱性磷酸酶去磷酸化的方法,该方法过程简单,重复性好,检测所得条带清晰,效果明显;本发明提供的方法对人体的潜在伤害小,是一种高效的可以实现碱性磷酸酶去磷酸化的方法;依据本发明提供的方法可以为改善宰后肉品质提供新的思路和理论依据。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
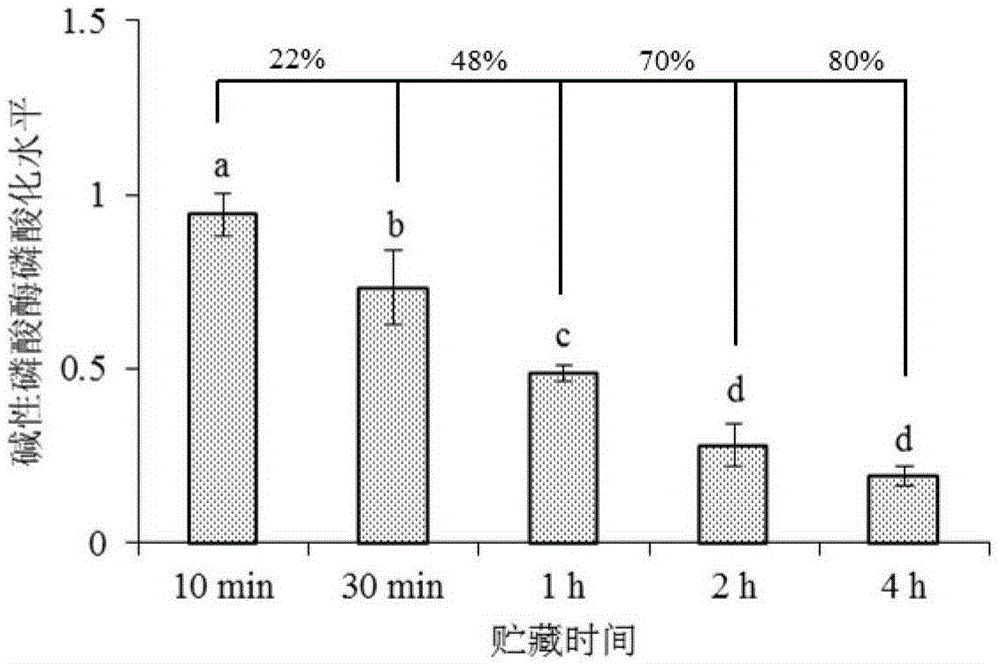
图1为本发明实施例1中碱性磷酸酶磷酸化水平变化;
图2为本发明实施例2中碱性磷酸酶磷酸化水平变化;
图3为本发明实施例3中碱性磷酸酶磷酸化水平变化;
图4为本发明实施例4中碱性磷酸酶磷酸化水平变化;
图5为本发明实施例5中碱性磷酸酶磷酸化水平变化;
图6为本发明实施例6中碱性磷酸酶磷酸化水平变化;
图7为本发明实施例7中碱性磷酸酶磷酸化水平变化;
图8为本发明实施例8中碱性磷酸酶磷酸化水平变化。
具体实施方式
下面结合具体实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
实施例1
a)建立含有碱性磷酸酶的离体模型,离体模型中溶液体系包括:0.4m氯化钾、50mm三羟甲基氨基甲烷、1.0mm二硫苏糖醇、10mm氯化镁、100mmatp;
b)提取宰后畜禽肌肉中的肌原纤维蛋白,调蛋白浓度至8μg/μl,并添加0.5ml到a)中所建立的离体模型。在25℃、ph为6.4的条件下孵育0~4h,振荡速率为900r/min;
c)孵育10min、30min、1h、2h、4h后进行取样,-80℃保存备用。
实施例2
a)建立含有碱性磷酸酶的离体模型,离体模型中溶液体系包括:0.4m氯化钾、50mm三羟甲基氨基甲烷、1.0mm二硫苏糖醇、10mm氯化镁、100mmatp;
b)提取宰后畜禽肌肉中的肌原纤维蛋白,调蛋白浓度至8μg/μl,并添加0.5ml到a)中所建立的离体模型。在4℃、ph为6.4的条件下孵育0~48h,振荡速率为900r/min;
c)孵育30min、4h、12h、24h、48h后进行取样,-80℃保存备用。
实施例3
a)建立含有碱性磷酸酶的离体模型,离体模型中溶液体系包括:0.4m氯化钾、50mm三羟甲基氨基甲烷、1.0mm二硫苏糖醇、10mm氯化镁、100mmatp;
b)提取宰后畜禽肌肉中的肌原纤维蛋白,调蛋白浓度至8μg/μl,并添加0.5ml到a)中所建立的离体模型。在25℃、ph为5.2的条件下孵育0~4h,振荡速率为900r/min;
c)孵育10min、30min、1h、2h、4h后进行取样,-80℃保存备用。
实施例4
a)建立含有碱性磷酸酶的离体模型,离体模型中溶液体系包括:0.4m氯化钾、50mm三羟甲基氨基甲烷、1.0mm二硫苏糖醇、10mm氯化镁、100mmatp;
b)不添加肌原纤维蛋白,在25℃、ph为6.4的条件下孵育0~4h,振荡速率为900r/min;
c)孵育10min、30min、1h、2h、4h后进行取样,-80℃保存备用。
实施例5
a)建立含有碱性磷酸酶的离体模型,离体模型中溶液体系包括:50mm三羟甲基氨基甲烷、1.0mm二硫苏糖醇、10mm氯化镁;
b)在25℃、ph为6.4的条件下孵育0~4h,振荡速率为900r/min;
c)孵育10min、30min、1h、2h、4h后进行取样,-80℃保存备用。
实施例6
a)建立含有碱性磷酸酶的离体模型,离体模型中溶液体系包括:0.3m氯化钾、40mm三羟甲基氨基甲烷、1.0mm二硫苏糖醇、8mm氯化镁、80mmatp;
b)提取宰后畜禽肌肉中的肌原纤维蛋白,调蛋白浓度至8μg/μl,并添加0.5ml到a)中所建立的离体模型。在30℃、ph为10的条件下孵育0~4h,振荡速率为1000r/min;
c)孵育10min、30min、1h、2h、4h后进行取样,-80℃保存备用。
实施例7
a)建立含有碱性磷酸酶的离体模型,离体模型中溶液体系包括:0.5m氯化钾、60mm三羟甲基氨基甲烷、1.0mm二硫苏糖醇、12mm氯化镁、120mmatp;
b)提取宰后畜禽肌肉中的肌原纤维蛋白,调蛋白浓度至8μg/μl,并添加0.5ml到a)中所建立的离体模型。在0℃、ph为5.0的条件下孵育0~4h,振荡速率为1200r/min;
c)孵育10min、30min、1h、2h、4h后进行取样,-80℃保存备用。
实施例8
a)建立含有碱性磷酸酶的离体模型,离体模型中溶液体系包括:0.4m氯化钾、50mm三羟甲基氨基甲烷、1.0mm二硫苏糖醇、10mm氯化镁、100mmatp;
b)提取宰后畜禽肌肉中的肌原纤维蛋白,调蛋白浓度至8μg/μl,并添加0.5ml到a)中所建立的离体模型。在15℃、ph为7.2的条件下孵育0~4h,振荡速率为900r/min;
c)孵育10min、30min、1h、2h、4h后进行取样,-80℃保存备用。
对实施例1~8的磷酸化水平测定:
采用荧光试剂染色和bio-rad单向电泳系统进行蛋白质磷酸化水平测定。
(1)分别取实施例1~8各时间点保存的样品溶液,采用bca法测定蛋白浓度;
(2)将1体积的样品溶液与2倍体积的上样缓冲液(100mmtris-hcl,ph6.8,40g/lsds,1g/l溴酚蓝,250g/l甘油)混合,沸水浴中煮沸5min,冷却后12000×g离心2~5min,上清液即为电泳上样样品;
(3)采用4%浓缩胶和12%分离胶进行sds-page电泳,设置初始电压70v,当溴酚蓝进入分离胶后调至电压到110v,待溴酚蓝跑出分离胶后关闭电源;
(4)电泳结束后,卸下凝胶进行pro-qdiamond磷酸化蛋白染色和syproruby全蛋白染色,并用chemidoctmmp凝胶成像系统对凝胶进行图像扫描;
(5)采用quantityone4.6.2软件对pro-qdiamond磷酸化蛋白染色后的光密度值(p)和syproruby全蛋白染色后的光密度值(t)进行分析,p/t值衡量蛋白质磷酸化水平。
其中实施例1~3考察了孵育条件对碱性磷酸酶去磷酸化水平的影响,所述孵育条件包括孵育时间、孵育温度和孵育ph值;实施例4~5通过对比考察了缓冲溶液成分对碱性磷酸酶去磷酸化水平的影响;实施例6~8例证了孵育ph在3.5~10之间肌原纤维蛋白都可以使得碱性磷酸酶去磷酸化。
如图1~3,随着孵育时间延长碱性磷酸酶磷酸化水平均呈下降趋势,说明实施例1~3中建立的离体模型可使碱性磷酸酶去磷酸化。而且通过差异显著性分析发现,实施例1中的孵育条件(25℃、ph=6.4)较实施例2和实施例3中的孵育条件,碱性磷酸酶去磷酸化程度最大。在实施例1的条件下(25℃、ph=6.4),孵育30min后碱性磷酸酶磷酸化水平较孵育10min时下降22%,孵育4h后碱性磷酸酶磷酸化水平较孵育10min时下降80%,而在实施例2的条件下(4℃、ph=6.4),孵育30min后碱性磷酸酶磷酸化水平较孵育10min时下降10%,孵育24~48h后碱性磷酸酶磷酸化水平较孵育10min时才下降到78%~81%。而且在实施例3的条件下(25℃、ph=5.2),孵育30min后碱性磷酸酶磷酸化水平较孵育10min时仅下降3%,孵育4h后碱性磷酸酶磷酸化水平较孵育10min时仅下降到49%。说明同一温度孵育,ph降低会抑制碱性磷酸酶去磷酸化,而同一ph孵育,温度降低也会抑制碱性磷酸酶去磷酸化,使其去磷酸化的时间延后。
图4和5中,图中显示条带即为碱性磷酸酶,观察pro-q染色图谱,在不添加肌原纤维蛋白的情况下,随着孵育时间延长碱性磷酸酶磷酸化并未去磷酸化,说明实施例4和5中建立的离体模型不能使碱性磷酸酶去磷酸化。虽然实施例5中溶液体系的离子强度高于实施例4中溶液体系的离子强度,但碱性磷酸酶仍不能去磷酸化,说明碱性磷酸酶去磷酸化与孵育体系的离子强度无关。图6~图8中,观察pro-q染色图谱,随着孵育时间延长碱性磷酸酶逐渐发生去磷酸化反应,说明在ph5.0~10范围内碱性磷酸酶均可催化自身发生去磷酸化。
如上所述,根据本发明,使碱性磷酸酶去磷酸化取得了成功,且经反复试验,本发明方法试验重复性好,结果可靠。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的实施例。
- 还没有人留言评论。精彩留言会获得点赞!