一种抗体糖型改造的配方、细胞培养方法以及在工业化生产中的应用与流程
本发明涉及生物制药领域,具体地,涉及抗体糖型改造的配方、细胞培养方法以及在工业化生产中的应用。
背景技术:
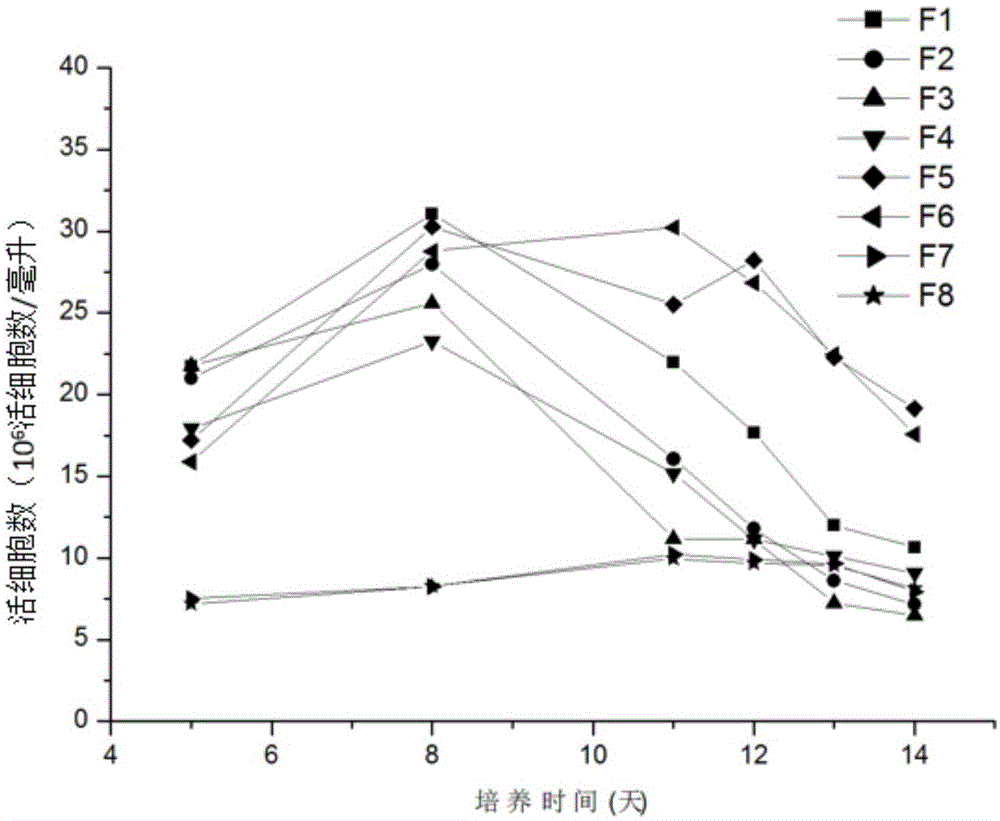
:随着生产技术的改进,生物抗体药物的产量可以达到一个很高的水平,然而,抗体分子的糖型控制却始终是抗体药物生产中的一个大挑战,即使是仿制药,常规的生产工艺也难以达到糖型控制上的质量标准。对cd20抗体原研药美罗华而言,糖型是一个非常重要的质量指标,该抗体的n-糖基化质量标准为45.0%<g1f+g2f<70.0%。然而,使用商业化培养基的实践操作中所生产的美罗华抗体类似药物糖型与原研药美罗华糖型差异较大,具体表现在n-端糖基化的g0f(57.71%)高于原研药(原研药g0f为37.78%);g1f(29.24%)、g2f(7.58%)低于原研药(原研药g1f、g2f分别为41.43%、10.34%),抗体g1f+g2f为36.82远远低于该抗体n-糖基化的质量标准(n-糖基化质量标准45.0%<g1f+g2f<70.0%)。因此,现有的生产方法难以满足国家对仿制药的质量控制要求,造成即使原研药专利过期,仿制药也无法如期上市的困境。。培养基是维持细胞生存和生长代谢的基本溶液,是细胞培养最重要的条件之一。它给细胞提供了便于控制和标准化的生存环境。虽然细胞培养所使用的是经标准化生产、组分和含量都已确定的化学合成培养基,然而在进行大规模生产之前,细胞培养基以及培养工艺通常需要放大过程进行验证以实现大规模或较大规模生产。放大过程中须整体考虑温度、ph、溶氧、搅拌等参数设置,来验证细胞培养基以及培养工艺是否适合商业化生产。因此,本领域迫切需要开发出一种能够使美罗华抗体生物类似药的培养表达符合原研药预期糖型的培养基,以及在工业放大生产中能够稳定高产符合预期糖型的美罗华抗体生物类似药的方法。技术实现要素:本发明的目的就是提供一种能够使美罗华抗体生物类似药的培养表达符合预期糖型的培养基,以及在工业放大生产中能够稳定高产符合预期糖型的美罗华抗体生物类似药的方法。在本发明的第一方面,提供了一种制备抗cd20抗体美罗华类似药的方法,包括步骤:(a)培养细胞,其中所用培养基包括基础培养基和流加培养基;和(b)任选地从培养产物中分离所得类似药;其中,所述流加培养基添加有调节剂a,所述调节剂a中包括:尿苷、mn2+、半乳糖和普兰尼克(pluronic);所述尿苷、mn2+和半乳糖的摩尔浓度比为(0.8-1.2):(0.001-0.003):(2-10),且尿苷与普兰尼克的浓度比为1mmol:(0.02-0.08)g;并且,制备所得的所述类似药的45.0%<g1f+g2f<70.0%。在另一优选例中,所述方法还包括步骤:(c)监测培养体系中的葡萄糖浓度,当葡萄糖浓度低于4g/l时,补充葡萄糖母液至培养体系中,使培养体系中葡萄糖含量至约4g/l。在另一优选例中,所述葡萄糖母液中,葡萄糖的浓度为200-400g/l,较佳地250-350g/l,更佳地300g/l。在另一优选例中,所述基础培养基选自市售的商业化培养基,包括但不限于cdfortichomedia(thermofisherscientific)、dynamis(gibco)、balancdchogrowtha(irvinescientific)、artipro(ge-hyclone)、cdc1m1(lifetechnology)、cd012(奥普曼)、cd11v(健顺生物)。在另一优选例中,所述流加培养基选自市售的商业化培养基,包括但不限于cdefficientfeedc+agtsupplement(thermofisherscientific)、sheff-chopluspfacf(kerry)、cellboost5(ge-hyclone)、cellboost4(ge-hycone)、cdfeed002(奥普曼)、pff05(健顺生物)。在另一优选例中,所述培养的温度为30-40℃,较佳地为32-38℃,更佳地为37℃。在另一优选例中,在培养至第4-6天(优选地第5天),将培养温度调整为34℃;和/或在培养至第7-9天(优选地第8天),将培养温度调整为32℃。在另一优选例中,所述培养体系的体积为0.1-500l,较佳地3-300l,更佳地100-250l。在另一优选例中,所述细胞选自下组:cho细胞、ns0细胞、hek293细胞,或其组合。在另一优选例中,所述细胞为cho细胞。在另一优选例中,所述cho细胞选自cho-s细胞、cho-k1细胞、cho-dg44细胞。在另一优选例中,所述cho细胞为cho-s细胞。在另一优选例中,所述流加培养基分别在培养至第4-6天和第7-9天加入反应体系中,较佳地,分别在培养至第5天和第8天加入反应体系中。在另一优选例中,所述流加培养基加入的总量为总反应体系的10-30v/v%,较佳地15-25v/v%,更佳地20v/v%。在另一优选例中,所述流加培养基每次加入的量为总反应体系的3-20v/v%,较佳地5-15v/v%,更佳地10v/v%。在另一优选例中,所述调节剂a在流加培养基中所占比例为0-100v/v%,较佳地0-75v/v%,更佳地25-50v/v%。在另一优选例中,所述尿苷、mn2+和半乳糖的摩尔浓度比为(0.9-1.1):(0.0015-0.0025):(3-8),较佳地1:0.002:5。在另一优选例中,在培养体系中,尿苷、mn2+和半乳糖的终浓度为0.3×umg至4×umg,较佳地为0.5×umg至3×umg,更佳地为1×umg至2×umg;其中,所述1×umg表示:尿苷浓度为1mm,mn2+浓度为0.002mm,半乳糖浓度为5mm。在另一优选例中,所述尿苷与普兰尼克的浓度比为1mmol:(0.03-0.06)g,较佳地1mmol:0.05g。在另一优选例中,所述普兰尼克选自下组:pluronicl31、pluronicl35、pluronicl38、pluronicl42、pluronicl43、pluronicl44、pluronicl61、pluronicl62、pluronicl63、pluronicl64、pluronicl65、pluronicl68、pluronicl72、pluronicl75、pluronicl77、pluronicl81、pluronicl84、pluronicl85、pluronicl87、pluronicl88、pluronicl121、pluronicl122、pluronicf38、pluronicf68、pluronicf108、pluronicf127、pluronicp85、pluronicp94、pluronicp104、pluronicp105、pluronicp123等,或其组合。在另一优选例中,所述普兰尼克选自下组:pluronicf68、pluronicf77、pluronicf88、pluronicf87、pluronicl65、pluronicl38,或其组合。在另一优选例中,所述普兰尼克为pluronicf68。在另一优选例中,所述调节剂a还包括防止悬浮培养细胞结团的抗结团剂。在另一优选例中,所述抗结团剂包括:硫酸葡聚糖、右旋糖酐40、右旋糖酐70,或其组合。在另一优选例中,所述抗结团剂为硫酸葡聚糖。在另一优选例中,所述普兰尼克与抗结团剂的质量比为1:(0.2-0.8),较佳地1:(0.4-0.7),更佳地1:(0.5-0.6)。在本发明的第二方面,提供了一种制备抗cd20抗体美罗华类似药过程中所用的培养基,所述培养基包括基础培养基和流加培养基,其中,所述流加培养基包括调节剂a,所述调节剂a中包括:尿苷、mn2+、半乳糖和普兰尼克(pluronic);所述尿苷、mn2+和半乳糖的摩尔浓度比为(0.8-1.2):(0.001-0.003):(2-10),且尿苷与普兰尼克的浓度比为1mmol:(0.02-0.08)g;并且,制备所得的所述类似药的45.0%<g1f+g2f<70.0%。在另一优选例中,所述普兰尼克选自下组:pluronicl31、pluronicl35、pluronicl38、pluronicl42、pluronicl43、pluronicl44、pluronicl61、pluronicl62、pluronicl63、pluronicl64、pluronicl65、pluronicl68、pluronicl72、pluronicl75、pluronicl77、pluronicl81、pluronicl84、pluronicl85、pluronicl87、pluronicl88、pluronicl121、pluronicl122、pluronicf38、pluronicf68、pluronicf108、pluronicf127、pluronicp85、pluronicp94、pluronicp104、pluronicp105、pluronicp123等,或其组合。在另一优选例中,所述普兰尼克选自下组:pluronicf68、pluronicf77、pluronicf88、pluronicf87、pluronicl65、pluronicl38,或其组合。在另一优选例中,所述普兰尼克为pluronicf68。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1显示了实施例1中培养基筛选各实验组的活细胞密度。图2显示了实施例1中培养基筛选各实验组的细胞生长和活率变化曲线。图3显示了实施例2中3l反应器培养的活细胞数图4显示了实施例2中3l反应器培养的细胞生长和活率变化曲线。图5显示了实施例2中3l反应器培养的抗体表达曲线。图6显示了实施例3中250l工艺放大细胞培养的流程图。图7显示了实施例3中250l工艺放大细胞培养摇瓶种子培育阶段的细胞生长情况,图中展示了摇瓶种子培养阶段的活细胞数和生长活率变化曲线。图8显示了实施例3中250l工艺放大过程中,15l反应器种子培养阶段的细胞生长情况。图中包括15l反应器种子培养阶段的活细胞数和种子细胞生长活率曲线。图9显示了实施例3中250l工艺放大过程中,50l反应器种子培养阶段的细胞生长情况。图中包括50l反应器种子培养阶段的活细胞数和种子细胞生长活率曲线。图10显示了实施例3中250l工艺放大细胞培养中添加了调节剂a,添加调节剂b以及3l小试工艺细胞培养中r3-01组(实施例2)的细胞生长情况对比图。图中箭头所示为补加流加培养基的阶段。图11显示了实施例3中250l工艺放大细胞培养中添加了调节剂a,添加调节剂b以及3l小试工艺细胞培养中r3-01组(实施例2)的抗体表达情况对比图。图12显示了抗体n-糖基化的类型。具体实施方式本发明人经过广泛而深入的研究,通过大量筛选,首次意外地开发出一种制备抗cd20抗体美罗华类似药的方法,通过在细胞的培养体系中,使用加入调节剂a的流加培养基,能够得到糖型与原研药美罗华相似的生物仿制药。其中,调节剂a中包括:尿苷、mn2+、半乳糖和普兰尼克(pluronic),且所述尿苷、mn2+和半乳糖的摩尔浓度比为1:0.002:5,以及所述尿苷与普兰尼克的浓度比为1mmol:0.05g。此外,本发明人在3l反应器糖型小试工艺的基础上,进行了250l反应器规模放大实验。在此培养体系得到的培养产物中,分离出的抗体产品,在保证细胞活率和抗体产量的前提下,其n-糖基化水平g1f+g2f值能够达到51.44,显著高于现有技术中所能达到的36.82,且非常接近于原研药美罗华的g1f+g2f值51.77。在此基础上完成了本发明。术语如本文所用,术语“美罗华类似药”、“美罗华仿制药”、“抗cd20抗体美罗华类似药”和“抗cd20抗体美罗华仿制药”可互换使用,指与已获准注册的原研药(参照药)抗癌药物-美罗华(利妥昔单抗注射液)在质量、安全性和有效性方面与具有相似性的治疗用生物制品。具体地,其可达到n-糖基化质量标准45.0%<g1f+g2f<70.0%。培养基包括商业化的基础培养基以及流加培养基,由于商业化培养基没有公开具体的配方信息,下表1为常用的商业化培养基:表1常用的商业化培养基上述培养基的配置方法需要根据培养基说明书的要求来进行。制备方法调节剂a的关键成分及添加比例:表2实施例1-3中所使用的调节剂a的分子组成物质配制方法(1l)摩尔数/l尿甘6.11g25mmolmncl26.34g0.05mmol半乳糖22.52g125mmol普兰法克f681.25g1.25g在其他实施例中,普兰法克可以选自pluronicl31、pluronicl35、pluronicl38、pluronicl42、pluronicl43、pluronicl44、pluronicl61、pluronicl62、pluronicl63、pluronicl64、pluronicl65、pluronicl68、pluronicl72、pluronicl75、pluronicl77、pluronicl81、pluronicl84、pluronicl85、pluronicl87、pluronicl88、pluronicl121、pluronicl122、pluronicf38、pluronicf68、pluronicf108、pluronicf127、pluronicp85、pluronicp94、pluronicp104、pluronicp105、pluronicp123等,或其组合。其添加比例为,每1mmol尿苷配置普兰法克0.03~0.06g。另外,可以根据实验需要加入抗结团剂,所述的抗结团剂选自硫酸葡聚糖、右旋糖酐40、右旋糖酐70,或其组合。在实施例1-3中,所使用的抗结团剂为硫酸葡聚糖,优选地,硫酸葡聚糖的分子量在5000道尔顿,在1l的调节剂a中,添加0.25g的分子量5000道尔顿的硫酸葡聚糖。一般地,普兰尼克与抗结团剂的质量比为1:(0.2-0.8),较佳地1:(0.4-0.7),更佳地1:(0.5-0.6)。调节剂b不含f68,硫酸葡聚糖两种组分。常规细胞培养方法用于制备抗体的细胞,选自cho细胞、ns0细胞以及hek293细胞,这些细胞遵从常规的细胞培养方法,包括细胞复苏、基础培养基重悬、细胞扩增、补料培养等各个阶段,其中,细胞扩增的初始细胞接种密度为1x106细胞数/毫升;在培养过程中,需要每日取样检测活细胞密度、细胞活力以及细胞液理化指标,包括葡萄糖、谷氨酰胺、乳酸、nh4+的水平;流加培养液的补加一般控制在葡萄糖低于2g/l、谷氨酰胺低于0.5mm时,依据经验摸索,流加培养基分别在培养至第4-6天和第7-9天加入反应体系中,较佳地,分别在培养至第5天和第8天加入反应体系中;此外,当葡萄糖含量低于4g/l时,补加葡萄糖溶液至4g/l。一般地,当细胞活率低于70%时或在培养14±2天时可以收获培养液,用于抗体表达量的检测以及n-糖型的检测。抗体糖型抗体的糖基化修饰是治疗性抗体药物的关键的质量属性,主要的糖基化形式为fc端的n-糖基化修饰。n-糖基化的几种形式请见图12。n-糖基化分析方法将样品稀释至待检浓度,加入2.5μlpngasef(糖苷酶),混匀,瞬离5s,50℃水浴1小时。加入40μlhilic标记试剂,再加入60μl甲醇,盖紧离心管盖后,于80℃水浴75min。取出样品,10℃、15000rpm离心20分钟,沉淀蛋白。取上清于1.5ml离心管中,真空冷冻干燥,设置温度4℃。待样品干燥后,加入40μl50%acn,混匀;12000rpm离心5min后,取上清18μl于内插管中,除去底部气泡。在wastersuplc上运行样品,采用hilic柱进行分析,进样量2μl,激发波长360nm,发射波长425nm,采用荧光检测器进行检测。采用梯度洗脱,洗脱梯度设置为下表3。表3洗脱梯度设置本发明的优点包括:1)通过成分和剂量的探索,确定了一种有效的糖型调节剂,既控制了糖型规格达到工业生产的需求,又保证了更高的细胞和抗体的产率/量。2)相对于商业化的糖型调节剂,成分简单,大大节约了生产成本。3)由于商业化糖型调节剂的配方都是不公开的信息,因此本发明也进一步打破了商业化糖型调节剂的技术垄断。4)突破了进口抗体药物仿制药生产的技术壁垒,大大加速了国产仿制抗体药物上市的进程。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。如无特别说明,实施例所用的材料和试剂均为市售产品。实施例1:细胞培养基筛选和确定1.1细胞培养基筛选在超净工作台中,每个250ml摇瓶取约12ml细胞液,共取7瓶,分别加入38ml8种不同比例的基础培养基,基础培养基组成见表4,设置7个实验组,实验组编号分别为f1、f2、f3、f4、f5、f6、f7,对照组为f8。培养体积50ml,将摇瓶置于37.0℃,120rpm,5.0%co2的二氧化碳摇床中进行培养,以1×106个细胞/ml初始培养密度接种,共培养14天。其中ge001(ge-hyclone)为市售的培养基,可用作糖型调节,具体使用方法,详见产品说明书。表4各实验组基础培养组成培养至第5天将二氧化碳摇床温度调整为34.0℃,培养至第8天将二氧化碳摇床温度调整至32.0℃。培养过程中需补加流加培养基,以提供培养过程中细胞生长所需的营养物质,各实验组流加培养基组成及补加策略见表5。当摇瓶中葡萄糖含量低于4g/l时,补充浓度为30%的葡萄糖溶液(含葡萄糖300g/l)到摇瓶中,使培养基中葡萄糖含量至4g/l左右。表5各实验组流加培养基组成及补加策略第5,8,11,12,13,14天取样,检测细胞密度,并留取d5、d8、d11和d14天各1ml细胞上清液测抗体含量,d11和d14天留取约8ml细胞上清用于糖型检测。表6调节剂a关键成分终浓度表7调节剂b关键成分终浓度1.2细胞培养基确定细胞生长方面,从图1、图2中各实验组的细胞生长可以发现,虽然f5、f6、f7、f8组在培养过程中的细胞活率(图2)是相当的,但是实际活细胞数的水平有较大差别,f7组未添加任何调节剂,仅使用了商业化的流加培养基,其最高细胞密度仅为10×106个细胞/ml左右,其他六个实验组细胞最高密度为20×106个细胞/ml以上。f5和f6实验组相比其他5个实验组后期能够维持较高的细胞密度和活率。而f8组为调节剂对照组,不包含有f68与抗团结剂,其最高活细胞密度也仅为10×106个细胞/ml。在抗体表达方面,从抗体表达量情况(图3)可以看出,摇瓶f5和f6的抗体表达量明显均优于其他实验组,分别为1.729g/l和1.674g/l。且从抗体糖型检测结果(表8)来看f5和f6实验组更接近美罗华标准品的糖型期望值g1f+g2f更接近于标准品。因此,f5和f6实验组的细胞培养工艺整体表现最优,可作为3l反应器糖型小试工艺的依据。表8各实验组n-糖型结果汇总实施例2:3l细胞培养工艺2.1细胞复苏从液氮罐中将细胞冻存管取出,立即放入37℃水浴中,使细胞液迅速解冻跨过冰点,防止细胞液形成冰晶刺破细胞膜,对细胞造成影响。待细胞完全解冻后,从水浴中将其取出,用75%的酒精进行消毒处理。然后,在超净工作台里将冻存管打开,用无菌移液管吸出细胞液,放入已装有10ml培养基的50ml摇瓶中,摇匀后取出约0.5ml细胞悬液进行细胞计数。将摇瓶置于二氧化碳摇床(37.0℃,120rpm,5.0%co2)中培养。2.2摇瓶细胞扩增采用dynamis(gibco)+mtx(每升基础培养基添加0.5ml1mm的mtx溶液)培养基,每三天取样计数后传代一次,按细胞密度1.0×106个细胞/ml传代,传代至4个3l反应器所需细胞量,再转至4个3l反应器继续培养。2.33l反应器接种分别将约1.6ldynamis(gibco)培养基泵入4个3l反应器中,无菌检查后,将种子细胞约220ml分别接种至4个3l反应器中,混合均匀后分别排除约220ml细胞液,使每个3l反应器初始培养体积约为1.6l。培养至第5天将反应器温度调整为34.0℃,培养至第8天将反应器温度调整至32.0℃。按照表9流加培养基补加策略对4个3l反应器进行流加培养基补加。当摇瓶中葡萄糖含量低于4g/l时,补充浓度为30%的葡萄糖溶液(含葡萄糖300g/l)到反应器中,使培养基中葡萄糖含量至4g/l左右。r3-01与r3-02培养条件一样,r3-03与r3-04培养条件一样,4个3l反应器的培养参数见表9。表93l反应器工艺参数设定2.4取样及留样在3l反应器细胞培养过程中,除第6天和第7天外每天对3l反应器进行取样计数,并对细胞液进行生化参数检测。每次取样后留取1ml×2管细胞上清液置于-20℃条件下保存,用于蛋白含量的检测;第11天和第14天每个反应器留取50ml×1管细胞上清液置于-20℃条件下保存,用于糖型检测。2.5结果与讨论细胞生长方面,从图4可以看出两组平行的反应器细胞生长相似,4个3l反应器前期生长相似,最高密度均约为27×106个细胞/ml,后期r3-03与r3-04的细胞密度和细胞活率出现较明显下降,而r3-01和r3-02则维持着更高的细胞密度和活率。在抗体表达方面,从抗体表达量情况(图5)可以看出两组平行的反应器细胞抗体表达相似,r3-01和r3-02抗体表达量优于r3-03与r3-04。从抗体糖型检测结果(表10)可以看出,4个反应器糖型检测结果相似。综上所述,r3-01和r3-02工艺条件整体表现更适合作为250l反应器工艺放大生产的依据。表103l反应器抗体n-糖型检测结果实施例3:250l工艺放大培养3.1细胞培养流程如图6所示。3.2细胞复苏从液氮罐中将细胞冻存管取出,立即放入37℃水浴中,待细胞完全解冻后,从水浴中将其取出,用75%的酒精进行消毒处理。然后,在超净工作台里将冻存管打开,用无菌移液管吸出细胞液,放入已装有培养的50ml摇瓶中,摇匀后取出约0.5ml细胞悬液进行细胞计数。将摇瓶置于二氧化碳摇床(37.0℃,120rpm,5.0%co2)中培养。3.3摇瓶种子培养次日,细胞取样计数后,将细胞移入无菌离心管中700rpm离心5min。弃上清,用新鲜dynamis(gibco)(含mtx)重悬细胞到培养瓶中,使其终密度为1.0×106cells/ml左右。此后每三天取样计数后传代一次,传代细胞密度为1.0×106cells/ml,传代培养基为含mtx的基础培养基。传代至15l反应器所需细胞量,再转至15l反应器继续培养。3.415l反应器种子培养15l反应器接种前,对罐体进行组装(ph电极需提前校准),确保管线连接正确,在罐体内注入5lwfi,然后,对罐体及相关配件进行121℃,120mins湿热灭菌处理。罐体灭菌后,待其充分冷却,排空罐体中的wfi,加入约7.9ldynamis(gibco)培养基,将反应器参数设定为温度37.0℃、120rpm进行培养基无菌考察,考察时间18-24小时,无菌验证无误后,校准溶氧电极和校正ph电极。3.550l反应器种子培养50l反应器种子培养采用的是50lhyclone一次性反应器。使用前,先将反应袋安装好,再将灭菌好的电极(ph电极已校准过)插入到反应袋中,然后加入约42.5ldynamis(gibco)培养基。搅拌速度90rpm,温度37.0℃,培养18-24小时,取样镜检考察无菌情况。无菌验证无误后,校准溶氧电极和校正ph电极。50l反应器以密度约为1.0×106个细胞/ml进行接种,加入15l反应器种子液约5.3l。培养参数为do:50%,ph:7.00±0.20,温度:37.0℃,搅拌:90rpm。培养至第3天,转至250l反应器继续培养。每日取样检测细胞密度、细胞活率及代谢参数。3.6250l反应器种子培养250l反应器种子培养采用的是250lhyclone一次性反应器。使用前,先将反应袋安装好,再将灭菌好的电极(ph电极已校准过)插入到反应袋中,然后加入约150ldynamis(gibco)培养基。搅拌速度60rpm,温度37.0℃,培养18-24小时,取样镜检考察无菌情况。无菌验证无误后,校准溶氧电极和校正ph电极。以密度约为1.0×106个细胞/ml进行接种,加入50l反应器种子液约20l。培养参数为do:50%,ph:7.00±0.20,温度:37.0℃,搅拌:80rpm。培养至第5天,调整反应器培养的设定温度为34.0℃,培养至第5天,调整反应器培养的设定温度为32.0℃。培养过程中,用7.5%的碳酸氢钠溶液和co2气体控制ph,用5%的消泡剂溶液消泡。培养第5天和第8天补加流加培养基,当反应器中葡萄糖含量低于4.0g/l时,补充浓度为30%的葡萄糖溶液(含葡萄糖300g/l)到反应器中,使培养基中葡萄糖含量至约4.0g/l。每日取样检测细胞密度、细胞活率及代谢参数。3.7留样从培养第0天至培养终止,每天留取1ml*2管细胞上清液置于-20℃条件下保存,用于蛋白含量的检测;第11天和第14天留取40ml*2管细胞上清液置于-20℃条件下保存,用于蛋白理化性质的检测。3.8结果与讨论3.8.1摇瓶种子数据摇瓶种子细胞生长曲线见(图7)。3.8.215l种子培养数据15l反应器种子细胞生长曲线见(图8)。3.8.350l种子培养数据50l反应器细胞生长曲线见(图9)。3.8.4250l种子培养数据按照实施例2r3-01的流加培养添加策略,分别比较了250l加入调节剂a的情况下、250l加入调节剂b以及实施例2中所述的3l小试工艺中r3-01培养中细胞生长及活率变化曲线比较见图10。在细胞生长方面,250l反应器加入调节剂a的糖型工艺细胞培养细胞生长和细胞活率均优于3l小试培养和250l反应器加入调节剂b的培养条件。250l反应器加入调节剂a、250l反应器加入调节剂b及3l小试培养工艺的抗体表达情况比较见图11;抗体n-糖型检测结果比较见表11。在抗体表达方面,250l反应器加入调节剂a的抗体产量均高于3l小试和250l反应器加入调节剂b的培养条件,抗体n-糖型均优于3l小试和250l反应器加入调节剂b批次,与原研药比较有更高相似性。表11抗体n-糖型结果比较表实施例4其他培养基组合的摸索在实施例1-3的基础上,本发明还尝试使用其他商业化培养基联合调节剂a的开发策略,如将cdfortichomedia(thermofisherscientific)作为基础培养基,sheff-chopluspfacf(kerry)与调节剂a按照50:50的比例配制流加培养基;或balancdchogrowtha(irvinescientific)作为基础培养基,cdfeed002(奥普曼)与调节剂a按照75:25的比例配制流加培养基;或cdclm1(lifetechnology)作为基础培养基,cellboost5(ge-hyclone)与调节剂a按照25:75的比例配制流加培养基,均可以起到较好的糖型调节以及抗体产量提升的效果。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1