一种内皮祖细胞的培养方法与流程
本发明属于细胞工程
技术领域:
,尤其涉及一种内皮祖细胞的培养方法。
背景技术:
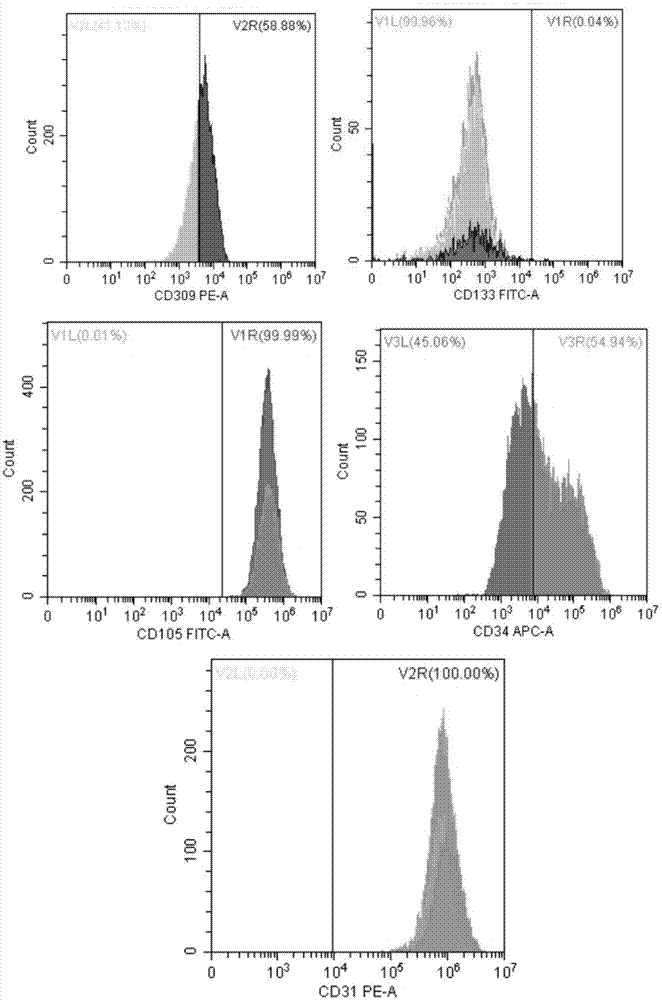
:内皮祖细胞是血管内皮细胞的前体细胞,通常分布在人的外周血、脐带血以及骨髓中,参与新生血管的形成,在组织工程学中经常会使用到血管内皮细胞对血管损伤进行修复。血管损伤性疾病具有高发病率和死亡率的特点。受损内皮的有效修复和新生血管生成是这类疾病的治疗关键。当内皮完整性破坏,内皮细胞(endothelialcells,ecs)从邻近血管中增殖和迁移,促使受损血管内皮修复。以往认为这是新血管形成的唯一方式。然而,这种血管形成的传统观念目前正面临挑战。asahara等第一个描述了骨髓来源的细胞群体有助于新血管形成,并命名这一细胞群为内皮祖细胞(endothelialprogenitorcells,epcs)。相对于血管形成,来源于骨髓并增殖和分化成熟的epcs形成的新血管被定义为血管发生。因此,epcs被认为是治疗血管性疾病的新方法。现有技术培养内皮祖细胞通常都是通过二维贴壁培养,也就是通过培养皿或者培养瓶在平面进行培养,而这种培养方法首先细胞获得率较低,耗费大量的人工与场地,耗费大量的培养基,并且得到的细胞容易分化,质量较差。技术实现要素:有鉴于此,本发明要解决的技术问题在于提供一种大规模内皮祖细胞的培养方法。本发明提供了一种内皮祖细胞的培养方法,包括:s1)将单个核细胞进行贴壁培养,消化后,得到扩增后的细胞;s2)将所述扩增后的细胞接种于培养基中,进行培养,得到内皮祖细胞;所述培养基中包括碱性成纤维细胞生长因子、血管内皮生长因子与微载体。优选的,所述步骤s2)培养基中扩增后的细胞密度为1×104~1×106cells/ml。优选的,所述步骤s2)培养基中碱性成纤维细胞生长因子与血管内皮生长因子的浓度各自独立地为10~50ng/ml。优选的,所述步骤s2)培养基中碱性成纤维细胞生长因子与血管内皮生长因子的浓度各自独立地为10~30ng/ml。优选的,所述步骤s2)培养基中微载体的浓度为0.001~0.02g/ml。优选的,所述步骤s2)中培养的温度为36℃~37℃,co2的体积浓度为3%~10%。优选的,所述步骤s2)中培养具体为:10~20转/分钟,培养1~3h,然后25~35转/分钟培养至第2天,补加培养基,再以40~60转/分钟进行培养。优选的,所述步骤s2)中培养具体为:13~18转/分钟,培养1.5~2.5h,然后28~32转/分钟培养至第2天,补加培养基,再以45~55转/分钟进行培养。优选的,所述补加培养基的量为原始培养基体积的1/10~1/5。优选的,所述步骤s2)中培养结束后,离心,用胰蛋白酶-edta消化液消化,终止消化后,离心去除上清,用磷酸盐缓冲液重悬沉淀后,过滤,得到内皮祖细胞。本发明提供了一种内皮祖细胞的培养方法,包括:s1)将单个核细胞进行贴壁培养,消化后,得到扩增后的细胞;s2)将所述扩增后的细胞接种于培养基中,进行培养,得到内皮祖细胞;所述培养基中包括碱性成纤维细胞生长因子、血管内皮生长因子与微载体。与现有技术相比,本发明在培养基中添加碱性成纤维细胞生长因子与血管内皮生长因子促进细胞生长,同时添加比表面积大的微载体,提高了单位体积培养液的细胞产率,简化了细胞生长各种环境因素的检测和控制,重现性好,培养基利用率高,并且也简化了细胞收获过程,劳动强度小,培养系统占地面积小。附图说明图1为本发明实施例1中得到的内皮祖细胞cd133、cd309、cd34、cd31、cd105的表达分析谱图。具体实施方式下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明提供了一种内皮祖细胞的培养方法,包括:s1)将单个核细胞进行贴壁培养,消化后,得到扩增后的细胞;s2)将所述扩增后的细胞接种于培养基中,进行培养,得到内皮祖细胞;所述培养基中包括碱性成纤维细胞生长因子、血管内皮生长因子与微载体。本发明对所有原料的来源并没有特殊的限制,为市售或自制均可。其中,所述单个核细胞的制备方法为本领域技术人员熟知的方法即可,并无特殊的限制,可采用ficoll密度梯度离心法,也可采用羟乙基淀粉分离法,本发明中优选具体为:将脐血与6%的羟乙基淀粉按照4:1的比例混合,室温静置30~60min,收集上层富含白细胞的血浆层,400~500g离心5~15min,弃上清,用磷酸盐缓冲液重悬细胞沉淀,得到细胞悬液;将细胞悬液与ficoll混合,采用水平离心机600~800g离心20~40min,收集ficoll与血浆层交界处的白色细胞层,即得到单个核细胞;所述细胞悬液与ficoll的体积比为(2~4):1,更优选为(2.5~3.5):1,再优选为3:1;细胞悬液与ficoll优选按照以下方式混合:用巴氏吸管将细胞悬液沿离心管壁缓慢加入ficoll的上层;采用水平离心机的转速优选为650~750g,更优选为700g,离心的时间优选为25~35min,更优选为30min;离心后收集ficoll与血浆层交界处的白色细胞层后优选加入磷酸盐缓冲液稀释,离心后再用磷酸盐缓冲液洗涤。所述白色细胞层与磷酸盐缓冲液的体积比优选为1:(3~5),更优选为1:(3.5~4.5),再优选为1:4;所述离心的转速优选为300~500g,更优选为350~450g,再优选为400g;所述离心的时间优选为3~10min,更优选为3~8min,再优选为4~6min,最优选为5min。将单个核细胞进行贴壁培养,消化后,得到扩增后的细胞;所述贴壁培养所用的培养基为本领域技术人员熟知的培养基即可,并无特殊的限制,本发明中优选为emg-2mv;所述贴壁培养时,培养基中单个核细胞的密度优选为1×104~1×105cells/ml,更优选为3×104~8×104cells/ml,再优选为5×104cells/ml;所述贴壁培养的条件优选为湿度90%以上,36℃~37℃,co2的体积浓度优选为3%~10%,更优选为3%~8%,再优选为4%~6%,最优选为5%;贴壁培养三天后优选补加培养基,补加培养基的体积优选为最开始培养基体积的0.8~1.2倍,更优选为0.9~1.1倍,最优选为1倍;培养至第6天时,优选弃去培养基上清以及未贴壁的细胞,重新补加培养基,补加培养基的体积优选为最开始培养基体积的0.8~1.2倍,更优选为0.9~1.1倍,最优选为1倍;之后优选每三天换液一次,直至细胞融合度达到80%,弃去培养基,加入磷酸盐缓冲液清洗,然后加入胰酶消化,终止消化后,离心,得到扩增后的细胞;所述清洗时磷酸盐缓冲液与细胞的体积比优选为(0.9~1.2):1,更优选为1:1;消化所用胰酶的浓度优选为0.2%~0.3%,更优选为0.25%;加入胰酶的量为培养基体积的1/6~1/3,更优选为1/5~1/4;所述消化的时间优选为1~2min,更优选为1min;所述终止消化优选采用含有胎牛血清的1640培养基;所述1640培养基中胎牛血清的质量百分含量优选为8%~12%,更优选为9%~11%,再优选为10%;所述1640培养基与胰酶的体积比优选为(4~7):1,更优选为(5~6):1,再优选为5:1;所述离心的转速优选为300~500g,更优选为350~450g,再优选为400g;所述离心的时间优选为4~7min,更优选为5~6min;离心弃去上清后,优选采用培养基重悬扩增后的细胞;所述培养基优选为emg-2mv。将所述扩增后的细胞接种于培养基中;所述培养基为本领域技术人员熟知的培养基即可,并无特殊的限制,本发明中优选为emg-2mv;所述培养基中包括碱性成纤维细胞因子、血管内皮生长因子与微载体;所述碱性成纤维细胞因子为本领域技术人员熟知的碱性成纤维细胞因子即可,并无特殊的限制,本发明中优选为hfgf-b;所述培养基中碱性成纤维细胞因子的浓度优选为10~50ng/ml,更优选为10~30ng/ml,再优选为10~20ng/ml,最优选为10ng/ml;所述培养基中血管内皮生长因子的浓度优选为10~50ng/ml,更优选为10~30ng/ml,再优选为10~20ng/ml,最优选为10ng/ml;所述微载体为本领域技术人员熟知的微载体即可,并无特殊的限制,本发明中优选为cytodex1、2、3,cytopore与cytoline中的一种或多种;所述培养基中微载体的浓度优选为0.001~0.02g/ml,更优选为0.004~0.015g/ml,再优选为0.008~0.01g/ml;所述培养基中接种扩增后的细胞的浓度优选为1×104~1×106cells/ml,更优选为5×104~5×105cells/ml,再优选为8×104~2×105cells/ml,最优选为1×105cells/ml。接种于培养基后,进行培养;所述培养优选在罐式生物反应器中进行;所述培养的温度为36℃~37℃,co2的体积浓度优选为3%~10%,更优选为3%~8%,再优选为4%~6%,最优选为5%;所述的培养方法为本领域技术人员熟知的方法即可,并无特殊的限制,本发明中优选按照以下方法培养:10~20转/分钟,培养1~3h,然后25~35转/分钟培养至第2天,补加培养基,再以40~60转/分钟进行培养;更优选为13~18转/分钟,培养1.5~2.5h,然后28~32转/分钟培养至第2天,补加培养基,再以45~55转/分钟进行培养;再优选为15转/分钟,培养2h,然后30转/分钟培养至第2天,补加培养基,再以50转/分钟进行培养;所述培养至第2天,补加培养基的量优选为原始培养基体积的1/10~1/5,更优选为1/8~1/5。培养结束后优选离心,用胰蛋白酶-edta消化液消化,终止消化后,离心去除上清,用磷酸盐缓冲液重悬沉淀后,过滤,得到内皮祖细胞;在本发明中离心后优选用磷酸盐缓冲液清洗两次后再胰蛋白酶-edta消化液消化;所述胰蛋白酶-edta消化液为0.25%胰蛋白酶-edta消化液;所述消化的时间优选为10~20min,更优选为13~18min,再优选为15min;终止消化的方法为本领域技术人员熟知的终止方法即可,并无特殊的限制,本发明中优选采用含有胎牛血清的1640培养基;所述1640培养基中胎牛血清的-质量百分含量优选为8%~12%,更优选为9%~11%,再优选为10%;所述过滤优选采用50~100μm筛网过滤,更优选为60~90μm,再优选为70~80μm,最优选为70μm;过滤得到的内皮祖细胞优选重悬于生理盐水中,进行细胞计数和流式检测。本发明在培养基中添加碱性成纤维细胞生长因子与血管内皮生长因子促进细胞生长,同时添加比表面积大的微载体,提高了单位体积培养液的细胞产率,简化了细胞生长各种环境因素的检测和控制,重现性好,培养基利用率高,并且也简化了细胞收获过程,劳动强度小,培养系统占地面积小。为了进一步说明本发明,以下结合实施例对本发明提供的一种内皮祖细胞的培养方法进行详细描述。以下实施例中所用的试剂均为市售。实施例1单个核细胞分离:取脐血20ml,按照脐血∶hes=4∶1的比例混合于容量瓶中,上下颠倒20次混匀;在室温下静置40分钟,收集上层富含白细胞的血浆层于离心管中,450g离心10min;离心完毕后弃去上清液,用pbs重悬细胞沉淀,取一只离心管加入一定量的ficoll,按照细胞悬液∶ficoll=3∶1的比例,用巴氏吸管将细胞悬液沿离心管壁缓慢加入ficoll的上层;在水平离心机上700g离心30min;用巴氏吸管小心收集ficoll与血浆层交界处的白色细胞层,即为单个核细胞,加入4倍体积的pbs稀释细胞悬液,400g离心5min;弃去上清液,加入20mlpbs洗涤两遍,用egm-2mv培养液稀释细胞,计数备用。内皮祖细胞的初步培养:将分离出的单个核细胞按5×104/cm2的密度分别接种于10cm的培养皿中,补加egm-2mv培养基至10ml;放入培养箱中,湿度90%以上,37℃,5%co2中培养;培养3天后补加10mlegm-2mv培养基;培养至第6天时弃去培养基上清以及未贴壁的细胞,重新补加10mlegm-2mv培养基;之后每3天换液一次,直到细胞融合度达到80%;弃去培养皿中的培养基,加入等量pbs清洗;弃去pbs,加入每皿2ml0.25%的胰酶,消化1min;向培养皿中加入5倍于胰酶体积含10%fbs的1640培养基终止消化;将细胞悬液转移到15ml离心管中,在水平离心机上400g离心5min;弃去上清,加入egm-2mv培养基重悬细胞调整密度至5×104cells/ml备用。内皮祖细胞的培养:用含有10ng/mlbfgf以及10ng/mlvegf的egm-2mv培养基将8×107个细胞调整细胞密度至1×105cells/ml,加入8g微载体混合,将混合液加入容积为2l的罐式生物反应器中在37℃、5%co2条件下培养;15转/分钟培养2小时;接着30转/分钟培养至第2天,添加200ml的egm-2mv培养基,然后50转/分钟培养至第4天;倒出反应器中的培养基,离心去除上清,pbs清洗2遍后用0.25%胰酶-edta消化液消化15分钟,含有10%fbs的1640培养基终止消化,离心去除上清,用pbs重悬沉淀,70μm筛网过滤收集内皮祖细胞,重悬于生理盐水中进行细胞计数和流式检测,细胞计数结果见表1。流式检测的方法为:加入抗体,用流式细胞仪检测分析cd133、cd309、cd34、cd31及cd105的表达分析谱图,得到结果如图1所示。实施例2单个核细胞分离:取脐血20ml,按照脐血∶hes=4∶1的比例混合于容量瓶中,上下颠倒20次混匀;在室温下静置40分钟,收集上层富含白细胞的血浆层于离心管中,450g离心10min;离心完毕后弃去上清液,用pbs重悬细胞沉淀,取一只离心管加入一定量的ficoll,按照细胞悬液∶ficoll=3∶1的比例,用巴氏吸管将细胞悬液沿离心管壁缓慢加入ficoll的上层;在水平离心机上700g离心30min;用巴氏吸管小心收集ficoll与血浆层交界处的白色细胞层,即为单个核细胞,加入4倍体积的pbs稀释细胞悬液,400g离心5min;弃去上清液,加入20mlpbs洗涤两遍,用egm-2mv培养液稀释细胞,计数备用。内皮祖细胞的初步培养:将分离出的单个核细胞按5×104/cm2的密度分别接种于10cm的培养皿中,补加egm-2mv培养基至10ml;放入培养箱中,湿度90%以上,37℃,5%co2中培养;培养3天后补加10mlegm-2mv培养基;培养至第6天时弃去培养基上清以及未贴壁的细胞,重新补加10mlegm-2mv培养基;之后每3天换液一次,直到细胞融合度达到80%;弃去培养皿中的培养基,加入等量pbs清洗;弃去pbs,加入每皿2ml0.25%的胰酶,消化1min;向培养皿中加入5倍于胰酶体积含10%fbs的1640培养基终止消化;将细胞悬液转移到15ml离心管中,在水平离心机上400g离心5min;弃去上清,加入egm-2mv培养基重悬细胞调整密度至5×104cells/ml备用。内皮祖细胞的培养:用含有10ng/mlbfgf以及10ng/mlvegf的egm-2mv培养基将8×107个细胞调整细胞密度至1×105cells/ml,加入10g微载体混合,将混合液加入容积为2l的罐式生物反应器中在37℃、5%co2条件下培养;15转/分钟培养2小时;接着30转/分钟培养至第2天,添加200ml的egm-2mv培养基,然后50转/分钟培养至第4天;倒出反应器中的培养基,离心去除上清,pbs清洗2遍后用0.25%胰酶-edta消化液消化15分钟,含有10%fbs的1640培养基终止消化,离心去除上清,用pbs重悬沉淀,70μm筛网过滤收集内皮祖细胞,重悬于生理盐水中进行细胞计数检测,细胞计数结果见表1。实施例3单个核细胞分离:取脐血20ml,按照脐血∶hes=4∶1的比例混合于容量瓶中,上下颠倒20次混匀;在室温下静置40分钟,收集上层富含白细胞的血浆层于离心管中,450g离心10min;离心完毕后弃去上清液,用pbs重悬细胞沉淀,取一只离心管加入一定量的ficoll,按照细胞悬液∶ficoll=3∶1的比例,用巴氏吸管将细胞悬液沿离心管壁缓慢加入ficoll的上层;在水平离心机上700g离心30min;用巴氏吸管小心收集ficoll与血浆层交界处的白色细胞层,即为单个核细胞,加入4倍体积的pbs稀释细胞悬液,400g离心5min;弃去上清液,加入20mlpbs洗涤两遍,用egm-2mv培养液稀释细胞,计数备用。内皮祖细胞的初步培养:将分离出的单个核细胞按5×104/cm2的密度分别接种于10cm的培养皿中,补加egm-2mv培养基至10ml;放入培养箱中,湿度90%以上,37℃,5%co2中培养;培养3天后补加10mlegm-2mv培养基;培养至第6天时弃去培养基上清以及未贴壁的细胞,重新补加10mlegm-2mv培养基;之后每3天换液一次,直到细胞融合度达到80%;弃去培养皿中的培养基,加入等量pbs清洗;弃去pbs,加入每皿2ml0.25%的胰酶,消化1min;向培养皿中加入5倍于胰酶体积含10%fbs的1640培养基终止消化;将细胞悬液转移到15ml离心管中,在水平离心机上400g离心5min;弃去上清,加入egm-2mv培养基重悬细胞调整密度至5×104cells/ml备用。内皮祖细胞的培养:用含有10ng/mlbfgf以及10ng/mlvegf的egm-2mv培养基将8×107个细胞调整细胞密度至1×105cells/ml,加入9g微载体混合,将混合液加入容积为2l的罐式生物反应器中在37℃、5%co2条件下培养;15转/分钟培养2小时;接着30转/分钟培养至第2天,添加200ml的egm-2mv培养基,然后50转/分钟培养至第4天;倒出反应器中的培养基,离心去除上清,pbs清洗2遍后用0.25%胰酶-edta消化液消化15分钟,含有10%fbs的1640培养基终止消化,离心去除上清,用pbs重悬沉淀,70μm筛网过滤收集内皮祖细胞,重悬于生理盐水中进行细胞计数检测,细胞计数结果见表1。表1实施例细胞计数结果实施例1实施例2实施例3计数结果2.5×10^93.8×10^93.1×10^9细胞活率94.36%95.89%94.72%比较例1将8×107个epc细胞(实施例1初步培养得到的)按-5x104/ml的密度分别接种于15cm的培养皿中,补加egm-2mv培养基至20ml,放入培养箱中,湿度90%以上,37℃,5%co2中培养;在培养48小时后换液一次,每皿更换20ml培养基,培养至第4天;弃去培养皿中的培养基,加入等量pbs清洗;弃去pbs,加入每皿2ml0.25%的胰酶,消化1min;向培养皿中加入5倍于胰酶体积含10%fbs的1640培养基终止消化;将消化液离心去除上清,加入10ml生理盐水清洗2遍,用生理盐水重悬细胞进行计数,得到结果见表2。比较例2将8×107个epc细胞(实施例1初步培养得到的)按8x104/ml的密度分别接种于15cm的培养皿中,补加egm-2mv培养基至20ml,放入培养箱中,湿度90%以上,37℃,5%co2中培养;在培养48小时后换液一次,每皿更换20ml培养基,培养至第4天;弃去培养皿中的培养基,加入等量pbs清洗;弃去pbs,加入每皿2ml0.25%的胰酶,消化1min;向培养皿中加入5倍于胰酶体积含10%fbs的1640培养基终止消化;将消化液离心去除上清,加入10ml生理盐水清洗2遍,用生理盐水重悬细胞进行计数,得到结果见表2。比较例3将8×107个epc细胞(实施例1初步培养得到的)按2x104/ml的密度分别接种于15cm的培养皿中,补加egm-2mv培养基至20ml,放入培养箱中,湿度90%以上,37℃,5%co2中培养;在培养48小时后换液一次,每皿更换20ml培养基,培养至第4天;弃去培养皿中的培养基,加入等量pbs清洗;弃去pbs,加入每皿2ml0.25%的胰酶,消化1min;向培养皿中加入5倍于胰酶体积含10%fbs的1640培养基终止消化;将消化液离心去除上清,加入10ml生理盐水清洗2遍,用生理盐水重悬细胞进行计数,得到结果见表2。表2细胞计数结果实施例1比较例1比较例2比较例3细胞计数2.5×10^97.6×10^88.4×10^84.9×10^8细胞活率94.36%95.01%92.58%90.87%当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1