一种重组乳酸乳球菌及其构建方法和应用与流程
本发明涉及生物医药技术领域,具体涉及一种重组乳酸乳球菌及其构建方法和在制备抗肿瘤药物或食品中的应用。
背景技术:
乳酸乳球菌是肠道中含量较多的一类益生菌,主要存在于乳制品和植物产品中,食品药品监督管理局(fda)评价乳酸乳球菌的安全性指标为“一般认为安全(gras)”,使乳酸乳球菌在食品业中得到广泛应用。而自发现和最初用于乳制品发酵以来,乳酸乳球菌近来也在生物技术生产中迅速发展,在基因工程中用于生产多种重组蛋白、作为外源物的代谢屏障等。近年来发现了许多内源性抗血管生成剂,其中内皮抑素作为一种抗癌蛋白已被广泛研究于治疗癌症等,有研究发现可以通过分子修饰方法来改善内皮抑素在临床应用中的半衰期短的局限性以及提高内皮抑素的生物活性。本专利构建了一种集乳酸乳球菌益生菌的活性和人内皮抑素抗肿瘤活性为一体的重组乳酸乳球菌,及其在制备抗肿瘤药物或食品以及抑制肿瘤生长、延长荷瘤模型生存期、促进肿瘤大面积坏死、抗肿瘤转移的药物或食品中的应用。
技术实现要素:
本发明的目的在于提供一种重组乳酸乳球菌及其构建方法,并将其应用于制备抗肿瘤以及抑制肿瘤生长、延长荷瘤模型生存期、促进肿瘤大面积坏死、抗肿瘤转移的药物或食品中。本发明不仅发现了重组乳酸乳球菌能抑制肿瘤的生长,而且发现其能延长荷瘤模型生存期,并且能够促进肿瘤大面积坏死,还能抗肿瘤转移。
本发明是通过以下技术方案来实现的:
一种重组乳酸乳球菌的构建方法,具体为:利用合成引物进行聚合酶链式反应,扩增获得人内皮抑素rhes片段,利用限制性内切酶分别酶切rhes基因片段和载体pnz8148,进行连接,转化乳酸乳球菌,筛选并获得阳性转化菌株。
优选地,所述合成引物为上游引物rhes-f和下游引物rhes-r;所述的聚合酶链式反应的条件为:90~95℃预变性5min,90~95℃变性30s,40~60℃退火30s,70~75℃延伸1min,共30个循环;70~75℃延伸10min。
所述的重组乳酸乳球菌,能够表达人内皮抑素。
所述的重组乳酸乳球菌,其质粒能稳定遗传。
优选地,所述的一种重组乳酸乳球菌在制备抗肿瘤药物或食品中的应用。
所述的抗肿瘤为抑制肿瘤生长、延长荷瘤模型生存期、促进肿瘤大面积坏死和抗肿瘤转移中的一种或者多种。
优选地,所述的一种重组乳酸乳球菌在制备抗黑色素肿瘤药物或食品中的应用。
所述的抗黑色素肿瘤为抑制黑色素肿瘤生长、延长黑色素肿瘤模型生存期、促进黑色素肿瘤大面积坏死和抗黑色素肿瘤转移中的一种或者多种。
优选地,所述的一种重组乳酸乳球菌在制备抗肿瘤药物中的应用,利用常规的制剂技术制备其注射、静脉、口服或喷剂形式。
优选地,所述的一种重组乳酸乳球菌在制备抗黑色素肿瘤药物或食品中的应用,利用常规的制剂技术制备其注射、静脉、口服或喷剂形式。
优选地,所述的一种重组乳酸乳球菌在制备与常规抗肿瘤治疗药物或食品联合运用的抗肿瘤药物或食品中的应用。
优选地,所述的一种重组乳酸乳球菌在制备与常规抗黑色素肿瘤治疗药物或食品联合运用的抗黑色素肿瘤药物或食品中的应用。
有益效果:
(1)本发明将乳酸乳球菌和人内皮抑素结合成为一个整体,重组乳酸质粒能稳定遗传。
(2)本发明的重组乳酸乳球菌有显著的抗肿瘤效果,包括:显著抑制肿瘤的生长,而且能有效延长荷瘤模型的生存期;通过对肿瘤组织的苏木精-伊红染色(he染色)结果分析发现口饲转人内皮抑素乳酸乳球菌能促进肿瘤细胞的大面积坏死、从而抑制肿瘤生长。其整体的抗肿瘤效果显著好于乳酸乳球菌本身。
(3)本发明的重组乳酸乳球菌能够口服。
附图说明
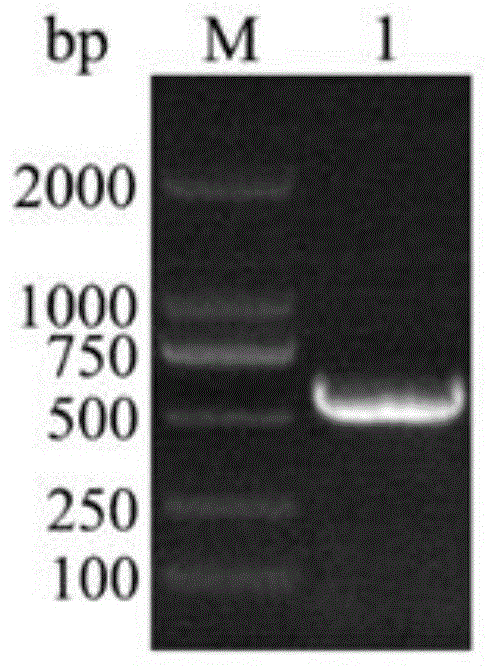
图1为pcr反应扩增的人内皮抑素rhes片段(573bp)的凝胶电泳分离照片;
其中,m-dl2000;1-人内皮抑素rhes片段。
图2为目的片段和载体酶切后的电泳分离照片;
其中,m-dl15000/2000;1-载体pnz8148酶切;2-载体pnz8148未酶切;3-rhes片段酶切。
图3为重组乳酸乳球菌质粒pnz8148-rhes的pcr产物的凝胶电泳照片;
其中,m-dl2000;1-重组乳酸乳球菌质粒pnz8148-rhes的pcr产物。
图4为内皮抑素蛋白的考染鉴定照片;
其中,m-proteinmarker;1-nz9000;2-nz9000-pnz8148;3-nz9000-pnz-rhes。
图5为连续传代携带质粒菌落的比例曲线图;
其中,a-nz9000-pnz8148;b-nz9000-pnz-rhes。
图6为不同给药组的小鼠黑色素瘤体积变化折线图;
其中,a-对照组;b-nz9000组;c-nz9000-pnz8148组;d-nz9000-pnz-rhes组。
图7为不同给药组的小鼠存活率图;
其中,a-对照组;b-nz9000组;c-nz9000-pnz8148组;d-nz9000-pnz-rhes组。
图8为肿瘤切片he染色图;
其中,a:对照组;b:nz900组;c:nz9000-pnz8148组;d:nz9000-pnz-rhes组。
具体实施方式
下面结合具体实施方式,对本发明作进一步的详细说明。
实施例1
(1)重组乳酸乳球菌的构建及制剂
利用合成引物(上游引物rhes-f和下游引物rhes-r)进行聚合酶链式反应(pcr反应)(反应条件:90~95℃预变性5min;90~95℃变性30s,40~60℃退火30s,70~75℃延伸1min,共30个循环;70~75℃彻底延伸10min),扩增获得人内皮抑素rhes片段,利用限制性内切酶分别酶切rhes基因片段和载体pnz8148,进行连接,转化乳酸乳球菌,筛选并获得阳性转化菌株。
将pcr反应扩增的人内皮抑素rhes片段(573bp)经1%琼脂糖凝胶电泳分离,如图1所示;将片段回收后将人内皮抑素基因rhes和载体pnz8148进行酶切并凝胶电泳分离,如图2所示。
本发明尝试了不同的常规制剂形式,包括注射、静脉、口服和喷剂形式。后续研究实验表明,不同制剂形式的效果相当,且本专利中的重组乳酸乳球菌制剂能够口服。
(2)重组质粒的电转化以及重组乳酸乳球菌的鉴定
从新鲜活化的无抗gm17培养基(m17肉汤+0.5%葡萄糖)琼脂板上挑取乳酸乳球菌nz9000单菌落,接种于sgm17(gm17肉汤+0.5m蔗糖)液体培养基,30℃静置厌氧培养过夜;以1:50的比例转接于预热的含有2.5%甘氨酸的sgm17培养基,培养至od600达到0.3;将菌液置于冰上冷却20min;在4℃下,5000rpm离心10min;弃上清液,预冷的含0.5m蔗糖的10%甘油电转化缓冲液洗涤两次;电转化缓冲液重悬即为乳酸乳球菌nz9000感受态细胞,取80μl感受态细胞加入待转化的连接产物,冰浴1h;将混合液转移至预冷的电转杯,在25μf、2.5kv、200ω条件下进行高压电脉冲,立即加入1ml冰冷的sgm17mc(sgm17+20mm氯化镁(mgcl2)+2mm氯化钙(cacl2))再生液体培养基中,冰上放置5min;转移至30℃培养3h;5000rpm离心5min,涂布至含有25μg/ml氯霉素抗性的gm17固体培养基上,30℃静置厌氧培养。待可见菌落长成后挑取单克隆菌落进行菌落pcr并测序筛选转化子。
连接构建重组质粒pnz8148-rhes并电转化至乳酸乳球菌nz9000中,挑取阳性菌落扩增出的片段(1015bp)进行转化子鉴定,并进行电泳分离,如图3所示。
由图1-3结果可知,表明已成功构建转人内皮抑素的乳酸乳球菌nz9000-pnz-rhes。
(3)转人内皮抑素乳酸乳球菌的蛋白表达验证
挑取nz9000、nz9000-pnz8148、nz9000-pnz-rhes菌株单菌落接种至gm17培养基,30℃静置厌氧培养过夜;按1:25的比例转接后培养至od600达到0.3;加入10ng/ml乳酸链球菌素(nisin)溶液诱导2.5h;5000rpm离心5min,弃上清,磷酸缓冲盐溶液(pbs)洗涤并重悬,测量菌液od值并用pbs调整为每300μl菌液为1od的细菌浓度,在冰浴条件下超声破碎后添加1mg/ml溶菌酶于37℃孵育20min;加入上样缓冲液,混匀后95℃下水浴10min;采用12%的分离胶和浓缩胶进行sds-聚丙烯酰胺(sds-page)凝胶电泳,恒压80v浓缩、120v分离后用考马斯亮蓝染色液染色3h,脱色至蛋白条带清晰后进行成像拍照。
将野生型乳酸乳球菌nz9000、转空载质粒乳酸乳球菌nz9000-pnz8148以及转人内皮抑素乳酸乳球菌nz9000-pnz-rhes经乳酸链球菌素(nisin)诱导表达并利用超声及溶菌酶处理后进行考马斯亮蓝染色,如图4所示,结果说明,转人内皮抑素乳酸乳球菌nz9000-pnz-rhes较对照样品在20kd处条带明显,表明构建的重组乳酸乳球菌能成功表达人内皮抑素。
(4)重组乳酸乳球菌质粒的稳定性验证
小鼠b16f1黑色素瘤细胞培养至指数生长期后0.5%胰酶消化;800rpm离心5min,弃上清液,用pbs洗涤并重悬后进行细胞计数;将细胞终浓度调整为2×106个/ml;每只c57bl/6雌性小鼠腋下脂肪垫处接种100μl细胞悬液,即每只小鼠2×105个细胞接种量。接种小鼠继续饲养于清洁级动物房。
(5)分组及给药方法
本发明分别尝试了肝癌细胞株、胰腺癌细胞株、肺癌细胞株、结直肠癌细胞株、乳腺癌细胞株、宫颈癌细胞株、黑色素肿瘤细胞株接种的肿瘤模型,都显示出类似的良好的抗肿瘤效果,此处只列出代表性肿瘤的研究结果。
待小鼠肿瘤体积长至约100mm3,将荷瘤小鼠随机分为4组,分别为对照组、nz9000组、nz9000-pnz8148组、nz9000-pnz-rhes组。取新活化的乳酸乳球菌l.lactisnz9000、转空载质粒pnz8148重组乳酸乳球菌nz9000-pnz8148以及转人内皮抑素重组乳酸乳球菌nz9000-pnz-rhes转接至gm17液体培养基,30℃厌氧静置培养过夜;次日按1:25的比例转接继续培养;重组乳酸乳球菌nz9000-pnz8148和nz9000-pnz-rhes的菌液培养至od600达到0.3时添加10ng/mlnisin诱导2.5h;三种菌液5000rpm离心5min弃上清收集细菌,用含5%葡萄糖的无菌生理盐水洗涤两遍,重悬细菌并根据od值将细菌终浓度调整为2×109cfu/ml待用。nz9000组、nz9000-pnz8148组、nz9000-pnz-rhes组每只小鼠每天灌胃当日新鲜制备的菌液100μl,即每只小鼠灌胃的菌量为2×108cfu;对照组每只小鼠每天灌胃100μl含5%葡萄糖的无菌生理盐水。所有小鼠连续灌胃15天,每隔2天根据肿瘤体积公式v=0.52×长×宽2记录小鼠肿瘤大小数据和小鼠存活情况。
将重组乳酸乳球菌nz9000-pnz8148、nz9000-pnz-rhes单菌落在无抗条件下连续传代15代,每代携带质粒的重组乳酸乳球菌比例统计如图5所示,可以看出重组乳酸乳球菌在无抗性的培养基中连续传代15代每代携带质粒的菌量比大致相近,在操作误差范围内传代第15代的携带质粒的乳酸乳球菌仍占100%。从而可认为重组乳酸乳球菌的质粒能稳定传代15代或以上。
在小鼠接种2×105个/只b16f1黑色素瘤细胞后,第6天可以看见肿瘤黑点长成,肿瘤模型生成率为100%,每组连续给药15天内所记录的小鼠b16f1黑色素瘤的肿瘤生长情况如图6所示,可以看出,小鼠黑色素瘤肿瘤生长曲线根据graphpadprism7统计软件采用t检验比较两组间差异的分析,可以发现口饲转人内皮抑素的重组乳酸乳球菌具有显著抑制肿瘤生长的作用(****表示p<0.0001),口饲乳酸乳球菌和转空载质粒的乳酸乳球菌之间没有统计学差异,但是相较对照组均表现出能抑制肿瘤生长(****p<0.0001),由此可以得出结论:口饲乳酸乳球菌对小鼠黑色素瘤有治疗作用,而转人内皮抑素的重组乳酸乳球菌能显著性抑制小鼠黑色素瘤的生长。
每组连续给药15天内所记录的荷黑色素瘤小鼠的生存情况如图7所示,可以看出,荷黑色素瘤小鼠的生存情况根据graphpadprism7统计软件采用生存分析法(kaplan-meier法)分析发现,口饲乳酸乳球菌能延长荷瘤小鼠的生存期,且灌胃15天后对照组荷瘤小鼠存活率为25%,而nz9000-pnz-rhes组的小鼠存活率仍超过50%,证明口饲转人内皮抑素的乳酸乳球菌较对照组具有显著延长小鼠生存期的作用。
(6)肿瘤切片he染色
在无菌环境下取出小鼠的肿瘤制成石蜡切片;将石蜡切片依次放入二甲苯ⅰ20min-二甲苯ⅱ20min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-75%酒精5min-自来水洗脱蜡;切片入苏木素染液染3-5min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗;切片依次入85%、95%的梯度酒精脱水各5min,入伊红染液中染色5min;切片依次放入无水乙醇ⅰ5min-无水乙醇ⅱ5min-无水乙醇ⅲ5min-二甲苯ⅰ5min-二甲苯ⅱ5min透明,中性树胶封片;显微镜镜检,图像采集分析,如图8所示。
从图8可以看出,对照组肿瘤切片的细胞分布较完整,其他三组给药组的肿瘤细胞均有不同程度的坏死情况,其中nz9000-pnz-rhes组的肿瘤细胞坏死区最多,在视野范围内出现大面积的肿瘤细胞坏死,而nz9000组和nz9000-pnz8148组的肿瘤细胞有小部分坏死,但整体而言大部分的肿瘤细胞仍是完整的。结果证明口饲乳酸乳球菌会造成部分肿瘤细胞坏死,而口饲转人内皮抑素的重组乳酸乳球菌能造成肿瘤细胞大面积坏死,可以认为口饲转人内皮抑素重组乳酸乳球菌能促进肿瘤细胞的坏死从而抑制肿瘤生长。
本发明也尝试将其他常规的益生菌制剂方法应用于重组乳酸乳球菌制剂,不同的制剂形式都产生了较好地抗肿瘤以及抑制肿瘤生长、延长荷瘤模型生存期、促进肿瘤大面积坏死、抗肿瘤转移的效果;本发明还尝试像常规的抗肿瘤药物或食品一样,将乳酸乳球菌通过与常规抗肿瘤药物或治疗方法联合应用,能够进一步提高肿瘤治疗效果;本发明还尝试将重组乳酸乳球菌与常规抗黑色素肿瘤治疗药物或食品联合运用,能够进一步提高抗黑色素肿瘤效果。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!