用于治疗眼科疾病的特异性针对过度磷酸化τ蛋白的抗体的制作方法
本发明涉及一种新颖种类的单克隆抗体,其特异性地结合病理性过度磷酸化(PHF)τ蛋白上的磷酸化丝氨酸396残基(pS396),并且涉及在类视黄醇淀粉样变性、年龄相关性黄斑变性(ARMD)、和青光眼的治疗中使用这些分子以及它们的τ蛋白结合片段的方法。
序列表的引用
本申请包括根据37C.F.R.1.821等的一个或多个序列表,所述序列表以计算机可读介质披露(文件名称:1047-DK sequences_ST25.txt,创建于2017年12月12日,并且具有86kB的大小),将该文件通过引用以其全文并入本文。
背景技术:
包括淀粉样蛋白β(Ab)在内的胞外沉积是视网膜老化的特征。青光眼是全世界不可逆失明的主要原因,其特征在于视网膜神经节细胞(RGC)的选择性死亡。阻断Aβ可保护青光眼模型中的视网膜神经节细胞(Salt等人,2014)。虽然富含轴突的微管相关蛋白τ蛋白是阿尔茨海默氏病和其他τ蛋白病变的神经毒性的关键介质,但已经表明青光眼患者的眼和脑脊液中的Aβ和τ蛋白水平发生了改变(Nucci等人,2011)。一些证据表明,τ蛋白也可能损伤视网膜。Chiasseu(J Neurosci.[神经科学杂志]2016年5月25日;36(21):5785-98)揭示,青光眼展示出τ蛋白病变的特征性病理特征,包括τ蛋白积累、磷酸化改变和误分。
τ蛋白在微管动力学中起关键作用,其磷酸化引起细胞功能障碍,包括对维持细胞能量和细胞死亡信号传导至关重要的线粒体动力学失调。(effery Experimental Eye Research[实验眼科研究]147(2016)138-143)。
青光眼可通过激光手术或传统手术或滴眼剂治疗。滴眼剂是前列腺素类似物,它们通过增加眼液体的流出而起作用,并且具有一些全身副作用,并且与眼本身的变化有关;β受体阻滞剂,它们通过减少液体的产生起作用,并且具有全身副作用;α受体激动剂,它们既可以减少液体的产生,又可以增加排水;和碳酸酐酶抑制剂(CAI),它们通过减少眼内液的产生来降低眼压。将这些药物的组合用于有效治疗并不罕见。需要通过替代性行动机制开发新的治疗方案。
技术实现要素:
本发明涉及单克隆抗体及其表位结合片段,其能够特异性地结合至人类(2N4R同种型)τ蛋白(SEQ ID NO:1)的磷酸化残基丝氨酸396。这些抗体被进一步表征为它们在磷酸化残基396和404之间区分的能力,使得它们基本上不结合磷酸化404残基(SEQ ID NO:2)。
不受具体理论的束缚,来自诸位发明人的证据证明,在残基404处而不是在396处磷酸化的τ蛋白的存在下,本发明的抗体针对在残基396处磷酸化的人类τ蛋白的区分和选择性从病理和治疗角度上是显著的。本发明的这些抗体在非病理性但磷酸化的τ蛋白的存在下对于病理性τ蛋白具有选择性。在正常τ蛋白存在下,本发明的这些抗体能够耗减病理性τ蛋白的τ蛋白缠结。不受具体理论的束缚,认为τ蛋白(包含在τ蛋白位置396处已经磷酸化的τ蛋白)的缠结耗减会防止将病理性τ蛋白接种到τ蛋白缠结中。因此,本发明的一个方面涉及一种抗体,该抗体能够选择性地结合至396磷酸化τ蛋白,甚至当此类分子是在τ蛋白位置404处已经磷酸化的τ蛋白的存在下时。本发明的相关方面涉及一种抗体,该抗体能够选择性地结合至396磷酸化τ蛋白,甚至当此类分子是在非病原性τ蛋白的存在下时。进一步定义,本发明涉及一种针对病理性τ蛋白具有选择性的抗体,所述病理性τ蛋白是过度磷酸化τ蛋白,其在过表达τ蛋白的人类2N4R亚型的转基因小鼠中作为64kDa条带出现(通过蛋白质印迹分析)。
本发明的一个方面是针对一种抗τ蛋白抗体,其满足以下测试标准:i)该抗体并不结合至非磷酸化τ蛋白;ii)该抗体并不结合至在404处磷酸化且在396处非磷酸化的τ蛋白;iii)该抗体结合至在396处磷酸化的τ蛋白;以及iv)该抗体结合至在396和404两者处均磷酸化的τ蛋白。诸位发明人已经发现,在测试标准iii)和iv)下的结合是在同一数量级上,并且假定在位置404处的磷酸化不干扰也不增强该结合过程。诸位发明人已经进一步发现,与测试标准ii)相反,结合至一种在396处非磷酸化但在404处磷酸化的τ蛋白并不耗减在测试模型中的缠结或明显的病理性τ蛋白。
本发明的一个方面是针对抗τ蛋白抗体,该抗体与来自转基因小鼠的经免疫耗减的rTg4510提取物一起使用时,其特异性地以至少90%减少过度磷酸化τ蛋白64和70kDa条带,同时以不多于10%减少55kDaτ蛋白条带。本发明的另外的方面是针对抗τ蛋白抗体,该抗体特异性地以至少90%减少过度磷酸化τ蛋白64和70kDa条带,同时以不多于10%减少55kDaτ蛋白条带;或者当如本文所述的与来自人类AD尸体解剖后脑的提取物一起使用时,其具有特异性地以至少90%减少磷酸化S396过度磷酸化τ蛋白条带、同时以不多于10%减少非过度磷酸化τ蛋白条带的能力。
本发明的另一个方面是针对一种治疗患有脉络膜和视网膜障碍相关的τ蛋白病变的患者的方法,该方法包括耗减缠结或衰减所述缠结的进展,所述缠结包括过度磷酸化τ蛋白,所述方法包括使过度磷酸化τ蛋白与本发明的抗体接触,以使得该缠结被耗减,其过度磷酸化τ蛋白的含量得以减少,或者缠结形成的进展得以衰减。
可替代地定义的,本发明涉及一种治疗患有脉络膜和视网膜障碍相关的τ蛋白病变的患者的方法,所述方法包括使缠结与对具有磷酸化残基396的τ蛋白具有选择性的抗体接触,这样使得缠结耗减过度磷酸化τ蛋白。
更确切地说,本发明的一个实施例涉及使用选自C10-2抗体和C10-2变体、C5.2抗体、C8.3抗体和D1.2抗体的抗体治疗选自由脉络膜和视网膜障碍组成的组的τ蛋白病变,该脉络膜和视网膜障碍选自由以下组成的组:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。类似地,本发明针对选自C10-2抗体、C10-2变体、C5.2抗体、C8.3抗体和D1.2抗体的化合物,用于治疗选自下组的脉络膜和视网膜障碍,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。可替代地陈述的,本发明针对选自C10-2抗体、C10-2变体、C5.2抗体、C8.3抗体和D1.2抗体的化合物,用于在一种药物的制备中使用,该药物用于治疗选自下组的脉络膜和视网膜障碍,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
根据实施例,以下抗体可用于治疗如上定义的τ蛋白病变,特别是脉络膜和视网膜障碍:
本发明的一个方面针对单克隆抗体C10-2,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
本发明另外的方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
可替代地定义的,使用IMGT定义,本发明的一个方面针对单克隆抗体或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:40的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:41的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:42的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:43的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:44的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:45的氨基酸序列的重链CDR3。
可替代地定义的,使用Chotia定义,本发明的一个方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:52的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:53的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:54的氨基酸序列的重链CDR3。
本发明的一个方面涉及抗体C10-2、抗体D55E的变体抗体。本发明的此方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2以及
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
本发明针对抗体D55E的方面的另外的实施例涉及单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;
(b)包含SEQ ID NO:13的氨基酸序列的重链。
可替代地定义的,本发明针对抗体D55E的方面的另外的实施例涉及单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含以下中的至少一个:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2以及
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
本发明的另一方面涉及抗体C10-2、抗体D55Q的变体抗体。本发明的此方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:29的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
本发明针对抗体D55Q的方面的另外的实施例涉及单克隆抗体,或其表位结合片段的抗体,该抗体或其表位结合片段包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;和
(b)包含SEQ ID NO:14的氨基酸序列的重链。
可替代地定义的,本发明针对抗体D55Q的方面的另外的实施例涉及单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含以下中的至少一个:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:29的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
本发明的另一个方面涉及抗体C10-2、抗体D55S的变体抗体。本发明的此方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:30的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
本发明针对抗体D55S的方面的另外的实施例涉及单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链以及
(b)包含SEQ ID NO:15的氨基酸序列的重链。
可替代地定义的,本发明针对抗体D55S的方面的另外的实施例涉及单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含以下中的至少一个:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:30的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
使用抗体D55S、抗体D55Q、抗体D55E的研究表明,当在室温下用低pH持续很长一段时间处理抗体之前和之后比较时,该残基的突变导致所述抗体具有未改变的结合特性,当与预处理相比时,表明在低pH下没有发生异构化作用或任何异构化的蛋白具有未改变的结合特性。
本发明的另一个方面涉及抗体C10-2、抗体N32S的变体抗体。本发明的此方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
本发明针对抗体N32S的方面的另外的实施例涉及单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)包含SEQ ID NO:16的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
可替代地定义的,本发明针对抗体N32S的方面的另外的实施例涉及单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
抗体N32S的可替代的定义,使用IMGT定义,是单克隆抗体或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:46的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:47的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:48的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:43的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:44的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:45的氨基酸序列的重链CDR3。
抗体N32S的另外的可替代的定义,使用Chotia定义,是单克隆抗体或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:52的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:53的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:54的氨基酸序列的重链CDR3。
本发明另外的方面针对单克隆抗体C5.2,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:66的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:67的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:68的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:69的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:70的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:71的氨基酸序列的重链CDR3。
本发明另外的方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)包含SEQ ID NO:72的氨基酸序列的轻链;和
(b)包含SEQ ID NO:73的氨基酸序列的重链。
本发明另外的方面针对单克隆抗体C8.3,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:74的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:75的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:76的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:77的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:78的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:79的氨基酸序列的重链CDR3。
本发明另外的方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)包含SEQ ID NO:80的氨基酸序列的轻链;和
(b)包含SEQ ID NO:81的氨基酸序列的重链。
本发明另外的方面针对单克隆抗体D1.2,或其表位结合片段,该抗体或其表位结合片段包含:
(a)具有SEQ ID NO:58的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:59的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:60的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:61的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:62的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:63的氨基酸序列的重链CDR3。
本发明另外的方面针对单克隆抗体,或其表位结合片段,该抗体或其表位结合片段包含:
(a)包含SEQ ID NO:64的氨基酸序列的轻链;和
(b)包含SEQ ID NO:65的氨基酸序列的重链。
如上所述的抗体及其表位结合片段可用于治疗选自下组的脉络膜和视网膜τ蛋白病变障碍,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
本发明的另外的方面涉及单克隆抗体或其表位结合片段,或包含所述抗体或片段的制剂或药物组合物,其用于检测或测量受试者眼中所述τ蛋白的存在或量,其中所述抗体选自下组,该组由以下组成:C10-2抗体、C10-2变体、C5.2抗体、C8.3抗体和D1.2抗体。
本发明的另外的方面涉及延迟患者中脉络膜和视网膜障碍的进展的方法,该障碍选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性(ARMD)、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD,所述方法包括通过给予能够免疫特异性地结合至人类τ蛋白(SEQ ID NO:1)的磷酸化残基396的抗体,使得当残基396未被磷酸化时,抗体或其表位结合片段基本上不结合至在残基404处磷酸化的SEQ ID NO:1,以降低或减弱所述患者中病理性τ蛋白的积累。
附图说明
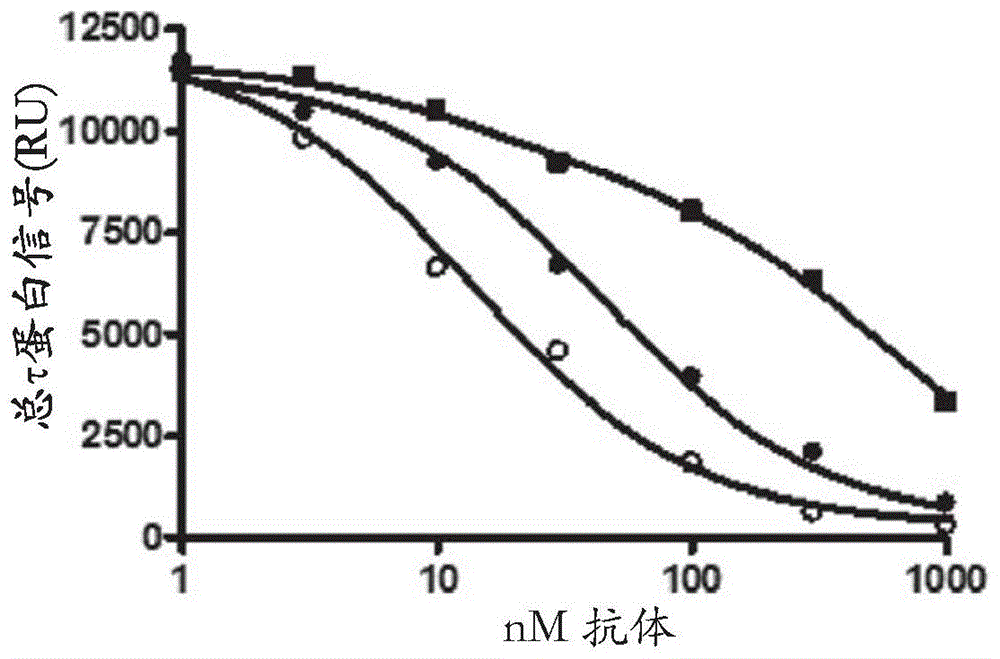
图1.使用人源化C10-2和C10-2变体(C10-2_N32S和C10-2_N32S_A101T)针对AD-P3捕获的液相抑制测定。由P396特异性抗体使用hC10-2(正方形)、hC10-2_N32S(黑色圆)和hC10-2_N332_A101T(空心圆)捕获的AD-P3的浓度依赖性抑制。将AD-P3抗原以增加浓度的抗体(0-1000nM)在r/t孵育60min,然后在用200ng/ml小鼠C10-2涂覆的孔中孵育。将捕获的AD-P3抗原用硫标记的抗总τ(MSD)进行检测。▄=c10-2,○=C10-2_N32S●=C10-2_N32S_A101T
将hC10-2_N32S(黑色圆)和hC10-2_N332_A101T(空心圆)C10-2变体的IC50分别计算为44nM和14nM。当比较图1的曲线时可以看出这是比C10-2显著的改进。因此,在本发明的一个方面中,这些抗体在本文所述的液相抑制测定中抑制AD-P3,这样使得在抗体的100nM或更少的浓度下(例如在50nM或更少的浓度下),该信号减少了50%。
图2.肽抑制测定说明了hC10-2及相关的C10-2变体的表观亲和力。在液相溶液中的抗体与Pτ(P396)386-408结合的浓度依赖性抑制。将人源化C10-2(正方形)、hC10-2_N32S(黑色圆)和1ng/ml hC10-2_N32_A101T(空心圆)与增加浓度(0-10000nM)的Pτ386-408(P396)在r/t孵育60min,然后在用100ng/ml Pτ386-408(P396/P404)涂覆的孔中孵育。用硫标记的抗人类IgG(MSD)检测结合良好的抗体。▄=c10-2(IC50=24nM),○=C10-2_N32S(IC50=50nM)●=C10-2_N32S_A101T(IC50=34nM)
图3.在阿尔茨海默氏病脑中和在rTg4510小鼠脑中的病理性τ蛋白的免疫组织化学检测。在来自3种不同的AD供体的前额叶皮质中,将hC10-2、hC10-2_N32S和hC10-2_N32S_A101T标记为神经原纤维缠结、神经毡线和营养不良性神经突。用最高浓度的抗体来检测最强的染色强度。对照脑切片缺少免疫反应性。将在患有晚期病变的rTg4510脑中的所有的3种抗体标记磷酸化τ蛋白。
染色从hC10-2向hC10-2_N32S并且向hC10-2_N32S_A101T加重。用hC10-2_N32S_A101T、然后用hC10-2_N32S,再然后用hC10-2检测最强的染色强度。hC10-2_N32S_A101T和hC10-2_N32S在低至100ng/mL的浓度下,进行在阿尔茨海默病脑中的病理性τ蛋白的免疫组织化学检测。
图4.静脉内注射hC10-2后在rTg4510小鼠的τ蛋白结构的修饰。(左图代表rTg4510;右图代表tTA)hC10-2特异性地标记在rTg4510脑中的海马体和皮质中的体内靶标结构,而非在对照tTA脑中进行标记。针对AlexaFluor488和Hoechst信号的成对的图像在海马体切片中示出。
图5.在rTg4510小鼠中τ蛋白结构的修饰,随后进行hC10-2_N32S的静脉内注射。(左图代表rTg4510;右图代表tTA)hC10-2_N32S特异性地标记在rTg4510脑中的海马体和皮质中的体内靶标结构,而非在对照tTA脑中进行标记。针对AlexaFluor488和Hoechst信号的成对的图像在海马体切片中示出。
图6.静脉内注射hC10-2_N32S_A101T后在rTg4510小鼠的τ蛋白结构的修饰。(左图代表rTg4510;右图代表tTA)hC10-2_N32S_A101T特异性地标记在rTg4510脑中的海马体和皮质中的体内靶标结构,而非在对照tTA脑中进行标记。针对AlexaFluor488和Hoechst信号的成对的图像在海马体切片中示出。
比较图4-6表明,hC10.2、hC10-2_N32S和hC10-2_N32S_A101T在静脉注射后穿过血脑屏障。这些图进一步表明,相比hC10-2,hC10-2_N32S和hC10-2_N32S_A101T标记靶标结构(对缠结的免疫反应性),具有改进结果的海马体和皮质。
图7.τ蛋白种类对阿尔茨海默氏病(AD)脑中的P-S396抗体具有免疫反应性。在AD脑切片中,τ蛋白缠结由E1和p396抗体共同标记,或对于单独P-S396抗体是阳性(箭头)的。
图8.通过蛋白质印迹检测病理性τ蛋白。图8A-8C.通过蛋白质印迹用hC10.2、hC10-2_N32S、hC10-2_N32S_A101T检测病理性τ蛋白。从在32周龄安乐死的三只rTg4510小鼠和非转基因的(非tg)对照同窝仔中收集前脑,并且从四只AD小鼠和四只健康的对照(HC)供体中收集皮质标本,分别将其分级为可溶性(S1)、TBS-可溶性沉淀(S1p)和肌氨酰不可溶性(P3)级分,并且通过蛋白质印迹针对在P-S396表位处的磷酸化τ蛋白,用1μg/ml hC10.2(A)、hC10-2_N32S(B)、hC10-2_N32S_A101T(C)进行分析。在rTg4510中,正常人类4R0Nτ蛋白显示为55kDa,而过度磷酸化τ蛋白种类显示为64和70kDa。在AD中,过度磷酸化τ蛋白种类显示为具有可变量的AD典型涂片的54kDa、64kDa、69kDa、和74kDa四个条带。
相比于非转基因小鼠,针对rTg4510小鼠的τ蛋白,以及相比于健康的对照供体,针对AD供体,每个hC10-2、hC10-2_N32S和hC10-2_N32S_A101T是可选择性的。此外,相比于正常rTg4510小鼠的τ蛋白55kDa蛋白,在可溶性(S1)、TBS-可溶性沉淀(S1p)和肌氨酰不可溶性(P3)级分中,每个hC10-2、hC10-2_N32S和hC10-2_N32S_A101T对于rTg4510小鼠的病原性τ蛋白64kDa蛋白是选择性的。
图9.来自AD脑的τ蛋白免疫沉淀反应。来自AD脑的具有hC10.2、hC10-2_N32S、hC10-2_N32S_A101T的τ蛋白免疫沉淀反应。τ蛋白的免疫沉淀反应,具有10μg hC10.2、hC10-2_N32S、hC10-2_N32S_A101T,来自从四个AD和健康对照(HC)供体中汇集的皮质的脑匀浆物的500μg预澄清的裂解物的人类IgG1对照(hIgG1),并且通过蛋白质印迹,用多克隆兔抗pS396τ蛋白(pS396τ蛋白)抗体进行分析。在AD中,过度磷酸化τ蛋白种类显示为具有可变量的AD典型涂片的54kDa、64kDa、69kDa、和74kDa四个条带。
图10.通过Cisbio测定的τ蛋白聚集的定量。Wt(野生型)接种材料(WW)显示出无接种并且从所有接种的样品中减去背景信号。相反,tg4510匀浆(CC)有效接种。这种接种效应不受用B12处理的影响,但部分地通过用τ蛋白抗体(hC10-2_N32S_A101T>hC10-2_N32S>hC10-2)处理而逆转。代表四个独立样品组的汇集的结果的图,并且将其绘制为相对的τ蛋白聚集(超出针对总蛋白归一化的背景的信号倍数),并且相对的不可溶性p396τ蛋白是通过曲通-X不可溶性级分(超过归一化背景的信号倍数)的蛋白质印迹的密度测定法进行定量的。将所有的样品归一化为同种型对照抗体B12。
图11.使用不同量的hC10-2和2.10.3抗体,阿尔茨海默氏病脑提取物的免疫耗减后τ5蛋白质印迹信号的定量。两种抗体均确实从阿尔茨海默氏病脑提取物去除了小部分的总τ蛋白。▲=2.10.3免疫耗减的;◆=hC10-2免疫耗减的
图12.使用不同量的hC10-2和2.10.3抗体,阿尔茨海默氏病脑提取物的免疫耗减后P-S422τ蛋白质印迹信号的定量。该图显示通过免疫耗减,使用hC10-2或2.10.3,可以将在丝氨酸422处磷酸化的τ蛋白从阿尔茨海默氏病脑提取物中有效地去除。两种抗体确实去除了多于90%P-S422τ蛋白,尽管需要更多的2.10.3抗体才能达到该相同的效果。
图13.使用不同量的hC10-2和2.10.3抗体,阿尔茨海默氏病脑提取物的免疫耗减后P-S396τ蛋白质印迹信号的定量。hC10-2免疫耗减去除了在丝氨酸396处磷酸化的88%的τ蛋白,而2.10.3仅从阿尔茨海默氏病脑提取物中去除了55%的P-S396τ蛋白。▲=2.10.3免疫耗减的;◆=hC10-2免疫耗减的
图14.使用不同量的hC10-2和2.10.3抗体,阿尔茨海默氏病脑提取物的免疫耗减后P-S199/202τ蛋白质印迹信号的定量hC10-2免疫耗减清除69%的在丝氨酸199/202处被磷酸化的τ蛋白。该2.10.3抗体没有给出相同的剂量依赖性降低。▲=2.10.3免疫耗减的;◆=hC10-2免疫耗减的
图15.免疫耗减之前和之后在蛋白质印迹上的阿尔茨海默氏病脑提取物。存在在丝氨酸396处的25kDa磷酸化的τ蛋白片段。使用hC10-2的免疫耗减导致该25kDaτ蛋白条带的降低。这2种其他的磷酸化特异性抗体2.10.3和AT8没有去除该25kDa种类。
图16.使用不同量的hC10-2变体N32S、N32Q、N32S_A101T、N32Q_A101T、N32Q_D55E和N32S_D55E,阿尔茨海默氏病脑提取物的免疫耗减后P-S396τ蛋白质印迹信号的定量。从阿尔茨海默脑匀浆中去除在丝氨酸396处磷酸化的τ蛋白的能力是显著的。在小于0.1μg的抗体(在75ng处的数据点)的情况下,C10-2变体导致S-P396信号减少至少28%(除了N32Q,D55E,其减少16%),然而该C10.2导致了S-P396信号的减少低于6%。▄=c10-2,□=C10-2_N32S◆=C10-2_N32S_D55E,==C10-2_N32Q,●=C10-2_N32Q_D55E,▲=2hC10-2_N32S;Δ=hC10-2_N32Q
图17.由注射阿尔茨海默氏病脑提取物导致的τ蛋白缠结该海马体的接种。该mC10-2处理显著地以57%(P<0.05)降低了在接种的海马体中的缠结病变。存在明显的趋势表明hC10-2还降低病变。通过对比,2.10.3没有显示出效果。
图18.残基P-Ser396和Tyr394位于抗原结合位点的中心
示出Ile(392)-VAL(393)-Tyr(394)-Lys(395)-P-Ser(396)-Pro(397)-Val(398)的结构。与本发明的抗体的主要相互作用涉及疏水口袋,τ蛋白肽的P-Ser396和Y394。形成了广泛氢键网络,并且存在具有P-Ser396的膦酸酯的Y(394)侧链与骨架之间的电荷/极性相互作用。本发明的抗体的HC CDR1包括回文的8-残基基序极性AA-疏水的AA-极性的AA-带电荷的AA-带电荷的AA-极性的AA-疏水的AA-极性的AA(Thr-Phe-Thr-Asp-Arg-Thr-Ile-His)。这些带电荷的残基通过由抗体和τ蛋白之间的氢键、电荷/电荷以及电荷/极性相互作用形成的广泛键合网络进行相互作用。
图19.(图A-D)在MSD中结合至病理性P3材料
图呈现了中尺度发现公司(Meso Scale Discovery(MSD))ELISA中D1.2(图A)、C5-2(图B)、C10-2(图C)和C8-3(图D)结合至从人类AD和非患病对照脑中分离的τ蛋白的结果(实例9)。将分离自疾病(AD)和健康对照脑中的τ蛋白固定在ELISA板上可以用于证明本发明中的抗体特异性地结合病理性τ蛋白种类。增加抗体的浓度导致饱和结合。结合的抗体的量是用第二抗-小鼠抗体检测。
通过引用引入的序列
SEQ ID NO:1人类τ蛋白(2N4R)
SEQ ID NO:2τ蛋白残基386-408(pS396,pS404)
SEQ ID NO:3C10-2轻链CDR1
SEQ ID NO:4C10-2轻链CDR2
SEQ ID NO:5C10-2轻链CDR3
SEQ ID NO:6C10-2重链CDR1
SEQ ID NO:7C10-2重链CDR2
SEQ ID NO:8C10-2重链CDR3
SEQ ID NO:9小鼠C10-2轻链
SEQ ID NO:10小鼠C10-2重链
SEQ ID NO:11人源化C10-2重链
SEQ ID NO:12人源化C10-2轻链
SEQ ID NO:13人源化C10-2重链变体D55E
SEQ ID NO:14人源化C10-2重链变体D55Q
SEQ ID NO:15人源化C10-2重链变体D55S
SEQ ID NO:16人源化C10-2轻链变体N32S
SEQ ID NO:17人源化C10-2轻链变体N32Q
SEQ ID NO:18人源化C10-2轻链变体N34S
SEQ ID NO:19人源化C10-2轻链变体N34Q
SEQ ID NO:20人源化C10-2轻链变体N32S,N34S
SEQ ID NO:21人源化C10-2轻链变体N32Q,N34S
SEQ ID NO:22人源化C10-2轻链变体N32Q,N34Q
SEQ ID NO:23人源化C10-2轻链变体N32S,N34Q
SEQ ID NO:24人源化C10-2重链变体A101T
SEQ ID NO:25人源化C10-2重链变体D55E,A101T
SEQ ID NO:26人源化C10-2重链变体D55Q,A101T
SEQ ID NO:27人源化C10-2重链变体D55S,A101T
SEQ ID NO:28人源化C10-2重链CDR2变体D55E
SEQ ID NO:29人源化C10-2重链CDR2变体D55Q
SEQ ID NO:30人源化C10-2重链CDR2变体D55S
SEQ ID NO:31人源化C10-2轻链CDR1变体N32S
SEQ ID NO:32人源化C10-2轻链CDR1变体N32Q
SEQ ID NO:33人源化C10-2轻链CDR1变体N34S
SEQ ID NO:34人源化C10-2轻链CDR1变体N34Q
SEQ ID NO:35人源化C10-2轻链CDR1变体N32S,N34S
SEQ ID NO:36人源化C10-2轻链CDR1变体N32Q,N34S
SEQ ID NO:37人源化C10-2轻链CDR1变体N32Q,N34Q
SEQ ID NO:38人源化C10-2轻链CDR1变体N32S,N34Q
SEQ ID NO:39人源化C10-2重链CDR3变体A101T
SEQ ID NO:40IMGT编号人源化C10-2轻链CDR1
SEQ ID NO:41IMGT编号人源化C10-2轻链CDR2
SEQ ID NO:42IMGT编号人源化C10-2轻链CDR3
SEQ ID NO:43IMGT编号人源化C10-2重链CDR1
SEQ ID NO:44IMGT编号人源化C10-2重链CDR2
SEQ ID NO:45IMGT编号人源化C10-2重链CDR3
SEQ ID NO:46IMGT编号人源化C10-2轻链CDR1变体N32S
SEQ ID NO:47IMGT编号人源化C10-2轻链CDR2变体N32S
SEQ ID NO:48IMGT编号人源化C10-2轻链CDR3变体N32S
SEQ ID NO:49IMGT编号人源化C10-2重链CDR1变体A101T
SEQ ID NO:50IMGT编号人源化C10-2重链CDR2变体A101T
SEQ ID NO:51IMGT编号人源化C10-2重链CDR3变体A101T
SEQ ID NO:52Chotia编号人源化C10-2重链CDR1
SEQ ID NO:53Chotia编号人源化C10-2重链CDR2
SEQ ID NO:54Chotia编号人源化C10-2重链CDR3
SEQ ID NO:55Chotia编号人源化C10-2重链CDR1变体A101T
SEQ ID NO:56Chotia编号人源化C10-2重链CDR2变体A101T
SEQ ID NO:57Chotia编号人源化C10-2重链CDR3变体A101T
SEQ ID NO:58D1.2轻链CDR1
SEQ ID NO:59D1.2轻链CDR2
SEQ ID NO:60D1.2轻链CDR3
SEQ ID NO:61D1.2重链CDR1
SEQ ID NO:62D1.2重链CDR2
SEQ ID NO:63D1.2重链CDR3
SEQ ID NO:64D1.2轻链
SEQ ID NO:65D1.2重链
SEQ ID NO:66C5.2轻链CDR1
SEQ ID NO:67C5.2轻链CDR2
SEQ ID NO:68C5.2轻链CDR3
SEQ ID NO:69C5.2重链CDR1
SEQ ID NO:70C5.2重链CDR2
SEQ ID NO:71C5.2重链CDR3
SEQ ID NO:72C5.2轻链
SEQ ID NO:73C5.2重链
SEQ ID NO:74C8.3轻链CDR1
SEQ ID NO:75C8.3轻链CDR2
SEQ ID NO:76C8.3轻链CDR3
SEQ ID NO:77C8.3重链CDR1
SEQ ID NO:78C8.3重链CDR2
SEQ ID NO:79C8.3重链CDR3
SEQ ID NO:80C8.3轻链
SEQ ID NO:81C8.3重链
发明详述
本发明基于τ蛋白抗体的开发,该抗体对过度磷酸化的病原性P-S396τ蛋白具有高选择性,并且在Tg4510小鼠的τ蛋白和人类眼中都与视网膜结合。本发明基于出人意料的发现:浓度低至1μg/mL的本发明的抗体对过度磷酸化的病原性P-S396τ蛋白具有高度特异性,并且对人类视网膜的标记切片具有高度特异性。本发明针对眼科疾病的治疗,包括青光眼和年龄相关性黄斑变性(AMD)。眼科疾病可能是由于阿尔茨海默氏病(AD)的早期阶段,并且是前驱AD的体征或可能与AD无关。本发明针对使用本发明的抗体治疗选自下组的脉络膜和视网膜障碍,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
如本文使用的,术语“τ蛋白(tau)”与“τ蛋白(tau protein)”是同义的,并且是指τ蛋白亚型的任一种(例如在UniProt中鉴定为P10636,1-9)。本文使用的τ蛋白的氨基酸编号是相对于如以下所示的亚型2(SEQ ID NO:1)给出的,其中甲硫氨酸(M)是氨基酸残基1:
SEQ ID NO:1:
MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT
PTEDGSEEPG SETSDAKSTP TAEDVTAPLV DEGAPGKQAA AQPHTEIPEG TTAEEAGIGD TPSLEDEAAG HVTQARMVSK SKDGTGSDDK KAKGADGKTK IATPRGAAPP GQKGQANATR IPAKTPPAPK TPPSSGEPPK SGDRSGYSSP GSPGTPGSRS RTPSLPTPPT REPKKVAVVR TPPKSPSSAK SRLQTAPVPM PDLKNVKSKI GSTENLKHQP GGGKVQIINK KLDLSNVQSK CGSKDNIKHV PGGGSVQIVY KPVDLSKVTS KCGSLGNIHH KPGGGQVEVK SEKLDFKDRV QSKIGSLDNI THVPGGGNKK IETHKLTFRE NAKAKTDHGA EIVYKSPVVS GDTSPRHLSN VSSTGSIDMV DSPQLATLAD EVSASLAKQG L
本发明涉及抗体及其表位结合片段,它们能够特异性地结合至τ蛋白,并且特别是人类τ蛋白,并且在一个实施例中展现出能够特异性地结合至人类τ蛋白的磷酸化S396残基(pS396)。本发明的抗体及其表位结合片段进一步表征为不能或基本上不能特异性地结合至人类τ蛋白上的磷酸化404(pS404)残基,例如在抗体限制或非饱和条件下。此外,在pS404处的磷酸化并不干扰特异性结合至pS396。如本文使用的,符号“pS”和“{p}S”表示氨基酸残基磷酸化丝氨酸。如本文使用的,如果相对于另一个表位,抗体与表位的结合是用这样的其他表位观察到的结合的小于20%、小于10%、小于5%、小于2%并且更优选小于1%,那么该抗体“基本上”不能结合至该表位。
τ蛋白的磷酸化状态改变其内在功能和对微管的结合亲和力。过度磷酸化的τ蛋白将聚集成寡聚体和原纤维,并且然后在神经元的树突区室中形成神经原纤维缠结
本发明上下文中的术语“抗体(Ab)”是指免疫球蛋白分子,或根据本发明的一些实施例是指能够与分子(“抗原”)的表位特异性结合的免疫球蛋白分子的片段。天然存在的抗体典型地包括四聚体,它典型地由至少两条重(H)链和至少两条轻(L)链构成。每条重链由重链可变结构域(本文缩写为VH)和重链恒定结构域构成,重链恒定结构域通常由3个结构域(CH1、CH2和CH3)构成。重链可以具有任何同种型,包括IgG(IgG1、IgG2、IgG3和IgG4亚型)。每个轻链是由轻链可变结构域(本文缩写为VL)和轻链恒定结构域(CL)构成。轻链包括κ链和λ链。重链和轻链可变结构域典型地负责抗原识别,而重链和轻链恒定结构域可以介导免疫球蛋白与宿主组织或因子(包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(C1q))的结合。该VH和VL结构域可以进一步细分为高变性结构域,称为“互补决定区”,其穿插有更保守序列的结构域(称为“框架区”(FR))。每个VH和VL由三个CDR结构域和四个FR结构域构成,按以下顺序从氨基末端排到羧基末端:FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。重链和轻链可变结构域含有与抗原相互作用的结合结构域。特别相关的是抗体与其表位结合片段,它们已经被“分离”以在一种照物理环境存在,该物理环境不同于它们在自然界中存在的环境,或者它们已经被修饰以在氨基酸序列方面不同于天然存在的抗体。
术语“表位”意指能够特异性地结合至抗体的抗原决定簇。表位通常由例如氨基酸或糖侧链分子的表面基团组成,并且通常具有特定的三维结构特征以及特定的电荷特征。构象表位和线性表位的区别在于,在变性溶剂的存在下常常丧失与前者而非后者的结合。表位可以包含直接涉及于结合中的氨基酸残基和其他未直接涉及于结合中的氨基酸残基,例如被特异性表位结合肽有效阻断的氨基酸残基(换言之,该氨基酸残基是在特异性表位结合肽的足迹内)。
如本文使用的,术语“抗体的表位结合片段”意指抗体的片段、部分、区域或结构域(无论它如何产生(例如,经由切割、重组、合成,等)),其能够特异性地结合至表位。表位结合片段可以包含这种抗体的CDR结构域的1、2、3、4、5或所有6个,并且虽然能够特异性地结合至这种表位,但可以展现对这种表位的不同于这种抗体的特异性、亲和力或选择性。然而,优选地,表位结合片段将包含这种抗体的所有6个CDR结构域。抗体的表位结合片段可以是单一多肽链的部分或者包括单一多肽链(例如scFv),或者可以是两个或更多个多肽链的部分或者包括两个或更多个多肽链,各自具有氨基末端和羧基末端(例如,抗体、Fab片段、Fab2片段等)。可以获得展现表位结合活性的抗体的片段,例如通过完整抗体的蛋白酶切割。更优选地,虽然Fv片段的两个结构域VL和VH天然地由单独基因编码,编码此类基因序列的多核苷酸(例如它们的编码cDNA)可以使用重组方法通过能将所述VL和VH产生为单一蛋白链的柔性接头进行连接,在该单一蛋白链中VL和VH区关联以形成单价表位结合分子(称为单链Fv(scFv);参见例如,Bird等人,(1988)Science[科学]242:423-426;和Huston等人(1988)Proc.Natl.Acad.Sci.(U.S.A.)[美国国家科学院院刊]85:5879-5883)。可替代地,通过采用太短的柔性接头(例如,小于约9个残基)以使得单一多肽链的VL和VH结构域能够关联在一起,可以形成双特异性抗体、双体、或类似分子(其中两个这样的多肽链关联在一起以形成二价表位结合分子)(关于双体的说明参见例如PNAS USA 90(14),6444-8(1993))。本发明所涵盖的表位结合片段的实例包括(i)Fab'或Fab片段,由VL、VH、CL和CH1结构域组成的单价片段,或如描述于WO 2007059782中的单价抗体;(ii)F(ab')2片段,包含两个由二硫键在铰链结构域连接的Fab片段的二价片段;(iii)Fd片段,实质上由VH和CH1结构域组成;(iv)Fv片段,实质上由VL和VH结构域组成,(v)dAb片段(Ward等人,Nature[自然]341,544-546(1989)),实质上由VH结构域组成,并且还称为结构域抗体(Holt等人;Trends Biotechnol.[生物技术趋势]2003年11月;2i(ll):484-90);(vi)骆驼抗体或纳米抗体(Revets等人;Expert Opin Biol Ther.[生物理论专家观点]2005年1月;5_(l):l ll-24)以及(vii)分离的互补决定区(CDR)。此外,虽然该Fv片段的两个结构域VL和VH是由单独的基因编码,它们可以使用重组方法通过能将所述VL和VH产生为单一蛋白链的合成接头来进行连接,在所述单一蛋白链中VL和VH结构域配对以形成单价分子(称为单链抗体或单链Fv(scFv),参见例如博尔德(Bird)等人,科学(Science)242,423-426(1988)和休斯顿(Huston)等人,美国国家科学院院刊(PNAS USA)85,5879-5883(1988))。本文进一步讨论在本发明的上下文中的这些和其他有用抗体片段。还应理解的是,术语抗体,除非另外指明,否则还包括抗体样多肽(例如嵌合抗体和人源化抗体)、以及保留特异性地结合至抗原的能力的抗体片段(表位结合片段),它们是通过任何已知的技术提供的,例如酶切割、肽合成、以及重组技术。这样产生的抗体可以具有任何同种型。如本文使用的,“同种型”是指由重链恒定结构域基因编码的免疫球蛋白类别(例如IgG1、IgG2、IgG3或IgG4)。使用本领域的普通技术人员已知的常规技术获得此类抗体片段;可以按与完整抗体相同的方式针对实用性容易地对能够与所希望的表位结合的适合片段进行筛选。
术语“双特异性抗体”是指包含两个独立表位结合片段的抗体,每个表位结合片段靶向独立的靶标。这些靶标可以是存在于不同蛋白质上的表位或存在于相同靶标上的不同表位。可以使用亲本单特异性二价抗体分子的HC的恒定结构域中的补偿氨基酸变化制备双特异性抗体分子。所得异源二聚体抗体含有一个由两个不同亲本单特异性抗体贡献的Fab。Fc结构域中的氨基酸变化导致具有随时间稳定的双特异性的异源二聚体抗体的稳定性增加。(Ridgway等人,Protein Engineering[蛋白质工程]9,617-621(1996);Gunasekaran等人,JBC 285,19637-1(2010);Moore等人,MAbs 3:6 546-557(2011);Strop等人,JMB[生物化学杂志]420,204-219(2012);Metz等人,Protein Engineering[蛋白质工程]25:10 571-580(2012);Labrijn等人,PNAS[美国国家科学院院刊]110:113,5145-5150(2013),Spreter Von Kreudenstein等人,MAbs[MAbs杂志]5:5 646-654(2013))。双特异性抗体还可以包括使用ScFv融合体产生的分子。然后将两个单特异性scfv独立地连接至能够形成稳定异源二聚体的Fc结构域,以产生单个双特异性分子(Mabry等人,PEDS[蛋白质工程、设计和选择]23:3 115-127(2010))。双特异性分子具有双重结合能力。
如本文和在图中使用的术语“C10-2”、“人类C10-2”、“hC10-2”、“HC10-2”、“hC10.2”、“人源化C10-2”和“人源化C10-2”旨在意指是同义的,并且被定义为抗体C10-2。该术语旨在表示抗体或其表位结合片段,包含抗体轻链可变结构域或由抗体轻链可变结构域组成,该抗体轻链可变结构域具有:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
以及抗体重链可变结构域,该抗体重链可变结构域具有:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
抗体C10-2是人源化抗体,其可以被定义为包含SEQ ID NO:11的重链、SEQ ID NO:12的轻链,或两者。本发明的一个实施例针对抗体或其表位结合片段,其包含SEQ ID NO:11的重链和SEQ ID NO:12的轻链。
如本文和在图中使用的术语“mC10-2”旨在意指小鼠抗体C10-2,并且由SEQ ID.NO.9和10定义。小鼠抗体C10.2被用作对照抗体,并且不是本发明的一部分。
如本文和在图中使用的,术语“hC10-2_N32S”和“C10-2_N32S”旨在意指是同义的,并且是抗体C10-2的变体,其中该轻链已经突变为至少包含从N至S的氨基酸残基32的突变,并且被定义为抗体N32S。如本文和在图中使用的术语“hC10-2_N32Q”和“C10-2_N32Q”旨在意指是同义的,并且是抗体C10-2的变体,其中该轻链已经突变为至少包含从N至Q的氨基酸残基32的突变,并且被定义为抗体N32Q。
如本文和在图中使用的术语“hC10-2_N34S”和“C10-2_N34S”旨在意指是同义的,并且是抗体C10-2的变体,其中该轻链已经突变为至少包含从N至S的氨基酸残基34的突变,并且被定义为抗体N34S。如本文和在图中使用的术语“hC10-2_N34Q”和“C10-2_N34Q”旨在意指是同义的,并且是抗体C10-2的变体,其中该轻链已经突变为至少包含从N至Q的氨基酸残基34的突变,并且被定义为抗体N34Q。
如本文和在图中使用的术语“hC10-2_N32S_N34S”和“C10-2_N32S_N34S”旨在意指是同义的,并且是抗体C10-2的变体,其中该轻链已经突变为至少包含从N至S的氨基酸残基32和34的突变,并且被定义为抗体N32S、N34S。如本文和在图中使用的术语“hC10-2_N32Q_N34S”和“C10-2_N32Q_N34S”旨在意指是同义的,并且是抗体C10-2的变体,其中该轻链已经分别突变为至少包含从N至Q和从N至S的氨基酸残基32和34的突变,并且被定义为抗体N32Q、N34S。如本文和在图中使用的术语“hC10-2_N32Q_N34Q”和“C10-2_N32Q_N34Q”旨在意指是同义的,并且是抗体C10-2的变体,其中该轻链已经突变为至少包含从N至Q的氨基酸残基32和34的突变,并且被定义为抗体N32Q、N34Q。如本文和在图中使用的术语“hC10-2_N32S_N34Q”和“C10-2_N32S_N34Q”旨在意指是同义的,并且是抗体C10-2的变体,其中该轻链已经分别突变为至少包含从N至S和从N至Q的氨基酸残基32和34的突变,并且被定义为抗体N32S、N34Q。
如本文和在图中使用的术语“hC10-2_D55E”和“C10-2_D55E”旨在意指是同义的,并且是抗体C10-2的变体,其中该重链已经突变为至少包含从D至E的氨基酸残基55的突变,并且被定义为抗体D55E。如本文和在图中使用的术语“hC10-2_D55Q”,“C10-2_D55Q”旨在意指是同义的,并且是抗体C10-2的变体,其中该重链已经突变为至少包含从D至Q的氨基酸残基55的突变,并且被定义为抗体D55Q。如本文和在图中使用的术语“hC10-2_D55S”,“C10-2_D55S”旨在意指是同义的,并且是抗体C10-2的变体,其中该重链已经突变为至少包含从D至S的氨基酸残基55的突变,并且被定义为抗体D55S。
如本文和在图中使用的术语“hC10-2_A101T”和“C10-2_A101T”旨在意指是同义的,并且是抗体C10-2的变体,其中该重链已经突变为至少包含从A至T的氨基酸残基101的突变,并且被定义为抗体A101T
如本文和在图中使用的术语“hC10-2_N32S_A101T”、“C10-2_N32S_A101T”、“hC10-2_A101T_N32S”和“C10-2_A101T_N32S”旨在意指是同义的,并且是抗体C10-2的变体,其中该重链已经突变为至少包含从A至T的氨基酸残基101的突变,并且其中该轻链已经突变为至少包含从N至S氨基酸残基32的突变,并且被定义为抗体N32S、A101T。
如本文和在图中使用的术语“hC10-2_N32Q_A101T”、“C10-2_N32Q_A101T”、“hC10-2_A101T_N32Q”和“C10-2_A101T_N32Q”旨在意指是同义的,并且是抗体C10-2的变体,其中该重链已经突变为至少包含从A至T的氨基酸残基101的突变,并且其中该轻链已经突变为至少包含从N至Q的氨基酸残基32的突变,并且被定义为抗体N32Q、A101T。
如本文所用的,术语“人抗体”(其可以缩写为“humAb”)旨在包括具有衍生自人种系免疫球蛋白序列的可变结构域和恒定结构域的抗体。本发明的人抗体可以包括不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,在体外通过随机或位点特异性诱变或在基因重排期间或在体内通过体细胞突变引入的突变)。
如本文所用的,术语“单克隆抗体”或“单克隆抗体组合物”是指单分子组合物的抗体分子制剂。常规的单克隆抗体组合物表现出对特定表位的单一结合特异性和亲和力。在某些实施例中,单克隆抗体可以由多于一种Fab结构域构成,由此增加对多于一种靶标的特异性。术语“单克隆抗体”或“单克隆抗体组合物”并不旨在受限于任何具体产生方法(例如,重组的、转基因的、杂交瘤等)。
本发明的这些抗体及其表位结合片段将优选是“人源化”的,特别是当被采用以用于治疗目的时。术语“人源化”是指一种通常使用重组技术制备的分子,具有从来自非人类物种的免疫球蛋白衍生的表位结合位点,以及基于人类免疫球蛋白的结构和/或序列的剩余免疫球蛋白结构。该表位结合位点可包括与人类恒定结构域融合的完整非人类抗体可变结构域,或者包括此类可变结构域的接枝到人类可变结构域的适当人类框架区上的仅互补决定区(CDR)。此类人源化分子的构架残基可以是野生型的(例如,全人的)或者它们可以被修饰成包含一种或多种未在其序列已经充当人源化基础的人抗体中发现的氨基酸取代。人源化减小或消除该分子的恒定结构域充当人个体中的免疫原的可能性,但是仍存在对外源可变结构域做出免疫应答的可能性(LoBuglio,A.F.等人(1989)“Mouse/Human Chimeric Monoclonal Antibody In Man:Kinetics And Immune Response[人体内的小鼠/人嵌合单克隆抗体:动力学与免疫应答],”Proc.Natl.Acad.Sci.(U.S.A.)[美国国家科学院院刊]86:4220-4224)。另一种方法不仅集中于提供人衍生的恒定结构域,还集中于修饰可变结构域以便将它们改造地尽可能接近人形式。已知的是,重链和轻链两者的可变结构域都含有三个互补决定区(CDR),它们应答于所讨论的抗原而改变并且决定结合能力,其侧翼为四个构架区(FR),这些构架区在给定物种中是相对保守的并且推定为CDR提供支架。当相对于特定抗原制备非人抗体时,可以通过在有待修饰的人抗体中存在的FR上接枝衍生自非人抗体的CDR来“改造”或“人源化”可变结构域。这种方法应用至不同抗体已经由以下报道:Sato,K.等人,(1993)Cancer Res[癌症研究]53:851-856。Riechmann,L.等人(1988)“Reshaping Human Antibodies for Therapy[改造人抗体用于疗法],”Nature[自然]332:323-327;Verhoeyen,M.等人(1988)“Reshaping Human Antibodies:Grafting An Antilysozyme Activity[改造人抗体:接枝抗溶菌酶活性],”Science[科学]239:1534-1536;Kettleborough,C.A.等人(1991)“Humanization Of A Mouse Monoclonal Antibody By CDR-Grafting:The Importance Of Framework Residues On Loop Conformation[通过CDR-接枝人源化小鼠单克隆抗体:框架残基在环构象中的重要性],”Protein Engineering[蛋白质工程]4:773-3783;Maeda,H.等人(1991)“Construction Of Reshaped Human Antibodies With HIV-Neutralizing Activity[具有HIV中和活性的经改造的人抗体的构建],”Human Antibodies Hybridoma[人抗体杂交瘤]2:124-134;Gorman,S.D.等人(1991)“Reshaping A Therapeutic CD4Antibody[改造治疗性CD4抗体],”Proc.Natl.Acad.Sci.(U.S.A.)[美国国家科学院院刊]88:4181-4185;Tempest,P.R.等人(1991)“Reshaping A Human Monoclonal Antibody To Inhibit Human Respiratory Syncytial Virus Infection in vivo[改造人单克隆抗体以抑制人呼吸道合胞病毒的体内感染],”Bio/Technology[生物/技术]9:266-271;Co,M.S.等人(1991)“Humanized Antibodies For Antiviral Therapy[用于抗病毒疗法的人源化抗体],”Proc.Natl.Acad.Sci.(U.S.A.)[美国国家科学院院刊]88:2869-2873;Carter,P.等人(1992)“Humanization Of An Anti-p185her2Antibody For Human Cancer Therapy[抗p185her2抗体的人源化用于人癌症疗法],”Proc.Natl.Acad.Sci.(U.S.A.)[美国国家科学院院刊]89:4285-4289;和Co,M.S.等人(1992)“Chimeric And Humanized Antibodies With Specificity For The CD33Antigen[具有针对CD33抗原的特异性的嵌合和人源化抗体],”J.Immunol.[免疫学杂志]148:1149-1154。在一些实施例中,人源化抗体保留所有CDR序列(例如,含有来自小鼠抗体的所有六个CDR的人源化小鼠抗体)。在其他实施例中,人源化抗体具有一个或多个CDR(一个、两个、三个、四个、五个、六个),它们相对于原始抗体是改变的,它们还被称为一个或多个“衍生自”来自原始抗体的一个或多个CDR的CDR。人源化抗原的能力是熟知的(参见例如,美国专利号5,225,539;5,530,101;5,585,089;5,859,205;6,407,213;6,881,557)。
术语抗体“XX”旨在表示一种抗体或其表位结合片段(例如抗体“C10-2”),包含或其组成为轻链、轻链可变结构域、或轻链可变结构域CDR1-3(如通过其对应的SEQ ID NO定义)以及重链、重链可变结构域、或重链可变结构域CDR1-3(如通过其对应的SEQ ID NO定义)。在某些实施例中,该抗体或其表位结合片段是通过它们的包含如通过其SEQ ID NO定义的整个重链可变结构域以及它们的如通过其SEQ ID NO定义的轻链可变结构域来定义。
除非在本文另外指定,在抗体的Fc区或恒定结构域中氨基酸残基的编号是根据EU编号系统,也成为EU索引,如在以下中描述的:Kabat等人,Sequences of Proteins of Immunological Interest[具有免疫学意义的蛋白的序列],第5版,公共卫生服务(Public Health Service),国立卫生研究院,贝塞斯达(Bethesda),马里兰州(MD),1991。
如本文使用的,如果一种抗体或其表位结合片段更频繁地、更快速地以更大持续时间和/或更大亲和力或亲合力(相对于可替代表位而言)与该表位发生反应或缔合,该抗体或其表位结合片段即被认为“特异性地”结合另一个分子的区域(即表位)。通过阅读本定义还应理解,例如,特异性地结合至第一靶标的抗体或其表位结合片段可以是或可以不是特异性地或优先地结合至第二靶标。如本文使用的,在抗体结合至预定抗原的背景中,术语“结合”典型地是指当通过例如表面等离子体共振(SPR)技术在3000仪器中使用抗原作为配体并且使用抗体作为分析物来确定时,以相应于约10-7M或更小(例如约10-8M或更小,例如约10-9M或更小)的KD的亲和力的结合,并且与结合至不是预定抗原或密切相关抗原的非特异性抗原(例如BSA,酪蛋白)的亲和力相比,以相应于低至少十倍例如低至少100倍、例如低至少1,000倍、例如低至少10,000倍、例如低至少100,000倍的KD的亲和力结合至该预定抗原。亲和力低的量依赖于抗体的KD,这样使得当抗体的KD非常低(即,该抗体具高度特异性)时,低于对非特异性抗原的亲和力的对抗原的亲和力的量可以是至少10,000倍。
如本文所用的,术语“kd”(sec-1或1/s)是指特定抗体-抗原相互作用的解离速率常数。所述值又称为koff值。
如本文使用的,术语“ka”(M-1x sec-1或1/Msec)是指特定抗体-抗原相互作用的缔合速率常数。
如本文使用的,术语“KD”(M)是指特定抗体-抗原相互作用的解离平衡常数并且通过kd除以ka获得。
如本文使用的,术语“KA”(M-1或1/M)是指特定抗体-抗原相互作用的缔合平衡常数并且通过ka除以kd获得。
在一个实施例中,抗τ蛋白抗体或其表位结合片段,展现出以下特性中的一种或多种:
(i)基本上不能结合至非磷酸化τ蛋白;
(ii)基本上不能结合至在S404处磷酸化且在S396处非磷酸化的τ蛋白;
(iii)能够结合至在S396处磷酸化的τ蛋白;
(iv)能够结合至在S396和S404两者处均磷酸化的τ蛋白;
(v)能够选择性地在磷酸化τ蛋白残基S396和S404之间区分,使其基本上不能结合磷酸化404残基(pS404);
(vi)能够结合来自人类阿尔茨海默病脑的过度磷酸化τ蛋白;
(vii)能够在病理性人类τ蛋白和非病理性人类τ蛋白之间区分;和/或
(viii)当如本文所述的与来自转基因小鼠的经免疫耗减的rTg4510提取物一起使用时,能够特异性地将过度磷酸化τ蛋白64kDa和70kDa条带减少至少90%,同时没有将55kDaτ蛋白条带减少多于10%;或者当如本文所述的与来自人类AD尸体解剖后脑的提取物一起使用时,其特异性地以至少90%减少S396磷酸化的过度磷酸化τ蛋白条带、同时以不多于10%减少非过度磷酸化τ蛋白条带的能力。
在另外的实施例中,通过用于产生高特异性、高亲和力抗体的方法产生抗体,该抗体对包含磷酸化S396残基的病原性过度磷酸化τ蛋白具有免疫特异性,用于选自下组的脉络膜和视网膜障碍,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD,其中所述方法包括以下步骤:
(A)将免疫原注入哺乳动物中,由此免疫所述哺乳动物,所述免疫原包含双磷酸化肽,该双磷酸化肽包含含有覆盖2N4Rτ蛋白的残基386-410的TDHGAEIVYK{p}SPVVSGDT{p}SPRHL(SEQ ID NO:2)的18-40个例如18-30个、例如20-30个连续氨基酸残基;
(B)将对所述哺乳动物的所述免疫重复进行两次或更多次;
(C)针对高特异性、高亲和力抗体的存在对来自所述经重复免疫的哺乳动物的血清样品进行筛选,这些高特异性、高亲和力抗体能够结合包含磷酸化S396残基的病原性过度磷酸化τ蛋白、但是基本上很少能够结合非病原性τ蛋白;和
(D)回收所述高特异性、高亲和力抗体。
如本文使用的,“基本上不能”结合τ蛋白分子表示,相对于由参考抗体介导的可检测结合而言,在功能方面的多于20%差异、多于40%差异、多于60%差异、多于80%差异、多于100%差异、多于150%差异、多于2倍差异、多于4倍差异、多于5倍差异、或多于10倍差异。
术语“选择性”和“免疫选择性”当指代抗τ蛋白抗体相对于两种表位的结合能力时,是旨在表示在饱和条件下观察到的结合展现至少80%差异、至少95%差异、以及最优选100%差异(即没有与一种表位的可检测结合)。术语“选择性”和“免疫选择性”当指代τ蛋白抗体时,进一步旨在意指该抗体结合来自人类阿尔茨海默氏病脑的过度磷酸化τ蛋白,并且能够在病理性和非病理性人类τ蛋白之间区分。
术语TBS-可提取的(S1)、高盐/肌氨酰-可提取的(S3)、以及肌氨酰-不溶性(P3)部分是如通过本文所述的τ蛋白生物化学分级获得的部分。
在一些抗体中,仅需CDR的一部分(即结合所需的CDR残基亚群,称为SDR)在人源化抗体中保持结合。可以通过分子建模和/或凭经验或者如在Gonzales,N.R.等人,(2004)“SDR Grafting Of A Murine Antibody Using Multiple Human Germline Templates To Minimize Its Immunogenicity[使用多个人种系模板对鼠类抗体进行SDR接枝以最小化其免疫原性]”,Mol.Immunol.[分子免疫学]41:863-872中所述的,基于先前研究(例如CDR H2中的残基H60-H65通常是不需要的)从位于Chothia超变环外的卡巴特CDR区(参见,Kabat等人,(1992)Sequences of Proteins of Immunological Interest[免疫学关注的蛋白质序列],National Institutes of Health[美国国立卫生研究院],公开号91-3242;Chothia,C.等人,(1987)“Canonical Structures For The Hypervariable Regions Of Immunoglobulins[免疫球蛋白的超变区的典型结构]”,J.Mol.Biol.[分子生物学杂志]196:901-917)中鉴定不接触抗原并且不在SDR中的CDR残基。在此类人源化抗体中,在一个或多个供体CDR残基不存在或整个供体CDR被省略的位置处,占据该位置的氨基酸可以是在受体抗体序列中占据相应位置(通过卡巴特编号)的氨基酸。在包含在内的CDR中受体对供体氨基酸的此类取代的数目反映了竞争考虑的平衡。此类取代在降低人源化抗体中的小鼠氨基酸的数目方面并且因此在降低潜在的免疫原性方面是潜在有利的。然而,取代还可以引起亲和力变化,并且优选避免亲和力的显著减少。还可以凭经验选择CDR内的取代位置和待取代的氨基酸。
CDR残基的单一氨基酸改变可以导致功能性结合的损失的事实(Rudikoff,S.等(1982)“Single Amino Acid Substitution Altering Antigen-Binding Specificity[改变抗原结合特异性的单一氨基酸取代]”,Proc.Natl.Acad.Sci.(USA)[美国国家科学院院刊]79(6):1979-1983)提供了用于系统地鉴定替代性功能CDR序列的手段。在用于获得此类变体CDR的一个优选方法中,诱变编码CDR的多核苷酸(例如经由随机诱变或通过定点方法(例如聚合酶链介导的采用编码突变座位的引物进行的扩增))以产生具有经取代的氨基酸残基的CDR。通过比较原始(功能性)CDR序列中的相关残基的身份与取代的(非功能性)变体CDR序列的身份,可以鉴定出该取代的BLOSUM62.iij取代得分。BLOSUM系统提供了通过分析受信任的比对的序列的数据库而创建的氨基酸取代的矩阵(Eddy,S.R.(2004)“Where Did The BLOSUM62Alignment Score Matrix Come From?[BLOSUM62比对得分矩阵来自哪里?]”,Nature Biotech.[自然生物技术]22(8):1035-1036;Henikoff,J.G.(1992)“Amino acid substitution matrices from protein blocks[来自蛋白质块的氨基酸取代矩阵]”,Proc.Natl.Acad.Sci.(USA)[美国国家科学院院刊]89:10915-10919;Karlin,S.等人(1990)“Methods For Assessing The Statistical Significance Of Molecular Sequence Features By Using General Scoring Schemes[用于通过使用一般评分方案评估分子序列特征的统计学显著性的方法]”,Proc.Natl.Acad.Sci.(USA)[美国国家科学院院刊]87:2264-2268;Altschul,S.F.(1991)“Amino Acid Substitution Matrices From An Information Theoretic Perspective[从信息理论角度的氨基酸取代矩阵]”,J.Mol.Biol.[分子生物学杂志]219,555-565)。目前,最先进的BLOSUM数据库是BLOSUM62数据库(BLOSUM62.iij)。表1呈现了BLOSUM62.iij取代得分(得分越高取代越保守,并且因此更加可能地,该取代将不会影响功能)。如果包含所得CDR的表位结合片段未能结合至τ蛋白,例如,则BLOSUM62.iij取代分数被认为是不足够保守的,并且选择并产生具有更高取代分数的新候选取代。因此,例如,如果原始残基是谷氨酸(E)并且非功能性取代残基是组氨酸(H),则BLOSUM62.iij取代得分将为0,并且更保守的变化(例如到天冬氨酸、天冬酰胺、谷氨酰胺或赖氨酸)是优选的。
本发明因此考虑了随机诱变用于鉴定改善的CDR的用途。在本发明的背景下,保守取代可以由表2、3、或4中的一个或多个中反映的氨基酸类别之内的取代来限定:
保守取代的氨基酸残基类别:
替代性保守氨基酸残基取代类别:
氨基酸残基的替代性物理和功能分类:
更保守的取代分组包括:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸以及天冬酰胺-谷氨酰胺。
另外组的氨基酸还可以使用描述于例如Creighton(1984)Proteins:Structure and Molecular Properties[蛋白质:结构和分子特性](第2版1993),W.H.Freeman and Company[W.H.弗里曼公司]中的原则来配制。
噬菌体展示技术可以可替代地用于增加(或降低)CDR亲和力。被称为亲和力成熟的这种技术采用诱变或者“CDR步移”和重选择,使用靶标抗原或其抗原表位结合片段来鉴别具有如下CDR的抗体,这些CDR当与初始抗体或亲本抗体比较时以更高(或更低)亲和力结合到该抗原(参见例如Glaser等人(1992)J.Immunology[免疫学杂志]149:3903)。诱变整个密码子而不是单个核苷酸产生氨基酸突变的半随机谱。可构建由一组变体克隆所组成的库,每一克隆都在单个CDR中相差单个氨基酸改变,并且这些克隆包含代表了每个CDR残基的每个可能氨基酸取代的变体。可通过使固定化突变体与经标记的抗原相接触来筛选对抗原的结合亲和力增加(或减少)的突变体。本领域中已知的任何筛选方法(例如ELISA)可以用于鉴定对抗原具有增加或降低的亲和力的突变体抗体(参见Wu等人1998,Proc.Natl.Acad.Sci.(U.S.A.)[美国国家科学院院刊]95:6037;Yelton等人,1995,J.Immunology[免疫学杂志]155:1994)。可以可能地使用使轻链随机化的CDR步移(参见例如Schier等人,1996,J.Mol.Bio.[分子生物学杂志]263:551)。
用于完成此类亲和力成熟的方法描述于例如:Krause,J.C.等人(2011)“An Insertion Mutation That Distorts Antibody Binding Site Architecture Enhances Function Of A Human Antibody[扭曲抗体结合位点构造的插入突变增强了人抗体的功能]”,MBio.2(1)pii:e00345-10.doi:10.1128/mBio.00345-10;Kuan,C.T.等人(2010)“Affinity-Matured Anti-Glycoprotein NMB Recombinant Immunotoxins Targeting Malignant Gliomas And Melanomas[靶向恶性胶质瘤和黑色素瘤的亲和力成熟的抗糖蛋白NMB重组免疫毒素]”,Int.J.Cancer[国际癌症杂志]10.1002/ijc.25645;Hackel,B.J.等人(2010)“Stability And CDR Composition Biases Enrich Binder Functionality Landscapes[稳定性和CDR组成偏移丰富了结合物功能景观]”,J.Mol.Biol.[分子生物学杂志]401(1):84-96;Montgomery,D.L.等人(2009)“Affinity Maturation And Characterization Of A Human Monoclonal Antibody Against HIV-1gp41[针对HIV-1gp41的人单克隆抗体的亲和力成熟和表征]”,MAbs1(5):462-474;Gustchina,E.等人(2009)“Affinity Maturation By Targeted Diversification Of The CDR-H2Loop Of A Monoclonal Fab Derived From A Synthetic Human Antibody Library And Directed Against The Internal Trimeric Coiled-Coil Of Gp41Yields A Set Of Fabs With Improved HIV-1Neutralization Potency And Breadth[通过衍生自合成原初人抗体文库并且针对Gp41的内部三聚卷曲螺旋的单克隆Fab的CDR-H2环的靶向多样化的亲和力成熟产生了一组具有改善的HIV-1中和效力和幅度的Fab]”,Virology[病毒学]393(1):112-119;Finlay,W.J.等人(2009)“Affinity Maturation Of A Humanized Rat Antibody For Anti-RAGE Therapy:Comprehensive Mutagenesis Reveals A High Level Of Mutational Plasticity Both Inside And Outside The Complementarity-Determining Regions[用于抗RAGE疗法的人源化大鼠抗体的亲和力成熟:全面诱变揭示在互补决定区内外同时存在的高水平的突变可塑性]”,J.Mol.Biol.[分子生物学杂志]388(3):541-558;Bostrom,J.等人(2009)“Improving Antibody Binding Affinity And Specificity For Therapeutic Development[改善抗体结合亲和力和特异性用于治疗开发]”,Methods Mol.Biol.[分子生物学方法],525:353-376;Steidl,S.等人(2008)“In Vitro Affinity Maturation Of Human GM-CSF Antibodies By Targeted CDR-Diversification[通过靶向的CDR多样化的人GM-CSF抗体的体外亲和力成熟]”,Mol.Immunol.[分子免疫学]46(1):135-144;和Barderas,R.等人(2008)“Affinity Maturation Of Antibodies Assisted By In Silico Modeling[通过计算机建模辅助的抗体的亲和力成熟]”,Proc.Natl.Acad.Sci.(USA)[美国国家科学院院刊]105(26):9029-9034。
因此,涵盖的抗体或其表位结合片段的CDR变体序列可以通过取代而不同于亲本抗体D1.2、C10-2、C5.2或C8.3的CDR序列;例如取代的4个氨基酸残基、3个氨基酸残基、2个氨基酸残基或氨基酸残基中的1个。根据本发明的实施例,此外设想的是,CDR区中的氨基酸可以用保守取代进行取代,如在上面3个表中定义的。例如,酸性残基Asp可以被Glu取代而不会实质性地影响该抗体的结合特征。
术语“正常τ蛋白”是指每摩尔蛋白中包含2-3摩尔磷酸的正常脑τ蛋白。
术语“过度磷酸化τ蛋白”是指与多阴离子种类诱导的在蛋白质印迹中的迁移性变动相一致的τ蛋白的多磷酸化种类,或者是指具有多于五个、六个或七个磷酸化的丝氨酸、苏氨酸或酪氨酸位点的τ蛋白种类。
术语“具有磷酸化残基396的τ蛋白”涉及过度磷酸化τ蛋白,其中残基396被磷酸化并且残基404磷酸化或不被磷酸化。
术语“转基因非人动物”是指具有包含一个或多个人重链和/或轻链转基因或转染色体(整合或未整合进动物的天然基因组DNA)的基因组并且能够表达全人抗体的非人动物。例如,转基因的小鼠可以具有人类轻链转基因和人类重链转基因或人类重链转染色体,这样使得当用τ蛋白抗原和/或细胞表达τ蛋白免疫时,该小鼠产生人类抗τ蛋白抗体。人类重链转基因可以被整合进小鼠的染色体DNA中,转基因小鼠就是这样,例如HuMAb小鼠,如HCo7或HCol2小鼠,或者人类重链转基因可以被维持在染色体外,如描述于WO 02/43478中的转染色体KM小鼠就是这样。这样的转基因和转染色体小鼠(本文统称为“转基因小鼠”)通过经历V-D-J重组和同种型转换能够产生多种针对给定抗原的人单克隆抗体同种型(如IgG、IgA、IgM、IgD和/或IgE)。
转基因非人动物还可以通过引入编码这样的特异性抗体的基因(例如通过将这些基因可操作地连接至在该动物的乳中表达的基因)而用于产生针对特定抗原的抗体。
如本文使用的,术语“治疗(treatment)”或“治疗(treating)”意指改善、减慢、衰减、或逆转疾病或障碍的进展或严重性、或者改善、减慢、衰减、或逆转这种疾病或障碍的一种或多种症状或副作用。出于本发明的目的,“治疗(treatment或treating)”另外意指用于获得有益的或所希望的临床结果的方法,其中“有益的或所希望的临床结果”包括但不限于症状的缓解、障碍或疾病程度的减小、稳定化的(即没有恶化的)疾病或障碍状态、疾病或障碍状态进展的延缓或减慢、疾病或障碍状态的减轻或缓和以及疾病或障碍的减退,不论是部分地或全部地、可检测出的或不可检测出的。
“有效量”,当应用于本发明的抗体或其表位结合片段时,是指一个在所需剂量和持续时期下足以实现预期生物效应或希望的治疗结果(包括而不限于临床结果)的量。短语“治疗有效量”当应用于本发明的抗体或其表位结合片段时,旨在表示该抗体或其表位结合片段足以改善、减轻、稳定、逆转、减慢、衰减或延缓障碍或疾病状态的进展或该障碍或疾病的症状的量。在实施例中,本发明的方法提供用于与其他化合物相组合来给予该抗体或其表位结合片段。在此类情况下,“有效量”是足以引起预期的生物作用的该组合的量。
本发明的抗τ蛋白抗体或其表位结合片段的治疗有效量可以根据因素例如个体的疾病状态、年龄、性别、和体重以及抗τ蛋白抗体或其表位结合片段在该个体中引发希望的应答的能力来改变。治疗有效量也是其中治疗有利作用大于抗体或抗体部分的任何毒性或有害作用的量。
如以上指出的,本发明特别涉及单克隆抗体或表位结合片段,并且涉及一种全新的用于产生此类分子(以及由此此类其表位结合片段)的方法。这种方法概述于图9中。新方法用以分离单克隆抗体的这种能力本文通过将该方法用于分离能够特异性地结合至人类τ蛋白(SEQ ID NO:1)的磷酸化残基丝氨酸396({p}S396)的单克隆抗体得以例证。这些抗体被进一步表征为它们在磷酸化残基丝氨酸396和丝氨酸404(pS404)之间区分的能力,使得它们不结合至具有磷酸化丝氨酸404的τ蛋白,除非τ蛋白在残基396处也被磷酸化。
已经通过使用方法产生并分离本发明的抗体、或其表位结合片段(图9),该方法有利于选择{p}S396特异性抗体(图9)。此外,通过应用这种非常严格的抗体克隆选择程序,已经获得不仅对S396具有高度特异性而且对磷酸化{p}S396表位具有高度选择性的抗体。这些抗体唯一性地识别来自阿尔茨海默氏病脑的τ蛋白。我们还证实,概述于图9中的筛选程序确保对具有功能性和治疗性效用的抗体的鉴定。
针对该双磷酸化肽产生抗体:TDHGAEIVYK{p}SPVVSGDT{p}SPRHL(SEQ ID NO:2)c覆盖2N4Rτ蛋白的残基386-408(实例1)。用该磷酸化肽免疫小鼠。一旦已经获得足够的抗体滴度,则处死这些小鼠并产生杂交瘤(实例2)。使用斑点印迹(实例3)以及MSD ELISA筛选这些杂交瘤,该ELISA中使用固定的人类病理性和非病理性τ蛋白(实例4)。在斑点印迹和蛋白质印迹中,在病理性和非病理性人类τ蛋白之间区分的能力用于选择杂交瘤。选择16个克隆,回收其中的4个杂交瘤克隆,这4个杂交瘤克隆产生展现出结合至人类病理性τ蛋白材料的非凡能力的抗体。
还通过从患病和未患病人类AD脑中分离τ蛋白,并且将此材料固定在MSD ELISA板上来确定与病理性和非病理性τ蛋白的特异性结合(实例4)。
本发明的另外一方面涉及针对双磷酸化肽引发的单克隆抗体或其表位结合片段,该双磷酸化肽包含覆盖2N4Rτ蛋白的残基386-410的TDHGAEIVYK{p}SPVVSGDT{p}SPRHL(SEQ ID NO:2)内的至少18个例如至少20个连续氨基酸残基。在本发明的此方面,该单克隆抗体或其表位结合片段典型地是针对双磷酸化肽引发,该双磷酸化肽包含含有覆盖2N4Rτ蛋白的残基386-410的TDHGAEIVYK{p}SPVVSGDT{p}SPRHL(SEQ ID NO:2)的18-40个例如18-30个、例如20-30个连续氨基酸残基。
本发明进一步涉及一种通过用于产生高特异性、高亲和力抗体的方法而产生的抗体,这些高特异性、高亲和力抗体对于包含磷酸化S396残基的病原性过度磷酸化τ蛋白具有免疫特异性,其中所述方法包括以下步骤:
(A)将免疫原注入哺乳动物中,由此免疫所述哺乳动物,所述免疫原包含双磷酸化肽,该双磷酸化肽包含含有覆盖2N4Rτ蛋白的残基386-410的TDHGAEIVYK{p}SPVVSGDT{p}SPRHL(SEQ ID NO:2)的18-40个例如18-30个、例如20-30个连续氨基酸残基;
(B)将对所述哺乳动物的所述免疫重复进行两次或更多次;
(C)针对高特异性、高亲和力抗体的存在对来自所述经重复免疫的哺乳动物的血清样品进行筛选,这些高特异性、高亲和力抗体能够结合包含磷酸化S396残基的病原性过度磷酸化τ蛋白、但是基本上很少能够结合非病原性τ蛋白;和
(D)回收所述高特异性、高亲和力抗体。
更确切地说,步骤A包括:用典型地为在涂覆缓冲液中0.5μg/ml(捕获抗体)的C10-2抗体涂覆MSD板(典型地在4℃过夜),封闭(典型地在室温1小时),并且洗涤(典型地3次)。步骤B包括:将来自AD(从3名患者聚集)的P3裂解物的样品(典型地1:1000=2-4μg/ml总蛋白)和/或S1(p)(典型地1:300=20-40ng/ml总蛋白)与成梯度浓度的pS396肽表位特异性抗体进行混合,并且孵育(典型在室温1小时)。随后将这些反应物在步骤A中制备的板上孵育2小时。遵循制造商的说明书,步骤C包括使用来自MSD的硫标记人类τ蛋白抗体(典型地1:50)检测C10-2捕获的τ蛋白。将板在MSDS600上进行分析。以类似设置测试AD P3和AD S1(p)。
另外的实施例涉及抗体或其抗原结合片段,其能够免疫特异性地结合至人类τ蛋白(SEQ ID NO:1)的磷酸化残基396,已经在一种细胞系中产生或制造,该细胞系例如是人类细胞系、哺乳动物非人类细胞系、昆虫细胞系、酵母细胞系或细菌细胞系。
该抗体或其抗原结合片段能够免疫特异性地结合至人类τ蛋白(SEQ ID NO:1)的磷酸化残基396,产生于CHO细胞系、HEK细胞系、BHK-21细胞系、鼠类细胞系(如骨髓瘤细胞系)、纤维肉瘤细胞系、PER.C6细胞系、HKB-11的细胞系、CAP细胞系和HuH-7人类细胞系中。
这些抗体识别与疾病病理性相关联的τ蛋白的独特能力是在此处的实例7中得以证实。我们在实例3中描述的测定中比较了病理性对比非病理性τ蛋白的结合。比较是与五种公开的τ蛋白抗体:hACI-2B6、IPN002、HJ8.5、2.10.3和4E4的比较。图6展示了参考抗体的每一个对于来自健康和患病脑的τ蛋白的结合,以及与分离自10月龄Tg4510τ蛋白转基因小鼠的P301L人类突变体τ蛋白的结合。这证明了分离的抗体展现出对于人类病理性τ蛋白的格外高程度的特异性和选择性。该选择性优于如表5中所示的对比抗体中的任一个。
饱和时,结合抗体D1.2和C10-2展现出对于分离自人类AD脑的P3τ蛋白大于100倍的选择性。
为了证明所选择的抗体具有功能性和治疗性效用,在体外和细胞内τ-聚集测定中测试了抗体。这些测定是功能测定,证实这些抗体能够干扰τ蛋白的病理性聚集过程。将HEK293细胞瞬时转染人类τ-P301L-FLAG(4R0N)。随后将细胞暴露于来自人AD脑或来自转基因Tg4510脑的τ蛋白提取物。到病理性τ蛋白的这种暴露促进τ蛋白摄取入细胞和细胞内聚集。使用抗体D1.2和C10-2两者对τ蛋白-制品的免疫耗减以及用这些抗体直接处理细胞能够显著减少τ蛋白聚集体的形成。
抗体D1.2和C10-2的治疗效用也已经在人类τ/PS1小鼠中被评价。这种小鼠模型是更加与AD疾病相关的动物模型,其仅在生命后期(12-18月龄)产生AD病理学。然而,这些小鼠在实体缠结病变的出现之前展现出τ蛋白过度磷酸化。慢性注射小鼠持续13周,每周两次,剂量为15mg/kg。抗体处理的小鼠展现出磷酸化τ蛋白的显著减少,表明用抗体D1.2和C10-2慢性处理将降低缠结病变,并且由此降低随后的体内神经退行性变。
本发明的抗体通过免疫耗减方法特异性地去除来自rTg4510小鼠脑提取物的过度磷酸化τ蛋白。此外,本发明的抗体并不去除来自匀浆的正常τ蛋白,而可商购的τ5抗体去除来自匀浆的正常τ蛋白。与结合至τ蛋白(其中磷酸化在残基404处或在残基404和396两者处)的商业抗体相比,本发明的抗体特异性地去除95%的在丝氨酸396上磷酸化的过度磷酸化τ蛋白。实验证明本发明的抗体,尽管仅去除脑匀浆中的总τ蛋白的非常少的部分(8%),但这些抗体特异性地去除过度磷酸化τ蛋白(以90%)。因此,本发明的一个方面是针对单克隆抗体或其表位结合片段,能够免疫特异性地结合至病原性过度磷酸化τ蛋白。此外,在其中使用本发明的抗体去除过度磷酸化τ蛋白的实验中,接种活性被消除。通过从匀浆中去除过度磷酸化τ蛋白,这些匀浆不再诱导τ蛋白病变的接种。
更确切地说,如上详述,本发明涉及使用任何对P-S396有选择性的τ蛋白单克隆抗体治疗选自下组的脉络膜和视网膜障碍,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
总之,这些实例示出包括C10-2的本发明的抗体有效地结合至AD-P3抗原涂覆的MSD板上。相比之下,商业抗体如PHF-13,具有低的结合活性。此外PHF-13证实了相比于本发明的抗体而言实质上更高程度的非特异性结合。数据显示在C10-2涂覆的板中,Pτ抗原捕获的mC10-2液相抑制是有效的(IC50=10-20nM),而PHF-13是无效的(IC50=500-1000nM)。
本发明的单克隆抗体或其抗原结合片段在液相抑制测定中典型地抑制AD-P3,这样使得在抗体的100nM或更少的浓度下(例如在50nM或更少的浓度下),该信号减少了50%。典型地根据对阿尔茨海默病脑提取物的免疫耗减研究后的P-S396τ蛋白的蛋白质印迹信号,本发明的单克隆抗体或其表位结合片段能够从阿尔茨海默脑匀浆物中以75ng的抗体去除在丝氨酸396处的至少15%的τ蛋白磷酸化。
该抗体或其表位结合片段优选是一种人类抗体或人源化抗体。
本发明还提供了一种降低患者中τ蛋白缠结形成的方法,该方法包括向需要这种治疗的患者给予治疗有效量的本发明的抗体或其表位结合片段。
本发明的另外的方面是针对在一种组合物中的本发明的抗体或其表位结合片段,连同药学上可接受的载体、稀释剂、佐剂和/或稳定剂。本发明的抗体或其表位结合片段可以在用于治疗τ蛋白病变的疗法中使用。典型地,该τ蛋白病变选自下组,该组由以下组成:通过本发明所设想的治疗可以是长期的并且患者可以接受至少2周(如至少持续1个月、6个月、1年或更久)治疗。
本发明的这些抗体可以例如是通过杂交瘤方法产生的单克隆抗体,该杂交瘤方法首次描述于Kohler等人,Nature[自然]256,495(1975),或可以是通过重组DNA或其他方法产生的单克隆抗体,或更优选可以通过本文披露的新颖方法产生(图9)。还可以使用在例如Clackson等人,Nature[自然]352,624-628(1991)和Marks等人,J.MoI.Biol.[分子生物学杂志]222,581-597(1991)中描述的技术从噬菌体抗体文库分离单克隆抗体。单克隆抗体可以从任何适合的来源获得。因此,例如,单克隆抗体可以从制备自鼠类脾脏B淋巴细胞的杂交瘤获得,这些淋巴细胞获得自用目的抗原或编码目的抗原的核酸免疫的小鼠,例如,这些淋巴细胞处于在表面表达该抗原的细胞的形式。单克隆抗体还可以衍生自免疫的人的或非人哺乳动物(例如大鼠、兔、狗、绵羊、山羊、灵长类动物等)的表达抗体的细胞的杂交瘤获得。
在一个实施例中,本发明的抗体是人抗体。可以使用携带部分人免疫系统而不是小鼠免疫系统的转基因或转染色体小鼠产生针对τ蛋白的人类单克隆抗体。此类转基因和转染色体小鼠包括分别在本文中称为HuMAb(人类单克隆抗体)小鼠和KM小鼠的小鼠,并且在本文中统称为“转基因小鼠”。
HuMAb小鼠包含人类免疫球蛋白基因迷你座位(mini-locus),该迷你座位编码未重排的人类重链可变和恒定(μ和Y)以及轻链可变和恒定(κ)链免疫球蛋白序列,连同靶向的突变,该突变使内源μ和K链座位失活(Lonberg,N.等人,Nature[自然]368,856-859(1994))。因此,该小鼠展示出小鼠IgM或IgK的表达减少,并且应答于免疫,所引入的人重链和轻链转基因经历类别转换和体细胞突变以产生高亲和力人IgG、Igκ单克隆抗体(Lonberg,N.等人(1994),同上;综述于Lonberg,N.,Handbook of Experimental Pharmacology[实验药物学手册]113,49-101(1994),Lonberg,N.和Huszar,D.,Intern.Rev.Immunol.[国际免疫学评论]第13卷65-93(1995),以及Harding,F.和Lonberg,N.,Ann.N.Y.Acad.Sci[纽约科学院年刊]764 536-546(1995))。HuMAb小鼠的制备详细描述于Taylor,L.等人,Nucleic Acids Research[核酸研究]20,6287-6295(1992),Chen,J.等人,International Immunology[国际免疫学]5,647-656(1993),Tuaillon等人,J.Immunol.[免疫学杂志]152,2912-2920(1994),Taylor,L.等人,International Immunology[国际免疫学]6,579-591(1994),Fishwild,D.等人,Nature Biotechnology[自然生物技术]14,845-851(1996)。还参见US 5,545,806、US 5,569,825、US 5,625,126、US 5,633,425、US 5,789,650、US 5,877,397、US 5,661,016、US 5,814,318、US 5,874,299、US 5,770,429、US 5,545,807、WO 98/24884、WO 94/25585、WO 93/1227、WO 92/22645、WO 92/03918以及WO 01/09187。
HCo7、HCo12、HCo17和HCo20小鼠在其内源轻链(κ)基因中具有JKD破坏(如描述于Chen等人,EMBO J.[欧洲分子生物学学会杂志]12,811-820(1993)),在其内源重链基因中具有种CMD破坏(如描述于WO 01/14424的实例1)以及KCo5人κ轻链转基因(如描述于Fishwild等人,Nature Biotechnology[自然生物技术]14,845-851(1996)中)。此外,HCo7小鼠具有HCo7人重链转基因(如描述于US 5,770,429),HCo12小鼠具有HCo12人重链转基因(如描述于WO 01/14424的实例2),HCo17小鼠具有HCo17人重链转基因(如描述于WO 01/09187的实例2)并且HCo20小鼠具有HCo20人重链转基因。所得小鼠在对内源小鼠重链和κ轻链座位破坏纯合的背景下表达人免疫球蛋白重链和κ轻链转基因。
在KM小鼠品系中,内源小鼠κ轻链基因已经被同型结合地破坏,如描述于Chen等人,EMBO J.[欧洲分子生物学学会杂志]12,811-820(1993),并且内源小鼠重链基因已经被同型结合地破坏,如描述于WO 01/09187的实例1中。这个小鼠品系携带人κ轻链转基因KCo5,如描述于Fishwild等人,Nature Biotechnology[自然生物技术]14,845-851(1996)中。这个小鼠品系还携带由染色体14片段hCF(SC20)构成的人重链转染色体,如描述于WO 02/43478中。HCo12-Balb/c、HCo17-Balb/c和HCo20-Balb/c小鼠可以通过将HCo12、HCo17和HCo20与KCo5[J/K](Balb)杂交来产生,如描述于WO 09/097006中。
rTg4510小鼠是已知的τ蛋白病变模型,提供了突变体τ蛋白转基因表达上的时空控制。在KM小鼠品系中,内源小鼠κ轻链基因已经被同型结合地破坏,如描述于Chen等人,EMBO J.[欧洲分子生物学学会杂志]12,811-820(1993),并且内源小鼠重链基因已经被同型结合地破坏,如描述于WO 01/09187的实例1中。这个小鼠品系携带人κ轻链转基因KCo5,如描述于Fishwild等人,Nature Biotechnology[自然生物技术]14,845-851(1996)中。该小鼠品系还携带由染色体14表位结合片段hCF(SC20)构成的人类重链转染色体,如在WO 02/43478中所述。
来自这些转基因小鼠的脾细胞可以用于根据熟知的技术产生分泌人单克隆抗体的杂交瘤。本发明的人单克隆抗体或多克隆抗体或者源于其他物种的本发明的抗体还可以通过产生对于感兴趣的免疫球蛋白重链和轻链序列而言转基因的另一非人哺乳动物或植物并且从其中产生可回收形式的抗体而转基因地产生。与哺乳动物中的转基因生产相结合,抗体可以从山羊、奶牛或其他哺乳动物的乳中产生和回收。参见例如US 5,827,690;US 5,756,687;US 5,750,172和US 5,741,957。
本发明的抗体可以具有任何同种型。同种型的选择典型地将由所希望的效应子功能(例如ADCC诱导)来指导。示例性同种型是IgG1、IgG2、IgG3和IgG4。可以使用人轻链恒定结构域κ或λ中任一者。如果希望的话,本发明的抗τ蛋白抗体的类别可以通过已知的方法转换。例如,最初是IgM的本发明抗体可以类别转换为本发明的IgG抗体。此外,类别转换技术可以用来将一个IgG亚类转化成另一亚类,例如从IgGl到IgG2。因此,本发明的抗体的效应子功能可以通过同种型切换变为例如IgG1、IgG2、IgG3、IgG4、IgD、IgA、IgE或IgM抗体,用于各种治疗用途。在一个实施例中,本发明的抗体是IgG1抗体,例如IgG1,κ。抗体被说成属于特定同种型,如果其氨基酸序列相对于其他同种型与该同种型大部分同源的话。
在一个实施例中,本发明的抗体是全长抗体,优选IgG抗体,特别是IgG1,κ抗体。在另一个实施例中,本发明的抗体是抗体表位结合片段或单链抗体。
抗体及其表位结合片段可以例如通过使用常规技术的表位结合片段化获得,并且以与本文对完整抗体所述的相同方式针对效用筛选表位结合片段。例如,F(ab')2表位结合片段可以通过用胃蛋白酶处理抗体产生。可以处理所得F(ab')2表位结合片段以减少二硫桥,以产生Fab'表位结合片段。Fab表位结合片段可以通过用木瓜蛋白酶处理IgG抗体获得;Fab'表位结合片段可以用胃蛋白酶消化IgG抗体获得。F(ab')表位结合片段还可以通过经由硫醚键或二硫键结合以下描述的Fab'来产生。Fab'表位结合片段是通过切割F(ab')2的铰链结构域的二硫键获得的抗体表位结合片段。Fab'-表位结合片段可以通过用还原剂如二硫苏糖醇处理F(ab')2表位结合片段获得。抗体表位结合片段还可以通过在重组细胞中表达编码此类表位结合片段的核酸产生(参见例如Evans等人,J.Immunol.Meth.[免疫学方法杂志]184,123-38(1995))。例如,编码F(ab')2表位结合片段一部分的嵌合基因可以包括编码CH1结构域和H链的铰链结构域的DNA序列,随后为翻译终止密码子,以产生这样一种截短的抗体表位结合片段分子。
在一个实施例中,抗τ蛋白抗体是单价抗体,优选地是具有铰链区缺失的单价抗体,如描述于WO 2007059782(将其通过引用以其全文并入本文)中。因此,在一个实施例中,该抗体是单价抗体,其中所述抗τ蛋白抗体是通过一种方法构建,该方法包括:i)提供一种核酸构建体,该核酸构建体编码所述单价抗体的轻链,所述构建体包含对所选抗原特异性抗τ蛋白抗体的VL区进行编码的核苷酸序列以及对Ig的恒定CL区进行编码的核苷酸序列,其中所述对所选抗原特异性抗体的VL区进行编码的核苷酸序列以及所述对Ig的CL区进行编码的核苷酸序列可操作地连接在一起,并且其中,在IgG1亚型的情况下,编码CL区的核苷酸序列已经被修饰为使得该CL区不包含任何能够在多克隆人类IgG的存在下或当给予至动物或人类时与其他肽(包含CL区的相同氨基酸序列)形成二硫键或共价键的氨基酸;ii)提供编码所述单价抗体的重链的核酸构建体,所述构建体包含编码所选抗原特异性抗体的VH区的核苷酸序列和编码人Ig的恒定CH区的核苷酸序列,其中编码CH区的核苷酸序列已经被修饰,这样使得在多克隆人IgG的存在下或当给予给动物、人时,对应于铰链区和(如由Ig亚型所要求的)CH区的其他区(例如CH3区)的区不包含参与和包含人Ig的CH区的一致氨基酸序列的其他肽形成二硫键或共价或稳定的非共价重链间键的任何氨基酸残基,其中编码所选抗原特异性抗体的VH区的所述核苷酸序列和编码所述Ig的CH区的所述核苷酸序列被可操作地连接在一起;iii)提供用于产生所述单价抗体的细胞表达系统;iv)通过在(iii)的细胞表达系统的细胞中共表达(i)和(ii)的核酸构建体来产生所述单价抗体。
类似地,在一个实施例中,本发明的抗τ蛋白抗体是单价抗体,其包含:
(i)如本文所述的本发明的抗体的可变结构域,或者所述结构域的表位结合部分,以及
(ii)免疫球蛋白的CH结构域或其包含CH2和CH3结构域的结构域,其中该CH结构域或其结构域已经被修饰,这样使得对应于铰链结构域和(如果该免疫球蛋白不是IgG4亚型的话)CH结构域的其他结构域(如CH3结构域)的结构域不包含任何氨基酸残基,这些任何氨基酸残基能够与相同CH结构域形成二硫键或在多克隆人IgG的存在下与相同CH结构域形成其他共价或稳定的非共价重链间键。
在另外的实施例中,本发明的单价抗体的重链已经被修饰为使得整个铰链区已缺失。
在另一个另外的实施例中,单价抗体的序列已经被修饰,这样使得它不包含用于N-连接的糖基化的任何受体位点。
本发明还包括“双特异性抗体”,其中抗τ蛋白结合区(例如抗τ蛋白单克隆抗体的τ蛋白-结合区)是靶向多于一个表位(例如第二表位可以包含活性运输受体的表位,使得双特异性抗体可以展现出改进的跨生物屏障例如血脑屏障的转胞吞作用)的二价或多价双特异性支架的部分。因此,在另一个另外的实施例中,抗τ蛋白抗体的单价Fab可以连接到另外的靶向不同蛋白的Fab或scfv上,以产生双特异性抗体。双特异性抗体可以具有双重功能,例如由抗τ蛋白结合结构域赋予的治疗功能,以及可以结合至受体分子以增强跨生物屏障如血脑屏障的转移的运输功能。
本发明的抗体及其表位结合片段还包括单链抗体。单链抗体是其中重链和轻链Fv结构域连接的肽。在一个实施例中,本发明提供了单链Fv(scFv),其中在本发明的抗τ蛋白抗体的Fv中的重链和轻链与柔性肽接头(典型地具有约10、12、15或更多个氨基酸残基)连接在单一肽链中。产生此类抗体的方法描述于例如US 4,946,778;Pluckthun,在The Pharmacology of Monoclonal Antibodies[单克隆抗体药理学],第113卷,Rosenburg和Moore编辑Springer-Verlag[施普林格出版公司],纽约,第269-315页(1994);Bird等人,Science[科学]242,423-426(1988);Huston等人,PNAS USA[美国国家科学院院刊]85,5879-5883(1988)和McCafferty等人,Nature[自然]348,552-554(1990)。单链抗体可以是单价的,如果仅使用单个VH和VL的话;可以是二价的,如果使用两个VH和VL的话;或可以是多价的,如果使用两个以上VH和VL的话。
本文所述的抗体及其表位结合片段可以通过包含任何适合数目的修饰氨基酸和/或与此类缀合取代基的关联来修饰。在该背景中的适合性通常是通过至少基本上保留与未衍生化的亲本抗τ蛋白抗体关联的τ蛋白选择性和/或τ蛋白特异性的能力来确定。该一个或多个修饰氨基酸的包含在以下方面可以是有利的,例如,增加多肽血清半衰期,降低多肽抗原性,或增加多肽储存稳定性。对一种或多种氨基酸进行修饰,例如,在重组产生的过程中与翻译同时进行或在翻译之后进行(例如,在哺乳动物细胞中表达过程中在N-X-S/T基序上的N-连接的糖基化作用),或通过合成手段进行修饰。经修饰的氨基酸的非限制性实例包括:糖基化的氨基酸、硫酸化的氨基酸、异戊二烯化(例如,法尼基化、香叶基-香叶基化(geranyl-geranylated))的氨基酸、乙酰化的氨基酸、酰化的氨基酸、聚乙二醇化的氨基酸、生物素酰化的氨基酸、羧基化的氨基酸、磷酸化的氨基酸、以及类似氨基酸。足够指导本领域中的普通技术人员进行氨基酸修饰的参考文献在文献中相当充分。示例性方案见于Walker(1998)Protein Protocols On CD-Rom[只读型光盘蛋白质指南],Humana Press[胡马纳出版社],Totowa[托托瓦],新泽西州。修饰的氨基酸可以例如选自糖基化的氨基酸、聚乙二醇化的氨基酸、法尼基化的氨基酸、乙酰化的氨基酸、生物素酰化的氨基酸、缀合到脂质部分的氨基酸或缀合到有机衍化剂的氨基酸。
本发明的抗体及其表位结合片段还可以通过共价缀合到聚合物上进行化学修饰,以例如增加它们的循环半衰期。示例性聚合物和将其附接至肽的方法展示于例如US 4,766,106;US 4,179,337;US 4,495,285和US 4,609,546。另外的说明性聚合物包括聚氧乙基化的多元醇和聚乙二醇(PEG)(例如,分子量在约1,000与约40,000之间,例如在约2,000与约20,000之间,例如约3,000-12,000g/mol的PEG)。
本发明的抗体及其表位结合片段可以进一步用于诊断方法中或用作诊断成像配体。
在一个实施例中,提供了包含一种或多种放射性标记的氨基酸的本发明的抗体及其表位结合片段。经放射性标记的抗τ蛋白抗体可以用于诊断和治疗目的两者(缀合至经放射性标记的分子是另一种可能的特征)。此类标记的非限制性实例包括但不限于:铋(213Bi)、碳(11C、13C、14C)、铬(51Cr)、钴(57Co、60Co)、铜(64Cu)、镝(165Dy)、铒(169Er)、氟(18F)、钆(153Gd、159Gd)、镓(68Ga、67Ga)、锗(68Ge)、金(198Au)、钬(166Ho)、氢(3H)、铟(111In、112In、113In、115In)、碘(121I、123I、125I、131I)、铱(192Ir)、铁(59Fe)、氪(81mKr)、镧(140La)、镥(177Lu)、锰(54Mn)、钼(99Mo)、氮(13N、15N)、氧(15O)、钯(103Pd)、磷(32P)、钾(42K)、镨(142Pr)、钷(149Pm)、铼(186Re、188Re)、铑(105Rh)、铷(81Rb、82Rb)、钌(82Ru、97Ru)、钐(153Sm)、钪(47Sc)、硒(75Se)、钠(24Na)、锶(85Sr、89Sr、92Sr)、硫(35S)、锝(99Tc)、铊(201Tl)、锡(113Sn、117Sn)、氙(133Xe)、镱(169Yb、175Yb、177Yb)、钇(90Y)、锌(65Zn)以及锆(89Zr)。锆(89Zr)是特别感兴趣的。用于制备放射性标记的氨基酸和相关肽衍生物的方法在本领域中是已知的(参见例如荣汉斯(Junghans)等人,癌症化学疗法和生物疗法(Cancer Chemotherapy and Biotherapy)655-686(第2版,查范纳和隆哥编(Chafner and Longo,eds.),Lippincott Raven(1996)),以及US 4,681,581;US 4,735,210;US 5,101,827;US 5,102,990(US RE35,500)、US 5,648,471以及US 5,697,902。例如,放射性同位素可以氯胺T方法进行缀合(Lindegren,S.等人(1998)“Chloramine-T In High-Specific-Activity Radioiodination Of Antibodies Using N-Succinimidyl-3-(Trimethylstannyl)Benzoate As An Intermediate[使用N-琥珀酰亚胺基-3-(三甲基锡烷基)苯甲酸酯作为中间体的抗体的高比活放射性碘化中的氯胺-T]”,Nucl.Med.Biol.[核医学与生物学]25(7):659-665;Kurth,M.等人(1993)“Site-Specific Conjugation Of A Radioiodinated Phenethylamine Derivative To A Monoclonal Antibody Results In Increased Radioactivity Localization In Tumor[放射性碘化的苯乙胺衍生物至单克隆抗体的位点特异性缀合在肿瘤中产生增加的放射性]”,J.Med.Chem.[药物化学杂志]36(9):1255-1261;Rea,D.W.等人(1990)“Site-specifically radioiodinated antibody for targeting tumors[用于靶向肿瘤的位点特异性放射性碘化的抗体]”,Cancer Res.[癌症研究]50(3增刊):857s-861s)。
本发明还提供了抗τ蛋白抗体及其表位结合片段,使用以下项将它们可检测地进行标记:荧光标记(例如稀土螯合物(例如铕螯合物))、荧光素型标记(例如荧光素、异硫氰酸荧光素、5-羧基荧光素、6-羧基荧光素、二氯三嗪基胺荧光素)、罗丹明型标记(例如ALEXA568(英杰公司(Invitrogen)、或丹磺酰氯)、VIVOTAG 680XL FLUOROCHROMETM(珀金埃尔默公司(Perkin Elmer))、藻红蛋白;伞形酮、丽丝胺(Lissamine);花菁;藻红蛋白、德克萨斯红、BODIPY(英杰公司(Invitrogen))或其类似物,所有这些都适合用于光学检测。可以采用化学发光标记(例如,鲁米诺、萤光素酶、萤光素和水母蛋白)。这种诊断和检测还可以通过将本发明的诊断分子偶合至可检测物质(包括但不限于各种酶,酶包括但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶)或者偶合至辅基复合体(例如但不限于链霉亲和素/生物素和亲和素/生物素)来完成。
可以采用化学发光标记(例如,鲁米诺、萤光素酶、萤光素和水母蛋白)。这种诊断和检测还可以通过将本发明的诊断分子偶合至可检测物质(包括但不限于各种酶,酶包括但不限于辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或乙酰胆碱酯酶)或者偶合至辅基复合体(例如但不限于链霉亲和素/生物素和亲和素/生物素)来完成。还可以采用顺磁性标记,并且优选地使用正电子发射断层术(PET)或单光子发射计算机断层术(SPECT)进行检测。此类顺磁性标记包括但不限于含有铝(Al)、钡(Ba)、钙(Ca)、铈(Ce)、镝(Dy)、铒(Er)、铕(Eu)、钆(Gd)、钬(Ho)、铱(Ir)、锂(Li)、镁(Mg)、锰(Mn)、钼(M)、钕(Nd)、锇(Os)、氧(O)、钯(Pd)、铂(Pt)、铑(Rh)、钌(Ru)、钐(Sm)、钠(Na)、锶(Sr)、铽(Tb)、铥(Tm)、锡(Sn)、钛(Ti)、钨(W)和锆(Zi)并且特别是Co+2、CR+2、Cr+3、Cu+2、Fe+2、Fe+3、Ga+3、Mn+3、Ni+2、Ti+3、V+3和V+4的顺磁离子的化合物,使用各种正电子发射断层术的正电子发射金属以及非放射性顺磁金属离子。
因此,在一个实施例中,本发明的抗τ蛋白抗体或其τ蛋白-结合片段可以用荧光标记、化学发光标记、顺磁性标记、放射性同位素标记或酶标记来标记。标记的抗体或片段可以用于检测或测量所述τ蛋白在受试者脑中的存在。这种方法可以包括检测或测量结合到所述τ蛋白上的抗τ蛋白抗体或τ蛋白结合片段的体内成像,并且可以包括对结合到这种τ蛋白上的所述抗τ蛋白抗体或τ蛋白结合片段的离体成像。
在另外的方面,本发明涉及编码本发明的抗体或其τ蛋白结合片段的一种或多种多肽链的表达载体。此类表达载体可以用于重组产生本发明的抗体或其表位结合片段。
在本发明的上下文中,表达载体可以是任何适合的DNA或RNA载体,包括染色体载体、非染色体载体和合成核酸载体(包含一组适合的表达控制元件的核酸序列)。此类载体的实例包括SV40的衍生物、细菌质粒、噬菌体DNA、杆状病毒、酵母质粒、衍生自质粒与噬菌体DNA的组合的载体以及病毒核酸(RNA或DNA)载体。在一个实施例中,编码抗τ蛋白抗体的核酸被包含在包含例如直链表达元件的裸DNA或RNA载体(如例如Sykes和Johnston,Nat Biotech[自然生物技术]12,355-59(1997)中所述),压缩核酸载体(如例如US 6,077,835和/或WO 00/70087中所述),质粒载体如pBR322、pUC 19/18、或pUC 118/119,“midge”最小尺寸的核酸载体(如例如Schakowski等人,MoI Ther[分子理论]3,793-800(2001)中所述)中,或作为沉淀核酸载体构建体,如CaPO4沉淀构建体(如例如WO 00/46147,Benvenisty和Reshef,PNAS USA 83,9551-55(1986),Wigler等人,Cell[细胞]14,725(1978),以及Coraro和Pearson,Somatic Cell Genetics[体细胞遗传学]2,603(1981)中所述)。此类核酸载体及其使用在本领域是熟知的(参见例如US 5,589,466和US 5,973,972)。
在一个实施例中,该载体适合用于在细菌细胞中表达本发明的抗τ蛋白抗体或其表位结合片段。此类载体的实例包括表达载体,例如BlueScript(Stratagene公司)、pIN载体(Van Heeke和Schuster,J.Biol.Chem.[生物化学杂志]264,5503-5509(1989),pET载体(Novagen公司,麦迪逊(Madison),威斯康星州)。
表达载体还可以是或可替代地是适用于在酵母系统中进行表达的载体。可以采用任何适用于在酵母系统中进行表达的载体。适合的载体包括例如包含组成型或诱导型启动子(如α因子、醇氧化酶和PGH)的载体(综述于:F.Ausubel等人编辑的Current Protocols in Molecular Biology[分子生物学实验指南],Greene Publishing and Wiley InterScience[格林出版和威利国际科学]纽约(1987);Grant等人,Methods in Enzymol[酶学方法]153,516-544(1987);Mattanovich,D.等人,Methods Mol.Biol.[分子生物学方法]824,329-358(2012);Celik,E.等人,Biotechnol.Adv.[生物技术进展]30(5),1108-1118(2012);Li,P.等人,Appl.Biochem.Biotechnol.[应用生物化学与生物技术]142(2),105-124(2007);E.等人,Appl.Microbiol.Biotechnol.[应用微生物学与生物技术]77(3),513-523(2007);van der Vaart,J.M.,Methods Mol.Biol.[分子生物学方法]178,359-366(2002)和Holliger,P.,ethods Mol.Biol.[分子生物学方法]178,349-357(2002))。
在本发明的表达载体中,编码抗τ蛋白抗体的核酸可以包含任何适合的启动子、增强子、以及其他表达辅助元件或与其相关联。此类元件的实例包括强表达型启动子(例如,人CMV IE启动子/增强子连同RSV、SV40、SL3-3、MMTV和HIV LTR启动子)、有效的聚(A)终止序列、用于在大肠杆菌中产生质粒的复制起点、作为选择性标志的抗生素抗性基因和/或便利的克隆位点(例如,多聚接头)。核酸还可以包含与组成型启动子(如CMV IE)相对的诱导型启动子(本领域的技术人员应认识到此类术语实际上是在某些条件下的基因表达程度的描述语)。
在甚至另外的方面,本发明涉及重组真核或原核宿主细胞,如转染瘤,其产生如本文定义的本发明的抗体或其表位结合片段或者如本文定义的本发明的双特异性分子。宿主细胞的实例包括酵母、细菌、和哺乳动物细胞,例如CHO或HEK细胞。例如,在一个实施例中,本发明提供了一种细胞,该细胞包含稳定地整合到细胞基因组中的核酸,该核酸包含编码用于表达本发明的抗τ蛋白抗体或其表位结合片段的序列。在另一个实施例中,本发明提供了一种细胞,该细胞包含一种非整合的核酸,如质粒、粘粒、噬菌粒、或线性表达元件,该非整合的核酸包含编码用于表达本发明的抗τ蛋白抗体或其表位结合片段的序列。
在另外的方面,本发明涉及一种用于产生抗τ蛋白抗体的方法,所述方法包括以下步骤:a)培养杂交瘤或如以上定义的本发明的宿主细胞,并且b)从培养基纯化本发明的抗体。
在一个实施例中,本发明涉及一种制品,在这种术语在本文使用时,该制品包含如本文定义的抗τ蛋白抗体,并且基本上不含天然产生的不能结合至τ蛋白或者不实质性地改变该制品的抗τ蛋白功能的抗体。因此,这种制品不包含天然产生的血清、或这种血清的纯化衍生物,该血清或其纯化衍生物包含抗τ蛋白抗体与另一种不改变该制品的抗τ蛋白抗体的功能的抗体的混合物,其中这种功能是:
(i)基本上不能结合至非磷酸化τ蛋白;
(ii)基本上不能结合至在S404处磷酸化且在S396处非磷酸化的τ蛋白;
(iii)能够结合至在S396处磷酸化的τ蛋白;
(iv)能够结合至在S396和S404两者处均磷酸化的τ蛋白;
(v)能够选择性地在磷酸化τ蛋白残基S396和S404之间区分,使其基本上不能结合磷酸化404残基;
(vi)能够结合来自人类阿尔茨海默病脑的过度磷酸化τ蛋白;
(vii)能够在病理性人类τ蛋白和非病理性人类τ蛋白之间区分;和/或
(viii)当如本文所述与经免疫耗减的来自转基因小鼠的rTg4510提取物一起使用时,能够特异性地将过度磷酸化τ蛋白64kDa和70kDa条带减少至少90%,同时没有将55kDaτ蛋白条带减少多于10%,或者当如本文所述与来自人类AD尸体解剖后脑的提取物一起使用时,特异性地将S396磷酸化的过度磷酸化τ蛋白条带减少至少90%,同时没有将非过度磷酸化τ蛋白条带减少多于10%。
本发明具体涉及这样一种抗τ蛋白抗体的制品,该抗体在氨基酸序列方面(在其CDR、可变结构域、框架残基和/或恒定结构域中的任一个中)相对于天然存在的抗τ蛋白抗体的结构而言具有结构变化,其中相对于由所述天然存在的抗τ蛋白抗体展现出的功能而言,所述结构变化引起抗τ蛋白抗体展现出显著改变的功能(即在功能方面多于20%的差异,多于40%的差异,多于60%的差异,多于80%的差异,多于100%的差异,多于150%的差异,多于2倍的差异,多于4倍的差异,多于5倍的差异,或多于10倍的差异);其中这种功能性是:
(i)基本上不能结合至非磷酸化τ蛋白;
(ii)基本上不能结合至在S404处磷酸化且在S396处非磷酸化的τ蛋白;
(iii)能够结合至在S396处磷酸化的τ蛋白;
(iv)能够结合至在S396和S404两者处均磷酸化的τ蛋白;
(v)能够选择性地在磷酸化τ蛋白残基S396和S404之间区分,使其基本上不能结合磷酸化404残基;
(vi)能够结合来自人类阿尔茨海默病脑的过度磷酸化τ蛋白;
(vii)能够在病理性人类τ蛋白和非病理性人类τ蛋白之间区分;和/或
(viii)当如本文所述的与来自转基因小鼠的经免疫耗减的rTg4510提取物一起使用时,能够特异性地将过度磷酸化τ蛋白64kDa和70kDa条带减少至少90%,同时没有将55kDaτ蛋白条带减少多于10%;或者当如本文所述的与来自人类AD尸体解剖后脑的提取物一起使用时,其特异性地以至少90%减少S396磷酸化的过度磷酸化τ蛋白条带、同时以不多于10%减少非过度磷酸化τ蛋白条带的能力。
术语“基本不含”天然产生的抗体是指在此类制品中完全不存在此类天然产生的抗体,或者在此类制品中包含不会实质性影响这些制品的τ蛋白结合特性的一个浓度的此类天然产生的抗体。抗体被说成是“分离的”,如果它具有非天然产生的对应物或已经从天然伴随它的组分中分离或纯化出来的话。
术语“天然产生的抗体”,在它涉及此类制品时,是指在活人或其他动物内引发的抗体(包括天然产生的自身抗体),作为对活人或其他动物的免疫系统发挥作用的自然结果。
因此,本发明的制品不排除并且事实上明确涵盖此类包含抗τ蛋白抗体和有意添加的能够结合至未由τ蛋白拥有的表位上的另外抗体的制品。
本发明的中心方面针对如本文定义的τ蛋白抗体用于治疗眼科疾病的用途。可替代地陈述的,本发明的一个方面是延迟患者的脉络膜,视神经和/或视网膜的τ蛋白病变的进展的方法。患者可能处于阿尔茨海默氏病的早期阶段,或者可能没有相关的诊断。
本发明针对用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中所述单克隆抗体或其表位结合片段能够免疫特异性结合人类τ蛋白(SEQ ID NO:1)的磷酸化残基396,使得抗体或其表位结合片段基本上不与SEQ ID NO:1结合。
在本发明的一个实施例中,如本文定义的τ蛋白抗体用于治疗与视神经病变相关的视网膜神经节细胞神经退行性变的方法。在相关的实施例中,τ蛋白病变是选自下组的障碍,该组由以下组成:类视黄醇淀粉样变性,年龄相关性黄斑变性(ARMD),包括干性ARMD和渗出性ARMD、和青光眼。该障碍可能导致AD早期阶段患者的认知视觉改变,或患有前驱或未诊断的阿尔茨海默氏病的患者,该障碍可能包括阅读和寻找物体的困难、深度感知的变化、从运动中感知结构的困难、颜色识别困难、以及空间对比敏感度损害。
脉络膜和视网膜障碍可选自下组,该组由以下组成类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
治疗可包括耗减缠结或衰减所述缠结的进展,所述缠结包括过度磷酸化τ蛋白,所述方法包括使过度磷酸化τ蛋白与本发明的抗体接触,以使得该缠结被耗减,其过度磷酸化τ蛋白的含量得以减少,或者缠结形成的进展得以衰减。
在一个实施例中,该障碍选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。典型地,用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段选自下组,该组由以下组成:如本文定义的C10-2抗体、C10-2变体、C5.2抗体、C8.3抗体、和D1.2抗体。
本发明的另外的方面针对单克隆抗体或其表位结合片段,该单克隆抗体或其表位结合片段用于制备药物,该药物用于治疗脉络膜和视网膜障碍,其中所述单克隆抗体或其表位结合片段能够免疫特异性结合人类τ蛋白(SEQ ID NO:1)的磷酸化残基396,使得当残基396未被磷酸化时,该抗体或其表位结合片段基本上不结合至在残基404处磷酸化的SEQ ID NO:1。该障碍典型地选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
本发明的另外的方面针对:对受试者中的脉络膜和视网膜障碍进行治疗、诊断或成像的方法,所述方法包括以有效量向所述受试者给予能够免疫特异性地结合至人类τ蛋白(SEQ ID NO:1)的磷酸化残基396的单克隆抗体或其表位结合片段,使得当残基396未被磷酸化时,该抗体或其表位结合片段基本上不结合至在残基404处磷酸化的SEQ ID NO:1。该障碍典型地选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
本发明的一个方面针对延迟脉络膜和视网膜障碍的进展的方法,该障碍选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性(ARMD)、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD,在患者中所述方法包括通过给予能够免疫特异性地结合至人类τ蛋白(SEQ ID NO:1)的磷酸化残基396的抗体,使得当残基396未被磷酸化时,该抗体或其表位结合片段基本上不结合至在残基404处磷酸化的SEQ ID NO:1,以降低或减弱所述患者中病理性τ蛋白的积累。
本发明的一个方面针对单克隆抗体或其表位结合片段,或包含所述抗体或片段的制剂或药物组合物,用于检测或测量受试者眼中所述τ蛋白的存在或量,其中所述抗体选自下组,该组由以下组成:C10-2抗体、C10-2变体、C5.2抗体、C8.3抗体、和D1.2抗体。
在甚至另外的方面,本发明涉及药物组合物,该药物组合物包含:
(i)均本文定义的τ蛋白抗体、或其表位结合片段,或包含这种抗τ蛋白抗体或其表位结合片段的制品(在这种术语在本文定义时);和
(ii)药学上可接受的载体。
这些药物组合物可以用药学上可接受的载体或稀释剂以及任何其他已知的佐剂和赋形剂根据常规技术配制,这些常规技术是例如在以下中披露的技术:Remington:The Science and Practice of Pharmacy[雷明顿:药学科学与实践],第22版,Gennaro编,马克出版公司(Mack Publishing Co.),伊斯顿,宾夕法尼亚,2013。
药学上可接受的载体或稀释剂连同任何其他已知的佐剂和赋形剂应该适合于本发明的所选化合物和所选给予方式。对于载体和药物组合物的其他组分的适合性是基于对本发明的所选化合物或药物组合物的关于表位结合的期望生物学特性缺乏显著负面影响(例如少于实质性影响(10%或更低的相对抑制,5%或更低的相对抑制,等))而确定的。
本发明的药物组合物还可以包括稀释剂、填充剂、盐、缓冲剂、洗涤剂(例如,非离子型洗涤剂(如吐温-20或吐温-80)、稳定剂(例如,无糖或无蛋白氨基酸)、防腐剂、组织固定剂、增溶剂、和/或其他适用于包含于药物组合物中的材料。以不影响组合物的生物活性为目的来选择稀释剂。此类稀释剂的实例为蒸馏水、生理磷酸盐缓冲盐水、林格氏溶液、右旋糖溶液和汉克氏溶液。此外,药物组合物或配制品还可以包含其他载体,或无毒的、非治疗性的、非免疫原性的稳定剂等。组合物还可以包含大的、缓慢代谢的大分子,例如蛋白质、多糖(像壳聚糖)、聚乳酸、聚乙醇酸和共聚物(例如,乳胶功能化的交联琼脂糖、琼脂糖、纤维素等)、聚合氨基酸、氨基酸共聚物以及脂质聚集体(例如,油滴或脂质体)。
本发明的药物组合物中活性成分的实际剂量水平可以变化,以获得对于特定患者、组合物和给予方式而言有效实现所希望的治疗应答的活性成分量。所选的剂量水平将取决于多种药代动力学因素,包括所采用的本发明的具体组合物或其酰胺的活性,给予途径,给予时间,所采用的具体化合物的排泄速率,治疗持续时间,与所采用的具体组合物组合使用的其他药物、化合物和/或材料,所治疗患者的年龄、性别、体重、病情、一般健康状况和既往病史以及医学领域熟知的类似因素。
药物组合物可以通过任何适合的途径和方式给予,包括:用于预防性和/或治疗性治疗的胃肠外、局部、口服或鼻内手段。在一个实施例中,胃肠外地给予本发明的药物组合物。如本文所用的,短语“胃肠外给予(parenteral administration)”和“胃肠外地给予(administered parenterally)”意指除肠内和局部给予之外的给予方式,通常是通过注射,并且包括表皮、静脉内、肌内、和输注。
在优选的实施例中,本发明的抗体以溶液给予。给予可以通过玻璃体内给予或眼周给予,例如结膜下给予,筋膜囊下给予,或眼球后给予,例如注射,或通过眼内注射或滴眼剂,或作为软膏、乳膏或其他液体或凝胶配制品给予眼睛或眼睑周围皮肤。
在体内和体外给予本发明的化合物的另外的适合途径是本领域中熟知的,并且可以由本领域普通技术人员选择。
在一个实施例中,该药物组合物是通过静脉内或皮下注射或输注来给予。
药学上可接受的载体包括任何和所有适合的溶剂、分散培养基、包衣、抗细菌剂和抗真菌剂、等渗剂、抗氧化剂和吸收延迟剂以及可与本发明的化合物生理上兼容的类似物。
可以用于本发明的药物组合物中的适合的水性和非水性载体的实例包括水、盐水、磷酸盐缓冲盐水、乙醇、右旋糖、多元醇(例如甘油、丙二醇、聚乙二醇等)、以及其适合的混合物、植物油(例如橄榄油、玉米油、花生油、棉籽油、以及芝麻油)、羧甲基纤维素胶体溶液、黄蓍胶以及可注射的有机酯(例如油酸乙酯)和/或各种缓冲剂。在药物领域中其他载体是熟知的。
药学上可接受的载体包括无菌水溶液或分散体和用于临时制备无菌注射液或分散体的无菌粉剂。使用此类培养基和药剂用于药物活性物质在本领域是已知的。除了在任何常规培养基或药剂与活性化合物不兼容的情况下,考虑了其在本发明的药物组合物中的使用。
可例如通过使用包衣材料如卵磷脂,通过维持所需的颗粒大小(在分散剂的情况下)和通过使用表面活性剂,来维持适当的流动性。
本发明的药物组合物还可以包含药学上可接受的抗氧化剂,例如(1)水溶性抗氧化剂,例如抗坏血酸、盐酸半胱氨酸、硫酸氢钠、焦亚硫酸钠、亚硫酸钠等;(2)油溶性抗氧化剂,例如抗坏血酸棕榈酸酯、丁基羟基茴香醚(BHA)、丁基羟基甲苯(BHT)、卵磷脂、没食子酸丙酯、α-生育酚等;以及(3)金属螯合剂,例如柠檬酸、乙二胺四乙酸(EDTA)、山梨醇、酒石酸、磷酸等。
本发明的药物组合物还可以在组合物中包含等渗剂,例如糖、多元醇(例如甘露醇、山梨醇、甘油)或氯化钠。
本发明的药物组合物还可以含有一种或多种适用于所选给予途径的佐剂,例如防腐剂、润湿剂、乳化剂、分散剂、防腐剂或缓冲剂,这些佐剂可以增强药物组合物的保质期或有效性。本发明的化合物可以与载体一起制备,这些载体可以保护化合物免于被快速释放,如控释配制品,包括植入物、透皮贴剂和微囊化递送系统。此类载体可以包括明胶、单硬脂酸甘油酯、二硬脂酸甘油酯、可生物降解的生物兼容聚合物(例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸)(单独的或与蜡一起)或本领域熟知的其他材料。用于制备此类配制品的方法通常是本领域普通技术人员已知的。参见例如,Sustained and Controlled Release Drug Delivery Systems[缓释和控释递药系统],J.R.Robinson编辑,Marcel Dekker,Inc.[马歇尔德克公司],纽约,1978。
在一个实施例中,可以将本发明的化合物配制成确保在体内恰当分布。用于胃肠外给予的药学上可接受的载体包括无菌水溶液或分散体和用于临时制备无菌注射液或分散体的无菌粉剂。使用此类培养基和药剂用于药物活性物质在本领域是已知的。除了在任何常规培养基或药剂与活性化合物不兼容的情况下,考虑了其在本发明的药物组合物中的使用。还可以将补充活性化合物掺入组合物中。
注射用药物组合物在制造和储存条件下典型地必须是无菌且稳定的。可以将组合物配制为溶液、微乳液、脂质体或适于高药物浓度的其他有序结构。载体可以是含有例如水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等)及其适合的混合物、植物油(如橄榄油)和可注射有机酯(如油酸乙酯)的水性或非水性溶剂或分散介质。可以例如通过使用包衣材料(例如卵磷脂),通过维持所需的粒度(在分散体的情况下)和通过使用表面活性剂来维持适当的流动性。在许多情况下,优选的是在组合物中包括等渗剂,例如糖、多元醇(例如甘油、甘露醇、山梨醇)或氯化钠。可注射组合物的延长吸收可以通过在组合物中包括延迟抗体吸收的药剂(例如单硬脂酸盐和明胶)来实现。无菌可注射溶液可以通过按需要将所需量的活性化合物与一种例如像上文列举的成分或成分的组合掺在适当溶剂中,随后灭菌微孔过滤来制备。通常,通过将活性化合物掺入无菌载体中来制备分散体,该无菌载体含有基础分散介质和例如来自上文列举的那些的其他所需成分。在用于制备无菌可注射溶液的无菌粉剂的情况下,制备方法的实例是真空干燥和冷冻干燥(冻干),这从其之前的无菌过滤溶液得到活性成分和任何另外的所希望成分的粉剂。
无菌可注射溶液可以通过按需要将所需量的活性化合物与一种上文列举的成分或成分的组合掺在适当溶剂中,随后灭菌微孔过滤来制备。通常,通过将活性化合物掺入无菌载体中来制备分散体,该无菌载体含有基础分散介质和来自上文列举的那些的其他所需成分。在用于制备无菌可注射溶液的无菌粉剂的情况下,制备方法的实例是真空干燥和冷冻干燥(冻干),这从其之前的无菌过滤溶液得到活性成分和任何另外的所希望成分的粉剂。
调整在以上治疗方法和本文所述的使用中的剂量方案,以提供最佳希望的应答(例如,治疗应答)。例如,可以给予单次推注,可以随时间给予若干分次剂量或者可以由治疗情况的紧迫性所指示的按比例减少或增加剂量。为了便于给予和剂量统一,胃肠外组合物可以被配制为剂量单位形式。如本文使用的,剂量单位形式是指作为针对待治疗受试者的单一剂量适合的物理上离散的单位;每个单位含有经计算产生与所需药物载体相关的所希望的治疗作用的活性化合物的预定量。针对本发明的剂量单位形式的描述受指示于并且直接取决于(a)活性化合物的独特特征和待达到的具体治疗作用,以及(b)在复合这种活性化合物以在个体中获得灵敏治疗的领域中固有的限制。
针对本发明的抗体或其表位结合片段的有效剂量和剂量方案取决于待治疗的疾病或病症,并且可以由本领域的普通技术人员确定。在剂量给予的任何一天,剂量的范围可以从约0.0001至约100mg/kg宿主体重,并且更通常是从约0.01至约5mg/kg宿主体重。例如,剂量可以是1mg/kg体重或10mg/kg体重或在1-10mg/kg体重的范围内。因此示例性剂量包括:从约0.1至约10mg/kg/体重、从约0.1至约5mg/kg/体重、从约0.1至约2mg/kg/体重、从约0.1至约1mg/kg/体重,例如约0.15mg/kg/体重、约0.2mg/kg/体重、约0.5mg/kg/体重、约1mg/kg/体重、约1.5mg/kg/体重、约2mg/kg/体重、约5mg/kg/体重、或约10mg/kg/体重。
具有本领域普通技术的医师可以容易地确定并且开出所需药物组合物的有效量。例如,该医师可以按低于用以实现所希望的治疗效果所需的水平,起始用于药物组合物中的本发明的抗体或其表位结合片段的剂量,并且逐渐增加剂量直到实现所希望的效果。通常,本发明的组合物的适合日剂量将是有效产生治疗作用的最低剂量的化合物量。这样一个有效剂量通常将取决于上述因素。给予可以例如是静脉内的、肌内的、腹膜内的或皮下的。如果希望的话,药物组合物的有效日剂量可以在一整天以适当的时间间隔分开为两个、三个、四个、五个、六个或更多个子剂量来给予,任选地以单位剂型给予。虽然本发明的化合物可以单独给予,但是优选的是作为如上描述的药物组合物给予该化合物。
标记的本发明的抗体或其表位结合片段可以用于诊断目的以检测、诊断、或监测疾病或障碍。本发明提供了眼科τ蛋白病变的检测或诊断:(a)使用特异性地结合至τ蛋白的一种或多种抗体,测定焦谷氨酸化的Aβ片段在受试者细胞或组织样品中的存在;并且(b)将抗原的水平与对照水平(例如,正常组织样品中的水平)进行比较,由此相比于抗原的对照水平该抗原的测定水平的增加指示疾病或障碍,或指示疾病或障碍的严重性。
本发明的抗体或其表位结合片段可以用于使用在本领域中熟知的免疫组织化学方法测定生物样品中的τ蛋白或τ蛋白片段。有用于检测蛋白质的其他基于抗体的方法包括免疫测定(如酶联免疫测定(ELISA)和放射免疫测定(RIA))以及基于中型发现平台(mesoscale discovery platform)的测定(MSD)。适合的抗体标记可以用于此类试剂盒和方法中,并且本领域中已知的标记包括酶标记,如碱性磷酸酶和葡萄糖氧化酶;放射性同位素标记,例如碘(125I、131I)、碳(14C)、硫(35S)、氚(3H)、铟(121In)和锝(99mTc);和发光标记,例如鲁米诺和萤光素酶;以及荧光标记,例如荧光素和罗丹明。
可以在体内检测经标记的抗τ蛋白抗体或其τ蛋白结合片段的存在,以用于诊断目的。在一个实施例中,诊断包括:a)向受试者给予有效量的这种经标记分子;b)在给予之后等待一个时间间隔,以允许经标记的分子在Aβ沉积位点(如果有的话)浓缩,并且以允许未结合的经标记的分子被清除至背景水平;c)确定背景水平;并且d)检测受试者中经标记的分子,使得对超过背景水平的经标记的分子的检测指示受试者患有该疾病或障碍,或者指示该疾病或障碍的严重性。根据这种实施例,将该分子用成像部分标记,以用于使用本领域的普通技术人员已知的具体成像系统检测。背景水平可以通过本领域中已知的不同方法来确定,包括将检测到的经标记的抗体的量与之前确定的针对具体成像系统的标准值进行比较。可用于本发明的诊断方法中的方法以及系统包括但不限于计算机断层摄影(CT)、全身扫描例如正电子发射体层摄影(PET)、磁共振成像(MRI)、以及超声检查。
在另外的方面,本发明提供了一种如本文定义的单克隆抗体或其表位结合片段,用于在治疗中使用。
在另外的方面,本发明提供了一种如本文定义的单克隆抗体或其表位结合片段,用于在τ蛋白病变的治疗、诊断或成像中使用。
在另外的方面,本发明提供了一种如本文定义的单克隆抗体或其表位结合片段,用于在制造一种用于对τ蛋白病变进行治疗、诊断或成像的药物中使用。
在优选实施例中,该治疗是慢性的,优选持续至少2周,例如至少持续1个月、6个月、1年或更久。
在另外的方面,本发明提供了一种试剂盒,该试剂盒包括如本文定义的用于在治疗中使用的抗体或其片段。
实施例
1.一种用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中所述单克隆抗体或其表位结合片段能够免疫特异性结合人类τ蛋白(SEQ ID NO:1)的磷酸化残基396,使得当残基396未被磷酸化时,该抗体或其表位结合片段基本上不结合至在残基404处磷酸化的SEQ ID NO:1。
2.根据实施例1所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中所述治疗包括耗减缠结或衰减所述缠结的进展,所述缠结包括过度磷酸化τ蛋白,所述方法包括使过度磷酸化τ蛋白与本发明的抗体接触,以使得该缠结被耗减,其过度磷酸化τ蛋白的含量得以减少,或者缠结形成的进展得以衰减。
3.根据实施例1所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该障碍选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
4.根据实施例1所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该抗体选自下组,该组由以下组成:C10-2抗体、C10-2变体、C5.2抗体、C8.3抗体、和D1.2抗体。
5.根据实施例1所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该C5.2抗体包含:
(a)具有SEQ ID NO:66的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:67的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:68的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:69的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:70的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:71的氨基酸序列的重链CDR3。
6.根据实施例5所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该C5.2抗体包含:
(a)包含SEQ ID NO:72的氨基酸序列的轻链;和
(b)包含SEQ ID NO:73的氨基酸序列的重链。
7.根据实施例1所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该C8.3抗体包含:
(a)具有SEQ ID NO:74的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:75的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:76的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:77的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:78的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:79的氨基酸序列的重链CDR3。
8.根据实施例7所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该C8.3抗体包含:
(a)包含SEQ ID NO:80的氨基酸序列的轻链;和
(b)包含SEQ ID NO:81的氨基酸序列的重链。
9.根据实施例1所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该D1.2抗体包含:
(a)具有SEQ ID NO:58的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:59的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:60的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:61的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:62的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:63的氨基酸序列的重链CDR3。
10.根据实施例9所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该D1.2抗体包含:
(a)包含SEQ ID NO:64的氨基酸序列的轻链;和
(b)包含SEQ ID NO:65的氨基酸序列的重链。
11.一种单克隆抗体或其表位结合片段,其包含:
(a)轻链CDR1,其包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:3、SEQ ID NO:31;SEQ ID NO:32;SEQ ID NO:33;SEQ ID NO:34;SEQ ID NO:35;SEQ ID NO:36;SEQ ID NO:37;SEQ ID NO:38;SEQ ID NO:40;和SEQ ID NO:46;
(b)轻链CDR2,其包含SEQ ID NO:4;SEQ ID NO:41;和SEQ ID NO:47的氨基酸序列;
(c)轻链CDR3,其包含SEQ ID NO:5;SEQ ID NO:42;和SEQ ID NO:48的氨基酸序列;
(d)重链CDR1,其包含SEQ ID NO:6;SEQ ID NO:43;SEQ ID NO:49;SEQ ID NO:52;和SEQ ID NO:55的氨基酸序列;
(e)重链CDR2,其包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:7;SEQ ID NO:28;SEQ ID NO:29;SEQ ID NO:30;SEQ ID NO:44;SEQ ID NO:50;SEQ ID NO:53;和SEQ ID NO:56;和
(f)重链CDR3,其包含选自下组的氨基酸序列,该组由以下组成:SEQ ID NO:8,SEQ ID NO:39;SEQ ID NO:45;SEQ ID NO:51;SEQ ID NO:54;和SEQ ID NO:57。
12.一种单克隆抗体或其表位结合片段,其包含:
(a)选自下组的轻链,该组由以下组成:SEQ ID NO:12;SEQ ID NO:16;SEQ ID NO:17;SEQ ID NO:18;SEQ ID NO:19;SEQ ID NO:20;SEQ ID NO:21;SEQ ID NO:22和SEQ ID NO:23;和
(b)选自下组的重链,该组由以下组成:SEQ ID NO:11;SEQ ID NO:13;SEQ ID NO:14;SEQ ID NO:15;SEQ ID NO:24;SEQ ID NO:25;SEQ ID NO:26;和SEQ ID NO:27。
13.根据实施例1或5所述的单克隆抗体或其表位结合片段,其中,
(a)该轻链是SEQ ID NO:12;并且
(b)该重链选自下组,该组由以下组成:SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:24、SEQ ID NO:25、SEQ ID NO:26和SEQ ID NO:27。
14.根据实施例1或5所述的单克隆抗体或其表位结合片段,其中,
(a)该轻链选自下组,该组由以下组成:SEQ ID NO:16;SEQ ID NO:17;SEQ ID NO:18;SEQ ID NO:19;SEQ ID NO:20;SEQ ID NO:21;SEQ ID NO:22和SEQ ID NO:23;并且
(b)该重链是SEQ ID NO:11。
15.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2以及
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
16.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;
(b)包含SEQ ID NO:13的氨基酸序列的重链。
17.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含以下中的至少一个:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2以及
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
18.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:29的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
19.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;和
(b)包含SEQ ID NO:14的氨基酸序列的重链。
20.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含以下中的至少一个:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:29的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
21.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:30的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
22.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;和
(b)包含SEQ ID NO:15的氨基酸序列的重链。
23.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含以下中的至少一个:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:30的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
24.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
25.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:16的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
26.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
27.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:32的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
28.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:17的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
29.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:32的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3;
30.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:33的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
31.根据实施例1或5所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:18的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
32.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:33的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3;
33.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:34的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
34.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:19的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
35.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:34的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
36.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:35的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
37.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:20的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
38.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:35的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
39.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:36的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
40.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:21的氨基酸序列的轻链;
(b)包含SEQ ID NO:11的氨基酸序列的重链。
41.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:36的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
42.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:37的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
43.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:22的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
44.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:37的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
45.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:38的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
46.根据实施例1或5所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:23的氨基酸序列的轻链;和
(b)包含SEQ ID NO:11的氨基酸序列的重链。
47.根据实施例4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:38的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
48.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
49.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;和
(b)包含SEQ ID NO:24的氨基酸序列的重链。
50.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含以下中的至少一个:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
51.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
52.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:16的氨基酸序列的轻链;
(b)包含SEQ ID NO:24的氨基酸序列的重链。
53.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3;
并且进一步包含以下中的至少一个:
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;和
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2。
54.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:32的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
55.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:17的氨基酸序列的轻链;和
(b)包含SEQ ID NO:24的氨基酸序列的重链。
56.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:32的氨基酸序列的轻链CDR1;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3;
并且进一步包含以下中的至少一个:
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;和
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2。
57.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
58.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:16的氨基酸序列的轻链;
(b)包含SEQ ID NO:13的氨基酸序列的重链。
59.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:31的氨基酸序列的轻链CDR1;和
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2;
并且进一步包含以下中的至少一个:
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
60.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:32的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
61.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:17的氨基酸序列的轻链;
(b)包含SEQ ID NO:13的氨基酸序列的重链。
62.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:32的氨基酸序列的轻链CDR1;和
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2;
并且进一步包含以下中的至少一个:
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;和
(f)具有SEQ ID NO:8的氨基酸序列的重链CDR3。
63.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:33的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
64.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:18的氨基酸序列的轻链;和
(b)包含SEQ ID NO:24的氨基酸序列的重链。
65.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:33的氨基酸序列的轻链CDR1;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3;
并且进一步包含以下中的至少一个:
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;和
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2。
66.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:34的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
67.根据实施例1或5所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:19的氨基酸序列的轻链;和
(b)包含SEQ ID NO:24的氨基酸序列的重链。
68.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:34的氨基酸序列的轻链CDR1;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3;
并且进一步包含以下中的至少一个:
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含以下中的至少一个:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:7的氨基酸序列的重链CDR2。
69.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
70.根据实施例1或5所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;和
(b)包含SEQ ID NO:25的氨基酸序列的重链。
71.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:28的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
72.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:29的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
73.根据实施例1或5所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;和
(b)包含SEQ ID NO:26的氨基酸序列的重链。
74.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:29的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
75.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:30的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
76.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)包含SEQ ID NO:12的氨基酸序列的轻链;和
(b)包含SEQ ID NO:27的氨基酸序列的重链。
77.根据实施例1或4所述的单克隆抗体或其表位结合片段,其包含:
(a)具有SEQ ID NO:3的氨基酸序列的轻链CDR1;
(b)具有SEQ ID NO:4的氨基酸序列的轻链CDR2;和
(c)具有SEQ ID NO:5的氨基酸序列的轻链CDR3;
并且进一步包含:
(d)具有SEQ ID NO:6的氨基酸序列的重链CDR1;
(e)具有SEQ ID NO:30的氨基酸序列的重链CDR2;和
(f)具有SEQ ID NO:39的氨基酸序列的重链CDR3。
78.一种单克隆抗体或其表位结合片段,该单克隆抗体或其表位结合片段用于制备一种药物,该药物用于治疗脉络膜和视网膜障碍,其中所述单克隆抗体或其表位结合片段能够免疫特异性结合人类τ蛋白(SEQ ID NO:1)的磷酸化残基396,使得当残基396未被磷酸化时,该抗体或其表位结合片段基本上不结合至在残基404处磷酸化的SEQ ID NO:1。
79.根据实施例78所述的单克隆抗体或其表位结合片段,其中该障碍选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
80.根据实施例1所述的单克隆抗体或其表位结合片段,其包含选自下组的表位结合片段或由其组成,该组由以下组成:Fv片段(例如单链Fv和二硫化物键合的Fv);Fab样片段,例如Fab片段、Fab'片段和F(ab)2片段;和结构域抗体,例如单VH可变结构域或VL可变结构域。
81.根据前述实施例中任一项所述的单克隆抗体或其表位结合片段,其是人类的或人源化的。
82.一种对受试者中的脉络膜和视网膜障碍进行治疗、诊断或成像的方法,所述方法包括以有效量向所述受试者给予能够免疫特异性地结合至人类τ蛋白(SEQ ID NO:1)的磷酸化残基396的单克隆抗体或其表位结合片段,使得当残基396未被磷酸化时,该抗体或其表位结合片段基本上不结合至在残基404处磷酸化的SEQ ID NO:1。
83.根据实施例82所述的对脉络膜和视网膜障碍进行治疗、诊断或成像的方法,其中该障碍选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD。
84.一种单克隆抗体或其表位结合片段,或包含所述抗体或片段的制剂或药物组合物,用于检测或测量受试者眼中所述τ蛋白的存在或量,其中所述抗体选自下组,该组由以下组成:C10-2抗体、C10-2变体、C5.2抗体、C8.3抗体、和D1.2抗体。
85.一种延迟脉络膜和视网膜障碍的进展的方法,该障碍选自下组,该组由以下组成:类视黄醇淀粉样变性、年龄相关性黄斑变性(ARMD)、与视神经病变相关的视网膜神经节细胞神经退行性变,包括青光眼、干性ARMD和渗出性ARMD,在患者中所述方法包括通过给予能够免疫特异性地结合至人类τ蛋白(SEQ ID NO:1)的磷酸化残基396的抗体,使得当残基396未被磷酸化时,该抗体或其表位结合片段基本上不结合至在残基404处磷酸化的SEQ ID NO:1,以降低或减弱所述患者中病理性τ蛋白的积累。
86.一种单克隆抗体,用于治疗根据实施例1所述的脉络膜和视网膜障碍,该抗体由完整抗体组成。
87.一种根据实施例1所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,该抗体或其表位结合片段选自下组,该组由以下组成:Fv片段(例如单链Fv和二硫化物键合的Fv);Fab样片段(例如Fab片段、Fab'片段和F(ab)2片段);迷你体(mini-body)(Fv)2-CH3结构域,以及结构域抗体(例如,单VH可变结构域或VL可变结构域)。
88.根据前述实施例中任一项所述的用于治疗脉络膜和视网膜障碍的抗体或其表位结合片段,其中该抗体选自下组,该组由以下抗体组成:亚型IgG1、IgG2、IgG3或IgG4。
89.根据前述实施例中任一项所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其是人类的或人源化的。
90.根据前述实施例中任一项所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中该抗体或其表位结合片段展现以下特性中的一种或多种:
(a)针对人类病理性τ蛋白的选择性和特异性;
(b)对于p-τ386-408(pS396/pS404)(SEQ ID NO:1)的结合亲和力(KD)在0.5-10nM之间,例如1-5nM或1-2nM
91.根据前述实施例中任一项所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中所述抗体基本上不结合τ蛋白(SEQ ID NO:1)上的磷酸化404残基。
92.根据实施例1所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其包含:
(a)轻链CDR1,其具有SEQ ID NO:3的氨基酸序列或具有不多于4个氨基酸差异、或不多于3个氨基酸差异、或不多于2个氨基酸差异、或不多于1个氨基酸差异的氨基酸序列;
(b)轻链CDR2,其具有SEQ ID NO:4的氨基酸序列或具有不多于4个氨基酸差异、或不多于3个氨基酸差异、或不多于2个氨基酸差异、或不多于1个氨基酸差异的氨基酸序列;
(c)轻链CDR3,其具有SEQ ID NO:5的氨基酸序列或具有不多于4个氨基酸差异、或不多于3个氨基酸差异、或不多于2个氨基酸差异、或不多于1个氨基酸差异的氨基酸序列;
(d)重链CDR1,其具有SEQ ID NO:6的氨基酸序列或具有不多于4个氨基酸差异、或不多于3个氨基酸差异、或不多于2个氨基酸差异、或不多于1个氨基酸差异的氨基酸序列;
(e)重链CDR2,其具有SEQ ID NO:7的氨基酸序列或具有不多于4个氨基酸差异、或不多于3个氨基酸差异、或不多于2个氨基酸差异、或不多于1个氨基酸差异的氨基酸序列;和
(f)重链CDR3,其具有SEQ ID NO:8的氨基酸序列或具有不多于4个氨基酸差异、或不多于3个氨基酸差异、或不多于2个氨基酸差异、或不多于1个氨基酸差异的氨基酸序列。
93.根据前述实施例中任一项所述的用于治疗脉络膜和视网膜障碍的单克隆抗体或其表位结合片段,其中所述抗体或其片段与在实施例4-77中定义的抗体或其表位结合片段相竞争以结合至人类τ蛋白。
94.一种药物组合物,其包含根据实施例1至83中任一项所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,配制用于胃肠外、局部、口服或鼻内给予。
95.一种药物组合物,其包含根据实施例1至77中任一项所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,配制用于肠内或局部给予。
96.一种药物组合物,其包含根据实施例1至77中任一项所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,配制用于注射,例如包括表皮、静脉内、肌内、动脉内、鞘内、囊内、眼眶内、心内、真皮内、腹膜内、腱内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、椎管内、颅内、胸腔内、硬膜外以及胸骨内注射和输注。
97.一种药物组合物,其包含根据实施例1至77中任一项所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,配制用于作为溶液。
98.一种药物组合物,其包含根据实施例1至77中任一项所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,配制用于玻璃体内给予或眼周给予,例如结膜下给予,筋膜囊下给予,或眼球后给予,例如通过注射。
99.一种药物组合物,其包含根据实施例1至77中任一项所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,配制用于眼内注射或用于作为滴眼剂给予。
100.一种药物组合物,其包含根据实施例1至77中任一项所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,配制为软膏、乳膏或其他液体或凝胶例如给予眼睛或眼睑周围皮肤。
101.一种药物组合物,其包含根据实施例1至77中任一项所述的单克隆抗体或其表位结合片段,用于治疗脉络膜和视网膜障碍,配制用于静脉内或皮下注射或输注。
实例
实例1:用磷酸化肽396/404免疫小鼠
将C56/BL6和FVB小鼠用在TiterMax佐剂中配制的10μg P30缀合的磷酸化τ蛋白386-408(pS396/pS404)(SEQ ID NO:2)进行免疫。
小鼠(C56/BL6和FVB品系,雌性和雄性)。将2-3月龄小鼠用缀合肽表位P30的磷酸化τ蛋白386-408进行免疫。
遵循TiterMax/供应商方案,将缀合免疫原性P30的磷酸化τ386-408(pS396/pS404)肽配制于TiterMax(400μg/ml肽,以1:1vol:vol混合)中,并且将小鼠皮下注射20μg抗原肽(100μl)。对于对照小鼠仅注射佐剂。将所有用肽免疫的小鼠用0.5μg肽/Titermax(10μg/ml肽,如上所述配制并且注射)以月间隔进行强化。最后在将脾细胞与SP-2细胞融合前3天,在不用Titermax的情况下,将小鼠用缀合P30的磷酸化τ蛋白386-408(pS396/pS404)进行强化。在展现与ELISA板的阳性结合后(所述ELISA板已经用1μg/ml磷酸化τ蛋白386-408(pS396/pS404)涂覆),并且展现出与来自AD和TG4510脑裂解物的S1和P3抗原的优先结合活性之后,选择杂交瘤用于再克隆循环(下文描述于实例3中)。使用斑点印迹和脑裂解物涂覆的ELISA或MSD板,将这种结合与此类抗体结合到来自对照的脑裂解物的活性进行比较。
实例2:杂交瘤产生
在将脾细胞与SP-2细胞融合前3天,在不用Titermax的情况下,将小鼠用缀合P30的磷酸化τ蛋白386-408(pS396/pS404)进行强化。在用1μg/ml磷酸化τ蛋白386-408(pS396/pS404)涂覆的ELISA板中阳性结合、并且使用斑点印迹和脑裂解物涂覆的ELISA或MSD板相比于来自对照的脑裂解物与来自AD和TG4510脑裂解物的S1和P3抗原的优先结合活性之后,选择杂交瘤用于再克隆循环。
实例3.用于AD-P3捕获的液相抑制分析
实例3A的目的:为了量化在用小鼠C10-2涂覆的MSD板中AD-P3脑材料中人C10-2和突变变体与P(396)τ蛋白抗原结合的抑制。抑制的程度被表示为IC50值,反映液相抗体结合至抗原的相对亲和力。通过使用Graph Pad Prism软件拟合到一个或两个位点结合模型获得IC50值。添加与P(404)τ蛋白反应的阴性对照抗体(小鼠C10-1)进行比较(数据未示出)。
方法:在室温下,将MSD板用捕获的抗体(在碳酸盐缓冲液pH 8,5中的750ng/ml C10-2)涂覆过夜,随后封闭(30min在PBS中,3%BSA,0.1%NP40),并且洗涤5次(PBS,0.1%BSA,0.1%NP40)。如以上的描述,在室温下,将成梯度的浓度(0-1000nM)的抗体用AD-P3材料孵育60min,并且随后在室温下在涂覆小鼠C10-2的MSD板上孵育1小时。将板洗涤5次(在PBS中,0,1BSA,0,1%NP40),并且向检测的反映非抑制的游离τ蛋白抗原的捕获的τ蛋白中添加抗人类总τ蛋白(MSD硫标记1:50)。
结果:数据显示使用人类C10-2和C10-2变体(图1)的τ蛋白捕获的剂量依赖性抑制。C10-2变体C10-2_N32S和C10-2_N32S:A101T抑制更强(IC50分别=44nM和14nM,拟合至一个位点结合模型),然而C10-2示出由最佳拟合至两位点结合模型(IC50 14nM/630nM)的非均质的抑制。该低亲和力结合(IC50=630)是主要的,因为高亲和力抗体结合(IC50=14nM)包含少于25%的总结合。结果在图1中示出
实例3B的目的:为了量化在液相抑制分析中结合至P(396)τ蛋白386-408肽的人类C10-2和突变的变体的抑制。抑制的程度被表示为IC50值,反映抗体结合的表观亲和力。通过使用Graph Pad Prism软件拟合到一个或两个位点结合模型获得IC50值。添加与P(404)τ蛋白反应的阴性对照抗体(小鼠C10-1)进行比较(数据未示出)。
方法:在室温下,在碳酸盐缓冲液(pH 9,5)中,将MSD板用P(396)τ蛋白386-408涂覆过夜,随后封闭(在PBS中30min,3%BSA,0,1%NP40),并且洗涤5次(PBS,0.1%BSA,0.1%NP40)。如以上的描述,在室温下,将成梯度的浓度(0-1000nM)的P(396)τ蛋白386-408用1ng/ml抗体孵育60min,并且随后在室温下,在涂覆P(396)τ蛋白386-408的MSD板上孵育1小时。将板洗涤5次(在PBS中,0,1%BSA,0.1%NP40),并且向反映非抑制的游离抗体的检测结合抗体中添加抗人类总τ蛋白(MSD硫标记1:50)。结果在图2中示出。
实例4.抗体的免疫组织化学谱
组织
小鼠:从8个月龄rTg4510小鼠中收集小鼠脑组织。在CamK2阳性神经元中在tet-关(tet-off)响应元件下,这些转基因小鼠表达人类突变的τ蛋白(P301L0N4R),并且显示出显著的τ蛋白过度磷酸化作用,以及来自6个月龄及之前的缠结形成。非转基因的同窝仔充当对照。通过浸入4%多聚甲醛中将小鼠脑固定,并且包埋在石蜡中。人类:从组织方案公司(Tissue Solutions)(格拉斯哥,英国)获得福尔马林固定的石蜡包埋的人类额叶皮质的脑样品。将来自患有诊断的末期阿尔茨海默氏病(AD;Braak V-VI期)的3个供体的组织与年龄匹配的非痴呆对照供体进行比较。
免疫组织化学:
将小鼠和人类组织的4μm厚的切片在薄片切片机上切割,并且通过在10mM柠檬酸盐缓冲液(pH 6)中微波处理切片10分钟,使其经受抗原修复。将内源过氧化物酶用在PBS/1%BSA/0.3%曲通X-100(PBS-BT)中的1%过氧化氢/随后用在5%正常猪血清进行封闭。将处于在图1中示出的浓度范围内,在4℃下,将切片与稀释于PBS-BT中的hC10-2、hC10-2_N32S和hC10-2_N32S_A101T抗体孵育过夜。将这些切片在PBS,0.25%BSA,0.1%曲通X-100中洗涤,之后与生物素酰化的第二猪抗人类抗体(#B1140;西格玛奥德里奇公司(Sigma-Aldrich)),以1:200孵育1小时。在另外的洗涤后,应用链霉亲和素-生物素复合物试剂盒(载体实验室(Vector Laboratories),伯林盖姆(Burlingame),加利福尼亚州),并且最后用0.05%二氨基联苯胺使免疫反应性可见。将这些切片用苏木精复染,以显示细胞核的位置。
结果
hC10-2、hC10-2_N32S和hC10-2_N32S_A101T标记的结构与在3个AD脑(即,缠结、神经毡线、营养不良性神经突)中的病理性τ蛋白一致。免疫反应性的强度是浓度依赖性的。没有检测出例如神经胶质细胞或血管的表观标记。在来自对照脑的切片中没有检测到免疫反应性。同样地,所有的3种抗体导致针对在rTg4510脑的海马体和皮质二者中的磷酸化τ蛋白的预期模式。在来自非转基因小鼠的脑切片中,没有检测出免疫反应性。
实例5.静脉内注射后在rTg4510小鼠的τ蛋白结构的修饰
方法
10个月龄的rTg4510小鼠。在CamK2阳性神经元中在tet-关(tet-off)响应元件下,这些转基因小鼠表达人类突变的τ蛋白(P301L 0N4R),并且显示出显著的τ蛋白过度磷酸化作用,以及来自6个月龄及之前的缠结形成。另外,在10个月龄的rTg4510小鼠的具有强烈病变的区中出现神经退行性变。单个转基因的tTA同窝仔充当对照。在80mg/kg的浓度下,将该小鼠经由尾静脉用hC10-2、hC10-2_N32S或hC10-2_N32S_A101T抗体接受单次静脉内注射。以150微升的体积注射每只小鼠。注射后3天,将小鼠用PBS灌注2min,随后用4%多聚甲醛灌注10min。将这些脑在30%蔗糖中低温保护,并且将其切成40微米自由浮动的冷冻切片。将这些切片在PBS/1%BSA/0.3%曲通X-100中用5%正常猪血清孵育20分钟,在PBS中洗涤,并且最后与AlexaFluor488缀合的第二抗人类IgG以1:200(#709-545-149;杰克逊免疫研究实验室公司(Jackson ImmunoResearch Laboratories),美国宾夕法尼亚州西格罗夫(West Grove,USA))进行孵育。将Hoechst用于核染色。将这些切片在PBS中洗涤,封片,并且通过荧光显微镜检术进行检测。
结果
在年老的rTg4510小鼠脑中,hC10-2、hC10-2_N32S和hC10-2_N32S_A101T的静脉内注射导致结合至海马体和皮质的体内靶标结构中(图4-7)。观察到的阳性结构的数量在个体rTg4510动物之间变化。在tTA对照小鼠中,注射三种抗体中任一者的后,没有检测到特异性荧光信号(图4-7)。作为阴性对照,注射对照人类IgG没有导致在rTg4510小鼠中的信号(数据未示出)。在rTg4510脑中的阳性信号没有因为细胞内染色而容易地出现,并且可以代表在神经退行性变过程中释放的细胞外的τ蛋白材料。总体上,这些数据表明hC10-2、hC10-2_N32S和hC10-2_N32S_A101T抗体能够穿透脑薄壁组织,并且在体内特异性地修饰在rTg4510小鼠中的靶标。
实例6.阿尔茨海默氏病脑中的τ蛋白免疫反应性的表征
组织:
从组织方案公司(Tissue Solutions)(格拉斯哥,英国)获取石蜡包埋的人类额皮质的脑样品。将来自患有诊断的末期阿尔茨海默氏病(AD;Braak V-VI期)的供体的组织包括在内。
免疫组织化学
将4μm厚的人类组织的切片在薄片切片机上切割,并且通过在10mM柠檬酸盐缓冲液(pH 6)中微波处理切片10分钟,使其经受抗原修复。将切片用5%正常猪血清在PBS/1%BSA/0.3%曲通X-100(PBS-BT)中孵育过夜,随后在4℃下,与稀释于PBS-BT中的hC10-2或hC10-2_N32S_A101T抗体进行孵育。将这些切片在PBS,0.25%BSA,0.1%曲通X-100中洗涤。通过AlexaFluor488缀合的第二抗人类IgG(1:200;#709-545-149,杰克逊免疫研究实验室公司(Jackson ImmunoResearch Laboratories),美国宾夕法尼亚州西格罗夫(West Grove,USA))将免疫反应性可视化。对于双免疫荧光,将切片与AT8(1:500;#MN1020,赛默飞世尔公司(ThermoFisher),沃尔瑟姆,美国)、或E1总人类τ蛋白抗体、针对N-端τ蛋白19-33(Crowe等人,1991)饲养的定做兔抗体共孵育。将AT8和E1的免疫反应性分别用抗小鼠AlexaFluor568(1:400;#A10037,赛默飞世尔公司(ThermoFisher))和抗兔AlexaFluor568(1:400;#A10042,赛默飞世尔公司(ThermoFisher))可视化。通过荧光显微镜检术分析这些切片。
结果
在针对N-端总τ蛋白和p396τ蛋白的双染色的AD切片中,通过E1以及hC10-2和hC10-2_N32S_A101T抗体标记具有缠结神经元的群体(图7)。许多τ蛋白缠结是仅由hC10-2和hC10-2_N32S_A101T抗体标记的(图7,箭头)。细胞外的τ蛋白(血影缠结)先前已经示出没有被N-末端τ蛋白抗体染色(例如,Bondareff等人,1990;Braak等人,1994;Flores-Rodrigues等人,2015)。因此,由单独地hC10-2或hC10-2_N32S_A101T抗体标记的τ蛋白种类可能代表细胞外的血影缠结。
蛋白质印迹和免疫沉淀反应
实验流程和实验描述
使用转基因的rTg4510小鼠:将具有P301L突变(4R0NτP301L)的人类τ蛋白cDNA置于四环素-操纵子-效应器(TRE)构建体的下游。为了激活转基因,该效应器必须与由四环素条件基因表达系统(tTA)组成的激活剂构建体共表达。将该tTA激活剂系统置于CaMKIIα启动子的下游,因此限制TRE主要对前脑结构的表达。将该τ蛋白转基因效应器在FVB/N(塔康公司(Taconic))小鼠品系中表达,并且将该tTA激活剂系统在129S6(塔康公司(Taconic))小鼠品系上保持。它们的F1子代携带效应器和激活剂转基因(rTg4510)连同非转基因的(非-tg)和单个转基因的同窝仔小鼠。仅使用F1小鼠用于实验。将所有的小鼠饲养在塔康公司(Taconic),丹麦,并且使用引物对的针对tTA激活剂转基因的5'-GATTAACAGCGCATTAGAGCTG-3'和5'-GCATATGATCAATTCAAGGCCGATAAG-3'以及针对突变τ蛋白效应器转基因的5'-TGAACCAGGATGGCTGAGCC-3'和5'-TTGTCATCGCTTCCAGTCCCCG-3',通过尾部DNA的分析来进行基因分型。将小鼠分组笼养,并以随意量获得水和食物(Brogaarden,丹麦)以及浓缩物质。光/暗循环是12小时;室温是21℃±2℃,并且相对湿度是55%±5%。根据丹麦对实验动物的法律(许可证号2014-15-0201-00339)进行实验。
通过颈脱位将小鼠安乐死,以保护大脑的代谢环境,并且防止可能改变τ蛋白生物学特征的人工制品。将小鼠大脑在中线下对切为矢状,以产生两个半球。将每只动物右半球的大脑皮质和海马体在干冰上迅速冷冻并在-80℃下储存直至使用。来自阿尔茨海默氏病(AD)患者和年龄健康的对照(HC)供体的冷冻人类皮质是购自组织方案公司(Tissue Solutions)(格拉斯哥,英国)。人脑标本具有相似的<6h的死后处理时间,并且其特征为淀粉样蛋白和τ蛋白病变,并且将所选择的AD标本分类为Braak V-VI期。
为了免疫沉淀来自脑裂解物的τ蛋白,遵循制造商的说明书使用交联免疫沉淀反应(Crosslink Immunoprecipitation)试剂盒(Thermo Fisher Pierce 26147)。简言之,将该抗体结合至蛋白A/G加琼脂糖,随后通过将结合的抗体与DSS(丁二酰亚胺辛二酸酯)的交联。将脑匀浆在Tris缓冲液(25mM Tris/HCl pH 7.6,150mM NaCl,1mM EDTA,1mM EGTA,以及完整的蛋白酶和磷酸酶抑制剂混合物)中制备,并且在4℃下用对照琼脂糖树脂预澄清。在4℃下,将预澄清的裂解物与抗体交联的树脂孵育过夜,随后用50μl洗脱缓冲液(pH 2.8)将抗原进行洗脱,并且立即离心至含有5μl 1M Tris,pH 9.5的收集管中。如下文描述的,将免疫沉淀的τ蛋白溶解于含有二硫苏糖醇(DTT,100mM)的SDS-样品缓冲液中,加热处理(95℃持续10分钟),并且经受蛋白质印迹。
遵循制造商的说明书(英杰公司(Invitrogen)),通过ELISA,针对总人类τ蛋白测量在脑匀浆物和预澄清的裂解物中的人类τ蛋白浓度。
将组织匀浆化于10个体积的如下含有蛋白酶和磷酸酶抑制剂的Tris-缓冲盐水(TBS)中:50mM Tris/HCl(pH 7.4);274mM NaCl;5mM KCl;1%蛋白酶抑制剂混合物(罗氏公司(Roche));1%磷酸酶抑制剂混合物I&II(西格玛公司);和1mM苯甲基磺酰氟(PMSF)。在4℃下,将匀浆物在27,000x g下离心20min,以获得上清液(S1)和沉淀部分。将沉淀重新匀浆化于5个体积的高盐/蔗糖缓冲液(0.8M NaCl、10%蔗糖、10mM Tris/HCl[pH 7.4]、1mM EGTA、1mM PMSF)中,并且如上离心。将上清液收集,并且与肌氨酰(1%终浓度;西格玛公司(Sigma))在37℃下一起孵育1小时,随后在150,000x g下4℃离心1小时,以获得盐和肌氨酰-可提取物(S3)和肌氨酰不可溶性(P3)级分。将P3沉淀重悬浮于TE缓冲液(10mM Tris/HCl[pH 8.0]、1mM EDTA)中到一个体积,该体积相当于对于脑匀浆所使用的原始体积的一半。为了丰富针对过度磷酸化τ蛋白种类的S1级分,通过在150,000×g下进一步离心20min,将一部分的S1级分分离,以形成上清液(S1)和沉淀物(S1p)级分。将该S1p沉淀重悬浮于TBS缓冲液中至相当于使用的原始S1体积的五分之一的体积。将分级的组织提取物S1、S1p和P3溶解于含有DTT(100mM)的SDS-样品缓冲液中。将经热处理的样品(95℃持续10min)通过在4%-12%Bis-Tris SDS-PAGE凝胶(英杰公司(Invitrogen))上的凝胶电泳进行分离,并且转移到PVDF膜(伯乐实验室(BioRad Laboratories),赫拉克勒斯(Hercules),加利福尼亚州)上。用含有在TBS中的5%脱脂奶和0.1%Triton-X100的封闭液封闭后,将膜与1μg/ml hC10.2、hC10-2_N32S、hC10-2_N32S_A101T或兔抗pS396τ蛋白(英杰公司(Invitrogen))孵育。将膜洗涤,并且与过氧化物酶缀合的抗人类IgG或抗兔抗体(1:5000;杰克逊免疫研究公司(Jackson ImmunoResearch),美国宾夕法尼亚州西格罗夫(West Grove,PA))进行孵育。使用增强的化学发光系统(ECL PLUS试剂盒;珀金埃尔默(Perkin Elmer))检测结合的抗体。使用连接计算机的LAS-4000生物成像分析仪系统(富士胶片公司(Fujifilm),东京,日本)和Multi Gauge v3.1软件(富士胶片公司(Fujifilm))进行蛋白质印迹和印迹免疫反应性的定量和视觉分析。为了检测τ蛋白,我们加载来自小鼠的大约2μg S1,来自人脑的20μg S1,并且是不同级分(S1、S1p和P3)的相同的体积,用于SDS-PAGE。
通过蛋白质印迹检测病理性τ蛋白
将从3只32周龄的rTg4510小鼠和非转基因的(非-tg)对照同窝仔中收集的前脑匀浆物,并且从4个AD和4个健康的对照(HC)供体中收集的皮质标本分离为可溶性(S1)、TBS-可溶性沉淀(S1p)和肌氨酰不可溶性级分(P3),以1μg/ml在蛋白质印迹上使用hC10.2、hC10-2_N32S、hC10-2_N32S_A101T,并且检测来自rTg4510小鼠和AD的病理性τ蛋白。我们观察来自32周龄的rTg4510小鼠的在S1中的55kDa和64kDaτ蛋白,以及在P3和S1p级分中的64kDa和70kDaτ蛋白的检测。另外地,在该P3级分中我们观察到三种平截的τ蛋白条带<50kDa。在来自不表达人类转基因τ蛋白的非-tg对照同窝仔的S1p和P3中没有检测到信号。在来自非-tg小鼠的S1级分中检测到大约50kDa的弱信号,最可能代表在S396残基处的内源鼠类τ蛋白磷酸化(图8)。我们总结为hC10.2、hC10-2_N32S、hC10-2_N32S_A101T检测pS396τ蛋白,以及在rTg4510小鼠中的正常磷酸化55kDa和过度磷酸化64kDaτ蛋白种类。用hC10-2_N32S_A101T观察到最强的信号。
在来自AD供体的S1、S1p和P3级分中,hC10.2、hC10-2_N32S、hC10-2_N32S_A101T检测典型的ADτ蛋白涂片以及病理性的4个τ蛋白带型(54kDa、64kDa、69kDa和74kDaτ蛋白)。如预期的,从P3级分中分离的肌氨酰不可溶性过度磷酸化τ蛋白种类是最显著的,随后是富集于S1p级分中的可溶性过度磷酸化τ蛋白。来自健康的对照(HC)的P3级分中没有检测到信号。在来自HC的S1和S1p级分中,检测到大约55kDa的弱信号,可能代表在S396残基处正常的磷酸化τ蛋白(图8)。我们可以总结为hC10.2、hC10-2_N32S、hC10-2_N32S_A101T检测针对AD的特征的典型的τ蛋白涂片,以及代表过度磷酸化τ蛋白的病理性4个τ蛋白带型。用hC10-2_N32S_A101T观察到最强的信号。
病理性τ蛋白的免疫沉淀反应
在非变性条件下,为了确定hC10.2、hC10-2_N32S、hC10-2_N32S_A101T结合τ蛋白的能力,我们建立τ蛋白免疫沉淀反应(IP)方案,其中τ蛋白抗体共价交联至蛋白A/G树脂上,并由此给出不受抗体污染的IP。对于通过SDS page的τ蛋白分析,针对IP使用的抗体的重链的存在可以覆盖信号,因为检测到的两种信号是大约50kDa。我们研究hC10.2、hC10-2_N32S、hC10-2_N32S_A101T降低来自人类脑的病理性τ蛋白的疗效。作为抗原,我们分别使用含有0.1和0.15μg人类τ蛋白(通过人类τ蛋白ELISA确定)的来自4个汇集的AD和HC供体的来自脑匀浆物的500μg预澄清的裂解物。hC10.2、hC10-2_N32S、hC10-2_N32S_A101T(10μg)降低54kDa、64kDa、69kDa和74kDaτ蛋白种类(4种病理性τ蛋白条带)和通过多克隆兔抗pS396τ蛋白抗体可视化的来自预澄清的AD匀浆物(抗原/ab 1:100比率)的AD涂片(图9)。将用hC10.2、hC10-2_N32S、hC10-2_N32S_A101T降低的来自AD脑的τ蛋白条带的强度与对照人类IgG抗体和与HC脑相比,我们可以总结的是hC10.2、hC10-2_N32S、hC10-2_N32S_A101T免疫沉淀仅从AD脑中在pS396位点处的过度磷酸化τ蛋白,并且是以1:100的抗原/抗体比率是有效的。
细胞和聚集测定
在6孔板中在铺板后24h,将HEK293细胞用人类τ-P301L-FLAG瞬时转染,24h后接着与脑匀浆一起孵育24h,随后分离并重铺板细胞,并且在再一个24h之后收获。在补充有1%曲通X、Phos-stop和完全的磷酸酶抑制剂和蛋白酶抑制剂(罗氏公司(Roche))缓冲液的PBS中,将细胞裂解并进行声处理,并且在100,000x g下超速离心30min。将沉淀重悬浮于SDS中,进行声处理,在100,000x g下超速离心30min。通过蛋白质印迹分析上清液。表达人类τ-P301L的细胞在用来自rTg4510τ蛋白转基因小鼠的总脑匀浆接种后,显示不溶性(SDS级分,E1/FLAG检测)过度磷酸化的(D1.2/{P}S396检测)τ蛋白。
用来自tTA小鼠对照脑匀浆处理的细胞示出不存在聚集的过度磷酸化人类τ蛋白。此外,使用来自Cisbio的τ蛋白聚集测定来分析HEK293细胞的总细胞裂解物。这种测定是基于在FRET中的时间分辨荧光,对于供体(Tb3+缀合的)和受体(d2缀合的)Ab而言使用的是相同抗体。将10μl样品与10μl抗体混合物混合,并且孵育20h。在Pherastar酶标仪上读取板以评估时间分辨荧光(在切换激发光之后,测量的/整合的FRET信号)。该测定以高特异性和灵敏性测量在人类尸体解剖材料、rTg4510小鼠以及接种的HEK细胞两者中聚集的τ蛋白。结果在图10中示出。
实例7.τ蛋白的免疫耗减
在10倍体积的无菌冷PBS中,从冷冻的尸体解剖后前额叶皮质中制备阿尔茨海默氏脑提取物。使用刀匀浆器将组织匀浆化,然后超声处理,在输出2中5x0,9秒脉冲(Branson超声波仪)。然后将该匀浆以3000g在4℃下离心5分钟。将上清液等分,快速冷冻-80℃下储存直到使用。
将25μg抗体(人源化的C10-2变体和2.10.3,小鼠AT8,赛默飞世尔科技公司(Thermo Scientific)mn 1020)固定到125μl的磁珠(Magnetic dynabead)悬浮物(免疫沉淀反应试剂盒磁珠蛋白(Immunoprecipitation Kit Dynabeads Protein)G Novex,目录号10007D)上。在彻底洗涤之后,将涂覆的珠粒与可变量的非涂覆洗涤珠粒进行混合。从100%Ab涂覆的珠粒(对应于5μg抗体)开始,直到100%未涂覆的珠粒。珠粒的总量在所有样品中是相同的。将珠粒与20μl AD提取物混合,并且在室温下孵育10分钟。将磁珠与提取物分离,并且将提取物等分,迅速冷冻,并且保持在-80℃直到使用。
使用蛋白质印迹对耗减的分析
将样品在1x LDS加载缓冲液和100mM DTT中煮沸。将对应于3μl提取物的体积加载在4%-12%Bis-Tris NuPAGE凝胶(LifeTech Novex)上。在电泳后,将蛋白质印迹在Immobilon-FL PVDF膜(0.45μm,IPFL10100,密理博公司(Millipore))上。将膜用SEA封闭缓冲液(Prod#37527,赛默(Thermo))封闭。使用τ5(艾碧康(Abcam)ab80579,1:2000)、小鼠C10-2(1μg/ml)、P-S199/202(英杰公司,44768G,1:1000)、P-S422(艾碧康(Abcam)ab79415,1:750)、人类IPN(1μg/ml),对样品中的τ蛋白和P-τ蛋白水平进行评估。将磷酸甘油醛脱氢酶(Gapdh)和肌动蛋白用作加载对照(艾博抗公司(Abcam)ab9484,1:2000,西格玛公司(Sigma)A5441,1:20000)。使用第二荧光团缀合的IgG抗体(IRDye800CW山羊抗-人,IRDye 800CW,山羊抗-兔,IRDye 680山羊抗-小鼠,LI-COR生物科学),并且使用Odyssey CLx和Image studio软件(LI-COR生物科学)对信号定量。进行对整个泳道中单独条带以及信号的定量,并且据此绘制S形剂量反应曲线,并且可能时,评价最大效应和EC50值。
结果
2.10.3和C10-2抗体二者去除来自阿尔茨海默脑制剂的τ蛋白的小级分。这表明在总τ蛋白质含量内针对τ蛋白的子集的选择性。被设计为对P-S422τ蛋白具有特异性的2.10.3去除了高达24%的总τ蛋白量,而C10-2去除了高达15%的总τ蛋白(参见图11)。这可以解释为P-S396子集是τ蛋白的较小子集,所有其他因素是相等的。可替代地,该数据被解释为相比对于P-S422的具有选择性的2.10.3抗体,C10-2抗体对于P-S396是更具选择性的。
2.10.3和C10-2两者去除多于90%的在丝氨酸422处磷酸化的τ蛋白,但去除50%的P-S422τ蛋白所需的抗体的量不同,对相同效果而言,对于2.10.3需要0,42μg抗体,并且对于C10-2需要0.27μg(参见图12)。在本发明的一个实施例中,该抗体对于在386-404内的表位是免疫特异性的,其中人类τ蛋白的残基396是磷酸化的,并且使用少于1μg的抗体将其中80%的P-S422τ蛋白去除(在免疫耗减研究中通过蛋白质印迹分析)。
C10-2有效地去除了在丝氨酸396处磷酸化的τ蛋白(最大效应:88%,并且通过使用0,30μg抗体达到该效应的一半)。2.10.3去除了更少部分的在丝氨酸396处磷酸化的τ蛋白(最大效应:60%,并且当使用0,63μg抗体时达到该效应的一半)(参见图13)。这指示所有的在丝氨酸422处磷酸化的τ蛋白在丝氨酸396处也被磷酸化,但在位置422处的磷酸化丝氨酸不存在时,存在在丝氨酸396处磷酸化的一部分过度磷酸化τ蛋白。在本发明的一个实施例中,该抗体对于在386-404内的表位是免疫特异性的,其中人类τ蛋白的残基396是磷酸化的,并且使用少于1μg的抗体将其中80%的P-S396τ蛋白去除(在免疫耗减研究中通过蛋白质印迹分析)。
通过C10-2去除的大部分τ蛋白在丝氨酸199/202处也被磷酸化,因为69%的具有该磷酸化的τ蛋白受到免疫耗减的影响(当使用0,34μg抗体时该效应的50%)。2.10.3免疫耗减并不对P-S199/202τ蛋白给出S形剂量反应,但可看到信号随递增量的抗体而降低,当使用抗体的最大量(5μg)时最大值52%降低(参见图14)。在本发明的一个实施例中,该抗体对于在386-404内的表位是免疫特异性的,其中人类τ蛋白的残基396是磷酸化的,并且使用少于1μg的抗体将其中80%的P-S199/202τ蛋白去除(在免疫耗减研究中通过蛋白质印迹分析)。
这些结果指示,与靶向在422位置处的磷酸化丝氨酸的2.10.3抗体相比,靶向磷酸化丝氨酸396的C10-2抗体结合更大量的过度磷酸化τ蛋白。
在免疫耗减后,在蛋白质印迹上研究个体条带,25kDa条带被鉴定为在丝氨酸396处磷酸化。该片段通过C10-2是免疫耗减的,但是2.10.3和AT8不耗减该片段(参见图15)。因此,C10-2具有从阿尔茨海默氏病脑提取物中去除该平截形式的τ蛋白的独特特征。
实例8.比较C10-2变体
在免疫耗减测定中,所有的C10-2变体具有相同的高功效(参见图16)。这表明引入的突变没有减少功能性结合至阿尔茨海默脑特异性τ蛋白。
8a.在接种的rTg4510小鼠中的抗体处理
使用在CamK2阳性神经元(rTg4510)中在tet-关(tet-off)响应元件下表达人类突变τ蛋白(P301L 0N4R)的转基因小鼠。该模型正常地在3月龄开始发展τ蛋白病理学,但通过在妊娠期间用多西环素饲养母鼠并且持续到小鼠生命的第一个3周,病理学在后期(在6个月龄之后开始)发展。将多西环素预处理的小鼠用mC10-2、hC10-2、2.10.3或对照抗体进行长期处理,15mg/kg/周,从2个月龄开始。2.5个月大后将阿尔茨海默脑提取物输注到海马体中。将20只小鼠通过固定于立体定位架中的异氟烷吸入进行麻醉。将颅骨暴露并且调节直至前囱和人字点在水平方向上。在颅骨中在前囱侧向2mm(右)和后部2.4mm处钻孔。使用10μl的注射器斜尖(SGE)在脑表面侧部1,4mm以上文所述的坐标注射接种材料。将实例7中描述的2μl的提取物缓慢输注在位点处(1μl/分钟),并且将注射器保留5分钟之后将其移除。通过缝线将伤口闭合并且在小鼠醒来时加热。将小鼠笼养3个月,并且然后处死,并且用4%多聚甲醛进行灌注固定。将该小鼠用抗体处理,直到接种后3个月处死。
免疫组织化学
将固定的脑在NSA 30上切成35μm冠状切片,并且将每6个切片针对τ蛋白缠结(Gallyas银染)染色。将阳性染色的神经元(胞体)在所有脑的海马体的同侧和对侧中进行计数。包括海马体的所有亚区。每个脑计数八个切片。结果反映来自这8个切片的阳性神经元的总和。
统计分析:当比较各组时,差异是显著不同的。因此,使用非参数Kruskal-Wallis检验和Dunn的多重比较检验。
结果
这些提取物导致在同侧的海马体中的缠结病变的接种。该mC10-2处理显著地以57%(P<0.05)降低了在接种的海马体中的缠结病变。有明显的趋势表明hC10-2还减少了病理学,但2.10.3未显示出效果(参见图17)。
实例9使用固定的人类病理性材料筛选和选择396/404抗体
针对在能肯(nunc)板中的抗体结合来筛选杂交瘤上清液,使用0.1M碳酸盐缓冲液(pH 9)将所述板用1μg/ml肽磷酸化τ蛋白386-408(pS396/pS404)进行了涂覆。
随后将阳性上清液以1:50-1:800稀释于PBS、0.1%BSA和0.1NP40中,以便在分别用来自AD和健康对照(HC)的脑(P3沉淀)裂解物抗原包被的ELISA或MSD板中结合。将脑裂解物抗原在0.1M碳酸盐缓冲液(pH 9)中稀释1500倍,之后进行ELISA或MSD板的孵育/涂覆。将孔随后在室温下封闭2小时(PBS、3mg/ml BSA、0.1%NP-40),并且遵循供应商方案,用HRP(DAKO)和缀合硫标记(MSD,产品#)的抗小鼠IgG检测抗体结合活性。稀释于具有0.1%BSA的PBS中的抗体的选择(D1-2、C5-2、C8-3和C10-2)表征为剂量反应,并且示出的与AD-P3抗原涂覆的板的亚纳摩尔-纳摩尔结合活性被另外针对特异性肽和对照肽的选择的结合活性来表征。结果在图19中示出。
实例10免疫组织化学检测人类视网膜中的磷酸化τ蛋白
方法
人类视网膜(男性,50岁)被包括在石蜡切片的组织阵列中,这些石蜡切片包括来自人类供体的10个器官(US Biomax,目录号BN501)。将切片脱石蜡,再水化并通过在10mM柠檬酸盐缓冲液pH6中煮沸5min进行抗原修复。用PBS中的1%H2O2淬灭内源过氧化物酶10min。然后将切片在1%BSA,0.3%曲通X-100,在PBS中的5%正常猪血清中孵育20min,随后在4℃的潮湿室中与浓度为1μg/mL的第一抗体一起孵育过夜。为了使免疫反应性可视化,将切片与生物素化的第二山羊抗人IgG(西格玛公司(Sigma)Sigma,#B1140),链霉亲和素-生物素复合物(Vectastain Elite,载体实验室(Vector Laboratories),#PK-6100)和最终0.05%二氨基联苯胺一起孵育。最后,切片用苏木精复染并盖上盖玻片。
结果
C10-2、C10-2_N32S和C10-2_N32S_A101T抗体在1μg/mL下特异性标记了人类视网膜切片。用C10-2_N32S_A101T抗体获得最强的免疫反应性。省略第一抗体完全消除了信号。
- 还没有人留言评论。精彩留言会获得点赞!