斑马鱼糖原贮积症gys1和gys2基因突变体的构建方法与流程
本发明涉及斑马鱼基因遗传学技术领域,具体涉及crispr/cas9系统介导的斑马鱼糖原贮积症gys1和gys2基因突变体的构建方法。
背景技术:
糖原贮积症(glycogenstoragedisease,gsd)是一组由于参与糖原合成与分解过程的酶生成障碍而引起一系列不同症状的人类先天性糖代谢异常疾病,主要涉及肝脏、肌肉和脑中的糖原代谢异常。糖原贮积病有多种突变基因和遗传模式,其中ⅰ、ⅲ、ⅵ、ⅸ型以肝脏病变为主,ⅱ、ⅴ、ⅶ型以肌肉组织受损为主(曾召琼,易帆,谢小兵.糖原累积病研究进展[j].检验医学与临床,2018,15(22):3458-3461.)。
糖原合成酶(glycogensynthase,gs)是肝糖原合成的关键酶,分两个亚型:gys1和gys2。gs的活性受损导致肝脏中糖原储存大量减少:gys1表达于骨骼肌和心肌,其突变表现为易疲劳,运动不耐受,累及心脏可引起肥厚性心肌病,突发心脏骤停;gys2表达于肝脏中,催化α-1,4-葡萄糖残基连接到糖链的非还原端,其突变引起婴儿期或儿童期出现非胰岛素依赖性糖尿病症状,长期禁食后酮症性低血糖和低乳酸血症,进食后缓解,餐后高血糖和高脂血症,伴有肝肿大(曾召琼,易帆,谢小兵.糖原累积病研究进展[j].检验医学与临床,2018,15(22):3458-3461.)。
研究报道,有三兄妹因为gys1基因发生基因突变(r462→ter),形成终止密码子,导致心脏和肌肉组织糖原不足,哥哥在10.5岁时死于心脏骤停,尸检报告显示:该病人的心脏左心室壁增厚,死因为肥厚性心肌病,2年后该病人的弟弟(11岁)出现肌肉疲劳、肥厚性心肌病、运动时心率和血压异常等症状。(kollbergg,tuliniusm,gilljamt,ostman-smithi,forsanderg,jotorpp,oldforsa,holmee.cardiomyopathyandexerciseintoleranceinmuscleglycogenstoragedisease0.nengljmed.2007oct11;357(15):1507-14.pmid:17928598.)。另有研究报道,一个日本女孩患有肌肉gsd0病,该病人从5岁开始就反复发作劳力性晕厥并伴有肌肉无力和疼痛,直到12岁死于心脏骤停,她11岁时肌肉活检显示所有肌肉纤维的糖原耗尽(sukigaras,liangwc,komakih,fukudat,miyamotot,saitot,saitoy,nakagawae,sugaik,hayashiyk,sugieh,sasakim,nishinoi.muscleglycogenstoragedisease0presentingrecurrentsyncopewithweaknessandmyalgia.neuromusculdisord.2012feb;22(2):162-5.pmid:21958591.)。
pederson实验室曾构建一个肌肉糖原合成酶1基因(gys1)敲除小鼠模型,简称mgsko小鼠,该小鼠由于gys1基因遭到破坏,在肌肉、心脏和其他几个组织中缺乏葡糖糖储备;杂合突变体交配产生的纯合子中,大约90%在11.5dpc(dayspostcoitum)到18.5dpc由于心功能受损而死亡(pedersonba,chenh,schroederjm,shouw,depaoli-roachaa,roachpj.abnormalcardiacdevelopmentintheabsenceofheartglycogen.molcellbiol.2004aug;24(16):7179-87.pmid:15282316.)。xirouchaki实验室利用cre-loxp系统构建gys1基因突变小鼠,发现gys1ko小鼠糖代谢和运动能力受损(xirouchakice,mangiaficosp,batek,ruanz,huangam,tedjosiswoyobw,lamontb,pongw,favaloroj,blairar,zajacjd,proiettoj,andrikopouloss.impairedglucosemetabolismandexercisecapacitywithmuscle-specificglycogensynthase1(gys1)deletioninadultmice.molmetab.2016jan21;5(3):221-232.pmid:26977394)。
目前,人类糖原合成酶突变会导致人类糖原贮积症,糖原贮积症对人类身体健康有严重影响,已有mgsko小鼠疾病模型,但小鼠由于自身条件限制,无法肉眼直观观察gys1基因突变对心脏发育的影响,无法进一步研究糖原贮积症的发病进程及详细机制。
技术实现要素:
本发明的目的在于提供斑马鱼糖原贮积症gys1和gys2基因突变体的构建方法,基于斑马鱼和人类基因组的相似性高达87%,选择斑马鱼为对象,利用crispr/cas9系统敲除斑马鱼gys1和gys2基因,获得不同基因突变类型的斑马鱼,斑马鱼产卵量大,繁殖周期短,胚体透明,便于研究斑马鱼糖原合成酶基因对于糖原贮积症的作用,以及糖原贮积症的发病进程及详细机制。
本发明的上述目的通过以下技术方案实现:
斑马鱼糖原贮积症gys1和gys2基因突变体的构建方法,包括以下步骤:
(1)选择斑马鱼gys1基因序列的第四个外显子序列设计gys1基因敲除的靶点,斑马鱼gys2基因序列的第三个外显子序列设计gys2基因敲除的靶点;
(2)根据步骤(1)中gys1和gys2基因敲除的靶点序列设计扩增引物;
(3)以puc19-scaffoldplasmid为模板,用步骤(2)中所述扩增引物进行pcr扩增;
(4)对步骤(3)中pcr产物进行纯化,体外转录,获得斑马鱼gys1和gys2基因敲除靶点grna;
(5)将步骤(4)获得的靶点grna与cas9蛋白导入斑马鱼受精卵中;
(6)培养获得稳定遗传的斑马鱼gys1和gys2基因纯合突变体。
优选的,步骤(1)中,所述gys1基因敲除的靶点序列如seqidno.1所示;所述gys2基因敲除的靶点序列如seqidno.2所示。
优选的,步骤(2)中,所述扩增引物包括上游特异引物和下游通用引物;其中,
所述gys1基因敲除的上游特异引物序列如seqidno.3所示;
所述gys2基因敲除的上游特异引物序列如seqidno.4所示;
所述gys1和gys2基因敲除的下游通用引物序列如seqidno.5所示。
优选的,步骤(3)中,puc19-scaffoldplasmid的模板序列如seqidno.6所示。
优选的,步骤(4)中,所述斑马鱼gys1基因敲除靶点grna的序列如seqidno.7所示;所述斑马鱼gys2基因敲除靶点grna的序列如seqidno.8所示。
优选的,步骤(5)中,将grna与cas9蛋白导入斑马鱼受精卵的具体方法为:将grna与cas9蛋白按比例混合,显微注射到斑马鱼一细胞期胚胎中;其中,grna终浓度为80~100ng/μl,cas9蛋白终浓度为800ng/μl。
优选的,步骤(6)中,斑马鱼gys1和gys2基因纯合突变体的培养方法为:
(ⅰ)导入grna和cas9蛋白的斑马鱼胚胎48hpf后进行gys1和gys2基因敲除效率检测,确定gys1和gys2f0靶点突变效率;
(ⅱ)将gys1和gys2f0基因检测敲除成功的成鱼与野生型斑马鱼外交,得到f1胚胎;经基因型鉴定获得gys1和gys2f1杂合突变体斑马鱼;
(ⅲ)将相同突变类型的gys1和gys2f1杂合突变体斑马鱼成鱼内交,获得gys1和gys2f2突变体斑马鱼;
(ⅳ)鉴定为f2中gys1和gys2基因敲除的纯合子即所述稳定遗传的斑马鱼gys1和gys2基因纯合突变体。
更优选的,步骤(ⅰ)中,所述斑马鱼gys1基因敲除检测用引物序列如seqidno.9和seqidno.10所示;所述斑马鱼gys2基因敲除检测用引物序列如seqidno.11和seqidno.12所示。
与现有技术相比,本发明的有益效果在于:
本发明通过crispr/cas9基因编辑技术构建gys1-/-和gys2-/-纯合突变体,获得的gys1-/-(-7bp)纯合子表型与人类糖原贮积症相似,糖原贮积症的发病原因受多种信号通路调控,糖原合成酶gys1和gys2对糖原合成通路具有重要作用,利用gys1-/-和gys2-/-斑马鱼模型有助于进一步研究人类糖原贮积症的发病进程及详细机制。
附图说明
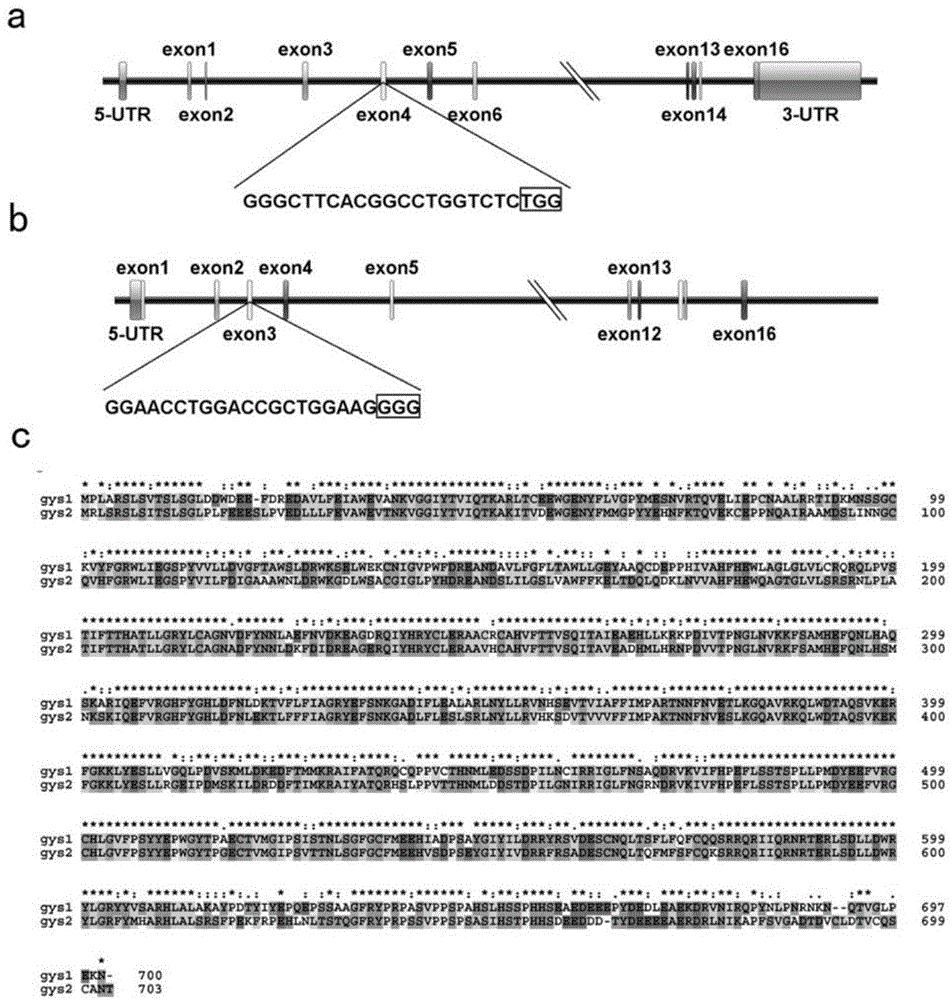
图1为斑马鱼gsy1和gys2基因结构、敲除靶点位置和氨基酸序列相似性比较;其中,a)gys1基因结构、基因敲除靶点位置和靶点序列,方框标注为pam区;b)gys2基因结构、基因敲除靶点位置和靶点序列;c)gsy1和gys2蛋白相似性比对,氨基酸相似性为72%。
图2为斑马鱼gys1和gys2基因敲除t7e1酶切检测和sanger法测序检测;其中,a)gys1注射敲除效率t7e1酶切检测;c)gys1注射敲除测序结果;b)gys2注射敲除效率t7e1酶切检测;d)gys2注射敲除测序结果;黑色方框标识为敲除靶点和pam区。
图3为斑马鱼gys1基因敲除sanger法测序检测突变类型;其中,a和b为f1杂合子检测gys1基因序列相对于未敲除(野生型亲本)序列碱基插入情况;c和d为f1杂合子检测gys1基因序列相对于未敲除(野生型亲本)序列碱基缺失情况。
图4为斑马鱼gys2基因敲除sanger法测序检测突变类型;其中,a和b为f1杂合子检测gys2基因序列相对于未敲除(野生型亲本)序列碱基插入情况;c为f1杂合子检测gys2基因序列相对于未敲除(野生型亲本)序列碱基缺失情况。
图5为斑马鱼gys1和gys2组织表达情况;其中,a)斑马鱼gys1的组织q-pcr结果;b)斑马鱼gys2的组织q-pcr结果。
图6为gys1-/-(-7bp)自交后代的死亡时间和数量统计;其中,a)gys1-/-(-7bp)自交后代48h内存活数量统计;b)gys1-/-(-7bp)自交后代48h内死亡数量统计。
图7为gys1-/-(-7bp)纯合子与野生型斑马鱼心脏和肌肉糖原含量比较。
具体实施方式
下面结合附图和实施例对本发明进一步说明。
实施例1
斑马鱼gys1和gys2基因敲除靶点grna设计和合成,具体过程为:
a)斑马鱼敲除基因gys1和gys2序列分析
根据ensembl斑马鱼基因组网站(http://asia.ensembl.org/danio_rerio/info/index/)对gys1和gys2基因的注释,获得gys1和gys2的基因结构,并分析两个基因编码蛋白序列的相似性。
b)靶点序列的选择
使用
c)靶点grna合成
采用t7启动子合成靶点grna,合成grna上游特异性引物如下:
t7promotertargetsitescaffold
5’-taatacgactcactatannnnnnnnnnnnnnnnnnnngttttagagctagaaatagc-3’(n之前的序列为t7体外转录promoter序列,n为基因敲除靶点序列,n之后的序列为puc19-scaffoldplasmid上的序列);
下游通用引物tracrrev:5’-aaaaaaagcaccgactcggtgccac-3’
合成grna使用的puc19-scaffoldplasmid由北京大学分子医学研究所熊敬维教授实验室惠赠。grna合成分成如下五个步骤:
第一步:puc19-scaffold质粒提取
将包含puc19-scaffold质粒的细菌,进行扩大培养,摇菌大约14h。使用质粒小提试剂盒(dp105,天根生化科技有限公司)进行质粒提取。
第二步:以puc19-scaffold质粒为模板扩增
利用合成grna上游特异性引物和下游通用引物对puc19-scaffold质粒进行扩增,采用
反应体系:
反应程序:
第三步:pcr产物纯化
pcr产物使用dnaclean&concentrator-5试剂盒(zymoresearch)进行纯化。将pcr产物与dnabindingbuffer按照1:5比例混合,将混合物转移到吸附柱中,rt°10,000g离心30s,弃掉液体,加入200μlwashbuffer,rt°10,000g离心30s,弃掉液体,重复上一步的清洗步骤,空离1min,开盖挥发,准备新的rnasefree1.5mlep管,加入>6μl65℃预热的rnasefreeh2o,rt°10,000g离心2min,用紫外分光光度计nanodrop检测pcr产物的质量。
第四步:grna体外转录
利用第三步纯合的pcr产物作为模板,使用
反应体系:
注意:10×transcriptionbuffer要放在室温,其余放在冰上,最后加buffer和酶。
混合均匀后微离,37℃加热反应80min。
向上述体系中加入1μlturbodnase,混合均匀后微离,37℃孵育15min。
第五步:grna纯化
采用licl/ethanol沉淀法纯化,此方法能够高效沉淀<500bp的片段。
沉淀步骤:
向第四步反应体系中加入1.5μl的7.5mlicl和100μl的冰无水乙醇,混合后转移至新rnasefree1.5mlep管中,随后在-80℃冰箱放置最少1h,也可过夜;4℃,14,000r/min离心5min。弃上清后加入70%冰乙醇,悬浮沉淀;重复上一步的清洗步骤,最后要尽量吸净乙醇;将样品放置在超净台中开盖挥发,直至rna沉淀干燥,加入适量的rnasefreeh2o后进行吹打,使沉淀溶解,用紫外分光光度计nanodrop检测rna浓度并记录,2%琼脂糖凝胶电泳检测grna质量。
实施例2
野生型斑马鱼亲本筛选和胚胎显微注射,具体方法为:
选取生长良好的性成熟的ab品系野生型斑马鱼约20尾,剪取尾鳍提取基因组dna(dp324,天根生化科技有限公司),利用靶点上下游引物(表1)扩增获得pcr产物。pcr产物送至上海生工生物有限公司进行测序,如果测序峰图碱基位点没有套峰,即测序个体扩增区域为纯合。选取测序个体pcr产物序列一致的纯合亲本,用于显微注射。
表1.斑马鱼gys1和gys2基因敲除靶点及检测用引物序列信息
显微注射前一天晚上,一对雌雄斑马鱼亲本在配鱼缸中配对,中间用隔板分隔。次日早晨8:00左右拔掉隔板,使斑马鱼亲本追逐,自然产卵、受精。约15min后收集受精卵,在显微注射仪下对受精卵(1细胞胚胎)进行注射。注射时每个靶点的grna和cas9蛋白(金斯瑞生物科技有限公司)按比例混合(80-100ng/μl:800ng/μl),每枚胚胎注射混合液1nl,每个靶点共注射约400枚胚胎。
实施例3
f0斑马鱼胚胎基因敲除效率检测,具体方法为:
a)naoh碱裂解法提取基因组
取注射后2天的胚胎(5枚/管,3管平行),向每管样品中加入50μl50mmnaoh,95℃加热10min,振荡;重复加热,振荡;加入5μl1mtris-hcl,10,000r/min,离心5min,上清即为基因组。
b)pcr反应
反应体系:
反应程序:
c)t7e1酶切检测
反应程序:
95℃5min,85℃3s,25℃5s,4℃∞
加入0.25μlt7e1酶(t7e1酶:h2o=1:1稀释液则加0.5μl),混合均匀后微离,37℃水浴加热45min。
2%琼脂糖凝胶电泳120v,30min。观察电泳图,根据切开条带的大小是否符合预期来判断是否敲除成功,根据如下公式计算敲除效率(图2a-b)。
敲除效率=100*(1-sqrt(1-(b+c)/(a+b+c)))
其中,a为未切开条带灰度值,b,c为切开条带的灰度值。
d)sanger法测序检测敲除情况
将酶切成功对应的pcr产物送生工进行测序,通过确认在靶点附近及其以后是否出现乱峰来确定是否敲除成功。敲除成功的鱼对应的pcr产物测序后的峰图在靶点附近及其以后出现乱峰(图2c-d)。
实施例4
f0斑马鱼生殖细胞对突变的遗传性检测,具体方法为:将敲除成功的f0胚胎饲养至性成熟。将f0成鱼与注射时留作对照的野生型成鱼外交,收集2dpf的胚胎,5枚f1胚胎为一组,共3组,提取基因组。同f0斑马鱼胚胎基因敲除效率检测方法一样,分别用t7e1酶切及测序的方法检测f0成鱼与野生型成鱼外交的后代有突变,即f1是否将f0的突变经生殖细胞进行遗传,将有突变对应的f1胚胎养起来。
实施例5
携带靶位点突变f1成年斑马鱼筛选,具体方法为:将前面筛选到的f1饲养至约2.5月龄大,剪取尾鳍提取基因组。利用靶点上下游引物扩增pcr产物,经t7e1酶切及测序检测靶位点突变情况。将酶切成功的pcr产物用试剂盒纯化后进行ta克隆,每条f1挑选5个单克隆进行测序,根据与野生型亲本序列比对确定突变类型(图3-4),直到筛选到3种以上有效突变的f1成鱼。
实施例6
靶位点突变f2纯合突变体的筛选,具体方法为:将上面筛选到的携带突变的f1饲养至性成熟,将同型突变类型的f1杂合子进行内交获得f2。同携带靶位点突变f1成年斑马鱼筛选的方法相似,将f2饲养至约2.5月龄大,剪取尾鳍提取基因组。利用靶点上下游引物扩增pcr产物,经t7e1酶切,区分f2是杂合子和纯合子。将纯合子pcr产物送测序,区分是野生型和突变型纯合子。
以下结合附图进一步说明:
参见图1,斑马鱼和人类基因组的相似性高达87%,斑马鱼存在gys1和gys2两个糖原合成酶基因,通过对它们的蛋白相似性比对发现gys1和gys2的蛋白相似性为72%(图1c),在gys1的第四个外显子上(图1a)和gys2的第三个外显子上(图1b)设计基因敲除靶点,靶点序列pam(protospaceradjacentmotif)区为cas9蛋白识别和切割位点。
参见图2,将每个靶点的grna和cas9蛋白按比例混合(80-100ng/μl:800ng/μl),在斑马鱼受精卵1细胞期显微注射混合液1nl,分别在受精后48小时,提取注射胚胎的基因组进行pcr(引物信息见表1),利用t7e1酶切检测和sanger测序的方法检测gys1和gys2基因的敲除效率,结果显示gys1和gys2的敲除效率都在40%左右。
参见图3和4,通过将嵌合体f0与野生型斑马鱼外交获得杂合子f1,经过剪尾、提取基因组、pcr、ta克隆等实验过程,筛选得到4种基因突变类型的gys1f1杂合子(图3)和3种基因突变类型的gys2f1杂合子(图4)。
参见图5-7,通过将f1进行自交获得纯合子f2,提取成年斑马鱼的12个组织,通过q-pcr实验分析gys1和gys2的组织表达情况;结果表示,gys1在斑马鱼的肌肉组织中高表达(图5a),gys2在斑马鱼的肝脏组织中高表达(图5b),基因的表达模式与人中的表达模式相似。将gys1-/-(-7bp)进行自交,发现后代不能存活超过48h(图6),pas(periodicacid-schiffstain)糖原染色实验显示gys1-/-(-7bp)心脏和肌肉中没有糖原储备(图7)。
综上所述,通过本发明的构建方法可以除成功敲除斑马鱼gys1和gys2基因,并在gys1-/-(-7bp)中发现与人类糖原贮积症相一致的表型。
序列表
<110>上海海洋大学
<120>斑马鱼糖原贮积症gys1和gys2基因突变体的构建方法
<130>2019-01-29
<141>2019-01-30
<160>12
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>未知()
<400>1
gggcttcacggcctggtctc20
<210>2
<211>20
<212>dna
<213>未知()
<400>2
ggaacctggaccgctggaag20
<210>3
<211>57
<212>dna
<213>未知()
<400>3
taatacgactcactatagggcttcacggcctggtctcgttttagagctagaaatagc57
<210>4
<211>57
<212>dna
<213>未知()
<400>4
taatacgactcactataggaacctggaccgctggaaggttttagagctagaaatagc57
<210>5
<211>25
<212>dna
<213>未知()
<400>5
aaaaaaagcaccgactcggtgccac25
<210>6
<211>83
<212>dna
<213>未知()
<400>6
gttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagt60
ggcaccgagtcggtgcttttttt83
<210>7
<211>103
<212>dna
<213>未知()
<400>7
gggcttcacggcctggtctcgttttagagctagaaatagcaagttaaaataaggctagtc60
cgttatcaacttgaaaaagtggcaccgagtcggtgcttttttt103
<210>8
<211>103
<212>dna
<213>未知()
<400>8
ggaacctggaccgctggaaggttttagagctagaaatagcaagttaaaataaggctagtc60
cgttatcaacttgaaaaagtggcaccgagtcggtgcttttttt103
<210>9
<211>25
<212>dna
<213>未知()
<400>9
tccttatgacaagaactctgtttcc25
<210>10
<211>19
<212>dna
<213>未知()
<400>10
ctgattgcacggtcctccc19
<210>11
<211>24
<212>dna
<213>未知()
<400>11
tgcctgagtgacagtatattggtt24
<210>12
<211>24
<212>dna
<213>未知()
<400>12
ggagatttatcagtgcaggaggaa24
- 还没有人留言评论。精彩留言会获得点赞!