基于CRISPR技术敲除FUT8基因的方法与流程
本发明涉及生物领域,特别是涉及一种基于CRISPR技术敲除FUT8基因以提高抗体ADCC活性的方法。
背景技术:
ADCC(antibody dependent cellular cytotoxicity,抗体依赖的细胞介导的细胞毒性作用)是指由NK(natural killer)细胞引发的一系列免疫反应,NK细胞通过FcγRIII受体与抗体分子恒定区(Fc)结合,然后通过穿孔素和颗粒酶在靶细胞表面引起细胞降解和引发细胞凋亡。然而,抗体分子的恒定区和FcγRIII受体之间的相互作用对抗体分子恒定区的糖基化水平非常地敏感,完全没有糖基化的抗体恒定区或者糖基化程度过高的抗体恒定区都无法正常地与FcγRIII受体结合。其中,更加重要的是岩藻糖基化的水平,已有文献报道没有岩藻糖基化的Fc端与FcγRIII受体的亲和力明显要比岩藻糖基化的Fc端高,相应的体外ADCC作用活性要强100倍。
大多数由哺乳动物细胞产生的单克隆抗体都是岩藻糖基化的,这其中当然也包括了最广泛使用的中国仓鼠卵巢细胞,岩藻糖与抗体Fc端上的氨基葡萄糖通过一个α-1,6糖苷键结合。在哺乳动物细胞中,这个糖苷键由FUT8基因编码的α-1,6-岩藻糖基转移酶催化形成。敲除FUT8基因将完全消除抗体Fc端的岩藻糖,从而提高单抗药物的ADCC作用。
传统的基于同源重组的基因编辑技术是一个高投入、低产出并且费时费力的过程,往往需要从106-109个细胞中才能筛选出一个被正确敲除的细胞。后续出现的一些可编码人工核酸酶基因编辑技术(如锌指酶、TALEN),它们依靠其DNA结合结构域结合到基因组中特定的位点上,然后,再依靠融合表达的酶切结构域,将该位点的DNA链切断。这样的人工核酸酶技术往往有着可识别序列受限制,编码过程复杂耗时以及作用效率低等缺点。
CRISPR是Clustered Regularly Interspaced Short Palindromic Repeats即成簇出现规律间隔的短回文序列的缩写,此序列和CRISPR相关基因(Cas基因)共同作用,因其特有的RNA介导的核酸内切酶活性引起了生物学界的广泛关注,其中以来源于Streptococcus Pyogenes为代表的II类CRISPR/Cas9系统应用最为广泛,以RNA作为基因组定位工具,用特定序列的sgRNA(small-guide RNA)引导Cas9核酸内切酶识别并切割靶向序列。众所周知在体内合成RNA要比在体内合成蛋白质容易的多,而与人工开发的特异性DNA位点结合蛋白相比,RNA无论是在定位的准确性上还是在效率上都要好的多。基于RNA定位的CRISPR技术可以避开DNA甲基化对定位的影响,所以CRISPR/Cas9系统在基因组定位的自由度方面要 比人工开发的特异性DNA位点结合蛋白技术要大得多。编码一段RNA要比编码一段蛋白质容易,所以CRISPR/Cas9系统只需要很短的时间就可以得到实验结果。
技术实现要素:
本发明要解决的技术问题之一是提供一种基于CRISPR技术敲除FUT8基因的方法,它可以提高抗体药物的ADCC的活性。
为解决上述技术问题,本发明的基于CRISPR技术敲除FUT8基因的方法,步骤包括:
1)针对FUT8基因的序列,设计引导核酸内切酶切割的sgRNA序列;
2)将所述sgRNA序列重组至第一载体中,得到sgRNA和核酸内切酶共表达的第二载体;
3)将第二载体转染至哺乳动物细胞中,孵育后,抽提细胞的DNA;
4)以所述DNA为模板,进行PCR扩增,得到包含FUT8基因片段的PCR产物;
5)对所述PCR产物进行变性、退火,形成异源杂交双链;
6)使用核酸内切酶对所述异源杂交双链进行切割,用凝胶电泳对切割产物进行分析,得到各个细胞群发生非同源末端连接的比例;
7)挑选非同源末端连接比例高的细胞群进行有限稀释法克隆,筛选出单克隆细胞进行扩大培养,获得稳定的FUT8基因敲除抗体。
较佳的,步骤1)所述sgRNA序列包括SEQ ID NO:1和SEQ ID NO:2所示的序列;所述核酸内切酶包括CAS9核酸内切酶。
较佳的,步骤2)所述第一载体包括基因敲除载体px330。
较佳的,步骤2)进一步包括步骤:
21)合成编码sgRNA靶向部分的引物,将两条引物退火,获得短的插入片段;
22)用BbsI核酸内切酶消化第一载体,获得酶切载体;
23)将所述插入片段和所述酶切载体用连接酶连接,转化大肠杆菌,获得所述第二载体。
步骤3),转染的方法包括脂质体转染法、电转化法等。所述细胞包括中国仓鼠卵巢细胞。孵育的较佳温度为37℃,时间为48-72小时。
较佳的,步骤5),变性条件为,95℃,10分钟;退火条件为:95-85℃,-1℃/s,85-25℃,-0.1℃/s。
步骤6),所述核酸内切酶包括T7E1酶。
较佳的,步骤7),采用小扁豆凝集素筛选单克隆细胞,具体步骤包括:
71)将有限稀释法获得的克隆转移到96孔板中,36.5℃培养1-3天至汇合度大于70%;
72)将上述克隆按1:5或者1:10传代至含有小扁豆凝集素的培养基中。
小扁豆凝集素的使用浓度为20-100μg/ml。细胞培养条件为:36.5℃,6%CO2,湿度85%。
本发明要解决的技术问题之二是提供用于上述方法的sgRNA的序列,该sgRNA序列包括有SEQ ID NO:1和SEQ ID NO:2所示的序列。
本发明通过编码一条能识别FUT8基因特定序列的sgRNA,并将含有此sgRNA的序列与编码核酸内切酶的序列转染进哺乳动物细胞中,使核酸内切酶通过sgRNA的引导靶向地切割FUT8基因的特定序列,引发细胞内的NHEJ修复机制,在FUT8基因的特定区域引入indel修饰,并进而引起FUT8基因序列出现编码框移位或者在FUT8基因序列中提前引入终止密码子,从而达到让FUT8基因失活的目的。在FUT8基因失活后,细胞产生的单克隆抗体将不再带有α-1,6岩藻糖基化的修饰,这样就提高了单克隆抗体的ADCC活性。
附图说明
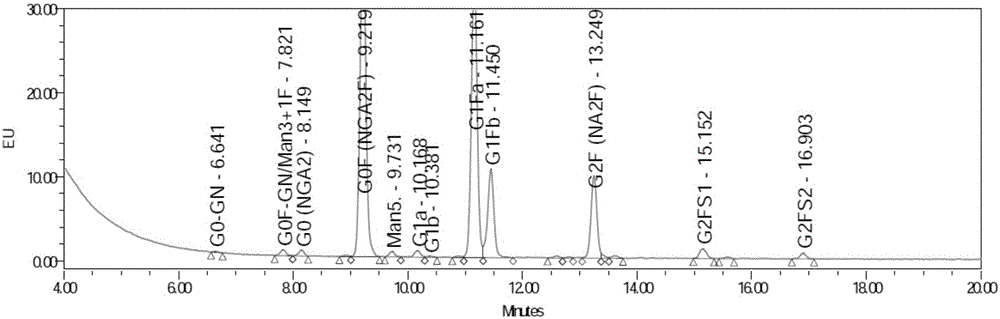
图1是未敲除FUT8基因克隆分泌抗体的糖基化结果。
图2是敲除FUT8基因克隆分泌抗体的糖基化结果。
图3是敲除FUT8基因克隆和未敲除FUT8基因克隆分泌抗体的ADCC活性结果。
图4是琼脂糖凝胶电泳分析不同细胞群NHEJ发生比例结果。其中,M为天根DNA marker III;1为细胞群1PCR产物变性退火后T7E1酶切结果,PCR片段包括靶向位点SEQ ID NO:2;2为细胞群2PCR产物变性退火后T7E1酶切结果,PCR片段包括靶向位点SEQ ID NO:1;3为细胞群3PCR产物变性退火后T7E1酶切结果,PCR片段包括靶向位点SEQ ID NO:1;4为细胞群4PCR产物变性退火后T7E1酶切结果,PCR片段包括靶向位点SEQ ID NO:2;5为野生型CHOK1细胞PCR产物变性退火后T7E1酶切结果,PCR片段包括靶向位点SEQ ID NO:1;6为野生型CHOK1细胞PCR产物变性退火后T7E1酶切结果,PCR片段包括靶向位点SEQ ID NO:2。
具体实施方式
为对本发明的技术内容、特点与功效有更具体的了解,现结合附图,详述如下:
本实施例的基于CRISPR技术敲除FUT8基因的方法,包括以下步骤:
步骤1,针对FUT8基因的序列,设计引导CAS9核酸内切酶切割的sgRNA序列。
其中,sgRNA序列包括:
ggatcaagtatttgacaaactgg (SEQ ID NO:1)
gtcagacgcactgacaaagtggg (SEQ ID NO:2)
步骤2,将步骤1所述sgRNA序列重组至基因敲除载体px330(以下称为第一载体)中,得到sgRNA和核酸内切酶共表达的载体(以下称为第二载体)。
具体包括如下步骤:
1)合成编码sgRNA靶向部分的引物,将两条引物退火,获得短的插入片段。
退火条件为:95~85℃,-1℃/s;85~25℃,-0.1℃/s。
2)用BbsI核酸内切酶消化第一载体,获得酶切载体。
3)将所述插入片段和所述酶切载体用Takara solution I连接酶连接,转化大肠杆菌,获得第二载体。
步骤3,将第二载体用脂质体转染法转染至中国仓鼠卵巢细胞中,在37℃下孵育48~72小时,抽提细胞DNA。
步骤4,以步骤3得到的DNA为模板,进行PCR扩增,得到包含FUT8基因所在片段的PCR扩增产物。
扩增条件为:98℃,2分钟,变性,98℃,15s;退火,60℃,10s;延伸,68℃,90s;扩增30个循环,最后68℃,5min;4℃保存。
步骤5,将步骤4得到的PCR扩增产物进行变性、退火,形成异源杂交双链。其中,变性条件为:95℃,10分钟。退火条件为:95~85℃,-1℃/s;85~25℃,-0.1℃/s。
步骤6,使用T7E1酶对所述异源杂交双链进行切割,用2%琼脂糖凝胶电泳对切割产物进行分析,得到各个细胞群发生非同源末端连接(Non Homologous End Joining,NHEJ)的比例,如图4所示。其中,细胞群1和细胞群4发生NHEJ的比例约为25%,细胞群2和细胞群3发生NHEJ的比例约为15%。
步骤7,根据细胞群发生NHEJ的比例,挑选细胞群1和细胞群4进行有限稀释法克隆,并进行小扁豆凝集素筛选,以获取单克隆细胞,然后将单克隆细胞进行扩大培养(细胞培养条件为:36.5℃,6%CO2,湿度85%),获得稳定的FUT8基因敲除抗体。
小扁豆凝集素可以特异性的识别并结合带有岩藻糖的多糖,粘附在细胞表面的小扁豆凝集素被内吞后会导致细胞死亡,以此为依据可以筛选出敲除了FUT8基因的单克隆细胞。小扁豆凝集素的筛选过程具体包括如下步骤:
1)将有限稀释法获得的克隆转移到96孔板中,36.5℃培养1-3天,至汇合度大于70%;
2)将步骤1)所得克隆按1:5或者1:10传代至含有小扁豆凝集素的培养基中。其中,小扁豆凝集素的筛选使用浓度为20-100μg/ml。细胞培养条件为:36.5℃,6%CO2,湿度85%。
敲除和未敲除FUT8基因的克隆分泌抗体的糖基化结果和ADCC活性结果请参阅图1~3所示。从图3可以明显看出,敲除FUT8基因克隆分泌抗体的ADCC活性要明显高于未敲除FUT8基因克隆分泌抗体的ADCC活性。
- 还没有人留言评论。精彩留言会获得点赞!