一种猪圆环病毒II型病毒样颗粒疫苗及其制备方法与流程
本发明涉及一种重组猪圆环病毒II型病毒样颗粒疫苗及其制备方法,尤其涉及一种利用马克斯克鲁维酵母高产量、低成本制备猪圆环病毒II病毒样颗粒疫苗的方法、以及一种免疫效果好、安全性高的猪圆环病毒II型病毒样颗粒疫苗。
背景技术:
猪圆环病毒(Porcine circovirus,PCV)是迄今发现最小的动物病毒之一,属于圆环病毒科圆环病毒属,是无囊膜的单股环状负链DNA病毒,20面体对称,直径17-20nm,已知PCV具有两个血清型,即猪圆环I型病毒(PCV1)和猪圆环II型病毒(PCV2),其中,PCV 1为非致病性病毒,PCV2为致病性的病毒。
PCV对养猪业的危害巨大,在世界范围内广泛流行。猪感染后表现为消瘦,淋巴结肿大,气喘,拉稀,还会引起母猪的繁殖障碍性疾病。PCV还会破环感染猪体的免疫系统,造成免疫抑制,引发疫苗免疫失败。临床上,PCV往往跟猪瘟,高致病性蓝耳病,猪细小病毒等混合感染,在猪群中造成了很高的感染率和死亡率。目前,还没有针对该病的特效药物,疫苗接种仍然是防控PCV疾病的最有效措施。
更为严峻的是,我国养猪业中的PVC2已呈现感染日龄早(产房哺乳仔猪即可感染)的状况。因此PCV2已被认为是世界养猪业的重要病原,能引起猪的免疫抑制,造成二重或者三重感染,发病率和死亡率高,给养猪业带来重大危害、和严重的经济损失。目前,PCV2疫苗已经成为继猪瘟、口蹄疫、蓝耳病和伪狂犬等疫苗后用量最大、用量最多的猪病疫苗品种,市场需求量大。
商品化的疫苗主要有灭活疫苗和亚单位疫苗(类病毒颗粒疫苗)两类,免疫效果都很好,对PCV疾病的防控具有重要意义。其中,亚单位疫苗因其安全性较高,免疫效果确切,成为临床使用的首选疫苗。
PCV病毒基因组大小约为1700bp,包含有11个开放阅读框(open reading frame,ORF),其中ORF1和ORF2是主要的开放阅读框,分别编码非结构蛋白Rep和结构蛋白Cap。Cap蛋白是病毒主要的衣壳蛋白,含有很多保护性抗原决定簇,是疫苗设计的靶标蛋白。目前市场上销售的PCV-2Cap蛋白类病毒颗粒疫苗有两类:
A)一类是大肠杆菌制备的PCV2类病毒颗粒(原核表达),PCV-2的ORF2基因(Cap蛋白)插入大肠杆菌原核载体中去,利用大肠杆菌表达PCV-2Cap蛋白,制备亚单位疫苗。大肠杆菌表达系统具有生长速度快、易培养、表达蛋白产量高等特点,但其表达的蛋白大多以无活性的包涵体形式存在,经过蛋白变性复性等一系列操作后,可以得到可溶性蛋白。但是原核表达容易出现不具备活性的包涵体,需要进行蛋白复性来提高疫苗效果,成本高,生产周期长(每批次耗时约2-3个月)、效率低,获得的蛋白免疫原性较差;特别是大肠杆菌表达的蛋白虽然经过纯化,依然有可能残留内毒素,免疫动物会产生副反应。
B)另一类由杆状病毒/昆虫细胞表达系统表达制PCV2类病毒颗粒疫苗由杆状病毒/昆虫细胞表达系统表达的类病毒颗粒(真核表达),用PCV-2的ORF2基因(Cap蛋白)插入到昆虫杆状病毒,用昆虫细胞培养,获得重组的PCV-2Cap蛋白,经纯化、与免疫佐剂混合后获得,在临床上以注射方式免疫,真核表达的工艺要求较高,产品中可能会混有杆状病毒颗粒,产生副反应,存在一定的生物安全风险。
技术实现要素:
针对目前猪圆环病毒II型病毒样颗粒疫苗及其制备方法存在的问题,本发明提供了一种新的重组猪圆环病毒II型病毒样颗粒疫苗制备方法,所述的制备方法是由马克斯克鲁维酵母重组表达猪圆环病毒II型病毒样颗粒,利用本发明提供的重组菌株,实现高产量、低成本猪圆环病毒II型疫苗的生产与应用。
本发明第一个方面是提供一种重组载体,所述重组载体通过将编码猪圆环病毒衣壳蛋白(下文中也称为“猪圆环病毒衣壳蛋白Cap”或“Cap蛋白”)的核苷酸插入到马克斯克鲁维酵母表达载体所构建。
本发明第二个方面是提供一种马克斯克鲁维酵母重组工程菌株,由所述重组载体转化马克斯克鲁维酵母营养缺陷型菌株所构建。
本发明第三个方面是提供一种制备猪圆环病毒II型病毒样颗粒疫苗、优选为注射疫苗的方法,包括:
将编码猪圆环病毒衣壳蛋白的核苷酸插入到马克斯克鲁维酵母表达载体,构建所述重组载体;
将重组载体转化马克斯克鲁维酵母营养缺陷型菌株,构建所述马克斯克鲁维酵母重组工程菌株;
重组酵母培养发酵,进行猪圆环病毒衣壳蛋白的表达;
利用猪圆环病毒衣壳蛋白在酵母细胞内自组装成猪圆环病毒II型病毒样颗粒;收集培养发酵的菌,获得猪圆环病毒II型病毒样颗粒;
以所述猪圆环病毒II型病毒样颗粒为活性成分或活性成分之一,制备猪圆环病毒II病毒样颗粒注射疫苗。
其中,所述猪圆环病毒衣壳蛋白优选为猪圆环病毒II型衣壳蛋白。
更优选地,以所述猪圆环病毒II型病毒样颗粒为活性成分或活性成分之一,与佐剂乳化制备猪圆环病毒II型病毒样颗粒注射疫苗。
更优选地,所述分离纯化包括:所收集的培养发酵的菌,破裂后收集释放的病毒样颗粒,凝胶层析纯化猪圆环病毒II型病毒样颗粒。
本发明第四个方面是提供一种猪圆环病毒II型病毒样颗粒疫苗、优选为注射疫苗,由所述马克斯克鲁维酵母重组工程菌株培养发酵、分离纯化获得的猪圆环病毒II型病毒样颗粒为活性成分或活性成分之一。更优选为由本发明第三个方面所述方法制备。
在本发明一种优选实施例中,上文中的任意疫苗可以是液体注射剂、注射粉剂、注射片剂中的一种或几种,并优选为液体注射剂。
其中,所述疫苗可以包括佐剂,所述佐剂可以是、但不限于水包油、油包水、水包油包水佐剂中的任意一种或几种。
如,所述佐剂可以是、但不限于ISA201水包油包水矿物油佐剂、IMS1313水溶性纳米侳剂、GEL01新型纳米侳剂中的任意一种或几种,并优选为IMS1313水溶性纳米侳剂。
在本发明的一种优选实施例中,所述猪圆环病毒II型病毒样颗粒为活性成分或活性成分之一,制成注射粉剂、注射片剂、或加入佐剂制成液体注射剂。
在一种优选实施例中,所述猪圆环病毒衣壳蛋白氨基酸序列包括(优选地,为):
1)SEQ ID No.1氨基酸序列;或
2)SEQ ID No.1氨基酸序列经过取代、缺失或添加一个或几个氨基酸且具有猪圆环病毒核衣壳Cap蛋白活性的由SEQ ID No.1氨基酸序列衍生的蛋白质。
在一种优选实施例中,编码所述猪圆环病毒衣壳蛋白的核苷酸系列优选为SEQ ID No.2所示序列。
在一种优选实施例中,所述方法中,根据马克斯克鲁维酵母的密码子偏好性,对编码所述猪圆环病毒衣壳蛋白的核苷酸进行密码子优化,更优选为在保证编码猪圆环病毒衣壳蛋白序列相同的条件下进行密码子优化。
在一种优选实施例中,所述马克斯克鲁维酵母表达载体包括马克斯克鲁维酵母菊粉酶启动子基因和终止子基因。
在一种优选实施例中,所述马克斯克鲁维酵母表达载体营养缺陷筛选标记基因。
在本发明的更一种优选实施例中,所述重组载体包括马克斯克鲁维酵母自主复制序列、马克斯克鲁维酵母菊粉酶启动子基因序列、编码猪圆环病毒核衣壳Cap蛋白的基因序列、马克斯克鲁维酵母菊粉酶终止子基因序列、营养缺陷筛选标记基因序列。还可以包括大肠杆菌复制序列和抗性筛选基因。
在一种更优选实施例中,重组载体中,由马克斯克鲁维酵母组成型菊粉酶启动子和终止子控制猪圆环病毒衣壳蛋白的转录翻译。
在一种更优选实施例中,所述马克斯克鲁维酵母表达载体的DNA序列为SEQ ID No.5。
本发明所述马克斯克鲁维酵母的营养缺陷型菌株,为马克斯克鲁维酵母敲除部分或全部特定营养基因所得。所述特定营养基因优选为选自URA3基因、HIS3基因、ADE2基因中的任意一种或几种,并优选为URA3基因。
其中,在一种更优选实施例中,所述马克斯克鲁维酵母营养缺陷型菌株在Uracil营养缺陷培养基中不能生长。
在本发明的优选实施例中,上述的马克斯克鲁维酵母优选为CGMCC No.10621。该菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏单位地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏日期为2015年3月13日。
在本发明的一种优选实施例中,所述转化可以是电转化或化学转化中的任意一种或几种。
在本发明的一种优选实施例中,所述重组酵母培养所用培养基中含有葡萄糖、硫酸铵、硫酸镁、磷酸二氢钾。
在本发明的一种优选实施例中,将所述马克斯克鲁维酵母重组工程菌株进行高密发酵,重组表达猪圆环病毒II型类病毒颗粒;收集发酵的酵母细胞,经高压均质破碎、离心澄清、分子筛凝胶过滤纯化猪圆环病毒II型病毒样颗粒;将纯化的病毒样颗粒悬液加入佐剂,乳化制成猪圆环病毒II型疫苗。
本发明所述的猪圆环病毒II型病毒样颗粒注射疫苗优选为用于制备预防和/或治疗猪圆环病毒II型病毒引发的疾病的药物和/或疫苗,优选为注射药物和/或疫苗。
其中,所述猪圆环病毒II型病毒引发的疾病包括、但不限于断奶仔猪多系统衰竭综合症、猪皮炎肾病综合症、仔猪先天性震颤和母猪繁殖障碍中的任意一种或几种。
在本发明的一种优选实施例中,所述猪圆环病毒II型病毒样颗粒注射疫苗也可以包括辅料,辅料优选为可以是、但不限于溶剂、助溶剂、增溶剂、乳化剂、助悬剂、崩解剂、润湿剂、稀释剂、絮凝剂或反絮凝剂、消泡剂或发泡剂、增稠剂、抗氧剂、防腐剂、金属带络合剂、缓冲剂、pH值调节剂、止痛剂、渗透压调节剂中的任意一种或几种。
本发明提供的猪圆环病毒II型病毒样颗粒疫苗,能够减少和预防感染PCV2所引起相关性临床症状,注射免疫一次即可获得高水平血清IgG抗体,具有免疫效果好、安全性高、培养操作简单,产量高、生产成本低以及可大规模放大生产等优点,可应用于减少、预防感染猪圆环病毒PCV2所引起相关性临床症状。
附图说明
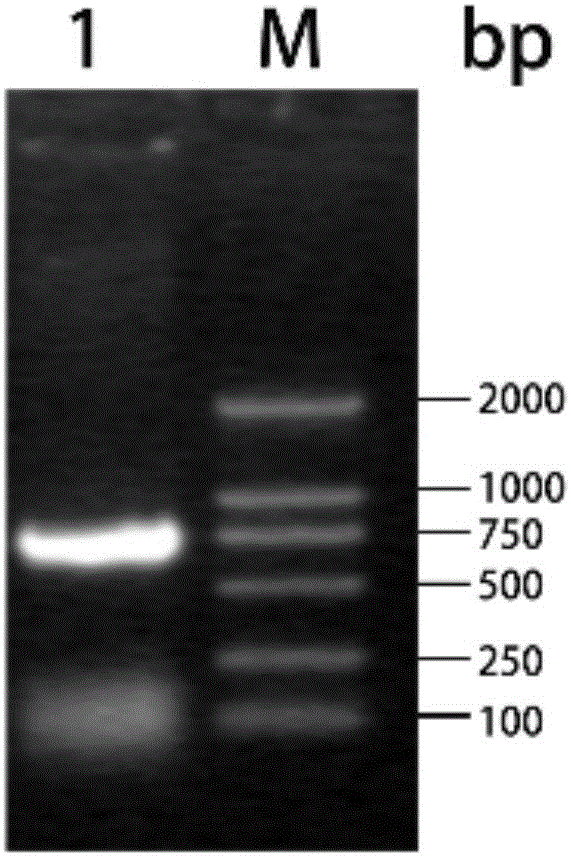
图1为Cap基因的PCR扩增DNA电泳图;
图2为Cap蛋白马克斯克鲁维酵母重组载体pUKD-N115/Cap示意图;
图3为猪圆环病毒II型Cap蛋白在马克斯克鲁维酵母中的表达;其中,泳道1:Fim-1ura3Δ;泳道2:Fim-1ura3Δ-pUKD-N115/Cap重组酵母全细胞裂解液;泳道3:Fim-1ura3Δ-pUKD-N115/Cap重组酵母解液上清;
图4为马克斯克鲁维酵母表达猪圆环病毒II型Cap蛋白的免疫印迹Western Blot检测;其中,泳道1:Fim-1ura3Δ;泳道2和3:Fim-1ura3Δ-pUKD-N115/Cap重组酵母;
图5为重组酵母Fim-1ura3Δ-pUKD-N115/Cap在不同培养基中高密度发酵结果,其中,a:不同培养基中随时间的生物量;b不同培养基所得Cap表达PCR检测;c和d为不同培养基中Cap蛋白的产量;
图6为马克斯克鲁维酵母表达细胞内(A)和纯化后(B)的PCV病毒样颗粒电子显微镜观察照片;
图7为马克斯克鲁维酵母中表达PCV病毒样颗粒AKTA纯化;
图8为马克斯克鲁维酵母中表达PCV病毒样颗粒AKTA纯化样品SDS-PAGE电泳检测,其中,泳道1:F4发酵的Fim-1ura3Δ-pUKD-N115/Cap细胞裂解上清;泳道2:F4发酵的Fim-1ura3Δ-pUKD-N115/Cap细胞裂解沉淀;泳道3:AKTA纯化收集的40-50ml组分;泳道4:AKTA纯化收集的50-60ml组分;泳道5:AKTA纯化收集的60-70ml组分;泳道6:AKTA纯化收集的70-80ml组分;泳道7:AKTA纯化收集的80-90ml组分;泳道8:AKTA纯化收集的90-100ml组分;泳道9:AKTA纯化收集的100-110ml组分;
图9为马克斯克鲁维酵母中表达PCV病毒样颗粒AKTA纯化样品的Cap蛋白免疫印迹Western Blot检测;
图10为佐剂对马克斯克鲁维酵母制备的猪圆环病毒II型疫苗免疫效果影响;
图11为不同剂量的马克斯克鲁维酵母制备的猪圆环病毒II型疫苗免疫小鼠效果。
具体实施方式
实施例1,PCV衣壳蛋白重组表达载体pUKD-N115/Cap的构建
本实施例中,编码猪圆环病毒衣壳蛋白(本发明上下文中也称为“猪圆环病毒Cap蛋白”、或“Cap蛋白”)的氨基酸序列的基因具有SEQ ID No.2的序列。根据马克斯克鲁维酵母的密码子偏好性,对Cap基因序列进行密码子优化,并将优化后的Cap基因序列进行人工合成。
所编码的Cap蛋白氨基酸序列可以是如SEQ ID No.1所示。
利用PCR扩增的方法,以PCVN125-F(5'-GGGGCCCGGG ACATATCCAA GGAGGCGTTTCAGAAG-3')和PCVN125-R(5'-GGGGGCGGCCGCTCACTT AGGGTTAAGTGGAGGGTCCTTAAG-3')为引物扩增Cap基因。经1%琼脂糖凝胶电泳后用DNA凝胶试剂盒回收700kb左右的片段(如图1)。
提供pUKD-N115载体,pUKD-N115载体中,包括马克斯克鲁维酵母自主复制序列、马克斯克鲁维酵母菊粉酶启动子序列、马克斯克鲁维酵母菊粉酶终止子序列、马克斯克鲁维酵母的营养缺陷筛选标记基因URA3(KmURA3ORF),如SEQ ID No.5所示。
pUKD-N115载体的制备方法可采用中国发明专利申请CN105063080A实施例公开的制备PUKDN115载体的方法。采用Sma I和Not I两个限制性酶切pUKD-N115载体,1%琼脂糖凝胶电泳,用DNA凝胶试剂盒回收11.3kb左右的载体片段。
Cap基因片段与载体片段的连接采用Gibson Assembly的方法,用NEB公司的Gibson Assembly无痕连接系统(产品编号E2611S/L)。
转化大肠杆菌Escherichia coli DH5α,在含100μg/ml氨苄青霉素的Luria-Bertani固体平板上筛选转化子,转化子经测序鉴定构建的重组载体pUKD-N115/Cap,如图2所示,编码Cap蛋白的基因序列(PCV2CAP)插入到重组载体内;重组载体内还包括菊粉酶启动子、菊粉酶终止子、以及缺陷筛选标记基因URA3(KmURA3)及其启动子。
实施例2,PCV衣壳蛋白蛋白重组马克斯克鲁维酵母基因工程菌Fim-1ura3Δ-pUKD-N115/Cap的构建
提供马克斯克鲁维酵母尿嘧啶营养缺陷型菌株Fim-1ura3Δ,该菌株的制备方法可采用中国专利公布文件CN105112313A实施例1公开的营养缺陷型菌Fim-1(ura3Δ)的构建方法。
Fim-1ura3Δ接种于含3mL YEPD培养基的玻璃试管中,30℃摇床过夜培养至OD600为12-15。收集菌体,LiAc-TE溶液(100mM LiAc,10mM Tris-HCl,1mM EDTA)洗涤。
在菌体中依次加入carrier DNA,重组载体pUKD-N115/Cap,PEG溶液(40%PEG 4000、100m M LiAc、10mM Tris-HCl pH 7.5、1mM EDTA)和终浓度为10mM DTT,充分混匀后,30℃水浴15min,47℃水浴15min,8000rpm瞬离,弃上清,加100μL无菌水悬浮菌体,涂SD平板(0.67%无氨基酵母氮源YNB、2%葡萄糖、2%琼脂),30℃培养2-4天直至克隆形成。
从选择培养基平板挑取单克隆,于3mL YEPD培养基的试管中30℃摇床过夜培养,采用常规酵母基因组提取方法提取转化子基因组,用上述PCVN125-F和PCVN125-R引物进PCR验证,扩增出700bp左右的条带的为阳性克隆,即为转入PCV Cap蛋白的基因工程菌Fim-1ura3Δ-pUKD-N115/Cap。
实施例3,PCV Cap蛋白在马克斯克鲁维酵母基因工程菌Fim-1ura3Δ-pUKD-N115/Cap中表达
构建的工程菌Fim-1ura3Δ-pUKD-N115/Cap与对照菌Fim-1ura3Δ分别接种于装有50ml的YP培养基(1%酵母抽提物(Yeast Extract),2%葡萄糖)中,30℃、220rpm培养96h后离心收集细胞,采用高压均质的方法破碎细胞,细胞裂解液进行蛋白电泳SDS-PAG(polyacrylamide gel electrophoresis,PAGE)和PCV抗体免疫印迹Western Blot检测,分析猪圆环病毒(PCV)Cap蛋白在克鲁维酵母的表达水平。Western Blot采用抗圆环病毒PCV猪血清多抗和羊抗猪HRP酶标二抗。
从细胞裂解液的蛋白质电泳检测和Western Blot检测结果中(如图3和图4),可以明显发现经密码子优化后猪圆环病毒(PCV)核衣壳蛋白Cap蛋白在克鲁维酵母中获得高效表达,重组表达的核衣壳蛋白Cap与其理论分子量28kD基本一致,。
实施例4,马克斯克鲁维酵母基因工程菌Fim-1ura3Δ-pUKD-N115/Cap高密度发酵
马克斯克鲁维酵母基因工程菌Fim-1ura3Δ-pUKD-N115/Cap接种于YEPD固体培养基上,30℃培养2天进行活化。然后转接到含有葡萄糖(或蔗糖)、硫酸铵、磷酸二氢钾和硫酸镁等成份的合成培养基或完全培养基(1%酵母萃取物,2%葡萄糖)中,30℃振荡(180-220rpm)培养18-24h。
种子液按照10%的比例接种到装有2L培养基的5升发酵罐中发酵过程中通风并搅拌,补料采用全料流加方式,溶解氧控制在20-30%,同时控制温度在30-35℃,pH值控制在5.5-6.0之间,发酵时间控制在80h。
参照图5,重组菌Fim-1ura3Δ-pUKD-N115/Cap在完全培养基(F1罐和F2罐)中的生物量及Cap蛋白的表达水平高于合成培养基(F3-F5罐)(图5a和b)。参照图5c和d,Cap蛋白的产量约2.5g/L左右,细胞干重达106g/L;F3罐则采用蔗糖为碳源,其表达Cap蛋白明显低于用葡萄糖作为碳源的F4罐和F5罐,Cap蛋白的产量约0.5g/L(如图5d)。同时,F4罐和F5罐培养基组成都采用葡萄糖,F5罐比F4罐多添加了核黄素和肌醇等维生素。F4罐Cap蛋白的表达约2.0g/L左右,而F5罐Cap蛋白表达水平反而降低,仅有0.9g/L左右(如图5d)。
实施例5.重组猪圆环病毒II型病毒样颗粒(VLP)的纯化与鉴定
通过电子显微镜观察发现猪圆环病毒(PCV)核衣壳蛋白Cap蛋白在表达马克斯克鲁维酵母中自我组装类病毒颗粒(如图6A)。
发酵罐高密度发酵获得Fim-1ura3Δ-pUKD-N115/Cap重组酵母细胞经去离子洗涤后用PBS缓冲液(137mM NaCl,2.7mM KCl,4.3mM Na2HPO4,1.4mM KH2PO4)重悬,经高压破碎、离心后收集上清,0.2μM膜过滤后,上样到丙烯葡聚糖凝胶HiPrep 26/60Sephacryl S-500(GE healthcare)进行凝胶层析纯化,用PBS缓冲液洗脱(如图7),每10ml收集一管,用蛋白质电泳SDS-PAGE(如图8)和免疫印迹Western Blot检测(如图9),发现猪圆环病毒PCV病毒样颗粒的洗脱体积在60-90ml处。
经凝胶层析纯化的病毒样颗粒纯度达95%左右,电子显微镜观察纯化后的样品中核衣壳Cap蛋白经纯化过程依然保持病毒样颗粒(如图6B)。
实施例6:重组猪圆环病毒II型疫苗的制备及免疫效果分析
纯化获得重组猪圆环病毒的病毒样颗粒(VLP)浓度采用Bradford蛋白浓度测定试剂盒测定,然后用PBS缓冲液调至120μg/ml,与佐剂1︰1混合后制的重组猪圆环病毒II型疫苗。佐剂的筛选包括ISA201水包油包水矿物油佐剂、IMS1313水溶性纳米侳剂、GEL01新型纳米侳剂等。
选用6周龄健康雌性SPF级Balb/c小鼠,随机分组,每组各7只,分空不做免疫白对照组(PBS)和疫苗组(按照佐剂分为ISA201组、IMS1313组、GEL01组),皮下多点注射免疫,剂量为60μg/只。免疫2周后小鼠眼眶后静脉丛取血,采用ELISA方法测定血清中PCV2抗体效价,检测过程参考武汉科前生物制品有限公司生产的猪圆环病毒2型ELISA抗体检测试剂盒使用说明书。
结果表明小鼠注射马克斯克鲁维酵母制备的猪圆环病毒II型疫苗2周后血清中产生PCV cap IgG抗体,并随时间延长而逐渐增加,35天后PCV cap IgG抗体滴度OD450达0.8左右(如图10)。在选用的三类佐剂中IMS1313水溶性纳米侳剂的小鼠应急反应小,是制备马克斯克鲁维酵母重组表达的猪圆环病毒II型疫苗首选佐剂。
利用IMS1313水溶性纳米侳剂,测试了不同疫苗免疫剂量对小鼠PCV cap IgG抗体浓度的影响,如图11所示,8μg/只和3μg/只的剂量蛋白在2周后都已产生PCV cap IgG抗体,42天后,3μg/只剂量的情况下,PCV cap IgG抗体滴度OD450已达到0.75左右,49天时抗体仍有增加,即低剂量蛋白在也能产生很好的免疫效果,表明利用马克斯克鲁维酵母制备的猪圆环病毒II型疫苗具有很好的免疫原性。
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!