一种丙烯酸酯碳酸酯及其均聚物和共聚物材料的制作方法
本发明涉及一种碳酸酯及其均聚物和共聚物材料,特别是一种丙烯酸酯碳酸酯及其均聚物和共聚物材料。
背景技术:
聚碳酸酯是一种工程性塑料,其综合性能优良,表现在其刚性和弹性模量高,热稳定性好,良好的透明性,突出的抗蠕变性、电绝缘性、耐候性,在相同使用条件下其抗冲击强度高于其他工程塑料。聚碳酸酯种类繁多,根据其结构特点可分为脂肪族聚碳酸酯、脂环族聚碳酸酯、芳香族聚碳酸酯及脂肪-芳香族聚碳酸酯。
目前聚碳酸酯的制备可以采用缩聚、环氧化合物与二氧化碳的开环聚合以及环状碳酸酯的开环聚合。双酚a与光气的缩聚是工业上聚碳酸酯的经典合成方法,包括溶液缩聚和界面缩聚两种途径,但光气有剧毒、且不易于定量,同时聚碳酸酯的分子量较小,其发展受到限制。采用三光气代替光气可以克服光气的部分缺点,公开号为cn1603353a的发明专利报道了以三光气及双酚a为原料,摩尔比为1:0.3-0.5,在相转移催化剂、叔胺及扩链剂存在下,通过缩聚、洗涤、沉降和分离个单元过程得到了超高分子量聚碳酸酯。
利用二元醇与二元烷基碳酸酯进行酯交换制备聚碳酸酯,通常采用碱性催化剂,在120-150℃下进行聚合,酯交换聚合可以通过选取不同结构的二元醇来调控聚碳酸酯的结构性能,聚合工艺简单、绿色环保,具有较好的工业化前景。dirkkuckling等以1,4-二氧六环为溶剂,4-二甲胺基吡啶或乙酰丙酮锂为催化剂,将不同结构的二醇与碳酸二甲酯按照等摩尔量的投料比,在常压及120℃条件下转酯化聚合,制备了线型和超支化的聚碳酸酯材料,其中线型聚碳酸酯在酸性及弱碱性条件下能稳定存在(rscadv.,2017,7,12550)。
较于传统的光气途径制备聚碳酸酯,利用环氧化合物与二氧化碳的开环聚合途径被认为更加环保绿色,符合可持续发展的要求。常用的环氧单体包括:环氧乙烷、环氧丙烷、环氧丁烷、氧化环己烯、氧化苯乙烯。环氧化合物单体取代基的给电子能力越强,其聚合活性越大,但二氧化碳的反应活性比较低,必须寻求高活性和高选择性的催化剂,这方面已引起广大学者的研究兴趣,目前已开发出基于锌、铝、铬、钴及双金属配合物的各种高效催化体系。(chem.soc.rev.2012,41,1462–1484)。holgerfrey等在钴配合物与双(三苯基膦)氯化亚铵构成的双催化体系中,实现二氧化碳与环氧丙烷(po)、十二烷基缩水甘油醚(ddge)的共聚,制备了侧链为长链缩水甘油醚结构的聚碳酸酯,通过调整po与ddge的比例,可以控制聚碳酸酯从无定型到半结晶型的转变(macromol.rapidcommun.2018,39,1800558)。
利用环碳酸酯单体的开环聚合可以制备高分子量聚碳酸酯,常用的单体包括五元环碳酸酯、六元环碳酸酯、七元环碳酸酯以及七元以上的大环碳酸酯单体。上述单体在不同引发剂及催化剂作用下,可以通过阳离子机理、阴离子机理、配位机理及酶催化机理实现开环聚合,从而获得结构明确的聚碳酸酯或是带有活性侧链、活性端基的寡聚物(prog.polym.sci.2000,25,259–342)。takeshiendo等选用碳酸二苯酯代替传统的三光气或光气,分别与新戊二醇和二(三羟甲基丙烷)反应,高效地合成出单六元环碳酸酯(npgc)及双六元环碳酸酯(dtmpc)单体,用不同结构的乙醇胺引发单六元环碳酸脂单体开环聚合,制备出含有叔胺结构的线型、遥爪、星型聚碳酸酯;npgc与dtmpc在乙醇胺引发下发生开环共聚,制备出氨基修饰的高分子量聚碳酸酯薄膜,具有透明度高,柔韧性好的特点,并通过进一步的烷基化反应转化为季铵盐功能化的薄膜。(jpolym.sci.pol.chem.,2016,54(4):487-497)。
聚碳酸酯材料由于其优越的性能,在电子电器、汽车、照明、仪表、光学、建材、包装和生活日用品等领域都占有一席之地,根据实际需求,设计结构新颖、性能优异、制备方法简单高效的聚碳酸酯材料,有利于聚碳酸酯工业的长久发展。传统制备聚碳酸酯的方法都是在聚合的过程中,在主链上形成碳酸酯官能团,本发明专利创新性提出先对烯烃单体进行碳酸酯功能化修饰,之后再对烯烃进行聚合,制备出碳酸酯官能在侧基上的聚碳酸酯。
聚甲基丙烯酸酯是重要的通用塑料之一,其中聚甲基丙烯酸甲酯作为“有机玻璃”用品和牙科材料已经超过半个多世纪,虽然其机械性能比一般工程塑料低,但在透光性、装饰性方面具有独特之处,已作为一种工程塑料品种广泛用于工业和交通运输业等方面。功能性聚甲基丙烯酸酯材料在化学和生物等领域中应用广泛,备受研究者的青睐,目前有两种途径可以制备功能性聚甲基丙烯酸酯:一种途径是先制备一定分子量及分散度的聚甲基丙烯酸酯,之后通过化学修饰接枝上功能性基团;另一种途径是先合成功能性甲基丙烯酸酯单体,之后通过均聚或共聚制备功能性聚甲基丙烯酸酯。第一种途径需要两步或多步骤过程,制备过程繁琐,并且接枝上去的官能团的位置和数量难以控制;第二种途径制备过程相对简单,是制备功能性聚甲基丙烯酸酯的常用方法,其关键是功能性甲基丙烯酸酯单体的结构设计和高效合成,已成为该领域的研究重点。
本发明专利通过强碱存在下丙烯酸羟烷基酯与二氧化碳的可逆加成构建含碳酸酯基团的丙烯酸酯单体衍生物,之后通过均聚或共聚制备聚丙烯酸酯碳酸酯及其共聚物材料,目前未见报道。
技术实现要素:
本发明的目的在于,提供一种丙烯酸酯碳酸酯及其均聚物和共聚物材料。本发明具有工艺操作简单易行,成本低廉,适用于工业化生产的特点。
本发明的技术方案:一种丙烯酸酯碳酸酯,其结构式如下:
其中y=0-5;r1为h、甲基或乙基中的一种;r2为以下官能团中的一种:
脂肪族官能团:
杂环官能团:
芳香族官能团:
前述的丙烯酸酯碳酸酯,通过如下方法制备:
1)在高压反应釜中,丙烯酸羟烷基酯与强碱催化剂在无溶剂或有机溶剂中混合均匀,通入二氧化碳并反应,获得碳酸单酯中间体;
2)往步骤1)的高压反应釜中加入卤代烷,通入二氧化碳反应,反应结束后分离提纯获得丙烯酸酯碳酸酯。
前述的丙烯酸酯碳酸酯,所述方法中丙烯酸羟烷基酯包括丙烯酸羟甲酯、丙烯酸羟乙酯、丙烯酸羟丙酯、丙烯酸羟丁酯、丙烯酸羟己酯、甲基丙烯酸羟甲酯、甲基丙烯酸羟乙酯、甲基丙烯酸羟丙酯、甲基丙烯酸羟丁酯、甲基丙烯酸羟己酯、乙基丙烯酸羟甲酯、乙基丙烯酸羟乙酯、乙基丙烯酸羟丙酯、乙基丙烯酸羟丁酯和乙基丙烯酸羟己酯。
前述的丙烯酸酯碳酸酯,所述方法中强碱包括有机碱和无机碱,有机碱包括1,1,3,3-四甲基胍、1,8-二氮杂二环十一碳-7-烯、1,5,7-三叠氮双环(4.4.0)癸-5-烯、三乙胺、二乙胺、4-二甲胺基吡啶、吡咯烷和哌啶和吡啶;无机碱包括碳酸铯、碳酸钾、叔丁醇钾、氢氧化钾和氢氧化钠;强碱的用量与丙烯酸羟烷基酯的摩尔比为:0.1-4:1。
前述的丙烯酸酯碳酸酯,所述方法中的有机溶剂为二甲基亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、乙腈或甲苯;使用有机溶剂时,丙烯酸羟烷基酯在有机溶剂中的浓度控制为0.5-5mol/l。
前述的丙烯酸酯碳酸酯,所述步骤1)中,通入二氧化碳后反应釜的压力维持在0.1-6mpa,反应温度在25-100℃,反应时间在0.5-24h。
前述的丙烯酸酯碳酸酯,步骤2)所述卤代烷包括以下化合物:
脂肪族卤代烷:
杂环卤代烷:
芳香族卤代烷:
前述的丙烯酸酯碳酸酯,步骤2)所述的卤代烷的加入量与丙烯酸羟烷基酯的摩尔比为1-3:1,加入的方式包括原位加入和泄压后加入,通入高压反应釜中的二氧化碳的压力维持在0.1-6mpa,反应温度在25-100℃,反应时间在0.5-72h,反应结束后通过减压蒸馏或硅胶柱层析分离提纯得丙烯酸酯碳酸酯。
一种前述的丙烯酸酯碳酸酯制备的均聚物材料,是以丙烯酸酯碳酸酯为单体,进行均聚反应后制得,其结构式如下:
其中n为平均聚合度,1≤n≤1000;y表示亚甲基的个数,y=0-5;r1为h、甲基或乙基中的一种;r2为以下官能团中的一种:
脂肪族官能团:
杂环官能团:
芳香族官能团:
一种前述的丙烯酸酯碳酸酯制备的共聚物材料,是以丙烯酸酯碳酸酯和r3基团作为单体,进行共聚反应后制得,其中r3基团包括乙烯基单体和二烯烃单体,其中乙烯基单体包括:乙烯、丙烯、氯乙烯、偏二氯乙烯、丙烯醇、丙烯酰胺、甲基丙烯酸、甲基丙烯酸甲酯、丙烯酸甲酯、丙烯酸乙酯、丙烯酸丁酯、丙烯酸己酯、丙烯酸-2-乙基己酯、丙烯腈、苯乙烯、α-甲基苯乙烯、醋酸乙烯酯、甲基乙烯基醚、乙烯基吡咯烷酮、顺丁烯二酸、马来酸酐、衣康酸、降冰片烯和环己烯;二烯烃单体包括:丁二烯、氯丁二烯、戊二烯、异戊二烯和环戊二烯。
本发明的有益效果
本发明具有工艺操作简单易行,成本低廉,适用于工业化生产的优点。本发明的丙烯酸酯碳酸酯制备过程简单高效,通过选取不同的卤代烷可以实现对丙烯酸酯碳酸酯结构的调控;本发明的丙烯酸酯碳酸酯的均聚物及其共聚物具有荧光基团,可以用于荧光涂料。
附图说明
图1为本发明丙烯酸酯碳酸酯共聚物材料的结构式;
图2为实施例1合成的丙烯酸酯碳酸酯产物核磁氢谱;
图3为实施例1合成的丙烯酸酯碳酸酯产物核磁碳谱;
图4为实施例8制备的聚丙烯酸酯碳酸酯产物核磁氢谱;
图5为实施例8制备的聚丙烯酸酯碳酸酯产物核磁碳谱;
图6为实施例8制备的聚丙烯酸酯碳酸酯产物热重图;
图7为实施例8制备的聚丙烯酸酯碳酸酯产物dsc图。
具体实施方式
下面结合实施例对本发明作进一步的说明,但并不作为对本发明限制的依据。
本发明的实施例
实施例1
往50ml高压反应釜中加入n,n-二甲基甲酰胺(dmf,20ml)、甲基丙烯酸羟乙酯(50mmol)、1,1,3,3-四甲基胍(tmg,50mmol),通入二氧化碳稳定至1mpa,置于30℃油浴锅中反应1小时,从原位加料管中加入苄溴(55mmol),通入二氧化碳稳定至2mpa,置于30℃油浴锅中反应24小时,反应结束后过滤除去盐,加水溶解后用乙酸乙酯萃取三次,合并有机相用无水硫酸钠干燥,之后用石油醚/乙酸乙酯=10:1为洗脱剂通过硅胶柱层析分离提纯获得目标产物,产率为78%。1hnmr(400mhz,cdcl3)δ7.37(dd,j=8.6,3.4hz,5h),6.12(s,1h),5.58(d,j=1.6hz,1h),5.30(s,1h),5.18(s,2h),4.39(ddd,j=6.0,3.7,1.4hz,4h),1.93(s,3h).13cnmr(101mhz,cdcl3)δ166.89,154.87,135.71,135.03,128.50,128.48,
128.26,128.24,126.07,69.68,65.53,62.22,18.11.
在相同条件下比较了不同有机溶剂对反应的影响,如表1所示,结果表明,使用溶剂有利于产物产率的提高,在低极性溶剂中目标产物的产率比较低(表1,编号5、6),在极性非质子溶剂中能获得比较理想的产率,其中以n,n-二甲基甲酰胺为反应溶剂的效果最好(表1,编号1);以dmf为溶剂,在相同条件下比较了不同催化剂的效果,结果表明有机碱的催化效果优于无机碱(表1,编号1、8-12),其中1,1,3,3-四甲基胍的催化效果最好;在相同的反应条件下考察了co2压力对反应的影响(表1,编号1、13-17),结果标明随着二氧化碳压力的提高,目标产物的产率呈增加趋势,当达到2mpa时产率达到最大值,进一步升高压力产率略有下降;在相同反应条件下,目标产物的产率随着反应时间的延长也出现增加的趋势(表1,编号1、18-20),反应24小时之后产率并没有增加;进一步实验表明随着反应温度的升高,产率呈现下降的趋势(表1,编号1、21-24)。
表1:不同反应条件丙烯酸酯碳酸酯合成的影响
实施例2
往50ml高压反应釜中加入n,n-二甲基甲酰胺(dmf,20ml)、甲基丙烯酸羟乙酯(50mmol)、1,8-二氮杂二环十一碳-7-烯(dbu,50mmol),通入二氧化碳稳定至0.5mpa,置于50℃油浴锅中反应0.5小时;停止反应后释放二氧化碳,打开反应釜,加入4-三氟甲基苄溴(60mmol),通入二氧化碳稳定至3mpa,置于50℃油浴锅中反应6小时,反应结束后过滤除去盐,加水溶解后用乙酸乙酯萃取三次,合并有机相用无水硫酸钠干燥,之后用石油醚/乙酸乙酯=6:1为洗脱剂通过硅胶柱层析分离提纯获得目标产物,产率为76%,1hnmr(600mhz,cdcl3)δ7.62(d,j=8.1hz,1h),7.50(d,j=8.0hz,1h),6.10(s,1h),5.57(s,1h),5.22(s,1h),4.44–4.40(m,1h),4.39–4.35(m,1h),1.92(s,2h).13cnmr(101mhz,cdcl3)δ167.14,154.91,139.11,135.82,128.34,126.38,125.70,125.66,68.79,65.97,62.30,18.31.
实施例3
往50ml高压反应釜中加入n,n-二甲基甲酰胺(dmf,20ml)、甲基丙烯酸羟乙酯(50mmol)、157-三叠氮双环(4.4.0)癸-5-烯(tbd,50mmol),通入二氧化碳稳定至2mpa,置于40℃油浴锅中反应3小时;从原位加料管中加入4-三氟甲氧基苄溴(70mmol),通入二氧化碳稳定至4mpa,置于40℃油浴锅中反应72小时,反应结束后过滤除去盐,加水溶解后用乙酸乙酯萃取三次,合并有机相用无水硫酸钠干燥,之后用石油醚/乙酸乙酯=6:1为洗脱剂通过硅胶柱层析分离提纯获得目标产物,产率为53%,1hnmr(600mhz,cdcl3)δ7.42(d,j=8.4hz,2h),7.21(d,j=8.3hz,2h),6.10(s,1h),5.57(s,1h),5.16(s,2h),4.41(dd,j=6.0,3.2hz,2h),4.37(dd,j=6.0,3.3hz,2h),1.92(s,3h).13cnmr(101mhz,cdcl3)δ167.13,154.93,149.39,149.37,135.83,133.86,130.02,126.34,121.20,121.19,121.18,121.17,68.85,65.86,62.32,18.29.
实施例4
往50ml高压反应釜中加入n,n-二甲基甲酰胺(dmf,20ml)、甲基丙烯酸羟乙酯(50mmol)、碳酸铯(cs2co3,150mmol),通入二氧化碳稳定至1mpa,置于30℃油浴锅中反应1小时;从原位加料管中加入溴代正丁烷(55mmol),通入二氧化碳稳定至3mpa,置于30℃油浴锅中反应24小时,反应结束后过滤除去盐,加水溶解后用乙酸乙酯萃取三次,合并有机相用无水硫酸钠干燥,之后用石油醚/乙酸乙酯=6:1为洗脱剂通过硅胶柱层析分离提纯获得目标产物,产率为70%,1hnmr(400mhz,cdcl3)δ6.48(d,j=2hz,1h),6.50(d,j=2hz,1h),4.39(s,2h),4.38(s,2h),4.21(s,2h),2.01(s,3h),1.62(s,2h),1.45(s,2h),0.9(s,3h).13cnmr(101mhz,cdcl3)δ167.2,155.5,136.0,125.7,69.2,67.8,62.5,30.8,19.3,18.5,17.2.
实施例5
往50ml高压反应釜中加入n,n-二甲基甲酰胺(dmf,20ml)、丙烯酸羟丁酯(50mmol)、1,1,3,3-四甲基胍(tmg,50mmol),通入二氧化碳稳定至1mpa,置于30℃油浴锅中反应1小时,从原位加料管中加入溴甲基呋喃(55mmol),通入二氧化碳稳定至3mpa,置于30℃油浴锅中反应24小时,反应结束后过滤除去盐,加水溶解后用乙酸乙酯萃取三次,合并有机相用无水硫酸钠干燥,之后用石油醚/乙酸乙酯=10:1为洗脱剂通过硅胶柱层析分离提纯获得目标产物,产率为65%。1hnmr(400mhz,cdcl3)δ7.55(s,1h),6.42(s,2h),6.12(s,1h),5.58(d,j=1.6hz,1h),5.30(s,1h),5.15(s,2h),4.26(t,j=2hz,2h),3.92(t,2h),1.66-1.62(m,4h).13cnmr(101mhz,cdcl3)δ166.7,158.3,150.3,147.2,133.2,128.3,110.7,107.5,65.0,62.9,69.0,26.3,21.5.
实施例6
往希莱克瓶中加入单体(10mmol),用2ml四氢呋喃溶解,通氮气置换三次后加入偶氮二异丁腈(2.5mol%),置于70℃油浴锅中氮气保护下反应24小时,反应结束后倒入10ml冷甲醇中析出沉淀,用甲醇洗涤三次(10ml×3),真空干燥,产率94%,1hnmr(400mhz,cdcl3)δ7.38–7.27(m,5h),5.11(s,2h),4.15(d,j=44.2hz,4h),1.82(d,j=32.2hz,2h),0.94(d,j=53.6hz,3h).13cnmr(101mhz,)δ176.73,176.01,154.72,135.08,128.47,128.20,69.56,64.91,62.31,44.92,44.57,18.51,16.68.数均分子量为:81000,分散性指数:1.71,玻璃化转变温度:6℃,起始分解温度为:216℃。
实施例7
往希莱克瓶中加入单体(10mmol),用2ml二氯甲烷溶解,通氮气置换三次后加入过氧化二苯甲酰(1mol%),置于70℃油浴锅中氮气保护下反应24小时,反应结束后倒入15ml冷乙醇中析出沉淀,用乙醇洗涤三次(15ml×3),真空干燥,产率90%,1hnmr(600mhz,cdcl3)δ7.57(d,j=7.8hz,2h),7.43(d,j=7.3hz,2h),5.15(s,2h),4.26(d,j=14.8hz,2h),4.12(s,2h),2.03–1.72(m,2h),1.08–0.76(m,3h).13cnmr(101mhz,cdcl3)δ154.73,139.20,128.25,125.58,125.54,68.64,67.93,65.25,62.42,45.04,44.71,25.58.数均分子量为:105300,分散性指数:1.98,玻璃化转变温度:4℃,起始分解温度为:293℃。
实施例8
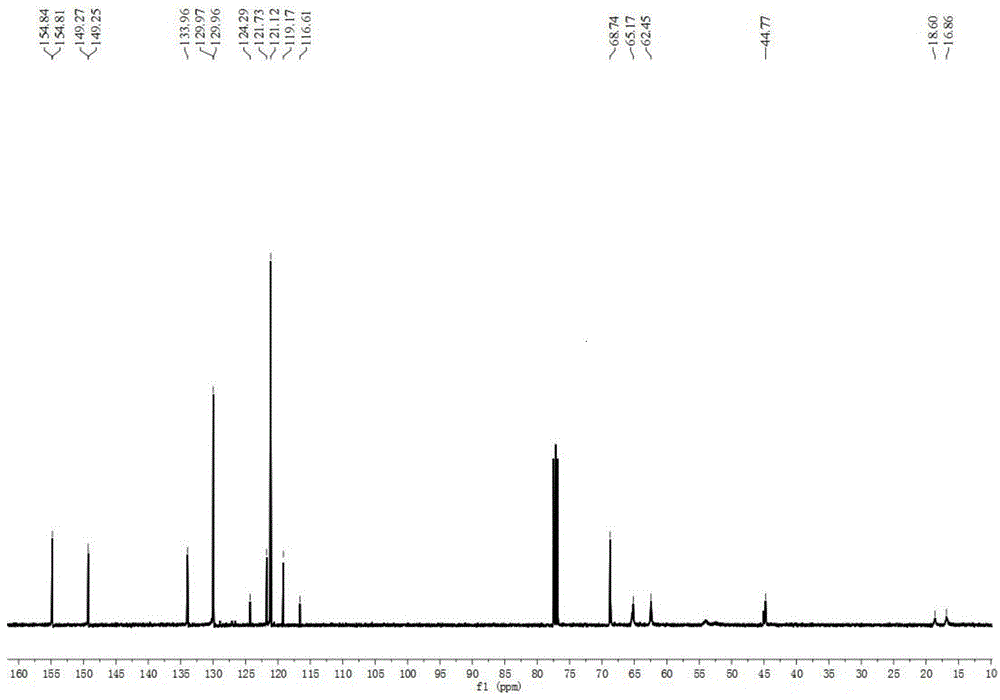
往希莱克瓶中加入单体(10mmol),用2ml四氢呋喃溶解,通氮气置换三次后加入偶氮二异丁腈(2mol%)、三硫代碳酸酯raft试剂,置于70℃油浴锅中氮气保护下反应24小时,反应结束后倒入20ml冷异丙醇中析出沉淀,用异丙醇洗涤三次(20ml×3),真空干燥,产率89%,1hnmr(600mhz,cdcl3)δ7.37(d,j=8.2hz,2h),7.17(d,j=7.9hz,2h),5.10(s,2h),4.24(s,2h),4.12(s,2h),1.85(t,j=36.7hz,2h),1.07–0.78(m,3h).13cnmr(101mhz,cdcl3)δ154.84,154.81,149.27,149.25,133.96,129.97,129.96,124.29,121.73,121.12,119.17,116.61,68.74,65.17,62.45,44.77,18.60,16.86.数均分子量为:141000,分散性指数:1.10,玻璃化转变温度:-6℃,起始分解温度为:302℃。
实施例9
往希莱克瓶中加入单体1(10mmol)和单体2(甲基丙烯酸甲酯,5mmol),用5ml四氢呋喃溶解,通氮气置换三次后加入过氧化二苯甲酰(1.5mol%),置于80℃油浴锅中氮气保护下反应24小时,反应结束后倒入20ml冷甲醇中析出沉淀,用甲醇洗涤三次(20ml×3),真空干燥,产率86%,1hnmr(400mhz,cdcl3)δ7.33(s,2h),7.30(s,1h),7.27(s,1h),5.26(s,2h),4.39-4.36(m,4h),3.9(s,3h),2.35-2.33(m,1h),2.23-2.20(m,2h),2.15(1h),1.20-1.16(m,4h),1.12(s,3h).13cnmr(101mhz,cdcl3)δ173.1,171.5,158.2,136.2,128.5,127.6,126.5,71.2,68.3,62.5,52.3,42.3,36.5,32.5,30.4,21.8,17.5.数均分子量为:112000,分散性指数:1.76,玻璃化转变温度:3℃,起始分解温度为:263℃。
表2丙烯酸酯碳酸酯热性能
- 还没有人留言评论。精彩留言会获得点赞!