小麦基因TaCPSF30编码序列的克隆及应用的制作方法
本发明属于植物分子生物学和基因克隆
技术领域:
,具体涉及一种小麦基因tacpsf30编码序列的克隆及应用。
背景技术:
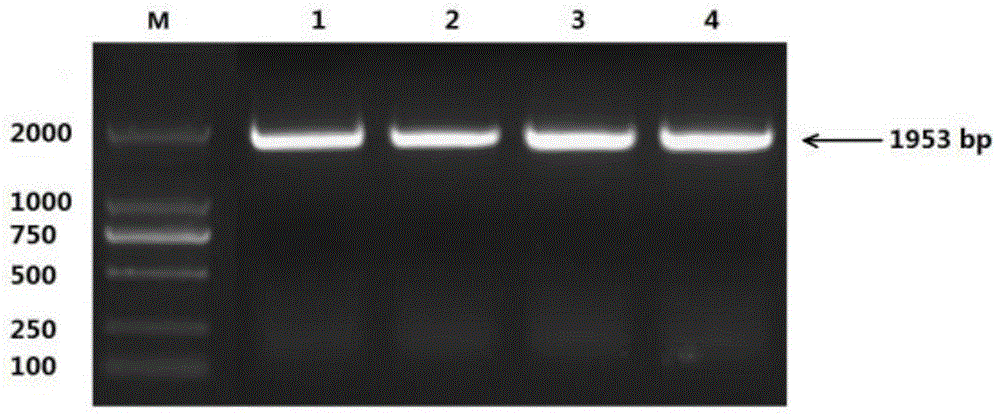
:小麦是我国重要的粮食作物,提高小麦产量和改善其品质成为我国小麦生产急需解决的战略性问题。小麦是喜硝态氮(no3-)作物,由于作物氮肥利用率低,特别是不同品种的小麦对于氮素利用率不同,从而造成产量出现较大差异,进而影响农民收益。研究小麦对no3-吸收、转运、同化和利用等代谢过程从而提高小麦氮素利用率是解决上述问题的关键。大量的研究表明,拟南芥多聚腺苷酸化因子cpsf30在靶基因mrna前体(pre-mrna)加工过程中起重要作用,广泛参与基因表达调控、氧化胁迫、生长发育等过程。最近我们发现,最近的研究结果发现,拟南芥cpsf30-l是一个重要的调控no3-代谢过程的基因。该基因可以改变植物对no3-吸收效率;同时,该基因还影响no3-在根部和地上部的转运。另外,atcpsf30调控no3-同化基因nia、nir的表达从而影响植物no3-的同化和在体内的积累。上述结果说明atcpsf30基因是是植物调控no3-代谢途径的关键因子。小麦品种中国春是复杂的六倍体基因组,在小麦中克隆并鉴定参与提高氮素利用率的基因非常困难。在前期的工作中,本发明人在中国春中发现了拟南芥cpsf30的同源基因tacpsf30,分别位于a、b和d基因组中。蛋白质二级结构分析结果表明,tacpsf30与atcpsf30高度一致。上述结果表明,tacpsf30极有可能调控小麦对no3-吸收、转运、同化等代谢过程,值得进行深入研究。技术实现要素:本发明提供的一种小麦基因tacpsf30编码序列的克隆及其应用,获得了小麦基因tacpsf30编码序列的克隆,提供了小麦基因tacpsf30编码序列的克隆在研究植物提高氮素利用率机制和遗传改良中的应用。为了实现上述目的,本发明采用的技术方案为:本发明小麦基因tacpsf30编码序列的克隆,所述小麦基因tacpsf30编码序列的克隆是按照以下方法获得的:(1)提取小麦总rna,反转录合成cdna;(2)以cdna为模板,设计特异引物,通过pcr扩增基因tacpsf30编码区序列,其中,pcr扩增所用引物序列如下:tacpsf30正向引物(f):5’-cggggtaccatggacgacggcgacggc-3’;tacpsf30反向引物(r):5’-ccgctcgagtcgcttccttgaccgcct-3’;(3)回收并纯化(2)的扩增产物中目的片段并进行测序,测序正确的即为小麦基因tacpsf30编码序列的克隆。本发明所述的小麦基因tacpsf30编码序列的克隆的应用,小麦基因tacpsf30编码序列的克隆在研究植物提高氮素利用率机制和遗传改良中的应用。先构建出gateway系统兼容的重组植物表达载体,该表达载体上有35s启动子驱动的tacpsf30编码序列的克隆和gfp基因,然后将所述重组表达载体转化入拟南芥cpsf30突变体,筛选得到纯合的转基因异源互补株系,研究互补株系中小麦基因tacpsf30在提高氮素利用率机制和在遗传改良中的应用。所述的小麦基因tacpsf30编码序列的克隆的应用,具体步骤如下:s1,pentr3c-tacpsf30重组质粒的构建:酶切连接所述小麦基因tacpsf30编码序列的克隆与克隆载体pentr3c:对纯化的小麦基因tacpsf30编码序列的克隆在分别在5’端和3’端加如kpni和xhoi酶切位点,双酶切后得到带有黏性末端的目的基因片段;然后与克隆载体pentr3c进行酶切连接,得到重组质粒pentr3c-tacpsf30;s2,利用gateway技术构建重组植物表达载体pmdc83-tacpsf30:将测序正确的重组质粒pentr3c-tacpsf30与gateway系统兼容的植物表达载体pmdc83进行lr反应,得到重组植物表达载体pmdc83-tacpsf30。s3,农杆菌侵染拟南芥:种植拟南芥cpsf30突变体;制备农杆菌感受态细胞;然后用重组表达载体pmdc83-tacpsf30转化农杆菌感受态细胞;挑取阳性克隆的转化农杆菌侵染拟南芥cpsf30突变体;得到能有效克隆小麦基因tacpsf30编码序列的转基因植物体。所述农杆菌为农杆菌gv3101。所述植物体为拟南芥cpsf30突变体或者小麦品种中国春。、s3中挑取阳性克隆的转化农杆菌侵染拟南芥cpsf30突变体后,经过3代自交,筛选出含有小麦基因tacpsf30编码序列的异源互补株系,用于研究小麦基因tacpsf30编码序列在研究植物提高氮素利用率机制和遗传改良中的应用。本发明的有益效果为:本发明获得了小麦基因tacpsf30编码序列的克隆,利用克隆得到的小麦基因tacpsf30编码序列和gateway系统兼容的35s驱动的带gfp标签的植物表达载体pmdc83,构建tacpsf30过表达重组载体pmdc83-tacpsf30,然后以农杆菌为媒介通过浸花发转化拟南芥cpsf30突变体,筛选得到纯合的转基因异源互补株系,研究互补株系中小麦基因tacpsf30在提高氮素利用率机制和在遗传改良中的应用。小麦品种中国春是复杂的六倍体基因组,在小麦中克隆并鉴定参与提高氮素利用率的基因非常困难,而拟南芥植株基因组小、易于转化。所以本发明通过生物信息学软件预测tacpsf30基因,再利用植物表达载体使小麦tacpsf30基因在拟南芥cpsf30突变体里表达,通过研究异源互补株系生理生化表型来鉴定小麦tacpsf30基因的功能,同时观察tacpsf30在转基因拟南芥中的组织定位,为小麦基因tacpsf30的克隆在作物提高氮素利用率研究及遗传改良应用打下基础。附图说明图1为目的小麦基因tacpsf30编码序列的克隆,其中m泳道为dl2000marker;1-4泳道均为小麦基因tacpsf30的编码区序列克隆;图2构建tacpsf30过表达的重组植物表达载体过程;图3为重组克隆载体pentr3c-tacpsf30转化大肠杆菌dh5α感受态细胞后的阳性菌落鉴定结果;其中m泳道为dl2000marker,1-4号泳道均为阳性菌落,5号泳道为阴性对照;图4为重组表达载体pmdc83-tacpsf30转化大肠杆菌dh5α感受态细胞后的阳性菌落鉴定结果;其中m泳道为dl2000marker,1-4号泳道均为阳性菌落,5号泳道为阴性对照;图5为重组表达载体pmdc8383-tacpsf30转化农杆菌gv3101感受态细胞后的阳性菌落鉴定结果;其中m泳道为dl2000marker,1-4号泳道均为阳性菌落,5号泳道为阴性对照;图6为转基因异源互补植株中tacpsf30表达量检测结果;图7转基因异源互补植株幼苗期在1/2ms固体培养基上的生长情况,其中a为拟南芥野生型;b为拟南芥cpsf30突变体;c为tacpsf30转拟南芥cpsf30突变体异源互补株系1;d为tacpsf30转拟南芥cpsf30突变体异源互补株系2;图8tacpsf30转拟南芥cpsf30突变体异源互补植株中硝态氮同化基因和转运基因表达量检测结果。具体实施方式下面结合具体实施例对本发明进行详细说明,但不应理解为本发明的限制。下列实施例中未注明具体条件的试验方法,通常按照常规条件操作,由于不涉及发明点,故不对其步骤进行详细描述。本发明提供的一种普通小麦基因tacpsf30编码序列的克隆及其应用,包括以下实施例。下述实施例中所用材料和试剂如下:材料:拟南芥col-0野生型、拟南芥cpsf30突变体cpsf30、gateway系统的克隆载体pentr3c和植物表达载体pmdc83(invitrogen)、大肠杆菌dh5α(invitrogen)、农杆菌gv3101(invitrogen)。试剂:phusion高保真酶试剂盒、taqdnapolymerase试剂盒(cwbio)、dna-marker(cwbio)、kpni限制性内切酶xhoi限制性内切酶、dna纯化回收试剂盒(天根)、质粒小量制备试剂盒(cwbio)、t4dna连接酶(invitrogen)、lr克隆酶(invitrogen)、rna纯化试剂盒(cwbio)、firststrandcdnasynthesiskit(thermofisher)、琼脂糖(promega),其余试剂如trizol、氯仿、异丙醇、无水乙醇、次氯酸钠、mes、蔗糖、琼脂等,均为国产分析纯。实施例1一种小麦基因tacpsf30编码序列的克隆,所述普通小麦基因tacpsf30编码序列的克隆是按照以下方法获得的:1、拟南芥总rna的提取(试剂盒法)利用试剂盒法(柱式总rna提取试剂盒)提取相应拟南芥植株的总rna,具体方法如下:(1)称取约100mg中国春小麦叶片于1.5mleppendorf管中,在液氮中充分研磨;(2)加入1mlbufferrlt(材料体积小于等于bufferrlt体积的10%),充分震荡混匀,室温静置5min;(3)为充分去除细胞壁残渣、蛋白、脂肪、多糖等,4℃,12000rpm离心10min,将上清转移到新的离心管中;(4)分相:①加0.2ml氯仿,剧烈震荡15s,室温静置2min;②离心(4℃,12000rpm,勿超过12000rpm)10min;(5)沉淀,并去除多糖:①取无色水相(大约原初bufferrlt体积的50%,约500μl)至一新的eppendorf管中,切勿吸到中间层;②加0.25ml70%乙醇,颠倒混匀;(6)将上步所得溶液加入到已装入吸附柱的收集管中(若液体体积超过700μl,则分两次转移),4℃,12000rpm离心20s,倒掉收集管中的废液,将吸附柱重新放回收集管中;(7)向吸附柱中加入700μlbufferrw1,4℃,12000rpm离心20s,倒掉收集管中的废液,将吸附柱重新放回收集管中;(8)向吸附柱中加入500μlbufferrw2,4℃,12000rpm离心20s,倒掉收集管中的废液,将吸附柱重新放回收集管中;(9)重复步骤(8)(10)4℃,12000rpm空离2min;(11)将空的吸附柱置于室温数分钟,以彻底晾干;(12)将吸附柱置于一个新的无rnase离心管中,加入30μlrnase-freewater,室温放置1min,4℃,12000rpm离心1min,收集rna溶液,置于-70℃保存。2、反转录取1μg总rna,加oligd(t)0.5μl,补充rnase-freewater至总体积为6μl。65℃水浴中放置5min,稍离心后在管中配置下列反转录反应液。42℃保温1h后,70℃处理15min,冰上冷却即可。3、利用phusion高保真dna聚合酶进行pcr扩增(1)取0.2mlpcr专用管,依次加入以下成分:正向引物(f):5’-cggggtaccatggacgacggcgacggc-3’;反向引物(r):5’-ccgctcgagtcgcttccttgaccgcct-3’;(2)封闭pcr管,放入pcr仪中。反应条件为:98℃预变性2min,98℃变性20s,根据引物的退火温度退火20s,72℃延伸30s/kb,循环30次,72℃后延伸10min。(3)反应完毕后,在1%琼脂糖凝胶中电泳,检查扩增效果。pcr产物琼脂糖凝胶电泳检测结果如图1所示,在1953bp处可以观察到清晰的目的条带。本发明还提供了一种所述的小麦基因tacpsf30编码序列的克隆在研究植物提高氮素利用率机制和遗传改良中的应用。先利用gateway技术构建重组植物表达载体,重组植物表达载体上有35s启动子驱动的连接有小麦基因tacpsf30编码序列的克隆和gfp基因(图2),然后将所述重组表达载体转化入拟南芥cpsf30突变体内,得到异源互补转基因植株,利用该转基因植株研究小麦基因tacpsf30的提高氮素利用率机制和遗传改良中的应用。具体步骤如下:克隆载体pentr3c-tacpsf30的构建1.pcr扩增tacpsf30基因cds并与pentr3c连接正向引物(f):5’-cggggtaccatggacgacggcgacggc-3’;反向引物(r):5’-ccgctcgagtcgcttccttgaccgcct-3’;以提取的cdna为模板,通过特异性引物f和r进行pcr扩增,并在目的基因上游和下游分别引入kpni和xhoi酶切位点。用天根(北京)胶回收试剂盒回收pcr产物,pcr产物与gateway兼容的pentr3c进行酶切连接,操作步骤按下表进行。成分用量目的片段回收产物0.5-10ngpent3c0.5μlsaltsolution0.5μlh2oupto3μl混匀后,室温(25℃)下反应30分钟,然后冰浴1分钟,用于转化大肠杆菌dh5α,表面涂含有卡那霉素的lb培养平板,37℃培养12小时。然后,挑取单个白色克隆涂布新的含有卡那霉素的lb培养平板,37℃培养12小时,进行菌落pcr扩增,如图3所示。同时,将筛菌正确的菌株送上海生工公司进行dna测序。dnaman软件将测序序列与预测的tacpsf30基因编码区序列进行比对,比对正确后说明克隆载体pentr3c-tacpsf30构建成功,提取阳性质粒备用。质粒的提取使用北京康维公司试剂盒,按说明书步骤进行。(1)取1-5ml过夜培养的菌液,加入离心管中,12000rpm离心1min,尽量吸弃上清。(2)向留有菌体沉淀的离心管中加入250μlbufferp1,使用移液器或涡旋振荡器彻底悬浮细菌沉淀。注意:如果菌块未彻底混匀,将会影响裂解效果,使提取量和纯度偏低。(3)向离心管中加入250μlbufferp2,温和地上下颠倒混匀4-6次,使菌体充分裂解,此时菌液应变得清亮粘稠。所用时间不应超过5min,以免质粒受到破坏。(4)向离心管中加入350μlbuffern3,立即温和地上下颠倒混匀4-6次,此时将出现白色絮状沉淀,12000rpm离心10min,此时在离心管底部形成沉淀。(5)柱平衡:向已装入吸附柱(spincolumn)的收集管中加入200μlbufferps,12000rpm离心2min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(6)将步骤4中所得上清加入到已装入吸附柱的收集管中,注意不要吸出沉淀,12000rpm离心1min,倒掉收集管中的废液,将吸附柱放回收集管中。(7)向收集管中加入600μlbufferpw,12000rpm离心1min,倒掉收集管中的废液。(8)重复步骤7。(9)将吸附柱重新放回收集管中,12000rpm离心1min,倒掉收集管中的废液。将吸附柱置于室温数分钟,以彻底晾干。(10)将吸附柱置于一个新的离心管中,向吸附膜的中间部位悬空滴加50-100μlbuffereb,室温放置数分钟,12000rpm离心1min,将质粒溶液收集到离心管中。-20℃保存质粒。2、植物表达载体pmdc83-tacpsf30的构建将测序正确的克隆载体pentr3c-tacpsf30与35s启动子和gateway系统兼容的植物表达载体pmdc83进行lr进行反应,得到35s启动子驱动的tacpsf30基因融合gfp报告基因的植物表达载体。lr反应体系如下:克隆载体1μl(约100ng)载体,pmdc83载体1μl(约100ng),lr克隆酶0.5μl。将上述物质混匀后置于室温(25℃)反应1-2小时,转化大肠杆菌dh5α。转化的菌株表面涂含有卡那霉素的lb培养平板,37℃培养12小时。然后,挑取单个白色克隆涂布新的含有卡那霉素的lb培养平板,37℃培养12小时,进行菌落pcr扩增,如图4所示。说明表达载体pmdc83-tacpsf30构建成功,提取阳性质粒备用,提取方法如上所述。小麦基因tacpsf30互补拟南芥cpsf30突变体的异源互补株系的构建1、根癌农杆菌gv3101感受态细胞的制备与转化农杆菌感受态细胞的制备方法如下所示:(1)挑取单菌落gv3101,接种于5mlyep液体培养基中,28℃,200rpm过夜培养。(2)取2ml培养物至50ml液体yep中,继续培养至od600为0.5左右。(3)将培养物冰浴30min,4℃,5000rpm,离心5min。(4)弃去上清,10ml0.1mol/l冷的nacl悬浮菌体;4℃,5000rpm,离心5min。(5)弃上清,沉淀用1ml20mmol/l冷的cacl2悬浮,分装成200μl/管,液氮中冷冻后-70℃保存。表达载体转化农杆菌采用冻融法,转化过程如下:(1)从-80℃取出gv3101感受态细胞(250μl),冰上解冻,立即加入1-2μl质粒dna。(2)冰上静置5min。(3)液氮中冷冻5min。(4)37℃水浴热激5min。(5)加入无抗生素的yep液体培养基1ml,28℃摇床培养2-4h。(6)4000rpm室温离心5min,收集菌体,用80-100μlyep溶液重新悬浮菌体。(7)将菌液均匀涂布于yep固体选择培养基,28℃静置培养2-3天。(8)长出菌落后,挑取单菌落重新划线于含抗生素的yep固体平板上,36h后进行菌落pcr鉴定,结果如图5所示。2、拟南芥的转化拟南芥的遗传转化采用花序浸染法,方法如下:(1)将拟南芥的主花序的剪掉,以诱导侧花序的生成,且侧花序同时开花,便于转化。转化前将材料浇透营养液,转化后要控制浇水或营养液,以便于种子及时成熟。(2)提前一天准备好转化所需要用的农杆菌,取2-5ml过夜培养的菌液加到250ml的培养基中摇床培养,以便于第二天可用于转化拟南芥。(3)收集过夜培养的农杆菌菌体,重新悬浮于50-100ml浸染液中。(4)将拟南芥伸长的种荚和已经开放的花全部剪掉后,将花絮浸入浸染液中,上下晃动花絮,以利于浸染液的进入。浸染时间一般持续1h左右。将浸染后的拟南芥平放入大盆中,薄膜覆盖以保湿,同时外罩黑色薄膜避光。黑暗处理后将拟南芥取出置于光下,待成熟后收种子。拟南芥浸染液配方如下:用1mkoh调ph值至5.7。3、转基因株系的筛选收集侵染后的拟南芥t0代种子,进行消毒处理,方法如下:(1)取适量种子于1.5mleppendorf管中,标明相关信息;(2)事先配置好70%乙醇,用移液器取1ml于管中,吸打混匀,使种子可以充分地接触乙醇溶液,静置处理5min(注意将管壁和管盖上的种子都冲洗下来以保证灭菌彻底),之后用1ml移液器将离心管内的乙醇吸出(注意不要将种子吸出);(3)吐温水冲洗一遍;(4)用移液器取1ml2.6%次氯酸钠溶液于管中,上下颠倒混匀,静置处理10min;(5)吐温水冲洗五遍;(6)置于4℃保存待用。转基因植株的筛选将消毒后的t0代种子点播在含有50μg/ml潮霉素的ms固体培养基上,在植物专用培养室中生长7d,培养条件为22℃,长日照(16h光照/8h黑暗)。在t1代中挑选能够在潮霉素ms平板上萌发和生长的植株,分别转移到蛭石上培养,培养条件同上。收集t1代种子,按上述方法消毒,点播在含有50μg/ml潮霉素的ms固体培养基上,在植物专用培养室中生长7d,培养条件为22℃,长日照(16h光照/8h黑暗)。在t2代中挑选能够在潮霉素ms平板上萌发和生长的植株,分别转移到蛭石上培养,培养条件同上。收集t2代种子,按上述方法消毒,点播在含有50μg/ml潮霉素的ms固体培养基上,在植物专用培养室中生长7d,培养条件为22℃,长日照(16h光照/8h黑暗)。在t3代中挑选能够在潮霉素ms平板上全部萌发和生长且不出现分离的植株,得到异源互补株系tacpsf30/cpsf30-1和tacpsf30/cpsf30-2。为了验证本发明方法的可行性,我们参照实施例1的方法制备了纯合的小麦基因tacpsf30互补拟南芥cpsf30突变体的异源互补株系,并研究了小麦基因tacpsf30的克隆在作物提高氮素利用率研究及遗传改良应用,如下:1、异源互补株系中tacpsf30的表达量测定(1)1/2ms培养基中异源互补株系的培养为了检测异源互补株系中tacpsf30的表达量,首先将异源互补株系tacpsf30/cpsf30-1和tacpsf30/cpsf30-2的种子消毒然后转移到固体1/2液体培养基上在植物光照培养箱中进行培养,培养温度为22℃,长日照(16h光照/8h黑暗)培养7d。(2)tacpsf30的表达量测定利用实时荧光定量pcr(qrt-pcr)检测异源互补株系tacpsf30/cpsf30-1和tacpsf30/cpsf30-2中tacpsf30的表达量。将在tacpsf30/cpsf30-1和tacpsf30/cpsf30-2中提取的rna进行反转录后得到的cdna样品稀释至0.5-2ng/μl,反应体系如下表所示:qrt-pcr正向引物:5’-gactacggcgagtgccgcgag-3’;qrt-pcr反向引物:5’-aagcctgaaccaggtgg-3’封闭pcr管,放入荧光定量pcr仪中(abi7500fast)。反应条件为:先50℃预变性20s,再95℃预变性10s,再95℃变性15s,60℃退火1min,之后进行plateread,从步骤3开始循环40次,溶解曲线为95℃15s,60℃1min,95℃30s,60℃15s。反应以tublin2作为内参基因以保证结果的准确性,每个处理有三次生物学重复,三个系统重复。异源互补株系tacpsf30/cpsf30-1和tacpsf30/cpsf30-2中tacpsf30的表达量如图6所示,结果表明小麦基因tacpsf30可以在异源互补株系中高效表达。2、异源互补株系在幼苗期1/2ms培养条件下的生长状况氮素是影响植物生长和发育的最重要的营养元素,氮素代谢异常会导致叶片中叶绿素下降和主根长缩短。我们观察了异源互补株系在幼苗期1/2ms培养条件下的生长状况,结果如图7所示。在1/2ms固体培养生长7d后,拟南芥野生型生长情况良好,叶片绿色;主根生长正常,长度约为4cm(图7a)。然而,拟南芥cpsf30突变体在生长情况差,叶片明显失绿;主根长变短,长度约3cm(图7b)。异源互补株系tacpsf30/cpsf30-1和tacpsf30/cpsf30-2的生长情况与野生型类似,叶片绿色;主根生长正常,长度约为4cm(图7c和d)。上述结果表明,在1/2ms培养条件下小麦基因tacpsf30能将拟南芥cpsf30突变体恢复至野生型表型,能提高植物的氮素利用率从而维持较高的叶绿素含量和主根生长。3、tacpsf30能够调控拟南芥no3-响应基因的表达植物利用和代谢氮素no3-,第一步是要感知外界环境中是否存在no3-。越来越多的研究表明,不仅是一种营养物质还是一种信号分子。植物根系感知外界存在no3-时,会引起体内众多基因表达发生变化。在这些基因中,no3-同化基因nia和nir、转运基因nrt2.1对no3-的响应最为敏感。因此,常用这三个基因的表达情况衡量植物对硝态氮信号的反应情况。我们检测了异源互补株系中tacpsf30对拟南芥nia、nir和nrt2.1表达的影响(图8)。结果表明,atcpsf30突变后拟南芥中nia、nir和nrt2.1的表达量下降,说明atcpsf30影响了植物对外界的no3-感知从而影响了氮素利用率。tacpsf30能够恢复cpsf30突变体中nia、nir和nrt2.1的表达至野生型水平,说明tacpsf30能够调控nia、nir和nrt2.1这三个重要的no3-响应基因的表达,该基因在提高氮素利用率方面其至关重要的作用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1