草鱼insulin基因及含有该基因的重组表达载体、重组菌及其应用的制作方法
本发明属于基因工程技术领域,具体涉及一种草鱼insulin基因及含有该基因的重组表达载体、重组菌及其在制备草鱼促生长剂或添加剂中的应用。
背景技术:
肝脏作为动物的重要代谢器官,不仅在调节机体的代谢中起着关键的作用,而且对机体的生长也起着重要的调控作用。在机体的代谢调节过程中胰岛素起着重要的调控作用。胰腺一直被认为是胰岛素的重要产生器官,但最近的研究表明胰腺以外的其它器官也能够分泌胰岛素,胰岛素作为重要的激素在机体的生长、细胞分化以及代谢方面发挥重要的功能。鱼类的肝胰脏或布氏体是胰岛素分泌的重要器官,在调节鱼类的摄食、生长、发育和糖脂代谢等多方面都发挥着重要作用。胰岛素与受体结合后能够通过pi3k/akt、erk和stat/jak-stat信号通路来引发下游多种的生物学功能。
草鱼属鲤形目,鲤科,草鱼属,因其生长迅速,饲料来源广,是中国淡水养殖的四大家鱼之一。另外草鱼以其肉质细嫩、个体大、肌间刺少而备受消费者喜爱。目前草鱼养殖的饲料还需要大量的动植物蛋白作为主要添加剂,然而动植物蛋白成本较高,如果能够提高草鱼对糖脂的利用,对生产成本会有很大的降低,但目前在草鱼人工养殖中还没有一种能有效促进糖脂利用的饵料添加剂。
技术实现要素:
本发明的目的是提供了一种草鱼insulin基因及含有该基因的重组表达载体、重组菌及其在制备草鱼促生长剂或添加剂中的应用。
本发明为实现上述目的采用如下技术方案,草鱼insulin基因,该草鱼insulin基因的核苷酸序列如seqidno:2所示。
本发明扩增了编码草鱼insulin蛋白的基因。克隆的方法是常规的基因克隆方法,根据已公布草鱼insulin基因序列设计引物,利用草鱼肝胰脏cdna为模板,经过pcr后得到目的片段,对pcr产物进行回收后,将得到目的基因连接到pcr2.1载体为pcr2.1-insulin。
本发明提供了上述草鱼insulin基因编码的草鱼insulin蛋白,该草鱼insulin蛋白的氨基酸序列如seqidno:1所示。
本发明提供了含有上述草鱼insulin基因的重组表达载体,该重组表达载体为含有编码草鱼insulin蛋白的大肠杆菌表达载体pet22b-insulin,其通过将带有酶切接头的编码草鱼insulin蛋白的基因经酶切和分离纯化后,接入到大肠杆菌载体表达pet22b的相应酶切位点即ecori和noti之间构建而成。
本发明构建了含有编码草鱼insulin蛋白的大肠杆菌表达载体。该表达载体的构建方法是按常规方法,利用自己所构建的载体pcr2.1-insulin为模板,通过pcr方法合成带有酶切接头的编码草鱼insulin蛋白的基因,经酶切和分离纯化后,接入到已有的载体pet22b的相应酶切位点(即ecori和noti)之间,即构建成所需的含有编码草鱼insulin蛋白的大肠杆菌表达载体pet22b-insulin。
本发明提供了上述重组表达载体转化的大肠杆菌重组菌株,该大肠杆菌重组菌株由含有编码草鱼insulin蛋白的大肠杆菌表达载体pet22b-insulin转入大肠杆菌bl21中而形成的大肠杆菌重组菌株pet22b-insulin-bl21。
本发明提供了大肠杆菌重组菌株在制备重组草鱼insulin蛋白中的应用,其具体过程为:将上述大肠杆菌重组菌株接种到lb液体培养基中,37℃,200转/分培养14-16小时,按照体积比1:100接种在500mllb液体培养基中,37℃,200转/分培养至od600达到0.5-0.8,然后加入iptg至终浓度为1mm,37℃,200转/分培养4小时后5000g离心10min收集菌体,超声破碎后12000g离心10min收集上清,经分离纯化得到重组草鱼insulin蛋白。
本发明提供了上述重组草鱼insulin蛋白的浓缩和脱盐的方法,将纯化得到的重组草鱼insulin蛋白加入到超滤管中,4℃,6000g离心1-2小时,使超滤管中蛋白溶液至1ml,去掉滤出液,向超滤管中加入10ml的pbs,反复重复4次,最终得到脱去咪唑的重组草鱼insulin蛋白。
草鱼具有重大的经济价值,采用常规的基因工程技术,可利用本发明的草鱼insulin基因重组株pet22b-insulin-bl21,生产重组草鱼insulin蛋白,并可进一步用作制备适合草鱼使用的促生长剂或添加剂。
与现有技术相比,本发明具有以下有益效果:本发明首次扩增编码草鱼insulin蛋白的基因,并将该基因构建重组表达载体和大肠杆菌重组菌株,利用大肠杆菌重组菌株在体外获得大量表达的重组草鱼insulin蛋白,该重组草鱼insulin蛋白可用于制备适合草鱼使用的促生长剂或添加剂。
附图说明
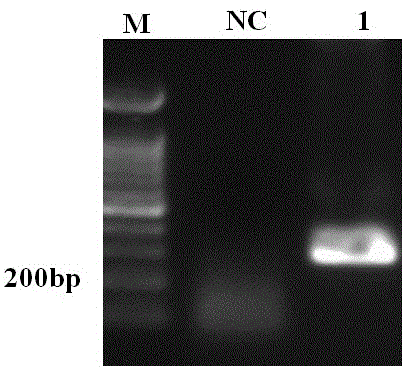
图1是以草鱼肝胰脏的反转录cdna为模板进行pcr扩增insulin中间片段产物的凝胶电泳分析图,其中,m:marker;1:pcr扩增产物;nc:阴性对照。
图2是带酶切位点编码草鱼insulin蛋白的基因片段pcr扩增凝胶电泳分析图,其中,m:marker;1:pcr扩增产物;nc:阴性对照。
图3是重组表达载体pet22b-insulin的酶切鉴定凝胶电泳分析图,其中,m:marker;1:pet22b-insulinecori和noti双酶切;2:pet22b-insulin未酶切。
图4中a和b是大肠杆菌重组菌株pet22b-insulin-bl21表达产物insulin的sds-page电泳分析图及westernblot鉴定图,其中:m:蛋白marker;1:空载体对照;2:未诱导;3、4、5是分别用iptg诱导1、2、3小时;c是大肠杆菌重组菌株pet22b-insulin-bl21表达产物insulin纯化产物的sds-page电泳分析图,其中,m:蛋白marker;1、2、3、4:纯化后insulin蛋白。
图5是重组草鱼insulin蛋白对草鱼原代肝细胞葡萄糖(glucose)和甘油三酯(tg)含量的影响,a是glucose,b是tg,其中“**”表示p<0.01。
具体实施方式
以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
实施例1
编码草鱼insulin蛋白基因片段的克隆
对已公布草鱼insulin基因序列,找到编码insulin蛋白的基因片段,设计克隆编码草鱼insulin蛋白的基因片段的一对引物,上游引物为5'ggggccccgcagcacctg3',下游引物为5'ttaattacagtaattctg3';以草鱼肝胰脏rna反转录后的cdna为模板做pcr。pcr条件为:94℃3min;94℃30s,56℃30s,72℃30s,35个循环;72℃10min;4℃∞。pcr反应后的凝胶电泳图见图1。
实施例2
带酶切位点的编码草鱼insulin蛋白的基因合成
根据自己克隆到的编码草insulin基因的序列及限制性内切酶ecori和noti的识别序列以及保护碱基,设计合成一对特异性引物,上游引物f为5'cggaattcacatcatcatcatcatcatggggccccgcagcacctg3'是在编码insulin蛋白的基因的成熟肽序列前添加了ecori酶切识别位点和6×his标签,下游引物r为5'atagtttagcggccgcttaattacagtaattctg3'是在编码insulin蛋白的基因成熟肽序列后添加了终止密码子及noti酶切识别位点。利用自己构建的pcr2.1-insulin为模板进行pcr反应,pcr反应条件为:94℃3min;94℃30s,56℃30s,72℃40s,35个循环;72℃10min;4℃∞。pcr扩增产物的电泳鉴定图见图2。
实施例3
含编码草鱼insulin蛋白的基因大肠杆菌表达载体pet22b-insulin的构建
pcr产物用限制性内切酶ecori和noti双酶切后,酶切产物用e.z.n.a.®gelextractionkit回收,进行琼脂糖凝胶电泳,分离纯化编码草鱼insulin基因片段;载体质粒pet22b经限制性内切酶ecori和noti双酶切后分离纯化,与分离纯化编码草鱼insulin基因片段混合,用takarat4连接酶16℃连接过夜后用标准氯化钙转化法转入大肠杆菌dh5a中,用lb平板筛选具ampicillin抗性的转化子,以标准方法提取质粒,用限制性内切酶ecori和noti双酶切重组质粒,得到大和小两个片段,大小分别与编码草鱼insulin蛋白的基因和表达载体pet22b大小相同,证明编码草鱼insulin蛋白的基因已克隆入大肠杆菌表达载体pet22b中,重组表达载体命名为pet22b-insulin。酶切分析图分别见图3。
实施例4
能高效表达草鱼insulin的大肠杆菌重组株pet22b-insulin-bl21的构建
制备好的重组表达载体pet22b-insulin用标准氯化钙转化法转入大肠杆菌bl21(de3)感受态细胞中,在含ampicillin的lb平板上37℃进行培养。过夜后长出单克隆,挑取大肠杆菌工程菌pet22b-insulin-bl21单菌落接种在5mllb液体培养基中,37℃,200转/分培养过夜,然后按照体积比1:100的比例接种于10mllb液体培养基中,37℃,200转/分培养至od600到0.5-0.8,然后加入iptg使其终浓度为1mm,37℃,200转/分分别培养1、2、3小时后,取1ml菌液5000g离心10min收集菌体,加入30μlpbs重悬菌体。取3μl菌液加等体积2×电泳上样缓冲液,煮沸10分钟后按标准方法跑sds-page凝胶电泳,同时取阴性对照按同样方法处理后电泳。阴性对照为空载质粒pet22b转化bl21后长出的单克隆培养后的菌液。结果见图4中的a。
将重组草鱼insulin蛋白采用免疫印迹(westernblot)方法进行鉴定。一抗为鼠抗his单克隆抗体(购自上海生工生物工程技术服务有限公司),二抗为羊抗鼠igg-hrp(购自上海生工生物工程技术服务有限公司)。结果见图4中的b。
实施例5
利用大肠杆菌基因工程菌pet22b-insulin-bl21生产重组草鱼insulin
挑取大肠杆菌工程菌pet22b-insulin-bl21单菌落接种在10mllb液体培养基中,37℃,200转/分培养过夜,然后按照体积比1:100的比例接种于500mllb液体培养基中,37℃,200转/分培养至od600到0.5-0.8,然后加入iptg使其终浓度为1mm,37℃,200转/分培养3小时后5000g离心10min收集菌体,超声破碎后12000g离心10min收集上清,经用ge公司的histrapexcel进行纯化处理。取10μl蛋白溶液加入等体积2×电泳上样缓冲液,煮沸10分钟后按标准方法跑sds-page凝胶电泳,结果见图4中的c。
实施例6
重组草鱼insulin的功能研究—对草鱼原代肝细胞葡萄糖和甘油三酯含量的影响
分离草鱼原代肝细胞后,用加入10wt%fbs的含有酚红的dmem/f12培养基把细胞浓度调成8×105细胞/ml,然后在24孔板中每孔加入1ml,放在28℃的生化培养箱中,培养过夜后,换成500μl的无fbs的dmem/f12培养基饥饿1小时,然后向处理组中每孔分别加入500μl的浓度为20nm、200nm、2000nm的分离纯化后的重组草鱼insulin蛋白,对照组加入等体积的无血清培养基,在28℃的生化培养箱中培养12h用ripa裂解液(购自beyotimebiotechnology公司)裂解细胞后完全收取裂解细胞后的裂解液。用bca(购自beyotimebiotechnology公司)法测量裂解液中的总蛋白浓度。用glucose和tg试剂盒(购自南京建成生物工程研究所公司)测定细胞内葡萄糖和tg的含量。以每孔中的总蛋白浓度作为内参,比较对照组和处理组之间葡萄糖浓度的变化情况。结果显示,与对照组相比,用重组草鱼insulin蛋白处理原代肝细胞12小时后能够显著的降低细胞内葡萄糖的水平;但是能够显著增加细胞内tg的含量,结果如图5所示。
以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
序列表
<110>河南师范大学
<120>草鱼insulin基因及含有该基因的重组表达载体、重组菌及其应用
<130>2019
<160>6
<170>patentinversion3.3
<210>1
<211>85
<212>prt
<213>人工序列(artificialsequence)
<400>1
glyalaproglnhisleucysglyserhisleuvalaspalaleutyrleuvalcysgly20
prothrglyphephetyrasnprolysargaspvalaspproleumetglypheleupro40
prolysseralaglngluthrgluvalalaaspproalaprolysasphisalagluleu60
ilearglysargglyilevalgluglncyscyshislysprocysserileprogluleu80
glnasntyrcysasn85
<210>2
<211>258
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggggccccgcagcacctgtgtggatctcatctcgtcgatgccctctacctggtctgtggg60
ccaacaggcttcttttacaaccccaagagagatgttgaccctcttatgggtttccttcct120
cctaaatctgcccaggaaactgaggtggctgactttgcatttaaagatcatgctgagctg180
ataaggaagagaggcatagtggagcagtgctgccacaaaccctgcagcatctttgagctg240
cagaattactgtaattaa258
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
ggggccccgcagcacctg18
<210>4
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttaattacagtaattctg18
<210>5
<211>45
<212>dna
<213>人工序列(artificialsequence)
<400>5
cggaattcacatcatcatcatcatcatggggccccgcagcacctg45
<210>6
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>6
atagtttagcggccgcttaattacagtaattctg34
序列表
<110>河南师范大学
<120>草鱼insulin基因及含有该基因的重组表达载体、重组菌及其应用
<130>2019
<160>6
<170>siposequencelisting1.0
<210>1
<211>85
<212>prt
<213>人工序列(artificialsequence)
<400>1
glyalaproglnhisleucysglyserhisleuvalaspalaleutyr
151015
leuvalcysglyprothrglyphephetyrasnprolysargaspval
202530
aspproleumetglypheleuproprolysseralaglngluthrglu
354045
valalaaspproalaprolysasphisalagluleuilearglysarg
505560
glyilevalgluglncyscyshislysprocysserileprogluleu
65707580
glnasntyrcysasn
85
<210>2
<211>258
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggggccccgcagcacctgtgtggatctcatctcgtcgatgccctctacctggtctgtggg60
ccaacaggcttcttttacaaccccaagagagatgttgaccctcttatgggtttccttcct120
cctaaatctgcccaggaaactgaggtggctgactttgcatttaaagatcatgctgagctg180
ataaggaagagaggcatagtggagcagtgctgccacaaaccctgcagcatctttgagctg240
cagaattactgtaattaa258
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
ggggccccgcagcacctg18
<210>4
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttaattacagtaattctg18
<210>5
<211>45
<212>dna
<213>人工序列(artificialsequence)
<400>5
cggaattcacatcatcatcatcatcatggggccccgcagcacctg45
<210>6
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>6
atagtttagcggccgcttaattacagtaattctg34
- 还没有人留言评论。精彩留言会获得点赞!