包含CD95-Fc同种型的混合物的组合物的制作方法
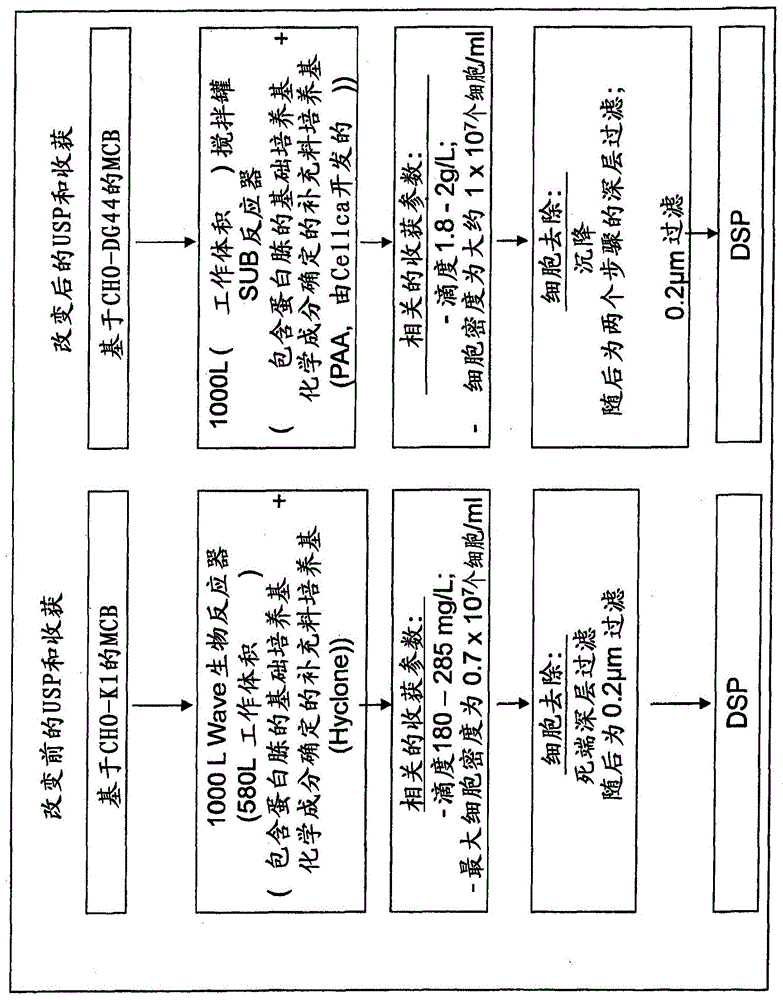
描述本发明涉及包含融合蛋白同种型的混合物的组合物,其中每个融合蛋白包含细胞外cd95结构域或其功能片段和fc结构域或其功能片段;以稳定形式提供这样的组合物的制剂;以及用于产生这样的组合物的方法。在pct/ep04/03239中描述了包含与免疫球蛋白fc结构域相融合的死亡受体cd95(apo-1;fas)的细胞外结构域的融合蛋白。但是,具有足够稳定性地以足够的量提供这样的融合蛋白经证明是困难的。通过本发明,首次可能提供这样的组合物或方法。根据第一个方面,本发明涉及包含融合蛋白同种型的混合物的组合物,每个融合蛋白包含至少一个细胞外cd95结构域(apo-1;fas)或其功能片段和至少一个为在大约4.0至大约8.5的pi范围之内分布的fc结构域或其功能片段的第二结构域。因此,本文中所使用的细胞外cd95结构域也可以称为“第一结构域”,而所述fc结构域可以称为“第二结构域”。第一结构域蛋白为细胞外cd95结构域,优选地哺乳动物的细胞外结构域,特别是人的蛋白,即人的细胞外cd95结构域。所述融合蛋白的第一结构域,即细胞外cd95结构域,优选地包含直至人cd95的氨基酸170、171、172或173的氨基酸序列(seqidno.1)。信号肽(例如,seqidno:1的位置1-25)可以存在或不存在。特别地对于治疗目的,人的蛋白的使用是优选的。所述融合蛋白可以包含一个或多个第一结构域,其可以是相同或不同的。但是,一个第一结构域,即包含一个细胞外cd95结构域的融合蛋白,是优选的。根据一个优选的实施方案,所述fc结构域或其功能片段,即根据本发明的融合蛋白的第二结构域,包含ch2和/或ch3结构域,和可选地至少一部分的铰链区结构域或从其衍生的经修饰的免疫球蛋白结构域。所述免疫球蛋白结构域可以为igg、igm、igd或ige免疫球蛋白结构域,或者从其衍生的经修饰的免疫球蛋白结构域。优选地,第二结构域包含至少一部分的恒定igg免疫球蛋白结构域。所述igg免疫球蛋白结构域可以选自igg1、igg2、igg3或igg4结构域,或者选自来自其的经修饰的结构域。优选地,第二结构域为人的fc结构域,例如iggfc结构域,例如人的igg1fc结构域。所述融合蛋白可以包含一个或多个第二结构域,其可以是相同或不同的。但是,一个第二结构域,即包含一个fc结构域的融合蛋白,是优选的。进一步地,第一和第二结构域两者优选地来自相同的物种。第一结构域,即所述细胞外cd95结构域或其功能片段,可以位于n-末端或c-末端。第二结构域,即所述fc结构域或其功能片段,也可以位于所述融合蛋白的c-末端或n-末端。但是,在所述融合蛋白的n-末端处的细胞外cd95结构域是优选的。根据一个进一步的优选的实施方案,所述融合蛋白为apg101(cd95-fc,seqidno:1中的位置26-400)。如由seqidno:1所定义的,apg101可以为这样的融合蛋白,其包含人的细胞外cd95结构域(氨基酸26-172)和人的igg1fc结构域(氨基酸172-400),进一步可选地包含n-末端信号肽(例如,seqidno:1的氨基酸1-25)。信号肽的存在指明了apg101的未成熟形式。在成熟过程中,信号肽被切除。根据一个特别优选的实施方案,信号序列被切除。具有信号序列的apg101也被术语“未修饰的apg101”所包括。在一个进一步的实施方案中,所述融合蛋白为与apg101具有至少70%同一性,更优选地75%同一性、80%同一性、85%同一性、90%同一性、95%同一性、96%同一性、97%同一性、98%同一性、99%同一性的多肽。根据本申请,术语“同一性”涉及所比较的两个氨基酸序列是不变的(换言之,在相同的位置处共享相同的氨基酸)的程度。术语“apg101”描述了seqidno:1的位置26-400的融合蛋白,具有和/或没有信号肽。术语“apg101”还包括这样的融合蛋白,其包含在n-末端处截短的形式的cd95细胞外结构域。在另一个优选的实施方案中,根据本发明的融合蛋白为apg101的功能片段。如在本文中所使用的,术语“片段”通常意指“功能片段”,即野生型或全长蛋白质的片段或部分,其具有与相应的野生型或全长蛋白质基本上相同的生物学活性和/或特性。本领域技术人员知晓用于设计和产生根据本发明的融合蛋白的方法。但是,融合蛋白同种型(特别是apg101同种型)的混合物是通过下文所描述的方法来获得的。此类方法描述在例如pct/ep04/03239中。根据一个优选的实施方案,设计本发明的融合蛋白包括选择第一结构域和第二结构域的末端氨基酸以便在这两个结构域之间产生至少一个氨基酸重叠。在第一和第二结构域之间或者在两个第一结构域之间的重叠具有优选地1、2或3个氨基酸的长度。更优选地,所述重叠具有一个氨基酸的长度。关于重叠氨基酸的例子为s、e、k、h、t、p和d。根据本发明的组合物包含蛋白质同种型的混合物。本文中所使用的术语“同种型”意指相同蛋白质的不同形式,例如apg101的不同形式,特别是没有信号序列的apg101。此类同种型可以例如由于蛋白质长度、氨基酸(即置换和/或缺失)和/或翻译后修饰而不同,当相比于相应的未修饰的蛋白质(即没有任何修饰的、从给定的编码序列翻译和表达出的蛋白质)而言时。不同的同种型可以例如通过电泳(例如,sds-电泳,和/或等电聚焦,其根据本发明是优选的)来区分。在蛋白质长度方面不同的同种型可以是例如在n-末端处和/或在c-末端处延伸的和/或缩短的,当与相应的未修饰的蛋白质相比较时。例如,根据本发明的apg101同种型的混合物可以包含以未修饰的形式的apg101,以及其在n-末端处和/或在c-末端处延伸的和/或缩短的变体。因此,根据一个优选的实施方案,根据本发明的混合物包含apg101的在n-末端处和/或在c-末端处缩短的变体。特别地,包含在n-末端处缩短的融合蛋白的融合蛋白同种型的混合物是优选的。所述缩短的融合蛋白可以包含在n-末端处截短了1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45和/或50个氨基酸的序列seqidno:1。优选的缩短的融合蛋白具有在n-末端处截短了16、20或25个氨基酸的seqidno:1。在本发明的范围内,这样的在n-末端处缩短的融合蛋白也可以进行命名,并且包括未修饰的apg101的-1、-2、-3、-4、-5、-6、-7、-8、-9、-10、-11、-12、-13、-14、-15、-16、-17、-18、-19、-20、-21、-22、-23、-24、-25、-26、-27、-28、-29、-30、-35、-40、-45和/或-50在n-末端处缩短的变体。特别优选的是-17、-21和/或-26在n-末端处缩短的变体。所述编号涉及根据seqidno:1的包括信号序列的apg101蛋白,其中所述数字涉及在所述在n-末端处截短的apg101变体中的第一个氨基酸。这意味着,具有在n-末端处截短了16个氨基酸的seqidno:1的缩短的融合蛋白相应于命名为-17的apg101变体,并且导致具有seqidno:1的氨基酸17-400的蛋白质;具有在n-末端处截短了20个氨基酸的seqidno:1的缩短的融合蛋白相应于-21(seqidno:1的氨基酸21-400);和具有在n-末端处截短了25个氨基酸的seqidno:1的缩短的融合蛋白相应于-26(seqidno:1的氨基酸26-400)。关于apg101同种型的c-末端缩短的例子为c-末端的lys-修剪。根据本发明的一个优选的实施方案,根据本发明的组合物的融合蛋白的混合物优选地包含相对于经修饰的同种型而言50摩尔%的未修饰的apg101,更优选地40摩尔%的未修饰的apg101,更优选地30摩尔%的未修饰的apg101,更优选地20摩尔%的未修饰的apg101,更优选地10摩尔%的未修饰的apg101,更优选地5摩尔%的未修饰的apg101,和更加优选地3摩尔%的未修饰的apg101,和最优选地1摩尔%和/或更少的未修饰的apg101。最优选的是这样的实施方案,其包括不包含任何未修饰的apg101的融合蛋白同种型的混合物。如上面所概括的,同种型也可以因氨基酸置换、氨基酸缺失和/或氨基酸添加而不同。这样的置换和/或缺失可以包括一个或多个氨基酸。但是,根据该实施方案,单个氨基酸的置换是优选的。根据本发明的同种型也可以在翻译后修饰方面不同。根据本发明的翻译后修饰可以涉及但不局限于,添加疏水基团,特别是用于膜定位,例如豆蔻酰化、棕榈酰化、异戊二烯化或糖基磷脂酰肌醇化,添加辅因子用于增强的酶促活性,例如硫辛酰化,添加较小的化学基团,例如酰化,甲酰化,烷基化,甲基化,在c-末端处的酰胺化,氨基酸添加,γ-羧基化,糖基化,羟基化,氧化,甘氨酰化、生物素化和/或peg化。根据本发明,添加唾液酸,基于fc的糖基化,特别是基于fc的n-末端糖基化,和/或pyro-glu修饰,是翻译后修饰的优选的实施方案。根据一个优选的实施方案,由本发明的组合物所包含的融合蛋白包含高数量的唾液酸。根据本发明,唾液酸的含量优选地为大约4.0至7.0molneuac/molapg101,更优选地4.5至6.0molneuac/molapg101,和最优选地大约5.0molneuac/molapg101。如在本文中所使用的,唾液酸是指神经氨酸的n-或o-取代的衍生物。一种优选的唾液酸为n-乙酰神经氨酸(neuac)。氨基基团通常携带乙酰基或羟乙酰基基团,但其他修饰已被描述过。羟基取代基可以相当大地变化。优选的羟基取代基为乙酰基、乳酰基、甲基、硫酸和/或磷酸基团。唾液酸的添加通常导致更阴离子的蛋白质。所得到的负电荷给予该修饰以改变蛋白质表面电荷和结合能力的能力。唾液酸的高数量导致更好的血清稳定性,和因此经改善的药物代谢动力学和更低的免疫原性。本发明的apg101同种型的高唾液酸化程度可以通过高数量的二触角结构来解释。不得不认为非常令人惊讶的是,在通过本发明方法获得的本发明的组合物中的apg101同种型显示出如此高程度的唾液酸添加。根据本发明,糖基化意指这样的反应,其中将碳水化合物附着至本文中所定义的融合蛋白或其功能片段的官能团。特别地,它涉及将碳水化合物添加至apg101或其同种型。碳水化合物可以例如通过n-连接或o-连接进行添加。将n-连接的碳水化合物附着至天冬酰胺或精氨酸侧链的氮。将o-连接的碳水化合物附着至丝氨酸、苏氨酸、酪氨酸、羟赖氨酸或羟脯氨酸侧链的羟基氧。根据本发明,n-连接,特别是基于fc的n-末端糖基化是优选的。特别优选的n-联糖基化位点位于apg101的位置n118、n136和/或n250(seqidno:1)。根据本发明的岩藻糖基化涉及将岩藻糖单元添加至分子。就本发明而言,岩藻糖单元向融合蛋白(特别是apg101)的这样的添加代表了尤其优选的糖基化类型。高份额的岩藻糖基化形式导致减小的抗体依赖性细胞毒性(adcc)。因此,融合蛋白同种型的混合物以减小的adcc为特征,这对于药学和诊断应用来说是有益的。当然,除了本文中所定义的第一和第二结构域外,根据本发明的融合蛋白还可以包含其他结构域例如其他靶向结构域,例如单链抗体或其片段和/或信号结构域。根据一个进一步的实施方案,根据本发明进行使用的融合蛋白可以包含n-末端信号序列,其允许在重组表达后从宿主细胞中分泌。所述信号序列可以是与所述融合蛋白的第一结构域同源的信号序列。备选地,所述信号序列也可以是异源信号序列。在一个不同的实施方案中,所述融合蛋白没有额外的n-末端序列,例如信号肽。根据本发明的组合物可以包含在n-末端处经封阻的融合蛋白,其提供了在由蛋白酶进行的n-末端降解方面的更高的稳定性;以及具有游离的n-末端的融合蛋白,其提供了在由蛋白酶进行的n-末端降解方面的更高的稳定性。封阻蛋白质的n-末端的修饰是本领域技术人员已知的。但是,一种优选的根据本发明的封阻n-末端的翻译后修饰为pyro-glu修饰。pyro-glu也称为吡咯烷酮羧酸。根据本发明的pyro-glu修饰涉及通过经由α-氨基基团与侧链羧基基团的缩合而发生的谷氨酰胺环化来修饰n-末端谷氨酰胺。经修饰的蛋白质显示出增加的半衰期。这样的修饰也可以出现在谷氨酸残基上。关于在n-末端处缩短的融合蛋白-26而言,特别优选的是pyro-glu修饰,即吡咯烷酮羧酸。在本申请的一个优选的实施方案中,根据本发明的组合物包含80-99摩尔%的在n-末端处经封阻的融合蛋白,和/或1-20摩尔%的具有游离的n-末端的融合蛋白。根据一个进一步的优选的实施方案,所述组合物包含0.0至5.0摩尔%,更优选地0.0至3.0摩尔%,和更加优选地0.0至1.0摩尔%的融合蛋白高分子量形式,例如聚集体。在一个优选的实施方案中,根据本发明的组合物不包含任何融合蛋白同种型聚集体,特别是没有apg101的二聚体或聚集体。二聚体或聚集体通常是不希望的,因为他们对于溶解性具有负面影响。apg101的功能形式包含两个在本文中所描述的融合蛋白,其在铰链区中在所述两个分子的关于seqidno:1而言的位置179或/和182处通过二硫桥相偶联(参见图7)。还可以在所述两个分子的关于seqidno:1而言的位置173处形成二硫桥,从而导致经改善的稳定性。如果不需要在关于seqidno:1而言的位置173处的二硫桥,那么在该位置处的cys残基可以被另一种氨基酸替代,或可以被删除。在一个优选的实施方案中,根据本发明的混合物通过在本文中所描述的根据本发明的方法来提供。根据本发明,融合蛋白同种型的混合物分布在大约4.0至大约8.5的pi范围之内。在一个进一步的实施方案中,由根据本发明的组合物所包含的融合蛋白同种型的混合物的pi范围为大约4.5至大约7.8,更优选地大约5.0至大约7.5。等电点(pi)通过特定分子或表面不携带电荷时所处的ph值来定义。依赖于周围介质的ph范围,蛋白质的氨基酸可以携带不同的正或负电荷。在特定的ph范围,其等电点,即pi值处,蛋白质的所有电荷的总和为零。如果在电场内的蛋白质分子到达具有该ph值的介质点处,那么其电泳迁移率就会减小并且它停留在该位点处。本领域技术人员熟悉用于测定给定蛋白质的pi值的方法,例如等电聚焦。该技术能够具有极其高的分辨率。可以分开和/或分级分离因单个电荷而不同的蛋白质。在本文中所描述的根据本发明的组合物可以用于药学、诊断和/或研究应用。它可以应用在人类医学以及兽医学中。本发明的另一个方面涉及包含根据本发明的组合物的制剂。根据一个优选的实施方案,所述制剂包含:(a)磷酸盐,更优选地大约1mm至大约100mm的磷酸盐缓冲液,更优选地大约5mm的磷酸盐至大约85mm的磷酸盐,更优选地大约20mm至大约80mm的磷酸盐,更优选地大约30mm至大约70mm的磷酸盐,更加优选地大约40mm至大约60mm的磷酸盐,最优选地大约50mm的磷酸盐,(b)粘度增强剂,优选地大约0.1-10重量%的粘度增强剂,更优选地1至8重量%的粘度增强剂,更优选地大约3重量%至大约7重量%的粘度增强剂,更加优选地大约6重量%至大约7重量%的粘度增强剂,和最优选地大约5重量%的粘度增强剂,和(c)具有在4-8的范围内的ph值。在本发明的范围内,术语“磷酸盐”包括本领域技术人员已知的任何合适的磷酸盐缓冲液。根据一个尤其优选的实施方案,所述磷酸盐缓冲液为磷酸钠。粘度增强剂或粘度增加剂是本领域技术人员熟知的,并且包括藻酸、羧甲基纤维素、糊精、明胶、瓜耳胶、羟乙基纤维素、硅酸铝镁、聚乙烯醇、聚环氧乙烷、二氧化硅、淀粉、黄原胶等。当然可以存在的其他赋形剂包括蔗糖、山梨糖醇和/或甘氨酸。但是,根据本发明尤其优选的粘度增强剂为山梨糖醇。根据一个尤其优选的实施方案,粘度增强剂山梨糖醇以大约5重量%存在。根据本发明的制剂的ph值在大约4至8的范围内。根据一个优选的实施方案,它在5至8,更优选地6至8,和更加优选地6.5至8的范围内。根据一个尤其优选的实施方案,所述ph为大约6.5,大约7.0,或大约7.5。根据一个尤其优选的实施方案,根据本发明的制剂包含大约30mm的磷酸钠或大约50mm的磷酸钠、大约5%的山梨糖醇,并且显示出大约6.5的ph值(参见图10的缓冲液5和6)。令人惊讶地,以那种制剂类型提供的本发明的组合物是非常稳定的并且不倾向于形成聚集体。例如,本发明的制剂进一步以减小的apg101片段化为特征。而且,可能的是,以稳定形式提供高的蛋白质浓度,例如大约20mg/ml。可以通过合适的方式,以对于治疗特定病况来说足够的剂量,向有此需要的受试者(特别地,人患者)施用根据本发明的组合物和/或制剂。例如,可以将根据本发明的组合物和/或制剂与药学上可接受的载体、稀释剂和/或助剂一起配制成药物组合物。治疗功效和毒性可以按照标准实验方案来测定。所述药物组合物可以全身地,例如以腹膜内方式、以肌内方式或以静脉内方式进行施用,或者局部地,例如以鼻内方式、以皮下方式或以鞘内方式进行施用。当然,所施用的组合物和/或制剂的剂量将会依赖于待治疗的受试者和受试者的状况例如受试者的体重、受试者的年龄和待治疗的疾病或损伤的类型和严重度,施用方式,以及处方医生的判断。例如,0.001至100mg/kg的日剂量是合适的。本发明的另一个方面涉及包含根据本发明的组合物或制剂的药物组合物或制剂,其包含至少一种其他活性试剂。施用哪种其他活性试剂取决于待治疗的适应症。例如,细胞毒性剂例如多柔比星、顺铂或卡铂,细胞因子,或者其他抗肿瘤剂,可以用在癌症的治疗中。根据本发明的制剂和/或组合物可以进一步包含药学上可接受的载体、稀释剂和/或助剂。当在本文中使用时,术语“载体”包括在所采用的剂量和浓度下对于暴露于它们的细胞或哺乳动物来说无毒的载体、赋形剂或稳定剂。通常,生理学上可接受的载体为水性的ph经缓冲的溶液或脂质体。生理学上可接受的载体的例子包括:缓冲液,例如磷酸盐、柠檬酸盐和其他有机酸(但是,关于本发明的制剂而言,磷酸盐缓冲液是优选的);抗氧化剂,包括抗坏血酸;低分子量(少于大约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;胶凝剂,例如edta;糖醇,例如甘露醇或山梨糖醇;成盐抗衡离子,例如钠;和/或非离子型表面活性剂,例如tween、聚乙烯或聚乙二醇。根据一个优选的实施方案,根据本发明的组合物和/或制剂可以用于抑制cd95信号传导途径,特别是由cd95l(即cd95受体配体)所触发的外因性凋亡途径。特别地,所述组合物可以在选自下列的病症的预防和/或治疗中使用:自身免疫病症,aids,心脏病症例如心肌梗死,移植物抗宿主病症,移植排斥,脑损伤例如中风,脊髓损伤,脓毒症,肝炎,与炎症相关的病症,缺血再灌注损伤,和肾脏病症。当然,在本文中所描述的组合物和/或制剂可以用于治疗癌症,优选地实体癌,例如脑癌,例如成胶质细胞瘤。备选地,待治疗的癌症可以为淋巴或骨髓起源的癌症。本发明的另一个方面涉及用于产生根据本发明的组合物的方法。根据一个优选的实施方案,所述方法包括下列步骤:(a)通过补料分批生产工艺来产生由本发明所提供的组合物,从而提供细胞收获物,和(b)从所述细胞收获物中分离本发明的组合物。相比于现有技术中已知的方法而言,本发明的方法的一个优点是其高产率。步骤(a),即“通过补料分批生产工艺来产生根据本发明的组合物,从而提供细胞收获物”,在下面也将被称为“上游工艺(usp)”。根据本发明的步骤(a)的过程也称为“本发明性usp”。图1显示了根据现有技术的上游工艺与本发明的上游工艺的一个优选实施方案的比较。步骤(b),即“从所述细胞收获物中分离本发明的组合物”,在下面也将被称为“下游工艺(dsp)”。优选地,步骤(a)包括给定的主要细胞批料的一系列培养步骤直至达到相关的收获参数,随后是沉降和过滤出融合蛋白,优选地包含融合蛋白的上清液。在本发明的一个优选的实施方案中,可以将上游工艺的过程步骤总结为包括下列步骤的系列:解冻,传代培养,50l生物反应器,200l生物反应器,1000l生物反应器,沉降,深层过滤,和0.2μm过滤。当然,施行从传代培养至1000l生物反应器的培养步骤仅是实施本发明的一种方式。例如,所述培养步骤同样可以在大小变化的生物反应器中进行。当然,在所述一系列传代培养步骤过程中,本领域技术人员可以确定合适的参数,例如温度、生长时间、培养基等。关键因素是达到相关的收获参数,其可以是滴度、细胞密度,其中所述滴度优选地在0.5g/l至5g/l,更优选地1g/l至3g/l,更优选地1.5g/l至5g/l,和最优选地1.8g/l至2g/l的范围之内。关于优选的细胞密度值的例子为大约1×106至1×108个细胞/ml,优选地大约1×107个细胞/ml。在本发明的一个尤其优选的实施方案中,所述滴度为大约1.8g/l至大约2g/l,和所述细胞密度为大约1×107个细胞/ml。优选地,根据本发明的方法在包含蛋白胨的基础培养基和化学成分确定的培养基中进行。步骤(b)可以包括捕获色谱法、病毒灭活、一系列阴离子和/或阳离子色谱法、病毒过滤,和/或调整至所希望的最终蛋白质浓度。根据上面所定义的步骤(b)来纯化通过步骤(a)而获得的包含apg101同种型的组合物的下游工艺包括,色谱法步骤、病毒灭活步骤、超滤步骤、渗滤步骤和病毒过滤步骤。根据一个优选的实施方案,该下游工艺包括三个不同的色谱法步骤。第一个色谱法步骤用树脂来进行以捕获靶蛋白质,和/或去除与工艺相关的杂质(例如,hcps,dna),和/或减小包含产物的级分的体积。相应的树脂可以由本领域技术人员来进行选择。树脂的一个例子为mabselectsure,其也是根据本发明的一个优选的实施方案。在该第一个色谱法步骤之后,接着是病毒灭活步骤。优选地,该病毒灭活步骤在酸性条件(例如,ph3.5±0.2)下进行,随后是调理灭活汇集物或在酸性更小的ph值例如ph5.0处。用于病毒灭活和随后的ph5.0调整的缓冲基质可以仅基于20nm柠檬酸钠缓冲液。在该病毒灭活步骤之后,进行离子交换色谱法步骤,以便减少与工艺相关的杂质例如dna。根据本发明,阴离子交换色谱法(aiex)步骤是优选的,特别地以流过(flow-through)模式。靶蛋白质通过aiex柱,而dna结合至树脂。优选地,随后对aiex流过汇集物进行加工处理,没有任何使用进一步的基于柱子的步骤来进行的调理。该可选的进一步步骤有助于总体减少病毒污染以及残留的hcp、dna和变白的蛋白a配体。根据一个优选的实施方案,以结合/洗脱模式来使用混合模式树脂capto-mmc操作型柱子。让洗脱物通过病毒滤器(vf)并随后应用于超滤-渗滤步骤(uf/df)。根据本发明,在病毒过滤步骤上可以获得≤100l/m2的比体积载荷。优选地,使用具有大约30kd截止值的膜。当然,上面所描述的单个纯化步骤可以用本领域技术人员已知的达到相同或相当的效果的步骤来代替。最后,将uf/df截留物进行配制,并且将根据本发明的apg101组合物的浓度调整至所希望的蛋白质浓度例如20±2mg/ml。图2图解说明了根据本发明的下游工艺的一个优选实施方案的流程图。正如可以从图3中看到的,本发明性下游工艺以许多超过现有技术中已知的下游工艺的优点为特征。例如,在病毒灭活后,不需要在中性ph处的保持步骤。关于病毒过滤步骤,≤100l/m2的体积载荷是可能的,相比于现有工艺中已知的37g/m2而言。进一步地,使用本发明的配制缓冲液,可以达到高的蛋白质浓度例如20mg/ml,相比于在pbs中的10mg/ml而言。在本文中所描述的用于产生根据本发明的组合物的方法导致处于4.0至8.5的pi范围内的apg101同种型。以该方式提供的组合物仅包含非常小量的不想要的较高分子量形式例如二聚体或聚集体。以该方式提供的apg101同种型以高数量的唾液酸含量以及包含高数量的岩藻糖基化形式的基于fc的n-末端糖基化为特征。附图图1:本发明性上游工艺与非本发明性上游工艺的比较。图2:显示了本发明的下游工艺的一个优选实施方案的流程图。图3:本发明性下游工艺与非本发明性下游工艺的比较。图4a:通过本发明性方法获得的apg101混合物的aex级分的ief。图4b:通过非本发明性方法获得的apg101混合物的aex级分的ief。图5:效能测定法的示意性概览。图6:相比于通过非本发明性方法获得的apg101而言,通过本发明性方法获得的apg101同种型混合物的体外生物学活性(ec50)。图7:有功能的apg101分子。图8:apg101组合物缓冲液比较的热荧光(thermofluorescence)测定法结果。图9:apg101组合物赋形剂比较的热荧光测定法结果。图10:强制降解稳定性研究的分析结果:关于apg101稳定性而言,赋形剂(+)显示出良好的缓冲液性能,而赋形剂(-)显示出差的缓冲液性能。图11:热荧光测定法,其评估了来自apogenix的两个批次的apg101的热稳定性,与商购可得的fas/fc直接比较。实施例1用于产生根据本发明的组合物的方法用于产生根据本发明的组合物的方法包括如上面所定义的上游工艺和下游工艺。1.上游工艺1.1.批次定义以补料分批培养来产生包含apg101同种型的组合物。将两个小瓶的主要细胞库mcb1aga解冻。第三次传代培养的生存力必须>90%,活细胞计数必须>1.5×106个细胞/ml。如果这两个小瓶都满足这些技术规范,就将具有较高生存力的培养物用于第四次传代培养和接种种子反应器。具有较低生存力的培养物将会在第三次传代培养后被丢弃。在接种第一个种子生物反应器之前,将细胞培养物在摇瓶中进行扩展直至≥4l总体积。作为第一个种子生物反应器,使用50lxcellerex一次性生物反应器(xdr)。在转移入第二个种子反应器200lxdr中之前,将细胞培养物培养三天。在另外培养3天后,接种1000l生产反应器。收获程序开始于第13天,或者更早,如果生存力下降到61%以下。1.2.细胞系所使用的主要细胞库(mcb)被命名为“mcb1aga”。1.3.解冻和传代培养连续地复苏两个低温小瓶的mcb。对每一个小瓶应用下面的解冻程序:将低温小瓶在具有wfi的烧杯中于36.8℃(设定点)进行解冻直至剩下小的冰晶。然后,将细胞转移入大约10ml的冷却的(于5±3℃)补充有6mml-谷氨酰胺(最终浓度)和50nmmtx(最终浓度)的生长培养基(培养基编号3001772,购自paa)中。为了去除残留的dmso,通过离心在冷却的(5±3℃)培养基中进行洗涤步骤。在离心步骤后,将细胞粒状沉淀重悬浮在50ml的预热的(36.8±1℃)培养基中。用cedex细胞计数器来测量细胞浓度和生存力。最后,通过使用250ml摇瓶,以50ml的工作体积,将该不再冷冻的培养物在摇动式培养箱中进行温育。第一次和第二次传代培养是通过使用500ml摇瓶以120ml(第一次传代培养)和150ml(第二次传代培养)的工作体积来进行的稳定分开。第三次和第四次传代培养是第一次扩展期,并且以800ml的工作体积在2000ml摇瓶中进行。对于这些初始的四次传代,使用预热的(于36.8±1℃)补充有6mml-谷氨酰胺和50nmmtx(最终浓度)的生长培养基(培养基编号3001772,购自paa)作为培养介质。在每一个培养步骤之前,使用cedex细胞计数器来进行细胞浓度和生存力的测量。依赖于细胞生长来准备下一次传代培养。在第5次传代培养时,将摇瓶汇集在5l玻璃瓶中。对该汇集物进行取样以用于测量细胞浓度和生存力。然后,依赖于实际的vcc,将所需要的细胞培养物体积转移入50l种子生物反应器中。1.4.种子生物反应器(50l)给该50l种子生物反应器配备安装在底部的磁力驱动型搅拌器系统和1mm喷射器圆片。在接种之前,给该50l生物反应器装填大约20l的补充有6mml-谷氨酰胺(最终浓度)的生长培养基(培养基编号3001772,购自paa)。这些参数应用于培养基预调理和种子训练培养过程。当工艺参数稳定在其可接受的范围之内时,开始进行接种物转移。在接种后,给所述反应器装填培养基至25l的最终工作体积。在所述50l生物反应器中的细胞团扩展期间,不向该过程应用补充料添加。经由喷射器用co2来控制ph。通过在需要时用氧气进行水下通气来控制氧水平。向顶部空间施加覆盖空气气流。实施以0.1l/分钟的流速用加压空气来进行的水下通气,其可以适应用于调整pco2。所预期的在种子生物反应器中的培养时间为3天,在接种200l种子生物反应器之前。1.5.种子生物反应器(200l)给该200l种子生物反应器配备安装在底部的磁力驱动型搅拌器系统和1mm喷射器圆片。在接种之前,给该200l生物反应器装填大约100l的补充有6mml-谷氨酰胺(最终浓度)的生长培养基(培养基编号3001772,购自paa)。这些参数应用于培养基预调理和种子训练培养过程。当工艺参数稳定在其可接受的范围之内时,开始进行接种物转移。在接种后,添加培养基至120l的最终工作体积。在所述200l生物反应器中的细胞团扩展期间,不向该过程应用补充料添加。用co2气体来纠正ph。通过在需要时用氧气进行水下通气来控制氧水平。向顶部空间施加覆盖空气气流。实施以0.4l/分钟的流速用加压空气来进行的水下通气,其可以适应用于调整pco2。所预期的在种子生物反应器中的培养时间为3天,在将细胞转移入1000l生产生物反应器中之前。1.6.补料分批生产工艺包含apg101同种型的组合物的生产工艺为补料分批培养。给1000l生产生物反应器配备安装在底部的磁力驱动型搅拌器系统和1mm喷射器圆片。在接种之前,给该1000l生物反应器装填大约580l的生长培养基(培养基编号3001829,购自bectondickison)并补充6mml-谷氨酰胺(最终浓度,基于720l的最终起始体积来计算的)。当工艺参数在其可接受的范围之内时,开始进行从种子生物反应器向生产生物反应器的接种物转移。在所述生产生物反应器中进行接种之后,靶细胞浓度为0.3×106个活细胞/ml,在720l的总体积中。将所需体积的种子生物反应器细胞培养物转移至生产反应器,然后给后者装填生长培养基(培养基编号3001829,购自bectondickison)直至达到720l的起始体积。用补充料培养基a(pm30728)(从第3天开始)和用葡萄糖补充料培养基b(pm30729)对细胞培养物进行补料。分开地用补充料b来开始每日补料,可以将补充料a和葡萄糖同时进行补料。-补充料培养基b:在取样后第3天开始进行集中式补料。第3-6天的补料速度:5.184g/l/天(基于720l的起始体积来计算的)第7-12天的补料速度:2.592g/l/天(基于720l的起始体积来计算的)-补充料培养基a:在取样后第3天开始进行集中式补料。第3-5天的补料速度:43.2g/l/天(基于720l的起始体积来计算的)第6-12天的补料速度:21.6g/l/天(基于720l的起始体积来计算的)-d-葡萄糖补充料:在第7天开始,实当际的d-葡萄糖浓度<5g/l时,添加葡萄糖。通过添加所需量的d-葡萄糖补充料来将d-葡萄糖的浓度调整至5g/l。氧水平通过应用具有3个优先级的氧控制器级联来进行控制:优先级1由在需要时的工艺空气流组成,直至达到10l/分钟的气流。然后,连续地增加搅拌(优先级2),直至达到100rpm的搅拌速度。第三个优先级由在需要时水下喷射o2组成。向顶部空间施加空气覆盖流。ph用co2来进行控制。如有必要,制备1mna2co3以待必要时添加。定期观察泡沫的形成,并且如有必要,添加消泡剂。收获程序开始于培养的第13天,或者更早,如果生存力下降到<61%以下(cedex)。该程序的第一步为细胞的沉降,其中将细胞培养液冷却至10±5℃。当温度在20℃以下时,切断搅拌器、通气和ph控制。在最少12小时的沉降后,开始澄清步骤。通过两步骤深层过滤和0.2μm过滤来使上清液澄清。1.7.沉降通过沉降步骤来开始收获程序。将培养液冷却至最终10±5℃。当温度<20℃时,撤销搅拌、po2和ph-控制。在最少12小时和最多22小时的沉降之后,开始深层过滤。1.8.过滤用来自pall的staxtm一次性深层过滤器系统来进行深层过滤,其中加载7xpdk5和2xpdd1深层过滤器。澄清之后是0.2μm过滤。以≤100l/m2/小时的流通率用大约900lpbs冲洗深层过滤器。用空气将残留的液体吹出系统。以≤3.5l/分钟的泵流速和1.0巴的最大压力来运行过滤过程。为了增加产物回收率,过滤器在之后用大约60lpbs(ph7.25)来进行漂洗并且用最大压力为0.8巴的加压空气向外吹。将过滤出的收获物通过壁管直接转移入gd套件中,收集在1000lmixtainer中,并且于室温进行贮存。2.下游工艺为了举例说明的目的,将会在下面给出在下游工艺期间的独个纯化步骤的描述。2.1.蛋白a捕获(c10)将来自上面的过滤材料转移至进行深层过滤(0.2μm)并调温至5±3℃。在进行加工处理之前,将收获物分为四个相等的等分试样,并且于室温贮存过夜以达到21±3℃的最终工艺温度。以四个循环,进行收获物的加工处理,而没有任何进一步的调理。通过低ph步骤来引发洗脱。在洗脱步骤之内,所述四个循环的uv280谱是高度一致的并且显示出所预期的形状,包括典型的单峰。蛋白a走柱的产率在94%和98%之间变动。因此,蛋白a走柱的产物回收率在所预期的范围内。进一步地,所有回收率彼此是相当的,并且验证了在加工处理、转移和适应期间所获得的数据。2.2.病毒灭活(v10)紧接在收集蛋白a洗脱物之后,在5分钟之内用20mm柠檬酸进行固定体积添加(技术规范:ph3.5±0.2)以灭活有包膜病毒。在室温(21±3℃)下分开地将所获得的病毒灭活溶液温育75±15分钟。最后,通过添加固定体积的20mm柠檬酸钠来将灭活溶液的ph调整至ph5.0±0.2以终止病毒灭活。整个调理规划如下:随后,将经调理的病毒灭活溶液通过0.22μm过滤器(sartobranp)进行过滤以分开可能形成的沉淀物和抑制在工艺溶液中的微生物生长。将每个经调理的病毒灭活批料贮存于21±3℃,并且最终在通过aiex(c20)步骤进行加工处理之前进行汇集。2.3.aiex(c20)-柱在病毒灭活、ph调整和过滤之后,将经调理的病毒灭活汇集物以两个循环以ft模式在captoq柱上进行加工处理。该方法包括原位清洁步骤1(缓冲液0.5mnaoh)、平衡步骤(20mm柠檬酸钠,ph5)、经调理的病毒灭活溶液的加载步骤、洗涤步骤(20mm柠檬酸钠,ph5.0)、再生步骤(20mm柠檬酸钠,1mna-cl,ph5.5)、原位清洁步骤2(0.5mnaoh)和贮存步骤(0.01mnaoh)。所述两个循环的uv280谱是一致的,并且在施加经调理的蛋白a洗脱物期间显示出所预期的uv280吸收谱的增加。最后,将每个所获得的流过级分进行0.22μm过滤(sartobranp)以便解决生物负荷减少。在此之后,汇集分开的级分,并且贮存于21±3℃直至通过mmc步骤(c30)进行进一步加工处理。经由ief来进行的通过本发明性方法获得的apg101同种型的混合物的aiex级分与通过非本发明性方法获得的apg101的混合物的aiex级分的比较显示在图4a和4b中。aiex走柱的产率在100%附近。2.4.mmc(c30)-柱在c20步骤后,以三个循环将aiex产物汇集物在captommc柱上进行加工处理。该方法包括原位清洁步骤(缓冲液0.5mnaoh)、平衡步骤(20mm柠檬酸钠,ph5.0)、使用aiex产物/洗涤液的加载步骤、洗涤步骤(20mm柠檬酸钠,ph5.0)、洗脱步骤(50mm磷酸钠,105mmnacl,ph7.4)、再生步骤(3mnacl,ph11)、原位清洁步骤(0.5mnaoh)、调理步骤(50mm磷酸钠,105mmnacl,ph7.4)和贮存步骤(20mm磷酸钠,20%乙醇,ph7.5)。通过ph的增加来引发洗脱。所述三个循环的uv280谱是高度一致的并且在洗脱步骤之内显示出所预期的形状,包括典型的单峰。随后,将洗脱物级分各自在0.22μm过滤器(sartobranp)上进行过滤,并且贮存于21±3℃。在通过病毒过滤步骤进行进一步加工处理之前,汇集特定的captommc洗脱物级分。mmc走柱的产率在100%附近变动。2.5.病毒过滤(i10)在c30步骤之后,在病毒过滤之前,将captommc洗脱物汇集物(1181ml)通过durapore0.1μm过滤器(millipak20)。通过在0.8±0.1巴的工作压力下在用50mmpbs,ph7.4(captommc洗脱缓冲液)进行平衡的planova15n病毒过滤器(100cm2)上施加0.1μm过滤物的等分试样(887ml)来进行所述病毒过滤。洗涤后的体积为0.5ml/cm2,其中使用平衡缓冲液。在过滤器使用之前,基于加压空气鼓泡的检测来进行过滤器测试。过滤物流量在加工处理期间保持恒定(大约22l/m2*小时)。病毒过滤导致99%的产率。随后,汇集残留的0.1μm过滤物和所述病毒过滤的过滤物级分,并且贮存于5±3℃直至通过随后的uf/df步骤进行进一步加工处理。2.6.超滤/渗滤(i20)在渗滤之前,使用两个pellicon330kda盒,将i10过滤物在crossflow系统上浓缩至25.0±2.0mgapg101/ml的蛋白质浓度。在此之后,进行渗滤以将缓冲液系统改变为下列缓冲液:50mm磷酸钠,5%山梨糖醇,ph6.5。将材料超滤至上面提及的浓度,并且渗滤至7.0±0.5倍。用于超滤和渗滤的参数为:截留物流量:450l/(m2*小时),tmp:1.2±0.1巴。uf/df产生97%的产物回收率。2.7.药物物质浓度调整关于最终浓度调整,向uf/df截留物汇集物添加确定体积(107ml)的配制缓冲液(50mm磷酸钠,5%山梨糖醇,ph6.5)。通过a280获得的最终药物物质浓度为20.4mg/ml。最后,将药物物质进行0.22μm过滤(sartobranp)。随后,将体积为200μl的药物物质的等分试样装瓶于500μl小瓶中。2.8.总产率从proa-hplc和a280分析获得的步骤和总产率列在表1中。对于产率的计算,不考虑靶分子的取样。表1:步骤产率的概览#1通过proa-hplc收获物方法测定加载物,通过proa-hplc测定洗脱物,#2通过proa-hplc收获物方法测定加载物,通过a280测定洗脱物。apg101同种型的混合物的一致性通过非还原性sds-page和ief来进行确认。同种型图式显示出相比于参考材料而言的额外的基础条带,和向酸性pi的在同种型分布方面的轻微漂移。这例如通过比较通过本发明的方法获得的ax级分的ief凝胶与通过根据图1的非本发明性方法获得的apg101混合物而得到显示。本发明的apg101同种型混合物进一步地在碳水化合物(n-聚糖唾液酸)的存在方面不同。碳水化合物(触角状程度/n-聚糖)在表2中,总结了碳水化合物结构的分析。尽管在参考材料和本发明性组合物之间有相当的碳水化合物结构,但碳水化合物结构的分布不同。表2:n-聚糖(碳水化合物)分析结果峰/样品参考材料(摩尔%)本发明性组合物(摩尔%)cf1gn234.118.2cf1gn2g119.217.8cf1gn2g330.151.5cf1gn2g39.17.6其他7.64.9碳水化合物(唾液酸)将本发明性组合物的apg101的“唾液酸量/摩尔”的分析总结在表3中。表3:唾液酸(碳水化合物)分析样品唾液酸含量(molneuac/molapg101)本发明性组合物5.1参考材料3.9所述参考材料总是涉及不是通过本发明的方法产生的apg101混合物。最后,实施测定法以测量包含apg101同种型的根据本发明的混合物的生物活性。3.用于测定apg101同种型的体外效能的方法将使用jurkata3永久性t-细胞系的细胞测定法用于测定apg101的生物学活性。该效能示意性地显示在图5中。通过采用jurkata3细胞的该凋亡测定法,测定了关于apg101对于由apg293(=cd95l-t4;250ng/ml)诱导的凋亡的抑制的ec50值。简而言之,使jurkata3细胞在具有补充有10%fbs、100个单位/ml青霉素和100μg/ml链霉素的rpmi1640-培养基+glutamax(gibco)的瓶中生长。将每孔100,000个细胞接种到96-孔微量滴定板中。将以250ng/ml的恒定浓度的cd95l-t4(apg293)在分开的96-孔微量滴定板中于37℃与不同浓度的apg101一起温育30分钟。在向细胞添加apg101/cd95l-t4混合物之后接着是于37℃温育3小时。通过添加裂解缓冲液(250mmhepes,50mmmgcl2,10mmegta,5%triton-x-100,100mmdtt,10mmaebsf,ph7.5)来裂解细胞,并且将平板放置在冰上30分钟至2小时。与凋亡伴随出现的是增加的胱天蛋白酶(例如,胱天蛋白酶3和7)活性。因此,将胱天蛋白酶底物ac-devd-afc的切割用于测定凋亡的程度。实际上,胱天蛋白酶活性与在用碘化丙锭和hoechst-33342对细胞进行染色后通过形态学方式确定的凋亡细胞的百分比相关。关于胱天蛋白酶活性测定法,将20μl细胞裂解液转移至黑色的96-孔微量滴定板。在添加80μl的包含50mmhepes、1%蔗糖、0.1%chaps、50μmac-devd-afc和25mmdtt(ph7.5)的缓冲液后,将平板转移至tecan微量滴定板阅读器,并且在给定的时间范围内监测荧光强度的增加(激发波长400nm,发射波长505nm)。采用graphpadprism软件来计算关于apg101的ec50值(即给定浓度的cd95l的凋亡诱导降低了50%)。采用所述效能测定法来测定apg101的生物学活性使得下列成为可能:·高的特异性。通过其与cd95相互作用,cd95l-t4对于jurkata3细胞诱导凋亡。通过添加apg101而特异性地阻断了cd95/cd95l-t4相互作用。·使用相关的细胞系统;凋亡的诱导是cd95/cd95l信号传导的一个重要的生理学特征,并且可以在经充分表征的人t-细胞系jurkata3中进行监测。·高的样品通量,这是由于96-孔微量滴定板的应用和短的温育时间。图6显示了通过本发明性方法获得的apg101同种型混合物(本发明性样品)的生物学活性(ec50),相比于通过非本发明性方法获得的apg101而言。活性是相当的。4.apg101制剂的热荧光测定法通过热荧光测定法来确认根据本发明的制剂的稳定性(参见图8和9)。通过热荧光(tf)测定法来实施apg101的热转变点的测定。由此,荧光染料结合至该蛋白质的疏水斑片。在温度增加过程中,该蛋白质解折叠,并且更多的染料可以结合,这导致荧光信号的增加。因此,更高的热转变点(解折叠温度,tm)表明apg101的更稳定的状态。该测定法的设置显示在表2中。表2:热荧光测定法设置参数值染料syproorange(sigma)染料浓度1:1000样品体积50μl样品浓度100μg/ml温度梯度35℃至95℃温度梯级0.2℃至0.5℃保持时间10秒热转变点被定义为在温度增加过程中荧光信号增加的拐点。测试了在不同缓冲液系统中apg101的稳定性(图8)。通过热荧光测定法,关于不同的赋形剂(即糖、多元醇、氨基酸和聚乙二醇),用起始材料3测定了apg101的热转变点。实验方法与上面所描述的相同。结果显示在图9中。tm值随着蔗糖、山梨糖醇和甘氨酸浓度增加而增加。甘氨酰甘氨酸(gly-gly)或peg的添加没有显示出正的稳定化效应。进一步地,进行热荧光测定法以将根据本发明制备的apg101批料与商购可得的fas/fc样品进行比较。采用了50μg/ml的样品浓度(apg101或fas/fc)。热荧光测定法清楚地揭示了,在热稳定性方面,本发明的两个批次的apg101(批次f10176和批次1011626)相比于来自sigma的商购可得的fas/fc而言的优越性(图11)。本发明的一些实施方案如下:1.包含融合蛋白同种型的混合物的组合物,其中每个融合蛋白包含至少一个细胞外cd95结构域或其功能片段和至少一个fc结构域或其功能片段,所述fc结构域或其功能片段在4.0-8.5的pi范围之内分布。2.根据实施方案1的组合物,其中所述fc结构域为人的fc结构域。3.根据实施方案1或2的组合物,其中所述融合蛋白为apg101、与apg101具有至少70%同一性的多肽、和/或apg101的功能片段。4.根据实施方案1-3中任一项的组合物,其中所述pi范围为4.5-7.8,优选地5.0-7.5。5.根据实施方案1-4中任一项的组合物,其包含0.0-5.0摩尔%的融合蛋白高分子量形式,例如二聚体和/或聚集体。6.根据实施方案1-5中任一项的组合物,其包含高数量的唾液酸。7.根据实施方案3-6中任一项的组合物,其包含在n-末端处缩短的融合蛋白,例如-17、-21和/或-26融合蛋白。8.根据实施方案1-7中任一项的组合物,其中所述fc结构域或其功能片段是n-联糖基化的,特别是以高数量的岩藻糖基化形式为特征。9.根据实施方案1-8中任一项的组合物,其包含在n-末端处经封阻的融合蛋白,例如通过pyro-glu修饰进行封阻的融合蛋白,和/或包含具有游离的n-末端的融合蛋白。10.根据实施方案1-9中任一项的组合物,其包含80-99摩尔%的在n-末端处经封阻的融合蛋白,和/或1-20摩尔%的具有游离的n-末端的融合蛋白。11.制剂,其包含根据实施方案1-10中任一项的组合物。12.根据实施方案11的制剂,其进一步包含:(a)磷酸盐,优选地大约20mm至大约100mm的磷酸盐,更优选地大约50mm的磷酸盐,(b)粘度增强剂,例如山梨糖醇,优选地大约0.1-10重量%的粘度增强剂,更优选地大约5重量%的粘度增强剂,和/或(c)具有在4-8的范围内的ph值。13.用于产生根据实施方案1-10中任一项的组合物的方法。14.根据实施方案13的方法,其包括下列步骤:(a)通过补料分批生产工艺来产生根据实施方案1-10中任一项的组合物,从而提供细胞收获物,和(b)从所述细胞收获物中分离根据实施方案1-10中任一项的组合物。15.根据实施方案13和14中任一项的方法,其中步骤(a)包括给定的主要细胞批料的一系列培养步骤直至达到相关的收获参数,随后是细胞沉降和过滤出包含融合蛋白的上清液,和/或步骤(b)包括捕获色谱法,病毒灭活,一系列阴离子和/或阳离子色谱法,病毒过滤,和/或调整至所希望的最终蛋白质浓度。序列表<110>apogenixgmbh<120>包含cd95-fc同种型的混合物的组合物<130>53445pwo<160>1<170>patentinversion3.5<210>1<211>400<212>prt<213>人工序列<220><223>由在其c-末端具有人igg1fc-部分的人cd95细胞外结构域组成的重组融合蛋白<220><221>signal<222>(1)..(16)<223>可变切割位点<220><221>signal<222>(1)..(20)<223>可变切割位点<220><221>signal<222>(1)..(25)<223>可变切割位点<220><221>domain<222>(26)..(172)<223>人cd95细胞外结构域<220><221>mod_res<222>(26)..(26)<223>吡咯烷酮羧酸<220><221>disulfid<222>(59)..(73)<220><221>disulfid<222>(63)..(82)<220><221>disulfid<222>(85)..(101)<220><221>disulfid<222>(104)..(119)<220><221>disulfid<222>(107)..(127)<220><221>carbohyd<222>(118)..(118)<223>在位置n118处的n-联糖基化<220><221>disulfid<222>(129)..(143)<220><221>disulfid<222>(135)..(140)<220><221>carbohyd<222>(136)..(136)<223>在位置n136处的n-联糖基化<220><221>disulfid<222>(146)..(157)<220><221>disulfid<222>(149)..(165)<220><221>domain<222>(172)..(400)<223>人igg1-fc结构域<220><221>disulfid<222>(173)..(173)<223>apg101同源二聚体的链间胱氨酸形成残基<220><221>disulfid<222>(179)..(179)<223>apg101同源二聚体的链间胱氨酸形成残基<220><221>disulfid<222>(182)..(182)<223>apg101同源二聚体的链间胱氨酸形成残基<220><221>disulfid<222>(214)..(274)<220><221>carbohyd<222>(250)..(250)<223>在位置n250处的n-联糖基化<220><221>disulfid<222>(320)..(378)<400>1metvalglyiletrpthrleuleuproleuvalleuthrservalala151015argleuserserlysservalasnalaglnvalthraspileasnser202530lysglyleugluleuarglysthrvalthrthrvalgluthrglnasn354045leugluglyleuhishisaspglyglnphecyshislysprocyspro505560proglygluarglysalaargaspcysthrvalasnglyaspglupro65707580aspcysvalprocysglngluglylysglutyrthrasplysalahis859095pheserserlyscysargargcysargleucysaspgluglyhisgly100105110leugluvalgluileasncysthrargthrglnasnthrlyscysarg115120125cyslysproasnphephecysasnserthrvalcysgluhiscysasp130135140procysthrlyscysgluhisglyileilelysglucysthrleuthr145150155160serasnthrlyscyslysglugluglyserargsercysasplysthr165170175histhrcysproprocysproalaprogluleuleuglyglyproser180185190valpheleupheproprolysprolysaspthrleumetileserarg195200205thrprogluvalthrcysvalvalvalaspvalserhisgluasppro210215220gluvallyspheasntrptyrvalaspglyvalgluvalhisasnala225230235240lysthrlysproargglugluglntyrasnserthrtyrargvalval245250255servalleuthrvalleuhisglnasptrpleuasnglylysglutyr260265270lyscyslysvalserasnlysalaleuproalaproileglulysthr275280285ileserlysalalysglyglnproarggluproglnvaltyrthrleu290295300proproserarggluglumetthrlysasnglnvalserleuthrcys305310315320leuvallysglyphetyrproseraspilealavalglutrpgluser325330335asnglyglnprogluasnasntyrlysthrthrproprovalleuasp340345350seraspglyserphepheleutyrserlysleuthrvalasplysser355360365argtrpglnglnglyasnvalphesercysservalmethisgluala370375380leuhisasnhistyrthrglnlysserleuserleuserproglylys385390395400当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1