一种表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌的构建及其应用的制作方法
本发明属于动物分子生物学领域,涉及一种表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌的构建及其应用。
背景技术:
猪轮状病毒(简称PoRV)感染多发生于寒冷季节,是一种地方流行性传染病,病猪是主要传染源,5~10d就能从感染猪的粪便中发现PoRV的抗体。经粪-口途径传播,大猪多为隐性感染,15~35d的仔猪易感,自然情况下感染轮状病毒的猪可产生循环抗体,母猪经母乳将轮状病毒抗体过继给仔猪,使仔猪获得母源抗体,时长3~5周,初产母猪的仔猪与经产母猪的仔猪相比,感染猪轮状病毒的几率高。
目前市面上的PoRV疫苗包括以细胞(MA104)扩繁的低毒力的病毒经灭活,然后用佐剂(矿物油)制成油佐剂灭活苗,用于怀孕母猪生产前一个月免疫以及仔猪出生后的第一周和第三周各免疫一次;另一类是美国Ambico公司研制的弱毒苗,10倍的TCID50/mL的病毒量,免疫接种(口服或肌肉注射),母猪在分娩前2周和第5周各接种1次。以上两种类别的疫苗通过生产验证,发现给需免猪免疫弱毒苗,可以阻止和预防PoRV感染,并且攻毒试验中疫苗保护率很高,而灭活苗与其相比各项验证结果都低。
DNA疫苗也称为基因疫苗,是将一种或几种目的基因,运用基因重组技术克隆到载体上形成重组DNA,直达宿主体内,并长期表达获得免疫。研究较多的蛋白包括VP7、VP4和VP6。其中VP4蛋白是中和抗原,在自然感染的情况下,可使机体产生中和抗体。VP6蛋白为群抗原,有较高的抗原性,可产生非中和的IgA抗体。VP7蛋白是中和抗原,也是一种糖蛋白,免疫后使机体产生中和抗体,是现今研究猪轮状病毒基因工程苗首选基因。基因疫苗与其它疫苗比,其可同时使机体产生体液免疫应答和细胞免疫应答,并且与亚单位疫苗同样安全,与弱毒苗一样有效,制备简单,易于保存,进入机体后免疫反应性良好,因此受到高度重视。
类干酪乳杆菌(Lactobacillus paracasei,L.paracasei)是肠道益生菌,具有激活淋巴细胞、刺激抗体产生等与获得性免疫相关的功能,保护肠道微生物菌群的平衡,是食品级微生物。以其作为黏膜疫苗递送载体可以表达同源和异源蛋白质,能够诱发局部黏膜免疫和全身的体液免疫,还起到黏膜佐剂的作用,例如重组菌株表达的酶无需经过纯化即可应用于饲料添加剂。类干酪乳杆菌主要通过黏膜途径进入机体,因此,以类干酪乳杆菌作为抗原递送载体研发黏膜疫苗对该病的防控具有十分重要的意义。
技术实现要素:
本发明的第一目的是提供一种表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌,解决轮状病毒通过黏膜感染动物,防控困难大的问题。
本发明的第二目的是提供上述表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌的构建方法。
本发明的第三目的是提供上述表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌的应用。
本发明的第四目的是提供上述表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌的给药方式。
本发明通过以下技术方案来实现:
一、一种表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌,是在类干酪乳杆菌的基因组中插入猪轮状病毒VP7蛋白的基因序列。
进一步的,猪轮状病毒VP7蛋白的基因序列如SEQ ID No.1所示。
二、一种根据上述的表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌的构建方法,该方法包括以下步骤:
(1)猪轮状病毒VP7蛋白的基因片段的扩增;
(2)目的片段构建入穿梭质粒PLA,转化大肠杆菌,筛选得阳性重组质粒pLA-VP7;
(3)阳性重组质粒pLA-VP7转化类干酪乳杆菌,筛选得筛选阳性重组类干酪乳杆菌pLA-VP7/L.paracasei。
进一步的,步骤(1)中扩增所用引物序列为:
Forward:5'-ACGCGTCGACGGCTTTAAAAGAGAGAATTT–3(SEQ ID No.2)
Reverse:5'-CCCAAGCTTGGTCACATCATACAACTCTAATC–3(SEQ ID No.3)。
三、上述的表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌在抗猪轮状病毒中的应用。
四、上述的表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌的给药方式为黏膜给药。
进一步的,所述的黏膜给药为口服。
采用上述技术方案的积极效果:本发明通过获取猪轮状病毒VP7全长基因序列,构建重组类干酪乳杆菌,选择口服方式免疫小鼠与仔猪,并对该重组菌的免疫效果进行评价,结果表现为增强了抗原表位的免疫效果,为制备口服轮状病毒基因工程乳酸菌的研究提供可行性依据;本发明利用了类干酪乳杆菌本身可以使机体产生相应的免疫反应的功能,通过类干酪乳杆菌作为表达载体携带外源蛋白VP7进入机体,对于以黏膜免疫为主的猪轮状病毒感染可以产生更为理想的黏膜免疫效果。
附图说明
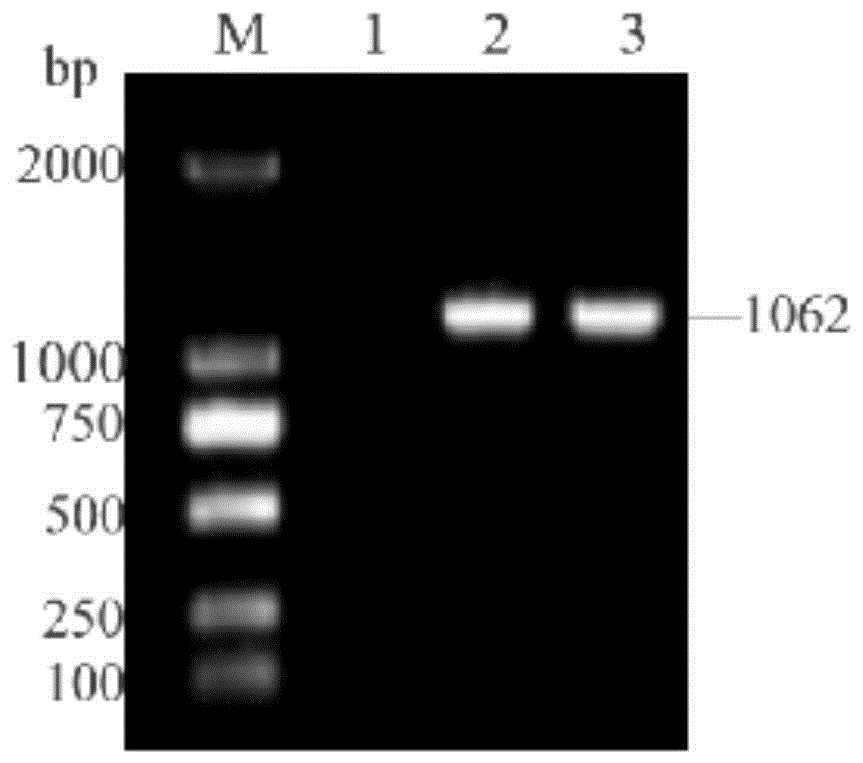
图1是VP7基因的PCR结果,图中,M:A:M.DL 2000DNA marker;1.阴性对照;2、3.VP7的PCR产物1062bp;
图2.重组质粒pLA-VP7/E.coli的双酶切鉴定,图中,M.DL 10000DNA maker;1.重组质粒pLA-VP7;2.重组质粒pLA-VP7双酶切产物,两条带分别在1062bp和6391bp左右;
图3.pLA-VP7/E.coli的SDS-PAGE分析,图中,M:蛋白Maker;1是10h的pLA空菌;2~6分别取pLA-VP7在2h、4h、6h、8h、10h的样品,图中重组蛋白的大小约为82kDa;
图4.pLA-VP7/E.coli的Western blot鉴定结果,图中,M:蛋白Marker;1.pLA/E.coli;2.pLA-VP7/E.coli;
图5.pLA-VP7/L.paracasei间接免疫荧光检测结果,图中,A为含重组质粒pLA-VP7的明视野下的菌体形态;B为重组质粒pLA-VP7的暗视野下菌体产生的荧光;C为pLA/L.paracasei空质粒的明视野;D为pLA/L.paracasei的暗视野,没有绿色荧光;
图6是pLA-VP7/L.paracasei流式细胞术检测结果;
图7是重组菌pLA-VP7/L.paracasei灌胃小鼠血清中IgG的抗体水平;
图8是重组菌pLA-VP7/L.paracasei灌胃小鼠粪便中sIgA的抗体水平;
图9是重组菌pLA-VP7/L.paracasei免疫仔猪粪便中sIgA水平。
具体实施方式
本发明中生物材料的来源:
1、猪轮状病毒BNCC124944购自北纳创联生物科技有限公司;
2、载体pMD18-T购自宝生物工程(大连)有限公司;
3、载体pLA;乳酸菌表面表达PEDV S1蛋白的研究,余丽芸、赵志刚、侯喜林、曹宏伟、王桂华,黑龙江八一农垦大学学报,2008年8月,第20卷,第4期,45-47,并由申请人保证从本申请日起二十年内向公众发放该生物材料;
4、类干酪乳杆菌CICC 6105购自中国工程微生物保藏中心。
下面结合实施例和试验例对本发明的技术方案做进一步的说明,但不应理解为对本发明的限制:
实施例1
本实施例说明重组类干酪乳杆菌的构建。
一、目的基因的获取。
根据GeneBank中发表的PoRV VP7全基因序列,登录号为GenBank:AB180971.1,利用DNA Man设计出一对特异性引物,分别在上下游引物的5’端引入SalⅠ和HindⅢ的酶切位点和保护性碱基(表1,下划线标记酶切位点)。以猪轮状病毒BNCC124944的cDNA为模板,PCR扩增得目的片段。PCR反应条件:95℃预变性5min;(94℃1min,58℃退火1min,72℃2min,)共30个循环;72℃终延伸10min。PCR产物用0.9%的琼脂糖凝胶分析。扩增出PoRV VP7全长约1062bp(图1)。
表1 PCR引物序列
二、重组大肠杆菌pLA-VP7/E.coli的构建与鉴定
采用琼脂糖凝胶DNA回收试剂盒对上述PCR产物进行回收并将其连接至pMD18-T上,转化入DH5α感受态细胞,涂布于含有氨苄青霉素的LB固体培养基中,37℃培养,次日挑取单菌落,进行PCR初步鉴定、双酶切鉴定阳性重组质粒。将鉴定正确的目的片段与pLA穿梭质粒连接转化至BL21感受态细胞中,经PCR挑选阳性重组质粒pLA-VP7。提取阳性重组质粒pLA-VP7,用SalⅠ和HindⅢ对重组质粒pLA-VP7进行双酶切鉴定,结果可见两条条带,一条为pLA载体片段大小约为6391bp,另一条为目的蛋白片段,大小约为1062bp,与预计值相符(见图2)。
三、重组干酪乳杆菌pLA-VP7/L.paracasei的构建
将获得的阳性重组质粒pLA-VP7电转化至类干酪乳杆菌感受态细胞中,涂布于含有氯霉素的MRS固体培养基中,次日挑取单菌落37℃厌氧培养12h,提取重组质粒进行PCR鉴定,筛选阳性重组类干酪乳杆菌pLA-VP7/L.paracasei。
实施例2
本实施例说明pLA-VP7/E.coli表达情况鉴定。
一、SDS-PAGE检测
鉴定正确的阳性重组乳酸菌pLA-VP7与pLA空菌的菌液扩大培养,取2h,4h,6h,8h,10h的重组乳酸菌液和10h的pLA/E.coli菌液,超声破碎,进行SDS-PAGE,结果可见,表达的重组VP7蛋白的相对分子质量约为82kDa(图3),与预计值一致。
二、Western blot鉴定
分别将表达6h的重组菌pLA-VP7/E.coli与pLA/E.coli的蛋白样品进行SDS-PAGE,将凝胶中的蛋白质转印至PVDF膜上,膜经5%脱脂乳封闭2h,弃去脱脂乳,PBST清洗三遍,将膜上的脱脂乳洗净后弃去PBST,用1:100稀释的猪源抗PoRV血清为一抗,4℃过夜或37℃孵育1h后回收一抗,PBST清洗三遍,每次15min,在膜上加入1:5000稀释的HRP标记的兔抗猪IgG抗体,室温下用水平摇床震荡孵育50min后回收二抗,用PBST洗三次,每次15min,加入DAB溶液,显色2-10min后观察结果。结果可见在82kDa处有明显的条带,而对照组没有,与预估值一致(图4)。
实施例3
本实施例说明pLA-VP7/L.paracasei表达情况鉴定。
一、间接免疫荧光鉴定
吸取表达6h的重组菌pLA-VP7/L.paracasei与pLA/L.paracasei 300μL,5000r/min,离心5min,弃上清留下菌体,用1mL PBS重悬菌体,离心5min,弃上清,此步骤重复3次。后用PBS溶液稀释菌体,取出事先经75%乙醇浸泡的载玻片自然干燥后,向载玻片上滴加10μL的稀释样品(视菌数决定),室温静置待样品风干,将载玻片放入冰冷的无水乙醇中浸泡30min使菌体固定,用无菌水缓慢洗去载玻片上的无水乙醇,后放入5%的脱脂乳中过夜封闭;第二天取出载玻片,用PBST溶液缓慢冲洗玻片4次,每次10min,加入1:100稀释的猪源抗PoRV的血清至载玻片菌体上,置于湿盒中,4℃放置6~8h,取出载玻片用PBST溶液缓慢冲洗玻片4次,每次10min,加入1:5000稀释的FITC标记的兔抗猪二抗,置于湿盒中,4℃避光过夜;第二天取出载玻片,用PBST溶液缓慢冲洗玻片4次,每次10min,再用去离子水缓慢冲洗一遍,加入甘油封片,放在荧光显微镜下镜检,观察结果。结果显示(图5)暗视野下的重组菌pLA-VP7/L.paracasei可见绿色荧光,明视野下可见与暗视野下的细菌形态一致;暗视野下空菌pLA/L.paracasei未见到绿色荧光,明视野下可见清晰的细菌形态,由此表明重组菌表达了VP7蛋白。
二、流式细胞术鉴定
吸取重组菌pLA-VP7/L.paracasei与pLA/L.paracasei 6h的菌液各1mL,然后用灭菌的300目筛子分别将两种菌液过滤,配平放入离心机中,6000r/min,5min后弃上清,用适量的PBS溶液重悬菌体,6000r/min,5min后弃上清,此步骤重复三次后,用PBS溶液稀释细菌至细菌数为5×106cfu/mL,往菌体中加入1:100稀释的猪源PoRV抗血清,4℃感作5h,6000r/min离心5min,弃去上清,用PBS溶液洗涤菌体三次,往菌体中加入1:1000稀释的FITC标记的兔抗猪IgG,4℃避光反应6h后,6000r/min离心5min,弃去上清,用PBS溶液吹洗菌体三次,后用PBS溶液重悬菌体,流式细胞仪检测。结果证明pLA-VP7/L.paracasei与对照组pLA/L.paracasei相比发生明显的偏移,其绿色荧光的强度明显高于对照组(图6),这表明重组蛋白VP7在干酪乳酸菌表面得到表达。
实施例4
本试验例说明重组菌pLA-VP7/L.paracasei激发动物免疫的效果。
一、制备免疫用的重组干酪乳杆菌
取冻存的重组菌pLA-VP7/L.paracasei与pLA/L.paracasei,划线于含氯霉素的MRS固体培养基中,37℃倒置培养过夜,次日挑取两固体培养基中的单菌落接种于含氯霉素的5mL MRS液体试管中,37℃培养过夜,次日,将生长好的菌液按2%接种于100mL含有氯霉素的MRS液体培养基中进行表达。10-12h后取出表达菌,4℃,7000r/min,10min后留下沉淀,用PBS溶液吹洗沉淀三次后,细菌计数,将重组菌浓度控制到5×109CFU/mL。
二、实验动物进行分组免疫
(1)将36只体重约16~18g,6~8周龄的SPF BALB/c小鼠随机分为A、B、C、D四组,每组9只,分别将重组菌pLA-VP7/L.paracasei,pLA/L.paracasei,干酪乳酸杆菌和灭菌的PBS溶液灌胃给小鼠,每天灌胃的菌液浓度控制在5×109CFU/mL。一免连续5天;二免在一免后2周,连续3天;三免在二免后3周,连续3天。
(2)将安徽省阜阳市临泉县众鑫牧场200头初生仔猪,100头不投喂重组菌的仔猪为对照组,100头投喂重组菌pLA-VP7/L.paracasei的仔猪为实验组,每次投喂的菌液量控制在2×1012CFU/mL,1天投喂两次,连续一周,观察猪只状况,试验周期为30d。
三、小鼠血清中的IgG检测
小鼠血清的采集:通过小鼠断尾采血的技术,分别采集投喂了重组菌pLA-VP7/L.paracasei组和三组对照组(pLA/L.paracasei、L.paracasei、PBS组)14d,28d,42d,56d和70d的小鼠血液,将收集的血液,放入37℃恒温箱中静置1h,取出待检血液放于冰箱中4℃过夜,第二日小心取出待检血液,放入离心机中,3800r/min,15min,小心吸取血清,并标记清楚放于-20℃保存备用。
取准备好的血清,运用间接ELISA技术对四组实验小鼠血清中IgG抗体进行检测,发现在免疫14d时,免疫重组乳酸菌的组抗体水平高于另三组对照组,免疫28d时,免疫重组乳酸菌的实验组IgG抗体水平上升趋势十分显著,此后抗体水平持续增长,一直检测到免疫后第70d,如图7所示。
四、小鼠粪便中的sIgA检测
小鼠粪便的收集:分别在14d,28d,42d,56d和70d分别收集免疫小鼠重组菌pLA-VP7/L.paracasei和三组对照组(pLA/L.paracasei、L.paracasei、PBS组)的粪便100mg/只,在粪便中加入1mL PBS溶液,4℃静置35min,后放在旋涡振荡器上充分混匀,12000r/min,离心30min,小心吸取上清液,并做好相应标记,置于-20℃保存备用。
取包被表达纯化的VP7蛋白的96孔板,用PBST洗涤三次,每次五分钟,并拍干孔内液体;每孔加200μL的5%脱脂乳封闭液,37℃封闭2h,用PBST洗涤三次,每次五分钟,并拍干孔内液体;每孔加入100μL处理好的粪便样品,37℃孵育1h,用PBST洗涤三次,每次五分钟,并拍干孔内液体;加用PBS溶液1:8000稀释的HRP标记的羊抗鼠IgA,100μL/孔,37℃孵育1h,用PBST洗涤三次,每次五分钟,并拍干孔内液体;加入新鲜配制的TMB-H2O2底物显色液,100μL/孔,室温避光10min;在显色液孔中加入50μL2M的硫酸终止反应;在酶标仪中检测OD450nm值。
取处理的粪便上清液,运用间接ELISA技术检测这四组实验动物的粪便中sIgA抗体水平,结果发现在免疫14d时,投喂重组菌pLA-VP7/L.paracasei的实验组,其sIgA抗体明显高于另外三组对照组,并且P/N值>2.0,在免疫28d时重组菌pLA-VP7/L.paracasei实验组,其sIgA抗体水平增长趋势十分明显,后抗体水平增长有所缓慢,在免疫42d后抗体水平又提高了,直至检测到免疫后第70d,如图8所示。
五、仔猪粪便中sIgA抗体的检测
仔猪粪便的收集:分别于免疫7d,14d,21d,28d,35d,分别收集当天灌服pLA-VP7/L.paracasei和对照组(pLA/L.paracasei、L.paracasei组)猪只的新鲜粪便,用适量的PBS处理,将混匀的粪便离心,获取待检的上清样品,检测粪便中特异性sIgA的水平。
将处理好的不同时间段的粪便上清液,通过间接ELISA方法检测两组试验猪粪便中sIgA的抗体水平,结果在猪免疫重组菌pLA-VP7/L.paracasei后的第14d,检测到其sIgA的抗体值明显高于对照组,其P/N值>2.0,证明重组菌刺激动物机体产生了相应的黏膜免疫,并且抗体水平增长趋势明显,免疫21d后抗体水平增长速度有所变缓,直至检测到免疫后第35d,抗体水平仍然较高,如图9所示。
实施例5
本试验例说明重组菌pLA-VP7/L.paracasei对实验动物的攻毒保护性效果。
一、PoRV的TCID50效价的测定
将长好的MA104细胞,用胰酶消化后,将细胞悬液按每孔50μL接种到96孔细胞板中培养,待细胞长好后,按两列为一组,进行分组实验,选一组作对照,其余组进行接毒,将经胰蛋白酶处理好的PoRV的病毒原液,用PBS按10-1,10-2,10-3,10-4,10-5,10-6稀释,每孔50μL病毒悬液,每个稀释度做16个重复,24h后观察出现CPE细胞孔的个数,分别记录每组实验中CPE细胞孔和未出现CPE的细胞孔数。然后利用Karber法计算每0.1mLPoRV的TCID50效价。结果发现原病毒液稀释10-1和10-2时,病变孔100%,病毒液稀释至10-3时,病变孔占75%,稀释至10-4病变孔占43.75%,病毒液稀释至10-5时,病变孔占6.25%,当病变稀释至10-6时未出现病变孔,如表2所示。根据Karber法测得每0.1mL病毒TCID50效价是10-3.75。
表2 TCID50效价的测定结果
二、免疫小鼠的攻毒试验
将灌胃重组菌pLA-VP7/L.paracasei与另三组对照组(,pLA/L.paracasei组,干酪乳酸杆菌组和PBS组),免疫程序:共免疫3次,初免与二免间隔为1周,二免与三免间隔为2周,每次连续免疫5d。在免疫后70d,对这四组实验动物用10倍的病毒TCID50进行攻毒实验,每只动物灌服1mL的病毒液,攻毒后连续一周观察并记录实验动物的身体状况。结果发现免疫重组菌pLA-VP7/L.paracasei的小鼠组,并未出现腹泻、被毛粗糙、食欲不振和精神萎靡等临床症状,而三组对照(分别是pLA/L.paracasei、L.paracasei和PBS组)从第三天起,开始陆续出现显著的PoRV感染的临床特征,如发生腹泻,精神沉郁,抱团蜷缩,被毛紊乱,甚至有些小鼠出现水样便等较重的症状。攻毒后pLA/L.paracasei组有6只动物先后出现腹泻症状,L.paracasei有7只小鼠出现腹泻现象,PBS有9只小鼠出现腹泻现象,如表3所示。
表3免疫小鼠攻毒保护性实验结果
实施例6
本试验例说明重组菌pLA-VP7/L.paracasei本体动物田间试验
一、重组菌pLA-VP7/L.paracasei本体动物田间试验
选取轮状病毒感染严重的猪场,饲喂初生仔猪pLA-VP7/L.paracasei,观察饲喂重组菌pLA-VP7/L.paracasei的仔猪与不饲喂对照组的仔猪腹泻率、死亡情况并做好相关记录。由表4结果可见,仔猪在免疫重组乳酸菌后,其腹泻头数只有2头,而未免疫重组乳酸菌的对照组腹泻头数达27头,远远高于免疫组,免疫组的腹泻率仅占2.02%。对照组腹泻率占27.55%,比免疫组高25.53%,采集腹泻仔猪粪便,利用轮状病毒抗原检测试剂盒检测是否为轮状病毒感染造成的腹泻,发现腹泻均为病毒感染所致。由此可见重组菌pLA-VP7/L.paracasei可以抵抗猪轮状病毒的感染。异常情况和病毒感染无关。
表4重组菌pLA-VP7/L.paracasei预防仔猪腹泻的田间试验结果
本发明通过获取猪轮状病毒VP7蛋白的全长基因,构建重组类干酪乳杆菌,选择口服方式免疫小鼠与仔猪,并对该重组菌的免疫效果进行评价,结果表现为增强了抗原表位的免疫效果,为制备口服轮状病毒基因工程乳酸菌的研究提供可行性依据;本发明利用了类干酪乳杆菌本身可以使机体产生相应的免疫反应的功能,通过类干酪乳杆菌作为表达载体携带外源蛋白VP7进入机体,对于以黏膜免疫为主的猪轮状病毒感染可以产生更为理想的黏膜免疫效果。
序列表
<110> 黑龙江八一农垦大学
<120> 一种表面展示猪轮状病毒VP7蛋白的重组类干酪乳杆菌的构建及其应用
<130> B011
<141> 2019-04-11
<160> 3
<170> SIPOSequenceListing 1.0
<210> 4
<211> 1061
<212> DNA
<213> 猪轮状病毒(Porcine rotavirus)
<400> 4
ggctttaaaa gagagaattt ccgtctggct agcggttagc tccttttaat gtatggtatt 60
gaatatacca cagttctaac ctttctgata tcaatagttt tattgaacta tatattaaaa 120
tcactaacta gtgcgatgga ctttataatt tatagattcc ttttacttat tgttattgta 180
tcaccatttg ttaaaacaca aaattatgga attaatttac caatcactgg ctccatggat 240
acagcatatg ccaattcatc acagcaagag acattcttaa cttcaacgtt atgcttatat 300
taccctactg aagcatcaac tcaaattgga gataccgaat ggaagaatac tctgtctcaa 360
ttattcttga ctaaggggtg gccaactgga tcagtctatt ttaaagaata taccgatatc 420
gcttcattct caattgaccc acaactttat tgtgattata atgttgtact gatgaagtat 480
gattcaacgt tagagctaga tatgtctgaa ttggctgatt tgattctaaa tgaatggcta 540
tgtaacccaa tggatataac attgtattat tatcagcaaa cagatgaagc gaataaatgg 600
atatcgatgg gacaatcttg taccataaaa gtgtgcccat taaatacaca gactttagga 660
ataggttgta ttactacaaa taaagcgaca tttgaagaag tggctacaaa tgagaaatta 720
gcaataactg atgttgttga tggtgtaaac cataaacttg atgtgactac aaatacctgt 780
acaattagaa attgtaagaa gttgggacca agagaaaatg tagcgattat acaagttggt 840
ggctcagaag tgctagatgt tacagcggat ccaactactg caccacaaac tgaacgtatg 900
atgcgagtaa attggaagaa atggtggcaa gttttctata cagtagtaga ttatattaat 960
cagattgtac aagttatgtc caaaagatca cgatcattaa attcagcagc tttttattat 1020
agagtctgat atatcttaga ttagaattgt atgatgtgac c 1061
<210> 4
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
acgcgtcgac ggctttaaaa gagagaattt 30
<210> 3
<211> 32
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
cccaagcttg gtcacatcat acaattctaa tc 32
- 还没有人留言评论。精彩留言会获得点赞!