紫色红曲菌mokH基因过表达菌株的构建方法与流程
本发明涉及一种紫色红曲菌mokh基因过表达菌株的构建方法,属于生物基因工程领域。
背景技术:
红曲菌又称“红曲霉”,在真菌分类学上属于真菌门,子囊菌亚门,不整子囊菌纲,红曲菌科,红曲霉属。红曲菌可以产生多种次级代谢产物,如红曲色素、monacolink、γ-氨基丁酸和桔霉素等,其中许多代谢产物被广泛的应用于食品色素、医药、酿酒等方面,monacolink又称“洛伐他汀”,是红曲菌产生的一种具有生理活性的聚酮类物质。研究发现,monacolink具有抑制胆固醇合成中关键酶hmg-coa活性的作用,能够有效的抑制胆固醇合成,因此,monacolink被国内外视为降胆固醇的理想药
由于对红曲菌中次级代谢产物monacolink生物合成途径的研究起步较晚,所以很多细节尚未清楚。但由于与土曲霉中monacolink的结构相似,因此根据土曲霉中monacolink的生物合成途径来推测红曲菌中monacolink的生物合成途径。经过研究初步推测,红曲菌中monacolink的生物合成基因簇中有9个功能域与土曲霉中monacolink生物合成酶基因高度同源,即moka-moki。基因过表达技术是分子生物学中十分重要的一项技术,主要是通过将完整的强启动子与目的基因融合,使目的基因能在宿主中进行表达,从而构建过表达载体,通过转化受体菌,获得该目的基因产物大量积累的菌株。曾有相关实验对红曲霉cg-6中的moke基因进行过表达,最后发现moke的过表达对红曲霉的菌体生长、孢子形态及生殖方式均有影响。而对于mokh基因在紫色红曲菌中的调节机制,目前未有研究,通过比较,发现mokh基因与love基因、mlcr基因具有同源性,因此推测mokh基因在monacolink合成过程中起到转录因子的作用,调控特异性途径上的基因,其表达量可能会直接影响其余8段基因的表达,从而影响monacolink的合成。
技术实现要素:
本发明所要解决的技术问题是提供一种紫色红曲菌mokh基因过表达菌株的构建方法。
为解决上述技术问题,本发明采用的技术方案是:
1)设计了一对引物mokh-f和mokh-r,具体如下:
mokh-f:5’-gctctagaatggccctatcgccagt-3’(xbai);
mokh-r:5’-cccaagcttttaggaggccaggttgtgtt-3’(hindiii);
2)通过pcr扩增紫色红曲菌基因组中的mokh基因;
3)将扩增得到的mokh基因连接到pbc-hygro原核表达载体上,构建pbc-hygro-mokh高表达质粒;
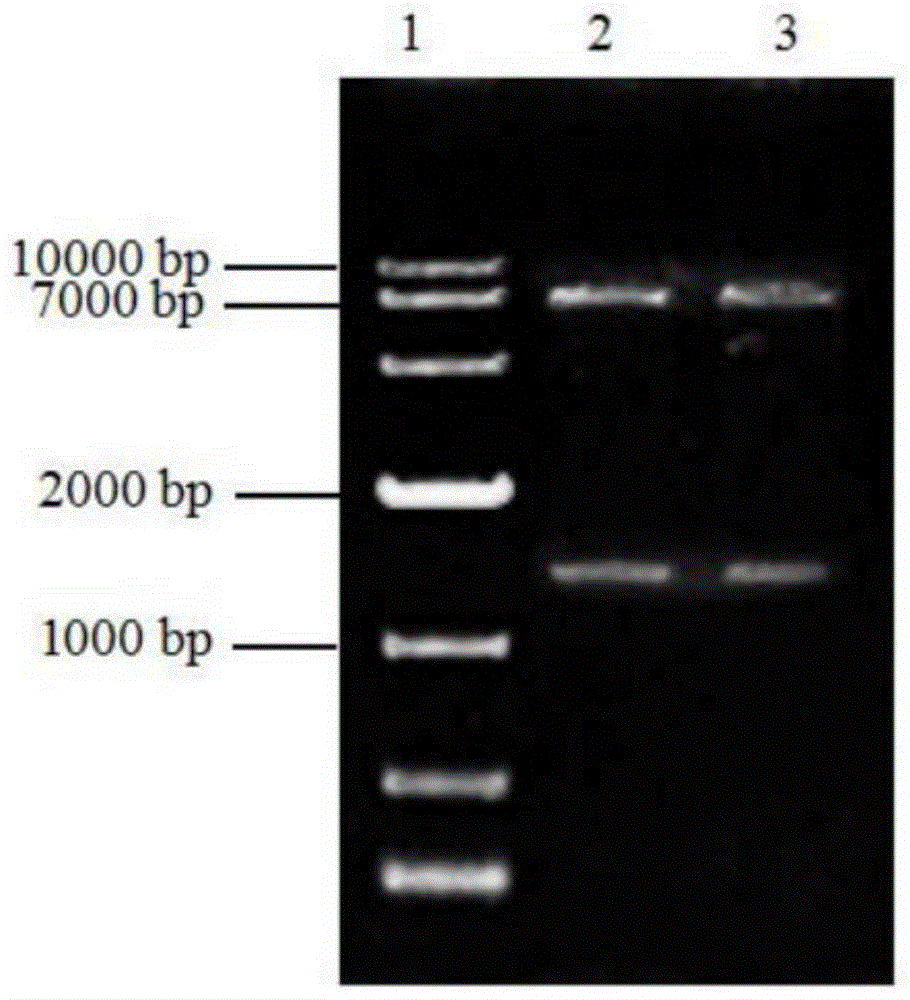
构建重组质粒后,通过琼脂糖凝胶电泳得到的片段条带大小对重组质粒进行初步验证,再用quickcutclaⅰ和xbaⅰ进行双酶切验证,经过双酶切后得到大小在6800bp左右和1400bp左右的两段目的片段,与预期大小一致,证明过表达质粒构建成功。
4)制备红曲菌原生质体
(1)将红曲菌m1接种于试管斜面培养基,30℃培养7-10d。
(2)加0.9%无菌生理盐水用接种环轻轻刮菌体表面,释放并收集孢子,制备成均一浓度的孢子悬液(1×108-1×109个/ml)。
(3)取200μl均一孢子悬液涂布于铺有玻璃纸的pda固体培养基上,30℃培养36-40h。
(4)用涂布棒刮取玻璃纸上的菌丝体并收集到500目尼龙布上,用0.6mmgso4溶液洗1-2次。
(5)取约0.3g菌丝体于100ml三角瓶中,并加入30ml裂解酶液,于30℃,60r/min酶解2.5h,然后用500目尼龙布过滤。
(6)滤液于4℃,7000r/min离心5min,弃上清。
(7)将收集的原生质体沉淀用1.2mol/l预冷的山梨醇溶液洗涤2次,然后将其分成2份。一份用预冷的1.2mol/l山梨醇溶液重悬后,于-80℃保存。另一份则用1.2mol/l山梨醇溶液重悬后置于冰上备用。
5)通过电击转化的方法将过表达质粒导入到红曲菌原生质体中,得到mokh过表达菌株。
本发明的有益效果:
本发明成功的克隆出了紫色红曲菌中的调控基因mokh,将得到的mokh基因在紫色红曲菌中进行过表达,从而探究mokh基因在紫色红曲菌中的功能。
通过hplc检测和潮霉素基因组的扩增,筛选出mokh基因过表达的目的工程菌株。对筛选出的工程菌株次级代谢产物、菌丝体形态及基因表达量进行检测,从而探究mokh基因在紫色红曲菌m1中对代谢、生长及基因表达的作用。
附图说明:
图1是pbc-hygro-mokh重组质粒双酶切琼脂糖凝胶电泳图,泳道1:dl10000dnamarker;泳道2,3:pbc-hygro-mokh+quickcutclaⅰ+xbaⅰ。
图2a红曲菌m1菌株对潮霉素b的耐受浓度,图2b是导入质粒菌株的筛选结果,图中,第一行:m1菌株;第二行;加入质粒的m1菌株。
图3是rna琼脂糖凝胶电泳图,泳道1:dl2000dnamarker;泳道2:过表达h7菌株转录组;泳道3:紫色红曲菌m1转录组。
图4是h7菌株潮霉素转录组的pcr电泳图,泳道1:dl2000dnamarker;泳道2,3:h7菌株;泳道4:m1菌株。
图5是三种菌株monacolink产量检测。每组比较中,从左到右以此是m1菌株、过表达菌株和敲除菌株。
图6是三种菌株色素产量检测,a:红曲红色素;b:红曲橙色素;c:红曲黄色素。每组比较中,从左到右以此是m1菌株、过表达菌株和敲除菌株。
图7是mokh基因过表达菌株h7与普通m1菌株在不同倍率下扫描电镜图,a:m1菌株5000×;b:h7菌株5000×;c:m1菌株10000×;d:h7菌株10000×。1:凹陷;2:褶皱。
具体实施方式:
实施例1
本实施例提供一种紫色红曲菌mokh基因过表达菌株的构建方法,包括下列步骤:
1)设计了一对引物mokh-f和mokh-r,具体如下:
mokh-f:5’-gctctagaatggccctatcgccagt-3’(xbai)。
mokh-r:5’-cccaagcttttaggaggccaggttgtgtt-3’(hindiii)。
2)通过pcr扩增紫色红曲菌基因组中的mokh基因;
3)将扩增得到的mokh基因连接到pbc-hygro原核表达载体上,构建pbc-hygro-mokh高表达质粒;
构建重组质粒后,通过琼脂糖凝胶电泳得到的片段条带大小对重组质粒进行初步验证,再用quickcutclaⅰ和xbaⅰ进行双酶切验证,经过双酶切后得到大小在6800bp左右和1400bp左右的两段目的片段,与预期大小一致,证明过表达质粒构建成功。
4)制备红曲菌原生质体,并通过电击转化的方法将过表达质粒导入到红曲菌原生质体中,得到mokh过表达菌株。
实施例2质粒验证
一、重组质粒的验证
构建重组质粒后,通过琼脂糖凝胶电泳得到的片段条带大小对重组质粒进行初步验证,再用quickcutclaⅰ和xbaⅰ进行双酶切验证。结果如图1所示,经过双酶切后得到大小在6800bp左右和1400bp左右的两段目的片段,与预期大小一致,证明过表达质粒构建成功。
二、重组质粒的导入及转化子的筛选
制备红曲菌原生质体,并通过电击转化的方法将过表达质粒导入到红曲菌原生质体中,再结合潮霉素b浓度筛选浓度结果,筛选导入过表达质粒的转化子。结果如图2a所示,从图中看出,随着潮霉素b浓度的增加,加入质粒和未加入质粒的红曲菌m1菌株的菌落数都逐渐减少;当潮霉素b浓度为10μg/ml时,加入质粒的红曲菌m1菌株的菌落数明显多于未加入质粒红曲菌m1菌株;当潮霉素b浓度为15μg/ml时,加入质粒的红曲菌m1菌株有菌落生长,而未加入质粒的红曲菌m1菌株则无菌落生长。因此,挑取潮霉素b浓度为15μg/ml抗性板上的菌落,从而成功获得具有潮霉素b抗性的转化子。
通过电击转化的方法将过表达质粒导入到红曲菌原生质体中,再结合潮霉素b浓度筛选浓度结果,筛选导入过表达质粒的转化子。结果如图2b所示,从图中看出,随着潮霉素b浓度的增加,加入质粒和未加入质粒的红曲菌m1菌株的菌落数都逐渐减少;当潮霉素b浓度为10μg/ml时,加入质粒的红曲菌m1菌株的菌落数明显多于未加入质粒的红曲菌m1菌株;当潮霉素b浓度为15μg/ml时,加入质粒的红曲菌m1菌株有菌落生长,而未加入质粒的红曲菌m1菌株则无菌落生长。因此,挑取潮霉素b浓度为15μg/ml抗性板上的菌落,从而成功获得具有潮霉素b抗性的转化子。将获得的转化子在具有潮霉素b抗性的平板上传5代,再进行发酵培养,对其monacolink的产量以及潮霉素b基因组进行测定,以筛选出阳性转化子。
实施例3过表达菌株的验证
一、rna质量验证
将m1菌株在发酵培养基中培养12天后,对菌株中的rna进行提取,通过琼脂糖凝胶电泳检测提取的rna质量,电泳结果如图3所示,有清晰的条带出现,且28s条带的亮度是18s的2倍,说明rna提取成功,且未降解。然后检测rna的od260/280比值、浓度,rna的浓度在300-500ng/μl之间,od260/280比值在1.8-2.1之间,说明rna提取成功,且未被污染。综上结果,该rna可以作为反转录扩增的模板,并进行后续实验。
二、过表达菌株h7潮霉素基因的pcr验证
通过hplc初步筛选出高产monacolink的转化子红曲菌株h7后,对h7菌株进行潮霉素基因的pcr验证。分别提取红曲菌m1菌株和h7菌株的rna,再将其反转录成cdna。以cdna为模板,hygro-f和hygro-r为引物进行扩增潮霉素基因。结果如图4所示,对照菌株红曲菌m1菌株未能扩增出明显条带,而h7菌株能扩增出明显条带,说明h7菌株中成功的导入了过表达质粒,因此说明,mokh过表达菌株构建成功。
三、monacolink产量检测
将过表达菌株h7、红曲菌m1菌株及mokh基因缺失菌株一起进行摇瓶发酵培养,通过hplc分别检测两种菌株不同阶段monacolink产量,以观测mokh基因对monacolink产量的影响。结果如图5所示。由图可知,第15d时,过表达菌株与m1菌株相比monacolink产量提高了0.82倍,达到了243.84mg/l,敲除菌株产量为84.42mg/l,降低了0.37倍。由此推测,mokh基因对紫色红曲菌monacolink的合成起正调控作用。
四、红曲色素产量检测
通过紫外分光光度计分别检测2,5,8,12,15d的h7菌株、m1菌株及mokh基因缺失菌株的红曲红色素、红曲橙色素和红曲黄色素。结果如图6a-c所示,由图得三种色素的产量变化总体呈现一致性,均是过表达菌株的三种色价低于普通的m1菌株和敲除菌株;敲除菌株的色价略高m1菌株。结合monacolink产量检测结果及文献报道推测:由于合成monacolink和红曲色素的前体物质均为乙酰辅酶a,所以两支路存在竞争关系,因此当monacolink产量增多时,红曲色素的产量会在一定程度上减少;反之,当monacolink产量降低时,红曲色素的产量会相应提高。所以,mokh基因过表达菌株的色素产量最低;mokh基因缺失菌株的色素产量最高。
五、过表达菌株h7微观菌体形态的检测
通过扫描电镜检测h7菌株和m1菌株菌丝体的形态差异,结果如图7所示,对比图a和图b可知,h7菌株的菌丝体与m1菌株相比更为饱满;对比图c和图d可知,h7菌株的菌丝体凹陷程度及褶皱明显多于m1菌株。由此推测,mokh基因的过表达可能会刺激胞内物质分泌到胞外,从而使红曲菌菌丝体的形态发生改变。
序列表
<110>北京工商大学
<120>紫色红曲菌mokh基因过表达菌株的构建方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>1
gctctagaatggccctatcgccagt25
<210>2
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>2
cccaagcttttaggaggccaggttgtgtt29
- 还没有人留言评论。精彩留言会获得点赞!