一种Amylin亲和多肽及其应用的制作方法
本发明涉及生物医药和生物材料领域,更具体地讲,涉及一种amylin亲和多肽及其应用。
背景技术:
amylin,也被称为人胰淀素,它是由37个氨基酸组成的多肽,序列为kcntatcatqrlanflvhssnnfgailsstnvgsnty(seqidno:5),其分子量为3906.33g/mol,整体带有正电荷。其c-末端具有酰氨基,第二位和第七位的半胱氨酸形成分子内二硫键,这两个特征对于amylin生物学功能的完整性具有重要意义。但是研究表明部分错误折叠的amylin自身会具有聚集形成淀粉样蛋白纤维的倾向,并且这些聚集形成的淀粉样蛋白纤维会沉积在胰岛β细胞内。
噬菌体展示技术是将编码目的蛋白或多肽的外源dna片段与噬菌体表面蛋白的编码基因融合后,以融合蛋白的形式呈现在噬菌体的表面,被展示的蛋白或多肽可保持相对的空间结构和生物活性并展示在噬菌体的表面。导入了各种各样外源基因的噬菌体则能构成一个噬菌体展示库。当用目的蛋白或多肽去筛查噬菌体展示库时,就会选择性地同与其有相互作用的外源多肽相结合,然后分离出噬菌体展示库里的特定噬菌体,对特定噬菌体进行基因组测序,从而推知目的蛋白或者多肽的氨基酸序列组成。
近些年的研究表明,ⅱ型糖尿病的发生与人胰岛内淀粉样蛋白纤维的沉积之间有着很密切的关系。临床病理发现,90%的ⅱ型糖尿病患者的胰岛内都存在淀粉样蛋白纤维的沉积。目前主流观点认为,胰岛淀粉样蛋白纤维的沉积使胰岛β细胞死亡,从而引发二型糖尿病。而研究表明,胰岛淀粉样蛋白纤维的形成遵从动力学成核理论,即作为胰岛淀粉样蛋白单体的amylin首先形成寡聚体核,再继续吸引外部amylin分子进一步聚合,最终形成人胰岛淀粉样蛋白纤维沉积,这些沉积会逐渐取代胰岛内正常细胞,从而损害胰岛功能,导致ⅱ型糖尿病的发生。因而,开发新的amylin的聚集抑制剂以阻止amylin的聚集成为治疗ⅱ型糖尿病的研究热点。虽然目前关于amylin抑制剂的开发门类繁多,但仍然缺乏亲和性强且特异性高的抑制剂。因此本发明通过噬菌体展示库与生物淘选的技术得到人amylin的亲和多肽,以期对ⅱ型糖尿病相关的amylin聚集抑制剂的开发提供一定的理论基础和试验依据。
技术实现要素:
本发明第一个目的在于,提供一种与amylin具有较强亲和力及结合特异性的amylin亲和多肽。
本发明第二个目的在于,提供amylin亲和多肽的应用。
为了实现本发明第一个目的,本发明提供了一种amylin亲和多肽,其特征在于,所述亲和多肽的氨基酸序列为ltphkhhkhlha(seqidno:1)。
为了实现本发明第二个目的,本发明提供了amylin亲和多肽在制备amylin抑制剂中的应用。
作为一个优选方案,所述amylin亲和多肽与amylin的摩尔浓度比为2:1。
本发明的优点在于,本发明首先利用噬菌体展示库和生物淘选的技术获得了特异性结合amylin的亲和多肽序列,然后通过对amylin与该亲和多肽进行分子模拟以及等温滴定量热分析,表明该亲和多肽与amylin的相互作用位点中包括amylin聚集形成β-sheet的热点序列,两者的亲和力及结合特异性均较强。afm与tht荧光检测实验表明该亲和多肽对amylin聚集形成纤维的过程有明显的抑制效果,这为ⅱ型糖尿病相关的amylin聚集抑制剂和药物的开发提供一定的理论基础和试验依据。
附图说明
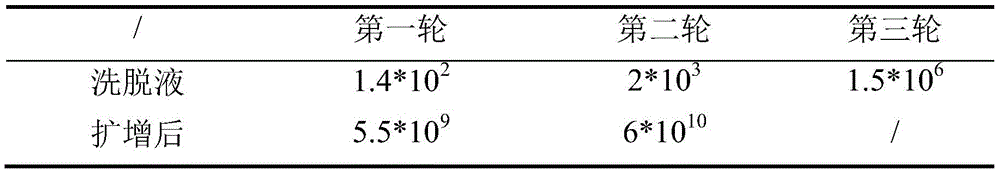
图1为amylin亲和多肽筛选过程中洗脱物和扩增后噬菌体的滴度测定结果。
图2为16个测序样品中所包含的亲和多肽的氨基酸序列。
图3为amylin蛋白分子结构图(pdb2l86)。
图4为亲和多肽la12的蛋白结构预测模型。
图5为amylin与亲和多肽la12的结合位点分析曲线。
图6为amylin氨基酸序列中易形成β-sheet结构的氨基酸热点序列。
图7为amylin与亲和多肽la12的预测结合模式图。
图8为amylin与亲和多肽la12的等温滴定量热曲线。
图9为amylin聚集动力学曲线(tht荧光曲线)。
图10为不同浓度比下亲和多肽la12对amylin聚集形成纤维的抑制效果(tht荧光曲线)。
图11为亲和多肽la12(上)与amylin(下)的氨基酸序列结构示意图。
图12为亲和多肽la12与amylin在浓度比为0:1、1:1、2:1、3:1的条件下混合孵育12h、180h、216h的afm图。
具体实施方式
以下,结合具体实施方式对本发明的技术进行详细描述。应当知道的是,以下具体实施方式仅用于帮助本领域技术人员理解本发明,而非对本发明的限制。
实施例1.amylin的亲和多肽的筛选
1.amylin的亲和多肽的筛选
①靶标的准备及宿主菌的活化:
a.将甘油保存的菌种er2738划线接种于lb-tet平板,37℃倒置培养过夜。封口膜封闭后4℃避光保存。
b.准备6个小型灭菌聚苯乙烯培养皿,每个加入1.5ml的100μg/ml的链霉亲和素溶液(溶于0.1mph8.6的nahco3),充分旋转润湿表面。
c.增湿容器中4℃轻微震荡孵育过夜,4℃贮存备用。
d.从lb-tet平板上挑取er2738单克隆接种到20mllb液体培养基中,用250ml三角瓶37℃剧烈震荡培养至对数前期。
e.取一个包被好的板,把包被液倒掉,板在干净纸巾上用力拍甩,尽量甩掉残余溶液。每板中加满封阻液,在4℃孵育1h。
f.在dmso中配制生物素标记amylin的母液5mg/ml;取母液3μl和原始文库10μl混合于1.5ml的tbst中,室温作用60min。
g.倒掉封阻液,再用tbst缓冲液快速洗板6次。每次均旋转以充分洗涤,倒掉缓冲液,拍掉残余溶液。
②噬菌体的初筛:
a.取一个清洗过的封阻板,加入噬菌体-靶蛋白溶液,室温温育10min。
b.加入生物素至终浓度0.1mm,继续温育5min。
c.倾倒除去未结合噬菌体,甩掉残余溶液。
d.用tbst洗板10次。
e.用1ml的0.2mglycine-hcl缓冲液(ph2.2)来分离已结合的分子。温和摇动大于10min,然后把洗脱液吸到另一干净离心管里,再用150μl的1mtris-hcl缓冲液(ph9.1)中和上述洗脱液。
③洗脱物的滴度测定:
a.将er2738单菌落接种于5-10mllb培养基中,震荡培养至od600约为0.5。
b.微波炉融化上层琼脂,每一噬菌体稀释度的管加3ml上层琼脂于灭菌试管中,保存于45℃备用。
c.将lb/iptg/xgal平板在37℃预温。d.用lb培养基对噬菌体进行10倍系列稀释。对未扩增的淘选洗脱物进行101-104稀释。
e.当菌体培养物达对数中期,每一噬菌体稀释度的管加200μl培养物于微量离心管中。
f.把10μl不同稀释度的噬菌体分别加到每个管中,震荡以充分混匀,室温温育1-5min。
g.把感染细胞加入上层琼脂培养管(45℃预温)中,快速而充分的混匀,立即倾倒在lb/iptg/xgal平板(37℃预温)上,均匀铺开。
h.平板冷却凝固后,在37℃倒置培养过夜。
i.计数蓝色噬菌斑少于100个的平板上的蓝斑数。然后乘以稀释因子即得到每10μl噬菌体的滴度。
④噬菌体的扩增:
a.把剩余洗脱物接种到20mler2738对数前期的培养物中,37℃培养4.5h,剧烈摇动培养。
b.培养物转移到一个离心管里,在4℃下10000rpm离心10min。上清液转到新离心管里,再离心。
c.使用移液器取出上清的上部80%,放到一个新管里,加入1/6体积的peg/nacl缓冲液,使噬菌体4℃沉淀过夜。
d.4℃10000rpm离心15min。上清液倒掉后,再短暂离心,利用移液器吸去残留上清液。
e.沉淀物用1mltbs缓冲液重悬,转入新离心管,在4℃下离心5min,以沉淀残余细胞。
f.上清液再转移到新离心管,加入1/6体积的peg/nacl缓冲液进行沉淀。冰上作用15-60min。然后在4℃下离心10min,倒掉上清,再短暂离心,吸去残余上清。
g.沉淀物重悬于200μltbs中。离心溶液1min,把不溶物都沉淀。上清移到另一新离心管,得到扩增后的洗脱物,4℃贮存。
⑤扩增后噬菌体滴度的测定:
a.er2738单菌落接于5-10mllb培养基中,震荡培养至od600约为0.5。
b.微波炉融化上层琼脂,每一噬菌体稀释度的管加3ml上层琼脂于灭菌试管中,保存于45℃备用。
c.将lb/iptg/xgal平板在37℃预温。
d.用lb培养基对噬菌体进行10倍系列稀释。对扩增的噬菌体培养物上清进行108-1011稀释。
e.当菌体培养物达对数中期,每一噬菌体稀释度的管加200μl培养物于微量离心管中。
f.把10μl不同稀释度的噬菌体分别加到每个管中,震荡以充分混匀,室温温育1-5min。
g.把感染细胞加入上层琼脂培养管(45℃预温)中,快速而充分的混匀,立即倾倒在lb/iptg/xgal平板(37℃预温)上,均匀铺开。
h.平板冷却凝固后,在37℃倒置培养过夜。
i.计数蓝色噬菌斑数少于100个的平板上的蓝斑数量。然后乘以稀释因子即得到每10μl噬菌体的滴度。
⑥第2-3轮淘选:
a.根据上述步骤3对平板上的蓝色噬菌斑进行计数以计算滴度。并用该值来估算相应于1-2×1011pfu的加入量。
b.进行第2-3轮淘选,方法同上,在清洗步骤中逐步提高吐温的浓度(0.3%-0.5%),以提高筛选的严格性和特异性。
⑦单克隆的扩增纯化:
a.取er2738的lb-tet过夜培养物,以1:100的比例稀释接种到lb培养基,分2ml到培养管中。每个要鉴定的克隆选取一管。由第三轮淘选的样品中挑取16个克隆。
b.37℃震荡培养4.5-5h。
c.培养物转到离心管中,离心30sec。把上清转到一个新管,再离心。使用移液器把80%的上清取出,转到新的离心管,得到扩增噬菌体贮液,可以4℃短期贮存。
d.500μl噬菌体上清转到另一新管。
e.加入200μl的peg/nacl溶液,充分混匀后室温作用10-20min。
f.14000rpm离心10min,弃上清液。
g.短暂离心后移液器吸去残余上清。
h.沉淀物彻底重悬于100μl碘化物缓冲液中,剧烈敲击试管确保沉淀溶解。加入250μl乙醇,室温温育10min。
i.14000rpm离心10min,弃上清。用0.5ml的70%的乙醇洗沉淀,离心弃上清后短暂真空干燥。
j.沉淀重悬于30μlte缓冲液中,-20℃贮存。
2.amylin的亲和噬菌体的测序和亲和多肽的合成
选择下列测序公司合成的引物:
-28giii测序引物5’-hogtatgggattttgctaaacaac-3’(seqidno:2);
-96giii测序引物5’-hoccctcatagttagcgtaacg-3’(seqidno:3)。
经测序公司测序后,结合引物序列与m13噬菌体序列以及遗传密码表,分析得到16个测序样品中所包含的亲和多肽氨基酸序列(如图2)。将亲和多肽的序列发至上海淘普生物公司合成纯度为96.8%的亲和多肽,命名为la12。
3.亲和多肽对amylin之间亲和作用的模拟与验证
①亲和多肽与amylin相互作用位点的分子模拟:
根据amylin的培养条件,从pdb数据库中找到溶解条件相同的且已发表的amylin(2l86)的蛋白质结构(biochimbiophysacta,2011),如图3。通过ressourceparisiennebioinformatiquestructurale在线服务器的pep-fold.(j.chem.theor.comput.2014)模块获得筛选得到的亲和多肽la12最可能的结构,如图4。
再通过该服务器的peptidesitefinder功能模块(nucleicacidsresearch,2014)进行结合位点预测,如图3与图5。图3不仅显示为amylin2l86的结构,而且显示amylin与亲和多肽la12的结合位点的预测。深色区域为最可能结合位点,超过90%的可能性,略浅色区域为70%以上可能性,其余的近白色区域的结合可能性则更低。图5显示为amylin中各氨基酸位点与亲和多肽la12结合的可能性,主要分析得到可能性超过70%的相互作用氨基酸序列,为nnfgailsstnvg(seqidno:4)。
通过多肽热点序列分析服务器predictionof"hotspots"ofaggregationinpolypeptides,分析得到图6的amylin中易形成β-sheet的热点区域,分别为anflvh和gails。amylin中这两段易形成β-sheet结构的热点序列也被多篇文章所报道(j.mol.biol.2002;bmcstructuralbiology.2005)。通过对图5与图6的分析可以得出,amylin与la12的结合位点区域中包括了amylin中易形成β-sheet的热点区域,这也就说明该亲和多肽la12对amylin形成β-sheet结构有一定的阻碍作用,从一定程度上说明以及肯定了该亲和多肽la12在amylin相关的淀粉样蛋白纤维抑制剂研发方面的巨大潜力。
把peptidesitefinder功能模块导出的数据用pymol软件进行分析,得到所有可能的amylin与亲和多肽la12的结合的模式图,最终根据每种结合模式构象得分选出最可能的结合模型,如图7。
②等温滴定量热法测定亲和多肽与amylin亲和常数
将amylin和亲和多肽la12的冻干粉末分别溶解于六氟异丙醇中,配成1mg/ml的肽储备液,在水浴中超声5min,4℃过夜充分溶解。取10μl1mg/ml的amylin肽储备液于1.5ml的ep管内,取160μl的1mg/ml亲和多肽la12储备液于另一个1.5ml的ep管内,真空干燥后,分别重新溶解于4℃ph7.3、10mm的tris-hcl缓冲液中,amylin的终浓度为0.01mg/ml,亲和多肽la12的终浓度为2mg/ml。将上述溶液13000rpm/min离心8-10min,取上清,保证amylin溶液的体积不少于300μl,亲和多肽la12溶液的体积不少于60μl。
等温滴定量热仪设定体系温度25℃、滴定次数为19、系统补偿功率为5μcal/s、每次滴定样品体积为2μl、搅拌转速100rpm等。曲线拟合选择onesitemodel。
通过等温滴定量热的结果可知,该亲和多肽la12与amylin的亲和常数为2.28*10-5±4.11*10-4mol/l,两者结合发生反应的焓变δh=-1.058*104±391.5cal/mol,熵变δs=-11.0cal/mol/deg。该结果从实验层面验证了前期分子模拟的预测结果,量化了亲和多肽la12与amylin之间结合强度,进一步证明了亲和多肽la12在amylin聚集抑制剂研发方面的应用潜力。
实施例2.la12对于amylin聚集形成纤维的过程具有抑制作用
分子模拟预测amylin与la12的结合位点中包含amylin聚集形成β-sheet的热点序列,并且等温滴定量热实验表明amylin与la12的亲和力较强,基于此,la12可被用于amylin抑制剂的研究。
tht荧光检测:
amylin处理:将冻干粉末溶解于六氟异丙醇中,配成1mg/ml的肽储备液,在水浴中超声5min,真空干燥后,重新溶解于ph7.3的10mmtris-hcl缓冲液中,稀释至30μm(终浓度),分装到每个ep管内,37℃220rpm/min震荡24h左右,取样时间点为0h、2h、8h、12h、18h、24h,得到如图8。分析可知,amylin的整个生长过程可以清晰地分为两个阶段:0-6h左右,生长处于对数期,该时期荧光强度增长快;6-24h,生长处于平台期,荧光强度值基本维持在600左右不再变化。
亲和多肽la12处理:将亲和多肽la12的冻干粉末溶解于六氟异丙醇中,配成1mg/ml的肽储备液,在水浴中超声5min,真空干燥后,重新溶解于4℃ph7.310mmtris-hcl缓冲液中,与amylin按比例稀释至30μm、60μm、90μm(终浓度),分装到每个ep管内,37℃220rpm/min震荡24h左右。设定亲和多肽la12与amylin的摩尔浓度比为1:1、2:1、3:1,取样时间点为0h、2h、8h、12h、18h、24h,得到如图9结果。分析可知,当亲和多肽与amylin的浓度比为2:1时,抑制效果最好。浓度较低时,亲和多肽la12不能完全饱和amylin而导致抑制效果差,浓度太高时,亲和多肽la12会发生自聚集而使得后期抑制效果下降。
afm测试:
将amylin与亲和多肽la12的冻干粉末分别溶解于六氟异丙醇中,配成1mg/ml的肽储备液,在水浴中超声5min,真空干燥后,重新溶解于4℃ph7.310mmtris-hcl缓冲液中,两者按比例稀释,以amylin的终浓度30μm为基准,亲和多肽la12分别稀释至终浓度为30μm、60μm、90μm,分装到每个ep管内,37℃条件下培养260h,分别在12h、180h、216h取样观察。取20μl样品滴在新揭开的表面平整云母片上,待其干燥后,用超纯水进行冲洗,待其表面干燥,进行afm测试。由afm结果可知,对照组在12h时形成的主要聚集体为梭状;而实验组1:1、2:1、3:1在12h时形成的主要聚集体为球状。对照组在180h开始形成细纤维,而实验组1:1、2:1、3:1在180h时依然以球状寡聚体为主要相,未见有纤维生成;对照组在216h时出现大量的纤维,并且相互交叉,呈网状,而实验组1:1、2:1、3:1在216h时以微小球状寡聚体为主要相,可见极少量细小纤维单独存在。以上结果中,以实验组亲和多肽la12与amylin摩尔比为2:1时为最佳,此条件下形成的寡聚集体较小且未见有纤维生成。
综合上述结果,,表明亲和多肽la12对于amylin的聚集形成纤维的过程具有一定的抑制作用,主要通过延长延滞期,降低β-sheet结构的形成来实现抑制作用。在亲和多肽la12的抑制条件下,amylin形成的主要物相为寡聚体,并且在亲和多肽la12与amylin的摩尔比为2:1时,amylin形成的寡聚体的粒径最小,这说明在该摩尔比浓度下,亲和多肽la12对amylin的抑制效果最好。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
sequencelisting
<110>华东理工大学
<120>一种amylin亲和多肽及其应用
<130>/
<160>5
<170>patentinversion3.5
<210>1
<211>12
<212>prt
<213>人工序列
<400>1
leuthrprohislyshishislyshisleuhisala
1510
<210>2
<211>22
<212>dna
<213>人工序列
<400>2
gtatgggattttgctaaacaac22
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
ccctcatagttagcgtaacg20
<210>4
<211>13
<212>prt
<213>人工序列
<400>4
asnasnpheglyalaileleuserserthrasnvalgly
1510
<210>5
<211>37
<212>prt
<213>homosapiens
<400>5
lyscysasnthralathrcysalathrglnargleualaasnpheleu
151015
valhisserserasnasnpheglyalaileleuserserthrasnval
202530
glyserasnthrtyr
35
- 还没有人留言评论。精彩留言会获得点赞!