一种用于检测水稻植物ZUPM01的核酸序列及其检测方法与流程
本发明涉及植物生物技术领域。具体的,涉及一种用于检测水稻植物zupm01的核酸序列及其检测方法,特别是涉及一种耐受草甘膦除草剂施用和低磷胁迫的转基因水稻事件zupm01和用于检测生物样品中是否包含特定转基因水稻事件zupm01的核酸序列及其检测方法。
背景技术:
田间杂草与作物竞争水、肥、光及生长空间,直接影响农作物产量与质量。同时许多杂草又是作物病原菌及害虫的中间寄主,是作物增产的重要生物限制因子之一。据联合国粮食与农业组织统计,全球因杂草导致的粮食生产损失每年高达950亿美元,相当于损失了3.8亿吨小麦,约合2009年全球小麦产量的半数以上。在950亿美元的经济损失中,贫困的发展中国家承受了大约700亿美元(fao.thelurkingmenaceofweeds[j/ol].(http://www.fao.org/news/story/en/item/29402/icode/),2009-08-11.)。因此,有效地控制田间杂草是促进粮食增产的重要措施之一。在我国,危害水稻的杂草种类有40多种,其中危害较大的杂草有10多种。在一般年份杂草可使水稻减产10-20%,严重时更高达30-50%。另外,随着我国农村人口往城市迁移速度的加快,水稻种植的规模化和机械化是一个可预见的趋势,这使得传统的人工除草方式变得不现实。当前,市场上广泛应用的选择性除草剂施用量大,残留期长、容易影响下茬作物的正常生长。草甘膦等灭生性除草剂具有高效、低毒、易降解、无残留等特点。但它们除草没有选择性,不能直接用在作物的生长期。通过转基因技术培育耐该类灭生性除草剂的水稻可以克服这一难题。在水稻生长期喷施1-2次就能有效解决杂草问题,减少了除草剂的用量及投入成本。因此,耐除草剂转基因水稻具有非常广阔的应用价值和市场潜力。
磷是植物体内核酸、磷脂和atp的重要组成成分,作为植物体内能量转移的物质,能够活化体内蛋白质、调控植物体的整个代谢过程。在植物所需多种无机营养之中,磷作为最重要的元素之一,却极难从土壤中获取。尽管生态系统中磷含量丰富,但是可被植物同化吸收的磷的化学形式却主要是无机磷-磷酸盐(pi)。土壤中磷酸盐分布极不均衡,而且大多数磷酸盐都无法自由移动,因而不利于根系的吸收(raghothamakg.phosphateacquisition[j].annualreviewofplantphysiologyandplantmolecularbiology,1999,50(1):665-693.)。因此,土壤有效磷的供应状况和植物对磷素营养的吸收能力便成为植物生长发育的主要决定因素之一(schachtmandp,reidrj,andaylingsm.phosphorusuptakebyplants:fromsoiltocell[j].plantphysiol,1998,116(2):447-53.)。
地球上的磷矿作为一种不可再生资源在人类不断的开采利用下正逐渐减少。美国地质勘探的数据显示,2008年全球磷酸盐开采总量为一亿六千万吨,而化肥的需求量在未来五年内将以每年2.5%-3%的速率增长。长此以往,世界磷矿资源只能再支撑人类需求125年左右(gilbertn.environment:thedisappearingnutrient[j].nature,2009,461(7265):716-8.)。同时,过度施用的磷也会对环境造成巨大的危害;因此,改善作物对磷素的吸收和利用对生态和农业经济都具有重要意义。
已知外源基因在植物体内的表达受到它们的染色体位置的影响,可能是由于染色质结构(如异染色质)或转录调节元件(如增强子)接近整合位点。为此,通常需要筛选大量的事件才有可能鉴定出可以商业化的事件(即导入的目标基因得到最优表达的事件)。例如,在植物和其他生物体中已经观察到导入基因的表达量在事件间可能有很大差异;在表达的空间或时间模式上可能也存在差异,如在不同植物组织之间转基因的相对表达存在差异,这种差异表现在实际的表达模式可能与根据导入的基因构建体中的转录调节元件所预期的表达模式不一致。因此,通常需要产生成百上千个不同的事件并从这些事件中筛选出具有以商业化为目的所预期的转基因表达量和表达模式的单一事件。具有预期的转基因表达量和表达模式的事件可用于采用常规育种方法通过有性异型杂交将转基因渗入到其他遗传背景中。通过这种杂交方式产生的后代保持了原始转化体的转基因表达特征。应用这种策略模式可以确保在许多品种中具有可靠的基因表达,而这些品种能很好的适应当地的生长条件。
能够检测特定事件的存在以确定有性杂交的后代是否包含目的基因将是有益的。此外,检测特定事件的方法还将有助于遵守相关法规,例如来源于重组农作物的食物在投入市场前需要获得正式批准和进行标记。通过任何熟知的多核苷酸检测方法来检测转基因的存在都是可能的,例如聚合酶链式反应(pcr)或利用多核苷酸探针的dna杂交。这些检测方法通常集中于常用的遗传元件,例如启动子、终止子、标记基因等。因此,除非与插入的转基因dna相邻的染色体dna(“侧翼dna”)的序列是己知的,上述这种方法就不能够用于区别不同的事件,特别是那些用相同的dna构建体产生的事件。所以,目前常利用跨越了插入的转基因和侧翼dna的接合部位的一对引物通过pcr来鉴定转基因特定事件,具体地说是包含于侧翼序列的第一引物和包含插入序列的第二引物。
技术实现要素:
本发明的目的是提供一种用于检测水稻植物zupm01的核酸序列及其检测方法,转基因水稻事件zupm01对草甘膦除草剂和低磷胁迫具有较好的耐受性,且检测方法可以准确快速地鉴定生物样品中是否包含特定转基因水稻事件zupm01的dna分子。
为实现上述目的,本发明提供了一种核酸序列,所述核酸序列包含seqidno:1或其互补序列、和/或seqidno:2或其互补序列,所述核酸序列源自转基因水稻事件zupm01。
进一步地,所述核酸序列包含seqidno:3或其互补序列、和/或seqidno:4或其互补序列。
更进一步地,所述核酸序列包括seqidno:5或其互补序列。
所述seqidno:1或其互补序列为转基因水稻事件zupm01中在插入序列的5’末端位于插入接合部位附近的一个长度为22个核苷酸的序列,所述seqidno:1或其互补序列跨越了水稻插入位点的左侧翼基因组dna序列和插入序列的左边界5’末端的dna序列,包含所述seqidno:1或其互补序列即可鉴定为转基因水稻事件zupm01的存在。所述seqidno:2或其互补序列为转基因水稻事件zupm01中在插入序列的3’末端位于插入接合部位附近的一个长度为22个核苷酸的序列,所述seqidno:2或其互补序列跨越了插入序列的右边界3’末端的dna序列和水稻插入位点的右侧翼基因组dna序列,包含所述seqidno:2或其互补序列即可鉴定为转基因水稻事件zupm01的存在。
本发明中,所述核酸序列可以为所述seqidno:3或其互补序列中转基因插入序列的任何部分的至少11个或更多个连续多核苷酸(第一核酸序列),或者为所述seqidno:3或其互补序列中5’左侧翼水稻基因组dna区域的任何部分的至少11个或更多个连续多核苷酸(第二核酸序列)。所述核酸序列进一步可以为同源于或互补于包含完整的所述seqidno:1的所述seqidno:3的一部分。当第一核酸序列和第二核酸序列一起使用时,这些核酸序列在产生扩增产物的dna扩增方法中包括dna引物组。使用dna引物对在dna扩增方法中产生的扩增产物是包括seqidno:1的扩增产物时,可以诊断转基因水稻事件zupm01或其后代的存在。本领域技术人员熟知的,第一和第二核酸序列不必仅仅由dna组成,也可包括rna、dna和rna的混合物,或者dna、rna或其它不作为一种或多种聚合酶模板的核苷酸或其类似物的组合。此外,本发明中所述探针或引物应该是至少大约11、12、13、14、15、16、17、18、19、20、21或22个连续核苷酸的长度,其可以选自seqidno:1、seqidno:2、seqidno:3、seqidno:4和seqidno:5中所述的核苷酸。当选自seqidno:3、seqidno:4和seqidno:5所示的核苷酸时,所述探针和引物可以为长度是至少大约21个到大约50个或更多的连续核苷酸。所述seqidno:3或其互补序列为转基因水稻事件zupm01中在插入序列的5’末端位于插入接合部位附近的一个长度为732个核苷酸的序列,所述seqidno:3或其互补序列由486个核苷酸的水稻左侧翼基因组dna序列(seqidno:3的核苷酸1-486)、74个核苷酸的pphf1g9a-1300构建体左边界dna序列(seqidno:3的核苷酸487-560)和172个核苷酸的camv35s终止子的3’末端dna序列(seqidno:3的核苷酸561-732)组成,包含所述seqidno:3或其互补序列即可鉴定为转基因水稻事件zupm01的存在。
所述核酸序列可以为所述seqidno:4或其互补序列中转基因插入序列的任何部分的至少11个或更多个连续多核苷酸(第三核酸序列),或者为所述seqidno:4或其互补序列中3’右侧翼水稻基因组dna区域的任何部分的至少11个或更多个连续多核苷酸(第四核酸序列)。所述核酸序列进一步可以为同源于或互补于包含完整的所述seqidno:2的所述seqidno:4的一部分。当第三核酸序列和第四核酸序列一起使用时,这些核酸序列在产生扩增产物的dna扩增方法中包括dna引物组。使用dna引物对在dna扩增方法中产生的扩增产物是包括seqidno:2的扩增产物时,可以诊断转基因水稻事件zupm01或其后代的存在。
所述seqidno:4或其互补序列为转基因水稻事件zupm01中在插入序列的3’末端位于插入接合部位附近的一个长度为913个核苷酸的序列,所述seqidno:4或其互补序列由254个核苷酸的nos(胭脂碱合成酶)转录终止子序列(seqidno:4的核苷酸1-254)、219个核苷酸的pphf1g9a-1300构建体右边界dna序列(seqidno:4的核苷酸255-473)和440个核苷酸的水稻整合位点右侧翼基因组dna序列(seqidno:4的核苷酸474-913)组成,包含所述seqidno:4或其互补序列即可鉴定为转基因水稻事件zupm01的存在。
所述seqidno:5或其互补序列为表征转基因水稻事件zupm01的长度为7306个核苷酸的序列,其具体包含的基因组和遗传元件如表1所示。包含所述seqidno:5或其互补序列即可鉴定为转基因水稻事件zupm01的存在。
表1seqidno:5包含的基因组及遗传元件
1:单位bp。
所述核酸序列或其互补序列可用于dna扩增法中以产生扩增子,所述扩增子的检测诊断生物样品中转基因水稻事件zupm01或其后代的存在;所述核酸序列或其互补序列可用于核苷酸检测法中,以检测生物样品中转基因水稻事件zupm01或其后代的存在。
为实现上述目的,本发明还提供了一种检测样品中转基因水稻事件zupm01的dna存在的方法,包括:
使待检测样品与至少两种引物在核酸扩增反应中接触;
进行核酸扩增反应;
检测扩增产物的存在;
所述扩增产物包含seqidno:1或其互补序列、和/或seqidno:2或其互补序列;
所述扩增产物源自转基因水稻事件zupm01。
在上述技术方案中,所述扩增产物还包括seqidno:6或其互补序列、和/或seqidno:7或其互补序列。
具体地,所述引物包括第一引物和第二引物,所述第一引物选自seqidno:1或其互补序列、seqidno:8和seqidno:10;所述第二引物选自seqidno:2或其互补序列、seqidno:9和seqidno:11。
为实现上述目的,本发明还提供了一种检测样品中转基因水稻事件zupm01的dna存在的方法,包括:
使待检测样品与探针接触,所述探针包含seqidno:1或其互补序列、或者seqidno:2或其互补序列,所述探针源自转基因水稻事件zupm01;
使所述待检测样品和所述探针在严格杂交条件下杂交;
检测所述待检测样品和所述探针的杂交情况。
所述严格条件可为在6×ssc(柠檬酸钠)、0.5%sds(十二烷基硫酸钠)溶液中,在65℃下杂交,然后用2×ssc、0.1%sds和1×ssc、0.1%sds各洗膜1次。
进一步地,所述探针还包括seqidno:6或其互补序列、或者seqidno:7或其互补序列。
可选择地,至少一个所述探针用至少一种荧光基团标记。
为实现上述目的,本发明还提供了一种检测样品中转基因水稻事件zupm01的dna存在的方法,包括:
使待检测样品与标记物核酸分子接触,所述标记物核酸分子包括seqidno:1或其互补序列、或者seqidno:2或其互补序列,所述标记物核酸分子源自转基因水稻事件zupm01;
使所述待检测样品和所述标记物核酸分子在严格杂交条件下杂交;
检测所述待检测样品和所述标记物核酸分子的杂交情况,进而通过标记物辅助育种分析以确定除草剂耐受性和/或低磷胁迫耐受性与标记物核酸分子在遗传学上是连锁的。
进一步地,所述标记物核酸分子还包括seqidno:6或其互补序列、或者seqidno:7或其互补序列。
为实现上述目的,本发明还提供了一种dna检测试剂盒,包括至少一个dna分子,所述dna分子包括seqidno:1或其互补序列、或者seqidno:2或其互补序列,其可以作为对于转基因水稻事件zupm01或其后代具有特异性的dna引物之一或探针;所述dna分子源自转基因水稻事件zupm01。
进一步地,所述dna分子作为探针时还包括seqidno:6或其互补序列、或者seqidno:7或其互补序列。
为实现上述目的,本发明还提供了一种保护水稻植物免受由除草剂引起的损伤的方法,包括将含有有效剂量草甘膦除草剂施加到种植至少一种转基因水稻植物的大田中,所述转基因水稻植物在其基因组中依次包含seqidno:1、seqidno:5第561-6647位核酸序列和seqidno:2,或者所述转基因水稻植物的基因组中包含seqidno:5;所述转基因水稻植物具有对草甘膦除草剂的耐受性。
为实现上述目的,本发明还提供了一种保护水稻植物免受由土壤低磷元素引起的损伤的方法,包括在低磷浓度土壤中种植至少一种转基因水稻植物,所述转基因水稻植物在其基因组中依次包含seqidno:1、seqidno:5第561-6647位核酸序列和seqidno:2,或者所述转基因水稻植物的基因组中包含seqidno:5;所述转基因水稻植物具有对低磷胁迫的耐受性。
为实现上述目的,本发明还提供了一种控制种植水稻植物的大田中杂草的方法,包括将含有有效剂量草甘膦除草剂施加到种植至少一种转基因水稻植物的大田中,所述转基因水稻植物在其基因组中依次包含seqidno:1、seqidno:5第561-6647位核酸序列和seqidno:2,或者所述转基因水稻植物的基因组中包含seqidno:5;所述转基因水稻植物具有对草甘膦除草剂的耐受性。
为实现上述目的,本发明还提供了一种培养对草甘膦除草剂具有耐受性的水稻植物的方法,包括:
种植至少一粒水稻种子,所述水稻种子的基因组中包含特定区域的核酸序列,所述特定区域的核酸序列依次包含seqidno:1、seqidno:5第561-6647位核酸序列和seqidno:2,或者所述特定区域的核酸序列包含seqidno:5;
使所述水稻种子长成水稻植株;
用有效剂量草甘膦除草剂喷洒所述水稻植株,收获与其他不具有所述特定区域的核酸序列的植株相比具有减弱的植物损伤的植株。
为实现上述目的,本发明还提供了一种培养对低磷胁迫具有耐受性的水稻植物的方法,其特征在于,包括:
在低磷土壤中种植至少一粒水稻种子,所述水稻种子的基因组中包含特定区域的核酸序列,所述特定区域的核酸序列依次包含seqidno:1、seqidno:5第561-6647位核酸序列和seqidno:2,或者所述特定区域的核酸序列包含seqidno:5;
使所述水稻种子长成水稻植株;
收获与其他不具有所述特定区域的核酸序列的植株相比具有减弱的植物损伤的植株。
为实现上述目的,本发明还提供了一种产生对草甘膦除草剂具有耐受性的水稻植株的方法,包括,向所述水稻植株的基因组中引入seqidno:5第561-6647位核酸序列,且使得所述水稻植株的基因组依次包含seqidno:1、seqidno:5第561-6647位核酸序列和seqidno:2,或者使得所述水稻植株的基因组包含seqidno:5,选择耐受草甘膦的水稻植株。
具体地,所述产生对草甘膦除草剂具有耐受性的水稻植株的方法,包括:
将对草甘膦除草剂具有耐受性的转基因水稻事件zupm01第一亲本水稻植株与缺少草甘膦耐受性的第二亲本水稻植株有性杂交,从而产生大量子代植株;
用草甘膦除草剂处理所述子代植株;
选择耐受草甘膦的所述子代植株。
为实现上述目的,本发明还提供了一种产生对低磷胁迫具有耐受性的水稻植株的方法,其特征在于,包括向所述水稻植株的基因组中引入seqidno:5第561-6647位核酸序列,且使得所述水稻植株的基因组依次包含seqidno:1、seqidno:5第561-6647位核酸序列和seqidno:2,或者使得所述水稻植株的基因组包含seqidno:5,选择耐受低磷胁迫的水稻植株。
具体地,所述产生对低磷胁迫具有耐受性的水稻植株的方法,包括:
将对低磷胁迫具有耐受性的转基因水稻事件zupm01第一亲本水稻植株与缺少低磷胁迫耐受性的第二亲本水稻植株有性杂交,从而产生大量子代植株;
用低磷胁迫处理所述子代植株;
选择耐受低磷胁迫的所述子代植株。
为实现上述目的,本发明还提供了一种产生自转基因水稻事件zupm01的组合物,所述组合物为稻米、稻草、稻壳或稻种。
为实现上述目的,本发明还提供了一种由转基因水稻事件zupm01生产的农产品或商品,所述农产品或商品为米粉、米油、米糠、米胚、米蛋白、米淀粉、米糠营养油或米糠多糖、化妆品或填充剂。
在本发明用于检测水稻植物的核酸序列及其检测方法中,以下定义和方法可以更好地定义本发明和指导本领域的普通技术人员实施本发明,除非另作说明,根据本领域普通技术人员的常规的用法来理解术语。
所述“水稻”是指水稻(oryzasativa),包括所有可与水稻繁殖的植物品种,包括野生稻种以及那些属于稻属的允许物种间繁殖的植物。
所述“包含”是指“包括但不限于”。
术语“植物”包括整株植物、植物细胞、植物器官、植物原生质体、植物可以从中再生的植物细胞组织培养物、植物愈伤组织、植物丛(plantclumps)和植物或植物部分中完整的植物细胞,所述植物部分例如胚、花粉、胚珠、种子、叶、花、枝、果实、茎秆、根、根尖、花药等。应理解为本发明范围内的转基因植物的部分包括但不限于植物细胞、原生质体、组织、愈伤组织、胚以及花、茎、果实、叶和根,以上植物部分源自事先用本发明的dna分子转化的并因此至少部分地由转基因细胞组成的转基因植物或其子代。
术语“基因”是指表达特定蛋白的核酸片段,包括编码序列前的调节序列(5’非编码序列)和编码序列后的调节序列(3’非编码序列)。“天然基因”是指天然发现具有其自身调节序列的基因。“嵌合基因”是指不是天然基因的任何基因,其包含非天然发现的调节和编码序列。“内源基因”是指天然基因,所述天然基因位于生物体基因组中它的天然位置。“外源基因”是现存在于生物的基因组中且原来不存在的外来基因,也指经转基因步骤导入受体细胞的基因。外源基因可以包含插入非天然生物体的天然基因或嵌合基因。“转基因”是通过转化程序已经被引入基因组的基因。植物基因组中重组dna已被插入的位点可以称为“插入位点”或“靶位点”。
“侧翼dna”可以包含天然存在于例如植物的生物体中的基因组或通过转化过程引入的外源(异源)dna,例如与转化事件相关的片段。因此,侧翼dna可以包括天然和外源dna的组合。在本发明中,“侧翼区”或“侧翼序列”或“基因组边界区”或“基因组边界序列”是指至少3、5、10、11、15、20、50、100、200、300、400、1000、1500、2000、2500或5000碱基对或更长的序列,其位于最初外源插入dna分子的直接上游或下游并且与最初外源插入dna分子相邻。当该侧翼区位于上游时,其也可以称为“左边界侧翼”或“5’侧翼”或“5’基因组侧翼区”或“基因组5’侧翼序列”等。当该侧翼区位于下游时,其也可以称为“右边界侧翼”或“3’侧翼”或“3’基因组侧翼区”或“基因组3’侧翼序列”等。
引起外源dna的随机整合的转化程序会导致含有不同侧翼区的转化体,所述不同侧翼区是每个转化体所特异性含有的。当重组dna通过传统杂交被引入植物时,其侧翼区通常不会改变。转化体也会含有异源插入物dna和基因组dna的段之间或两段基因组dna之间或两段异源dna之间的独特的接合。“接合”是两个具体的dna片段连接的点。例如,接合存在于插入物dna连接侧翼dna的位置。接合点还存在于转化的生物体中,其中两个dna片段以修饰自天然生物体中发现的方式的连接在一起。“接合dna”是指包含接合点的dna。
本发明提供了称为zupm01的转基因水稻事件及其后代,所述转基因水稻事件zupm01即为水稻植物zupm01,其包括转基因水稻事件zupm01的植物和种子及其植物细胞或其可再生部分,所述转基因水稻事件zupm01的植物部分,包括但不限于细胞、花粉、胚珠、花、芽、根、茎、穗、花序、叶和来自水稻植物zupm01的产物,例如稻米、稻草、稻壳或稻种和留在水稻作物田间的生物量。
本发明转基因水稻事件zupm01包含了一个dna构建体,当其在植物细胞内表达时,所述转基因水稻事件zupm01获得对草甘膦除草剂和/或低磷胁迫的耐受性。所述dna构建体包含一个表达盒,表达盒包含用于在植物中表达的适合的启动子和适合的多聚腺苷酸化信号序列,所述启动子可操作地连接编码5-烯醇-丙酮酰莽草酸-3-磷酸合酶(g9a)的基因,所述g9a蛋白的核酸序列对草甘膦除草剂具有耐受性。所述dna构建体包含另一个表达盒,,表达盒包含用于在植物中表达的适合的启动子和适合的多聚腺苷酸化信号序列,所述启动子可操作地连接编码水稻磷酸盐转运体协助运输因子(osphf1)基因,所述osphf1蛋白的核酸序列对低磷胁迫具有耐受性。进一步地,所述启动子可以为从植物分离的适合启动子,包括组成型、诱导型和/或组织特异性启动子,所述适合启动子包括但不限于,花椰菜花叶病毒(camv)35s启动子、玄参花叶病毒(fmv)35s启动子、泛素蛋白(ubiquitin)启动子、肌动蛋白(actin)启动子、土壤农杆菌(agrobacteriumtumefaciens)胭脂碱合成酶(nos)启动子、章鱼碱合成酶(ocs)启动子、夜香树属(cestrum)黄叶卷曲病毒启动子、马铃薯块茎储藏蛋白(patatin)启动子、核酮糖-1,5-二磷酸羧化酶/加氧酶(rubisco)启动子、谷胱甘肽硫转移酶(gst)启动子、e9启动子、gos启动子、alca/alcr启动子、毛根农杆菌(agrobacteriumrhizogenes)rold启动子和拟南芥属(arabidopsisthaliana)suc2启动子。所述多聚腺苷酸化信号序列可以为在植物中起作用的适合多聚腺苷酸化信号序列,所述适合多聚腺苷酸化信号序列包括但不限于,来源于土壤农杆菌(agrobacteriumtumefaciens)胭脂碱合成酶(nos)基因的多聚腺苷酸化信号序列、来源于花椰菜花叶病毒(camv)35s终止子、来源于蛋白酶抑制剂ii(pinii)基因的多聚腺苷酸化信号序列和来源于α-微管蛋白(α-tubulin)基因的多聚腺苷酸化信号序列。
此外,所述表达盒还可以包括其他的遗传元件,所述遗传元件包括但不限于,增强子和信号肽/转运肽。所述增强子可以增强基因的表达水平,所述增强子包括但不限于,烟草蚀刻病毒(tev)翻译激活因子、camv35s增强子和fmv35s增强子。所述信号肽/转运肽可以引导g9a蛋白转运到细胞外或者细胞内特定的细胞器或区室,例如,利用编码叶绿体转运肽序列靶向叶绿体,或者利用‘kdel’保留序列靶向内质网。
所述“草甘膦”是指n-膦酰甲基甘氨酸和它的盐,用“草甘膦除草剂”处理是指使用任何一种含有草甘膦的除草剂制剂进行处理。为了达到有效生物学剂量而对某种草甘膦制剂使用率的选择不超过普通农艺技术人员的技能。使用任何一种含有草甘膦的除草剂制剂处理包含了来源于转基因水稻事件zupm01的植物材料的田地,将控制所述田地中的杂草生长,并且不影响来源于转基因水稻事件zupm01的植物材料的生长或产量。
所述dna构建体采用转化方法被引入到植物中,所述转化方法包括但不限于,农杆菌(agrobacterium)介导转化法、基因枪转化法和花粉管通道转化法。
所述农杆菌介导转化法是植物转化的常用方法。将要引入到植物中的外源dna克隆到载体的左和右边界共有序列之间,即t-dna区。所述载体被转化到农杆菌细胞中,随后,所述农杆菌细胞用于感染植物组织,包含外源dna的载体的所述t-dna区被插入到植物基因组中。
所述基因枪转化法即为用包含外源dna的载体轰击植物细胞(粒子介导的生物弹击转化)。
所述花粉管通道转化法是利用植物授粉后所形成的天然的花粉管通道(又名花粉管引导组织),经珠心通道,将外源dna携带入胚囊。
转化后,必须从转化的植物组织再生转基因植物,并且利用适合的标记选择具有外源dna的后代。
dna构建体是dna分子互相连接起来的组合,该组合提供了一个或多个表达盒。dna构建体优选地是能够在细菌细胞内自我复制,而且含有不同的限制性内切酶位点的质粒,所含的限制性内切酶位点用于导入提供功能性基因元件,即启动子、内含子、前导序列、编码序列、3’终止子区域和其他序列的dna分子。dna构建体中所含有的表达盒包括提供信使rna的转录所必需的基因元件,所述表达盒可以设计为在原核细胞或真核细胞中表达。本发明的表达盒被设计为最优选地在植物细胞内表达。
转基因“事件”是通过用异源dna构建体转化植物细胞而得到的,即包括至少一个含有目标基因的核酸表达盒,通过转基因的方法插入到植物基因组中以产生植物群体,再生所述植物群体,和选择具有插入特定基因组位点特征的特定植株。术语“事件”指包括异源dna的原始转化体和该转化体的后代。术语“事件”还指转化体和含有异源dna的其它品种个体之间进行有性杂交而得到的后代,即使在与回交亲本进行反复回交后,来自于转化体亲本的插入dna和侧翼基因组dna也存在于杂交后代中的同一染色体位置。术语“事件”还指来自原始转化体的dna序列,该dna序列包含插入dna和与插入dna紧密相邻的侧翼基因组序列,该dna序列被预期转移到子代中,该子代由含有插入dna的亲本系(例如原始转化体和其自交产生的子代)与不含有插入dna的亲本系进行有性杂交而产生,且该子代接受了包含目标基因的插入dna。
本发明中“重组”是指通常不能在自然界中发现并且因此通过人工干预产生的dna和/或蛋白和/或生物体的形式。这种人工干预可产生重组dna分子和/或重组植物。所述“重组dna分子”是通过人工组合两种在其它情况下是分离的序列区段而获得的,例如通过化学合成或通过遗传工程技术操作分离的核酸区段。进行核酸操作的技术是众所周知的。
术语“转基因”包括任何细胞、细胞系、愈伤组织、组织、植物部分或植物,以上的基因型由于异源核酸的存在而改变,所述“转基因”包括最初被这样改变的转基因体以及由最初的转基因体通过有性杂交或无性繁殖生成的子代个体。在本发明中,术语“转基因”不包括通过常规植物育种方法或天然发生事件的基因组的(染色体的或染色体外的)改变,所述天然发生事件例如随机异体受精、非重组病毒感染、非重组细菌转化、非重组转座或自发突变。
本发明中“异源的”是指自然界中第一分子通常不被发现与第二分子组合。例如,分子可以源自第一物种并插入到第二物种的基因组中。因此这种分子对于宿主是异源的并被人工引入宿主细胞的基因组中。
培养对草甘膦除草剂具有耐受性的转基因水稻事件zupm01,通过以下步骤:首先使第一亲本水稻植物与第二亲本水稻植物有性杂交,从而产生了多样的第一代子代植株,所述第一亲本水稻植物由培育自转基因水稻事件zupm01及其后代的水稻植物组成,该转基因水稻事件zupm01及其后代是通过利用本发明的对草甘膦除草剂和/或低磷胁迫具有耐受性的表达盒进行转化而得到的,第二亲本水稻植物缺乏对草甘膦除草剂和/或低磷胁迫具有耐受性;然后选择对草甘膦除草剂和/或低磷胁迫具有耐受性的子代植株,可以培育出对草甘膦除草剂和/或低磷胁迫具有耐受性的水稻植物。这些步骤可以进一步包括使草甘膦和/或低磷胁迫耐受性的子代植株与第二亲本水稻植物或第三亲本水稻植物进行回交,然后通过用草甘膦除草剂施加或低磷胁迫或通过与性状相关的分子标记物如包含转基因水稻事件zupm01中插入序列的5’端和3’端鉴定出的接合位点的dna分子)的鉴定来选择子代,从而产生对草甘膦除草剂和/或低磷胁迫具有耐受性的水稻植物。
还应理解的是,两种不同的转基因植物也可以杂交以产生含有两个独立的、分离式添加的外源基因的后代。适当后代的自交可以得到对两个添加的外源基因来说都是纯合子的后代植株。如前所述的对亲本植株的回交和与非转基因植物的异型杂交也是可以预期的,无性繁殖也是同样的。
术语“探针”是一段分离的核酸分子,其上面结合有常规的可检测标记或报告分子,例如,放射性同位素、配体、化学发光剂或酶类。这种探针与目标核酸的一条链是互补的,在本发明中,探针与来自转基因水稻事件zupm01基因组的一条dna链互补,不论该基因组dna是来自转基因水稻事件zupm01或种子还是来源于转基因水稻事件zupm01的植物或种子或提取物。本发明的探针不仅包括脱氧核糖核酸或核糖核酸,还包括特异性地与目标dna序列结合并可用于检测该目标dna序列的存在的聚酰胺及其他探针材料。
术语“引物”是一段分离的核酸分子,其通过核酸杂交,退火结合到互补的目标dna链上,在引物和目标dna链之间形成杂合体,然后在聚合酶(例如dna聚合酶)的作用下,沿目标dna链延伸。本发明的引物对涉及其在目标核酸序列扩增中的应用,例如,通过聚合酶链式反应(pcr)或其他常规的核酸扩增方法。
探针和引物的长度一般是11个多核苷酸或更多,优选的是18个多核苷酸或更多,更优选的是24个多核苷酸或更多,最优选的是30个多核苷酸或更多。这种探针和引物在高度严格杂交条件下与目标序列特异性地杂交。尽管不同于目标dna序列且对目标dna序列保持杂交能力的探针是可以通过常规方法设计出来的,但是,优选的,本发明中的探针和引物与目标序列的连续核酸具有完全的dna序列同一性。
基于本发明的侧翼基因组dna和插入序列的引物和探针可以通过常规方法确定,例如,通过从来源于转基因水稻事件zupm01的植物材料中分离相应的dna分子,并确定该dna分子的核酸序列。所述dna分子包含转基因插入序列和水稻基因组侧翼区域,所述dna分子的片段可以用作引物或探针。
本发明的核酸探针和引物在严格条件下与目标dna序列杂交。任何常规的核酸杂交或扩增方法都可以用于鉴定样品中来源于转基因水稻事件zupm01的dna的存在。核酸分子或其片段在一定情况下能够与其他核酸分子进行特异性杂交。如本发明使用的,如果两个核酸分子能形成反平行的双链核酸结构,就可以说这两个核酸分子彼此间能够进行特异性杂交。如果两个核酸分子显示出完全的互补性,则称其中一个核酸分子是另一个核酸分子的“互补物”。如本发明使用的,当一个核酸分子的每一个核苷酸都与另一个核酸分子的对应核苷酸互补时,则称这两个核酸分子显示出“完全互补性”。如果两个核酸分子能够以足够的稳定性相互杂交从而使它们在至少常规的“低度严格”条件下退火且彼此结合,则称这两个核酸分子为“最低程度互补”。类似地,如果两个核酸分子能够以足够的稳定性相互杂交从而使它们在常规的“高度严格”条件下退火且彼此结合,则称这两个核酸分子具有“互补性”。从完全互补性中偏离是可以允许的,只要这种偏离不完全阻止两个分子形成双链结构。为了使一个核酸分子能够作为引物或探针,仅需保证其在序列上具有充分的互补性,以使得在所采用的特定溶剂和盐浓度下能形成稳定的双链结构。
如本发明使用的,基本同源的序列是一段核酸分子,该核酸分子在高度严格条件下能够和相匹配的另一段核酸分子的互补链发生特异性杂交。促进dna杂交的适合的严格条件,例如,大约在45℃条件下用6.0×氯化钠/柠檬酸钠(ssc)处理,然后在50℃条件下用2.0×ssc洗涤,这些条件对本领域技术人员是公知的。例如,在洗涤步骤中的盐浓度可以选自低度严格条件的约2.0×ssc、50℃到高度严格条件的约0.2×ssc、50℃。此外,洗涤步骤中的温度条件可以从低度严格条件的室温约22℃,升高到高度严格条件的约65℃。温度条件和盐浓度可以都发生改变,也可以其中一个保持不变而另一个变量发生改变。优选地,本发明的一个核酸分子可以在中度严格条件下,例如在约2.0×ssc和约65℃下与seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6和seqidno:7中一个或多个核酸分子或其互补序列,或者上述序列的任一片段发生特异性杂交。更优选地,本发明的一个核酸分子在高度严格条件下与seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6和seqidno:7中一个或多个核酸分子或其互补序列,或者上述序列的任一片段发生特异性杂交。本发明中,优选的标记物核酸分子具有seqidno:1、seqidno:2、seqidno:6或seqidno:7或其互补序列,或者上述序列的任一片段。
本发明另一优选的标记物核酸分子与seqidno:1、seqidno:2、seqidno:6或seqidno:7或其互补序列,或者上述序列的任一片段具有80%到100%或90%到100%的序列同一性。seqidno:1、seqidno:2、seqidno:6和seqidno:7可以用作植物育种方法中的标记物以鉴定遗传杂交的后代。探针与目标dna分子的杂交可以通过任何一种为本领域技术人员所熟知的方法进行检测,这些方法包括但不限于,荧光标记、放射性标记、抗体类标记和化学发光标记。
关于使用特定的扩增引物对目标核酸序列进行的扩增(例如,通过pcr),“严格条件”指的是在dna热扩增反应中仅允许引物对目标核酸序列发生杂交的条件,具有与目标核酸序列相应的野生型序列(或其互补序列)的引物,能够与所述目标核酸序列结合,并且优选产生唯一的扩增产物,扩增产物即扩增子。
术语“特异性结合(目标序列)”是指在严格杂交条件下探针或引物仅与包含目标序列的样品中的目标序列发生杂交。
如本发明使用的,“经过扩增的dna”或“扩增子”是指作为核酸模板一部分的目标核酸序列的核酸扩增产物。例如,为了确定水稻植物是否由含有本发明转基因水稻事件zupm01通过有性杂交方式产生,或采集自田地的水稻样品是否包含转基因水稻事件zupm01,或水稻提取物,例如粗粉、粉或油是否包含转基因水稻事件zupm01,从水稻植物组织样品或提取物提取的dna可以通过使用引物对的核酸扩增方法以产生对于转基因水稻事件zupm01的dna的存在是诊断性的扩增子。所述引物对包括一个来源于植物基因组中与插入的外源dna插入位点相邻的侧翼序列的第一引物,和来源于插入的外源dna的第二引物。扩增子具有一定长度和序列,所述序列对所述转基因水稻事件zupm01也是诊断性的。
扩增子的长度范围可以是引物对的结合长度加上一个核苷酸碱基对,优选加上约五十个核苷酸碱基对,更优选加上约两百五十个核苷酸碱基对,最优选加上约四百五十个核苷酸碱基对或更多。
可选的,引物对可以来源于插入dna两侧的侧翼基因组序列,以产生包括整个插入核苷酸序列的扩增子。来源于植物基因组序列的引物对中的一个可以位于距插入dna序列一定距离处,该距离的范围可以为一个核苷酸碱基对到约两万个核苷酸碱基对。术语“扩增子”的使用特别排除了在dna热扩增反应中形成的引物二聚体。
核酸扩增反应可以通过本领域已知的任何一种核酸扩增反应方法实现,包括聚合酶链式反应(pcr)。各种核酸扩增方法已是本领域技术人员所熟知的。pcr扩增方法已经发展到可扩增22kb的基因组dna和42kb的噬菌体dna。这些方法以及本领域的其他dna扩增方法可以用于本发明。插入的外源dna序列和来自转基因水稻事件zupm01的侧翼dna序列可以通过利用所提供的引物序列对转基因水稻事件zupm01的基因组进行扩增,扩增后对pcr扩增子或克隆的dna进行标准的dna测序。
基于dna扩增方法的dna检测试剂盒含有dna引物分子,它们在适当的反应条件下特异性杂交到目标dna上并扩增诊断性扩增子。试剂盒可提供基于琼脂糖凝胶的检测方法或者现有技术已知的检测诊断性扩增子的许多方法。含有与seqidno:3或seqidno:4的水稻基因组区的任何部分同源或互补的、以及与seqidno:5的转基因插入区的任何部分同源或互补的dna引物的试剂盒是本发明所提供的。特别地鉴别在dna扩增方法中有用的引物对是seqidno:8和seqidno:9,其扩增与转基因水稻事件zupm01的5’转基因/基因组区的一部分同源的诊断性扩增子,其中扩增子包括seqidno:1。鉴别在dna扩增方法中有用的引物对还包括seqidno:10和seqidno:11,其扩增与转基因水稻事件zupm01的3’转基因/基因组区的一部分同源的诊断性扩增子,其中扩增子包括seqidno:2。用作dna引物的其它dna分子可选自seqidno:5。
这些方法所产生的扩增子可以通过多种技术进行检测。其中一个方法是geneticbitanalysis,该方法设计了一个跨越插入dna序列和相邻的侧翼基因组dna序列的dna寡核苷酸链。将该寡核苷酸链固定在一个微孔板的微孔内,在对目标区域进行pcr扩增后(在插入序列内和相邻的侧翼基因组序列中各使用一个引物),单链pcr产物可与固定的寡核苷酸链进行杂交,并且作为单碱基延伸反应的模板,该延伸反应使用了dna聚合酶和为下一个预期的碱基特定标记的ddntps。可以通过荧光或elisa类方法得到结果。信号代表了插入/侧翼序列的存在,其说明扩增、杂交和单碱基延伸反应是成功的。
另一种方法是pyrosequencing(焦磷酸测序)技术。该方法设计了一个跨越插入dna序列和相邻的基因组dna结合部位的寡核苷酸链。将该寡核苷酸链和目标区域的单链pcr产物(在插入序列内和相邻的侧翼基因组序列中各使用一个引物)进行杂交,然后和dna聚合酶、atp、硫酰基酶、荧光素酶、三磷酸腺苷双磷酸酶、腺苷-5’-磷硫酸盐和萤光素一起进行温育。分别加入dntps,测量产生的光信号。光信号代表了插入/侧翼序列的存在,其说明扩增、杂交、和单碱基或多碱基延伸反应是成功的。
荧光偏振现象也是可以用于检测本发明扩增子的一种方法(chenx,levinel,andkwokpy.fluorescencepolarizationinhomogeneousnucleicacidanalysis[j].genomeres,1999,9(5):492-8.)。使用这种方法需要设计一个跨越插入dna序列和相邻的基因组dna结合部位的寡核苷酸链。将该寡核苷酸链和目标区域的单链pcr产物(在插入序列内和相邻的侧翼基因组序列中各使用一个引物)进行杂交,然后和dna聚合酶以及一种荧光标记的ddntp一起进行温育。单碱基延伸会导致插入ddntp。这种插入可以利用荧光仪测量其偏振的改变。偏振的改变代表了插入/侧翼序列的存在,其说明扩增、杂交和单碱基延伸反应是成功的。
taqman被描述为一种检测和定量分析dna序列存在的方法,该方法在制造商所提供的使用说明中有详细介绍。现简要举例说明如下,设计一个跨越插入dna序列和相邻的基因组侧翼结合部位的fret寡核苷酸探针。该fret探针和pcr引物(在插入序列内和相邻的侧翼基因组序列中各使用一个引物)在热稳定聚合酶和dntps存在下进行循环反应。fret探针的杂交导致fret探针上荧光部分和淬灭部分的分裂以及荧光部分的释放。荧光信号的产生代表了插入/侧翼序列的存在,其说明扩增和杂交是成功的。
基于杂交原理,用于检测来源于转基因水稻事件zupm01的植物材料的适合技术还可以包括southern印迹杂交、northern印迹杂交和原位杂交。特别地,所述适合技术包括温育探针和样品,洗涤以移除未结合的探针和检测探针是否已经杂交。所述的检测方法取决于探针所附标记的类型,例如,通过x光片曝光和显影可以检测放射性标记的探针,或通过底物转化实现颜色变化可以检测酶标记的探针。
也可应用分子标记对序列进行检测(tyagisandkramerfr.molecularbeacons:probesthatfluoresceuponhybridization[j].natbiotechnol,1996,14(3):303-8.)。设计一个跨越插入dna序列和相邻的基因组侧翼结合部位的fret寡核苷酸探针。该fret探针的独特结构导致其含有二级结构,该二级结构能够在近距离内保持荧光部分和淬灭部分。该fret探针和pcr引物(在插入序列内和相邻的侧翼基因组序列中各使用一个引物)在热稳定聚合酶和dntps存在下进行循环反应。经过成功的pcr扩增,fret探针和目标序列的杂交导致探针二级结构的丧失,从而使荧光部分和淬灭部分在空间上发生分离,产生荧光信号。荧光信号的产生代表了插入/侧翼序列的存在,其说明扩增和杂交是成功的。
其他描述的方法,例如微流体(microfluidics)提供了分离和扩增dna样品的方法和设备。光染料用于检测和测定特定的dna分子。包含用于检测dna分子的电子传感器或结合特定dna分子的纳珠并因而可被检测的纳试管(nanotube)设备对于检测本发明的dna分子是有用的。
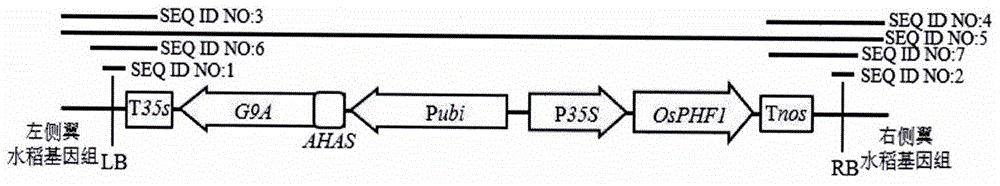
可以使用本发明所述的组合物和dna检测领域描述的或已知的方法来开发dna检测试剂盒。所述试剂盒有利于鉴定样品中是否存在转基因水稻事件zupm01的dna,还可以用于培育含有转基因水稻事件zupm01的dna的水稻植物。所述试剂盒可以含有dna引物或探针,其同源于或互补于seqidno:1、2、3、4或5的至少一部分,或含有其它dna引物或探针,其同源于或互补于dna的转基因遗传元件中所含的dna,这些dna序列可以用于dna扩增反应,或作为dna杂交方法中的探针。在水稻基因组中含有的以及在图1和表1中说明的转基因插入序列与水稻基因组结合部位的dna结构包含:位于转基因插入序列5’末端的水稻zupm01左侧翼基因组区域,来自农杆菌的左侧边界区域(lb)的一部分插入序列,第一个表达盒由玉米泛素蛋白基因启动子(ubiquitinpromoter),可操作地连接到玉米乙酰乳酸合成酶基因的信号肽序列(ahas)上,可操作地连接到耐辐射球菌中的草甘膦耐受性的5-烯醇-丙酮酰莽草酸-3-磷酸合酶基因(g9a)上,并可操作地连接到花椰菜花叶病毒的35s终止子胭脂碱合成酶基因终止子(camv35sterminator)上而组成,第二个表达盒由花椰菜花叶病毒的35s启动子玉米泛素蛋白基因启动子(camv355promoter),可操作地连接到水稻磷酸盐转运体协助运输因子序列(osphf1)上,并可操作地连接到胭脂碱合成酶基因终止子(nosterminator)上而组成,来自农杆菌的右侧边界区域(rb)的一部分插入序列,以及位于转基因插入序列3’末端的水稻植物zupm01右侧翼基因组区域(seqidno:5)。在dna扩增方法中,作为引物的dna分子可以是来源于转基因水稻事件zupm01中转基因插入序列的任何部分,也可以是来源于转基因水稻事件zupm01中侧翼水稻基因组的dna区域的任何部分。
转基因水稻事件zupm01可以与其他转基因水稻品种组合,例如除草剂(如草铵膦、麦草畏等)耐受性的水稻,或携带抗虫基因的转基因水稻品种。所有这些不同转基因事件的各种组合,与本发明的转基因水稻事件zupm01一起育种,可以提供抗虫并抗多种除草剂并耐受低磷胁迫的改良杂种转基因水稻品种。这些品种相比于非转基因品种和单性状的转基因品种可以表现出产量提升等更优异的特征。
本发明提供了一种用于检测水稻植物的核酸序列及其检测方法,转基因水稻事件zupm01具有耐受含草甘膦的农业除草剂和/或低磷胁迫的作用。该性状的水稻植株表达耐草甘膦抗性的耐辐射球菌5-烯醇-丙酮酰莽草酸-3-磷酸合酶(g9a)蛋白和水稻磷酸盐转运体协助运输因子蛋白(osphf1),其赋予植物对草甘膦和低磷胁迫的耐受性。同时本发明检测方法中包含seqidno:1或其互补序列的序列、包含seqidno:2或其互补序列的序列、seqidno:6或其互补序列、或者seqidno:7或其互补序列可以作为dna引物或探针以产生诊断为转基因水稻事件zupm01或其后代的扩增产物,且可以快速、准确、稳定的鉴定出来源于转基因水稻事件zupm01的植物材料的存在。
序列简述:
seqidno:1转基因水稻事件zupm01中5’转基因插入位点左侧翼水稻基因组dna和转基因片段左边界的各11个核苷酸序列;
seqidno:2转基因水稻事件zupm01中3’转基因插入位点转基因片段右边界和右侧翼水稻基因组dna的各11个核苷酸序列;
seqidno:3转基因水稻事件zupm01中在插入序列的5’末端位于插入接合部位附近的一个长度为732个核苷酸的序列;
seqidno:4转基因水稻事件zupm01中在插入序列的3’末端位于插入接合部位附近的一个长度为913个核苷酸的序列;
seqidno:55’左侧翼水稻基因组序列、整个t-dna序列和3’右侧翼水稻基因组序列;
seqidno:6位于seqidno:3内部的序列,跨越了5’左侧翼水稻基因组序列、pphf1g9a-1300构建体左边界dna序列和camv35s终止子序列;
seqidno:7位于seqidno:4内部的序列,跨越了nos转录终止序列、pphf1g9a-1300构建体右边界dna序列和3’右侧翼水稻基因组序列;
seqidno:8扩增seqidno:6的第一引物;
seqidno:9扩增seqidno:6的第二引物;
seqidno:10扩增seqidno:7的第一引物;
seqidno:11扩增seqidno:7的第二引物;
seqidno:12pcr检测g9a的第一引物;
seqidno:13pcr检测g9a的第二引物;
seqidno:14pcr检测osphf1的第一引物;
seqidno:15pcr检测osphf1的第二引物;
seqidno:16获得右边界侧翼序列的引物;
seqidno:17获得右边界侧翼序列的引物;
seqidno:18获得右边界侧翼序列的引物;
seqidno:19获得右边界侧翼序列的引物;
seqidno:20获得右边界侧翼序列的引物;
seqidno:21获得右边界侧翼序列的引物;
seqidno:22获得右边界侧翼序列的引物;
seqidno:23获得右边界侧翼序列的引物;
seqidno:24获得右边界侧翼序列的引物;
seqidno:25获得右边界侧翼序列的引物;
seqidno:26获得右边界侧翼序列的引物;
seqidno:27获得右边界侧翼序列的引物;
seqidno:28获得右边界侧翼序列的引物;
seqidno:29获得右边界侧翼序列的引物;
seqidno:30southern杂交检测中的探针;
seqidno:31southern杂交检测中的探针;
下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。
附图说明
图1转基因插入序列与水稻基因组结合部位的结构示意图。
图2重组表达载体pphf1g9a-1300的物理图谱。各元件英文及缩写含义列举如下:
camv35spromoter花椰菜花叶病毒(camv)的35s启动子。
osphf1编码磷酸盐转运体协助运输因子,促进水稻对磷的吸收和转运。
nosterminator胭脂碱合成酶基因的终止子。
t-border(right)农杆菌c58的t-dna右边界序列,t-dna转移所需。
pvs1stapvs1质粒的质粒稳定位点。
pvs1reppvs1质粒的复制起始位点。
pbr322bompbr322质粒的bom位点,迁移蛋白质mop的作用位点。
pbr322oripbr322质粒的复制起始位点。
kanamycin(r)编码氨基糖苷磷酸转移酶蛋白,赋予细菌卡那霉素抗性。
t-border(left)农杆菌c58的t-dna左边界序列,t-dna转移所需。
camv35sterminator花椰菜花叶病毒(camv)的35s终止子。
g9a源自耐辐射球菌,编码epsps蛋白,产生草甘膦抗性。
ahas玉米乙酰乳酸合成酶基因的信号肽序列。
ubiquitinpromoter玉米泛素基因的启动子。
图3zupm01目的基因osphf1的插入拷贝数southern印记杂交图。a:osphf1探针杂交图;b:t-dna区酶切位点和探针位置示意图,数字表示酶切后的条带大小,单位kb,所用的探针位置用线段标注在下部。泳道1-25分别表示不同的dna样品。1、7、13、19、20:dnamarker,条带大小标注在最左侧,单位kb;2、8、14、21:空白;3、9、22:质粒dna;4、10、15、16、23:非转基因9311基因组dna;5、11、17、24:zupm01t5基因组dna;6、12、18、25:zupm01t6基因组dna;3-6:ecori酶切;9-12:pvuii酶切;15-18:nhei酶切;22-25:hindiii酶切。
图4zupm01目的基因g9a的插入拷贝数southern印记杂交图。a:g9a探针杂交图;b:t-dna区酶切位点和探针位置示意图,数字表示酶切后的条带大小,单位kb,所用的探针位置用线段标注在下部。泳道1-18分别表示不同的dna样品。1、7、13:dnamarker,条带大小标注在最左侧,单位kb;2、8、14:空白;3、9、15:质粒dna;4、10、16:非转基因9311基因组dna;5、11、17:zupm01t5基因组dna;6、12、18:zupm01t6基因组dna;3-6:nhei酶切;9-12:hindiii酶切;15-18:saci酶切。
图5转化事件zupm01的检测结果。a:左边界检测,目标条带预期大小682bp;b:右边界检测,目标条带预期大小835bp;m:分子量标准,从上到下依次为2kb、1kb、750bp、500bp、250bp、100bp;n:阴性对照野生型9311;p:阴性对照pphf1g9a-1300质粒;w:水;t5、t6:分别表示t5和t6代转化事件;
具体实施方式
本申请涉及的转化事件zupm01是指以水稻自交系9311为受体经过遗传转化得到在特定基因组序列之间插入外源基因插入物(t-dna插入物)的水稻植株。在具体实施例中,转基因所用表达载体具有图1所示的物理图谱,所得到的t-dna插入物具有seqidno:5的第487-6866位核苷酸所示序列。转化事件zupm01可以指这一转基因过程,也可以指由这一过程所得到的基因组内的t-dna插入物,或t-dna插入物与侧翼序列的组合,或可以指由这一转基因过程得到的水稻植株。在具体实例中,该事件也适用于同样的表达载体转化其他受体品种,从而将t-dna插入物插入到同样基因组位置而获得的植物。转化事件zupm01还可以指由上述植物进行无性繁殖、有性繁殖、减倍或加倍繁殖或以上的组合而得到的后代植物。
实施例1转化载体的构建
本发明所用的骨架载体为pcambia1300载体改造后的双元ti载体p1300-ubqahas-1174s,载体已包含g9a基因表达盒。osphf1基因表达盒通过in-fusion技术构建上去。根据tigr网站提供(http://www.tigr.org/)的水稻磷酸盐转运体运输协助因子1(osphf1)基因的cdna序列,设计引物,以粳稻日本晴(nipponbare)的根部cdna为模板,扩增得到osphf1基因的编码区后,克隆至pmd-19载体(35s:phf1:nos/cpb),以该载体为模板,利用两端包含hindiii酶切位点的引物扩增得到两端带hindiii酶切位点的35s:phf1:nos表达盒产物。然后将p1300-ubqahas-1174s载体和35s:phf1:nos产物均用hindiii酶切,并将产物放于in-fusion反应液中42℃孵育30min后转化大肠杆菌,挑选经过pcr和酶切验证过的单克隆,得到命名为pphf1g9a-1300的表达载体。
所得载体大小为12.684kb,载体物理图谱见图1。
实施例2水稻遗传转化
本发明采用农杆菌介导法将目的基因表达载体转入水稻,所用农杆菌菌株为eha105。水稻种子消毒后诱导愈伤,然后与农杆菌共培养以感染愈伤,通过选择培养筛选被转化的愈伤,之后在选择培养基上进行植株再生。具体过程如下:
1)诱导水稻愈伤组织:取水稻成熟种子,人工或者机械脱壳,挑选饱满光洁无菌斑的种子,放入100ml无菌烧杯中,倒入70%酒精(15ml)消毒2min;倒去酒精,加入100ml30%次氯酸钠(naclo)溶液,浸泡30min;倒去次氯酸钠溶液,用无菌蒸馏水清洗种子4-5遍,最后一遍浸泡30min。将种子放在无菌滤纸上吸干,置入成熟胚诱导培养基中,每皿20-30颗;操作完毕用封口膜(microporetmsurgicaltape)封好培养皿,在28℃光照培养箱培养。在暗培养条件下诱导愈伤组织,需要7~10天;在超净工作台上打开培养皿,用镊子挑取自然分裂的胚性愈伤组织(淡黄色,致密呈球状),置入继代培养基中,在28℃暗培养1周继代。
2)农杆菌培养:挑取转化有目的表达载体的农杆菌单克隆于15mlyep培养液中(含相应的抗生素),28℃,250rpm振荡培养12~16h至菌液od600为0.8-1.0。
3)共培养和抗性愈伤组织的选择:将培养好的菌液于室温下,4000rpm离心10min,去上清。将长到一定大小的水稻愈伤组织挑出,放入农杆菌悬浮液,水平摇床上80rpm共培养30min;将愈伤组织取出,置于无菌的滤纸上沥干30-40min;将愈伤组织置于有一张无菌滤纸的共培养基上,25℃暗培养3天。
4)选择培养:愈伤组织取出,用无菌水清洗5-6次,其间需不停振荡。再用含300mg/l羧苄青霉素钠(carb)的无菌水清洗2遍,每次在水平摇床上摇晃30min,最后置于无菌滤纸上沥干2小时。将晾干的愈伤转入含300mg/l羧苄青霉素钠(carb)和相应筛选压力的选择培养基上,28℃暗培养14天,共进行两轮选择,直到颗粒性的抗性愈伤组织长出。
5)抗性愈伤组织的诱导分化和生根:挑取从不同愈伤来的颜色鲜黄的抗性愈伤3-5颗,移入装有分化培养基的塑料广口瓶中,用封口膜封好,放入恒温(25℃)培养室中(16h/8h),等待分化成苗(约40天)。待苗长至3cm左右,用剪刀从苗基部剪去老根和愈伤组织,放入生根培养基中壮苗(约1周)。
6)炼苗移栽:将苗根部和茎叶分化完好的试管挑出,打开封口膜,加入适量蒸馏水或无菌水(防止培养基长菌),炼苗2~3天,然后洗去琼脂,移栽苗到温室土钵中,检测转基因植株阳性。
实施例3转化体的筛选
(1)对转化获得的110个t0代转化苗进行目的基因分子检测。根据两个基因序列设计两个pcr引物对,第一个引物对引物序列分别为seqidno:12和seqidno:13,第二个引物对引物序列分别为seqidno:14和seqidno:15。取转化苗叶片提取基因组dna,按照以下pcr参数进行扩增:
反应体系:
反应程序:
阳性转化体的两个目的基因扩增片段大小与阳性质粒对照pcr的扩增片段大小一致,分别为600bp和296bp,收获77个阳性单株的t1种子。
(2)对t1-t3代植株经除草剂筛选,分离比考察等筛选得到编号为osphf1-9311-1、osphf1-9311-2、osphf1-9311-3、osphf1-9311-4的4个株系。
(3)在田间对t4-t5代osphf1-9311-1、osphf1-9311-2、osphf1-9311-3、osphf1-9311-4转化体的初步农艺性状鉴定,确定osphf1-9311-1(即zupm01)综合性状突出。
产量性状方面,zupm01和9311在株高、有效穗、穗长、总粒数、实粒数、结实率、单株产量、干物重、千粒重方面均无显著差异(p>0.05)(表2)。
表2zupm01产量及考种性状调查结果
数值以3次生物学重复的平均值±标准差表示,采用lsd法分析不同材料间各性状的差异显著性(α=0.05)。
实施例4转化事件zupm01外源序列的侧翼序列及水稻基因组插入位置
设计侧翼序列分离的引物(seqidno:16-seqidno:29),利用fpni-pcr扩增并测序的方法获得了转化体zupm01的右侧翼序列(seqidno:5第6867-7306位),并根据基因组序列通过pcr扩增测序得到左侧翼序列(seqidno:5第1-486位)。在plantgdb数据库(http://www.plantgdb.org/osgdb/cgi-bin/blastgdb.pl)中用blastn工具将侧翼序列与水稻基因组序列进行同源比对分析,以msu7为参考序列。分析可知转化体zupm01插入水稻基因组chr06:2736689-2736704位置处。
fpni-pcr的操作步骤如下:
1)提取水稻基因组dna。
2)以步骤1)中的基因组dna作为第一轮pcr反应的模板,反应体系如下:
反应程序为:
95℃,2.5min;(94℃,10sec;62℃,30sec;72℃,2min)×2循环;
94℃,10sec;
25℃,2min;
72℃(5.1%ramp),2min;
[94℃,10sec;62℃,30sec;72℃,2min;94℃,10sec;62℃,30sec;72℃,2min;94℃,10sec;44℃,30sec;72℃,2min;]
×5循环;
72℃,5min;
25℃,10min。
3)以步骤2)中相应的第一轮pcr产物为模板进行第二轮pcr扩增。
反应体系如下:
反应程序为:
95℃,1min30sec;
[94℃,10sec;62℃,30sec;72℃,2min]×30循环;
72℃,7min;
25℃,10min。
4)以步骤3)中相应的第二轮pcr产物(稀释50倍)为模板进行第三轮pcr扩增。
反应体系如下:
反应程序为:
95℃,1min30sec;
[94℃,10sec;62℃,30sec;72℃,2min]×30循环;
72℃,7min;
25℃,10min。
5)取第三轮pcr的产物于1%(w/v)1×tae琼脂糖凝胶中电泳检测,回收250bp以上dna片段。
6)将回收的片段连接t载体,16℃过夜连接。
7)转化6)中的连接产物。
8)挑取阳性克隆摇菌提质粒,送质粒进行测序。
9)测序结果在plantgdb数据库中用blastn工具,以msu数据库为参照基因组,与水稻基因组序列进行同源比对,以最好的匹配结果为插入位点。
进一步通过重叠pcr分段扩增并测序zupm01的全长插入序列。转化体zupm01实际插入序列和左右侧翼水稻基因组序列如seqidno:5所示。
表3侧翼序列分离所用引物信息
1:单位bp。
实施例5转化事件zupm01的拷贝数检测
采用southern印记杂交的方法确定外源基因插入的拷贝数。
osphf1基因片段的插入拷贝数杂交检测选取ecori、pvuii、nhei和hindiii四种限制性内切酶分别酶切阳性对照pphf1g9a-1300质粒、阴性对照野生型9311基因组dna和不同世代(t5和t6)zupm01转化体基因组dna。跑胶转膜后用osphf1基因探针(seqidno:30)标记。杂交结果见图3a所示。目的基因osphf1的探针位置及限制性内切酶ecori、pvuii、nhei和hindiii的酶切位点如图3b所示。
osphf1基因为水稻内源基因,ecori、pvuii、nhei和hindiii酶切阴性对照9311的基因组后,与标记探针杂交均得到1个条带,其中ecori酶切可标记出1.5kb条带(泳道4),pvuii酶切可标记出2.3kb条带(泳道10),nhei酶切可标记出9.4kb条带(泳道15、16),hindiii酶切可标记出15kb条带(泳道23)。可见osphf基因在非转基因水稻中有一个拷贝。同时,阴性对照野生型9311用ecori、pvuii、nhei和hindiii三种限制性内切酶酶切标记后没有看到除内源基因以外的条带,空白对照中(泳道2、8、14、21)也没有杂交出条带,表明了杂交探针的特异性。
ecori在t-dna区酶切位点只有一个,位于osphf1基因探针的左侧,经过酶切的zupm01转化体基因组dna与特异性探针杂交后获得的标记条带应该包括4.0kb的t-dna序列及其右侧基因组上大小未知的序列,整个片段长度大于4.0kb。实验中标记出两条杂交条带,其中一条为内源osphf1基因标记出的1.5kb条带,外源osphf1基因标记出的条带大小约为9.4kb(泳道5、6),符合预期。同时,ecori在载体骨架区没有酶切位点,因此阳性对照标记出的条带大小与质粒大小相同,为12.7kb(泳道3)。
pvuii在t-dna区的酶切位点也只有一个,位于osphf1基因探针的右侧,经过酶切的zupm01转化体基因组dna与特异性探针杂交后获得的标记条带应该包括6.4kb的t-dna序列及其左侧基因组上大小未知的序列,整个片段长度大于6.4kb。实验中标记出两条杂交条带,其中一条为内源osphf1基因标记出的2.3kb条带,外源osphf1基因标记出的条带大小约为9.3kb(泳道11、12),符合预期。同时,pvuii在载体骨架区没有酶切位点,因此阳性对照标记出的条带大小与质粒大小相同,为12.7kb(泳道9)。
nhei在t-dna区的酶切位点只有一个,位于osphf1基因探针的左侧,经过酶切的zupm01基因组dna与特异性探针杂交后获得的标记条带应该包括3.7kb的t-dna序列及其右侧基因组上大小未知的序列,整个片段长度大于3.7kb。实验中标记出两条杂交条带,其中一条为内源osphf1基因标记出的9.4kb条带,外源osphf1基因标记出的条带大小约为4.3kb(泳道17、18),符合预期。
hindiii在t-dna区的酶切位点有两个,位于osphf1基因探针两侧,会将t-dna区切出2.3kb固定大小的片段。实验中标记出两条杂交条带,其中一条为内源osphf1基因标记出的15kb条带,外源osphf1基因标记出的条带大小为2.3kb(泳道24、25),与用阳性对照质粒酶切标记的条带大小相同(泳道22),表明探针标记的条带确实在t-dna区上,且osphf1基因内部没有发生重组。
g9a基因片段的插入拷贝数杂交检测选取nhei、hindiii和saci三种限制性内切酶分别酶切空白对照、阳性对照pphf1g9a-1300质粒、阴性对照野生型9311基因组dna和不同世代zupm01转化体基因组dna。跑胶转膜后用g9a基因探针(seqidno:31)标记。杂交结果见图4a所示。目的基因g9a的探针位置及限制性内切酶nhei、hindiii和saci的酶切位点如图4b所示。
nhei在t-dna区的酶切位点有一个,位于g9a基因探针的右侧,经过酶切的zupm01转化体基因组dna与特异性探针杂交后获得的标记条带应该包括2.7kb的t-dna序列及其左侧基因组上大小未知的序列,整个片段长度大于2.7kb。实验中标记出单一的杂交条带,大小约为4.3kb(泳道5、6),符合预期。同时,nhei在载体骨架区有一个酶切位点,在距离左边界约3.2kb位置处,因此阳性对照标记出的条带大小为6.0kb(泳道3)。
hindiii在t-dna区的酶切位点有两个,都位于g9a基因探针的右侧,经过酶切的zupm01转化体基因组dna与特异性探针杂交后获得的标记条带应该包括3.8kb的t-dna序列及其左侧基因组上大小未知的序列,整个片段长度大于3.8kb。实验中标记出单一的杂交条带,大小约为7.0kb(泳道11、12),符合预期。同时,hindiii在载体骨架区没有酶切位点,因此阳性对照标记出的条带大小为10.4kb(泳道9)。
saci在t-dna区的酶切位点有四个,其中位于g9a基因探针两侧的位点会把t-dna区切出4.6kb固定大小的片段。实验中标记出单一的杂交条带约为4.6kb(泳道17、18),与用阳性对照质粒酶切标记的条带大小相同(泳道15),表明探针标记的条带确实在t-dna区上,且g9a基因内部没有发生重组。同时,阴性对照野生型9311用nhei、hindiii和saci三种限制性内切酶酶切标记后都没有看到条带(泳道4、10、16),空白对照也没有看到条带(泳道2、8、14),表明了杂交探针的特异性。
以上实验结果表明,zupm01转化体含有单拷贝的外源osphf1和g9a基因片段。
实施例6转化事件zupm01对草甘膦除草剂的耐受性
在符合隔离要求的田间环境下,通过人工喷施除草剂的方法测定转化体对除草剂草甘膦的耐受性,明确了转化体耐除草剂目标性状的有效性。试验设置三次重复,每小区1m2(1m×1m),小区间隔0.5m。试验处理设置转基因水稻不喷施除草剂、转基因水稻喷施目标除草剂、对应的非转基因水稻不喷施除草剂、对应的非转基因水稻喷施目标除草剂。除草剂喷施浓度分别为喷施清水(0×)及田间推荐剂量中量的1倍(1×,200ml/亩或82g/亩)、2倍(2×,400ml/亩或164g/亩)和4倍(4×,800ml/亩或328g/亩)。
靶标除草剂草甘膦喷施后分别在用药后1周、2周调查正常苗数,在用药后4周调查正常苗和药害苗数(2~5级)。用药后1周时,喷施清水对照的9311和转化体植株均能够正常存活,但是杂草丛生;喷施草甘膦的受体对照9311的大部分植株死亡,即使有少部分未完全失绿叶片,心叶也已死亡;而喷施草甘膦不同剂量的转化体zupm01可以正常生长。用药后2周和4周后,喷施清水对照的9311和转化体植株的杂草更加茂盛,严重影响了水稻的正常生长;喷施草甘膦的受体对照9311已全部干枯死亡;而喷施草甘膦不同剂量的转化体zupm01仍然可以正常生长。
在用药后1周、2周、4周对转化体zupm01的药害调查结果显示,在各剂量除草剂处理下,均未出现药害,药害率为0%,且没有出现4级和5级药害的苗(表4)。根据水稻对除草剂耐受性等级的判定标准,可判定转化体zupm01对靶标除草剂草甘膦的耐受性等级为优秀。
表4zupm01对草甘膦的耐受性表现
剂量以除草剂田间推荐剂量中量的倍数表示。数值以3次生物学重复的平均值±标准差表示,统计分析采用lsd法检验。
结果表明,受体对照9311不能耐受推荐剂量中量的草甘膦,而转化体zupm01可耐受至少4倍推荐剂量中量的草甘膦,对靶标除草剂的耐受性达到“优秀”级别,具有较好的推广价值。
实施例7转化事件zupm01对土壤低磷胁迫的耐受性
田间自然条件下,设4个处理,分为无磷、低磷、中磷和高磷,采用本实验室多年处理的几乎不含有磷元素的田块进行试验,各处理的施肥方案如下:
无磷处理(np):过磷酸钙0kg/亩,尿素30kg/亩,氯化钾20kg/亩;
低磷处理(lp):过磷酸钙7.5kg/亩,尿素30kg/亩,氯化钾20kg/亩;
中磷处理(mp):过磷酸钙15kg/亩,尿素30kg/亩,氯化钾20kg/亩;
高磷处理(hp):过磷酸钙30kg/亩,尿素30kg/亩,氯化钾20kg/亩。
分别在分蘖盛期、孕穗期和成熟期(蜡熟末期)测定茎叶的干物质重和磷含量,在成熟期测定剑叶、穗秆、谷壳和糙米的干物质重和磷含量,并且根据干物质重和磷含量算出磷的累积量。
磷养分效率由吸收效率、利用效率和转运效率三部分组成。本项目以植株地上部磷的累积量来衡量植株磷吸收效率;单位磷吸收量所生产的干物质量定义为植株体内磷的利用效率;收获后生殖部位磷占其地上部总磷量的百分数定义为磷的转移效率。
成熟期对处理小区收获晾晒称重,并折算成亩产。
进行磷肥处理后,检测了试验小区全磷、有机质、有效磷和ph值等,结果表明,无磷、低磷、中磷和高磷处理中全磷和有效磷含量呈显著上升趋势(表5),表明试验处理有效,符合预期。
表5土壤理化性质
1:单位“mg/kg”,结果来源于3次重复的均值。
在成熟期测定剑叶、穗秆、谷壳和糙米的干物质重和磷含量,并且根据干物质重和磷含量算出磷的累积量,计算得出了磷吸收、利用和转运效率,结果见表6。
表6zupm01磷元素吸收、利用和转运效率
数值以3次生物学重复的平均值±标准差表示,统计分析采用lsd法检验(α=0.05)。“/”前字母表示不同处理间数据的差异显著性,“/”后字母表示不同材料间数据的差异显著性。“np、lp、mp、hp”分别代表无磷处理、低磷处理、中磷处理和高磷处理。
受体9311的磷吸收、利用和转运效率随着土壤磷水平升高而增强,而转化体zupm01在不同磷浓度处理条件下的磷吸收、利用和转运效率无显著差异。在无磷和低磷处理时,zump01的磷吸收、利用和转运效率显著高于受体9311,而在中磷和高磷处理时,zupm01与受体9311的磷吸收、利用和转运效率无显著性差异。
考察了4个磷浓度处理下的产量,结果如表7所示,对照9311的产量随着土壤磷浓度的升高不断增加,表明了其对磷处理的敏感性;而转化体在不同磷浓度处理下产量差异并不显著,对磷缺乏胁迫的耐受性更强。zupm01转化体在无磷和低磷处理下产量分别为597.5±31.8和609.7±35.6kg/亩,显著高于9311(485.4±47.71和497.6±56.2kg/亩),转化体在中磷和高磷处理下产量分别为719.1±189.1kg/亩和633.1±125.5kg/亩,与对照无显著性差异。
表7不同磷浓度处理下转化体的产量表现(kg/亩)
数值以3次生物学重复的平均值±标准差表示,统计分析采用lsd法检验(α=0.05)。“/”前字母表示不同处理下数据的差异显著性,“/”后字母表示不同材料间数据的差异显著性。“np、lp、mp、hp”分别代表无磷、低磷、中磷和高磷处理。
以上结果表明,转化体zupm01中目的基因osphf1的表达能够增强水稻在无磷和低磷胁迫条件下的磷养分效率,从而改善水稻的生理性状增加水稻产量。
实施例8转化事件zupm01的检测方法
可由转基因水稻事件zupm01生产诸如农产品或商品。如果在所述农产品或商品中检测到足够的表达量,所述农产品或商品预期含有能够诊断转基因水稻事件zupm01材料在所述农产品或商品中存在的核苷酸序列。所述农产品或商品包括但不限于米粉、米油、米糠、米胚、米蛋白、米淀粉、米糠营养油或米糠多糖以及将要作为食物源供动物消费的任何其它食品、或者另外作为膨大剂或化妆组合物中的成分用于化妆用途等。基于探针或引物对的核酸检测方法和/或试剂盒可以被开发以检测生物样品中诸如seqidno:1或seqidno:2所示的转基因水稻事件zupm01核苷酸序列,其中探针序列或引物序列选自如seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6和seqidno:7中所示的序列,以诊断转基因水稻事件zupm01的存在。
其中一个检测方法为:利用pcr方法对zupm01两代(t5和t6)植株中的特异性边界序列进行检测,所用的pcr引物对分别为seqidno:8、seqidno:9和seqidno:10、seqidno:11,pcr反应体系:
反应程序为:
94℃,5min;(94℃,30sec;55℃,30sec;72℃,1.0min)×35循环;72℃,7min;4℃,5min。
取pcr产物于1%(w/v)1×tae琼脂糖凝胶中电泳检测,结果见图5。转化事件中可以扩增得到预期的目标条带,但是其他非来源于转化事件的样品则不能扩增出目标条带。
综上所述,本发明转基因水稻事件zupm01对草甘膦除草剂和低磷胁迫具有较高的耐受性,且检测方法可以准确快速的鉴定生物样品中是否包含转基因水稻事件zupm01的dna分子。
最后所应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!